基于滑移芯片的双浓度梯度反应阵列
鄢兴华等

摘 要 建立了一种基于微流控滑移芯片的反应微阵列体系,并应用于双浓度梯度研究。在此反应微阵列芯片中,两种试剂分别通过芯片进样形成多级浓度梯度,进一步在正交方向上形成双浓度梯度的微反应阵列,经过滑动、接触和混合,简便实现多路反应。采用不同色素和荧光染料对系统进行了表征,确认了方法的可靠性,在此基础上, 考察了β-半乳糖苷酶(β-gal)的反应条件。将45 nmol/L β-gal和45 μmol/L底物荧光素二半乳糖苷(FDG)分别注入芯片上下层,在芯片通道中各自形成浓度梯度,滑移后进行不同酶浓度和不同底物浓度的反应测定。结果表明,随着底物浓度的提高,反应产物逐渐增多;一定底物浓度下,产物随酶浓度升高而逐渐增多,但很快到达平台期。芯片上酶与底物的浓度对反应的影响与芯片外基本一致。此芯片具有结构简单、操作简便和消耗低等特点,适用于多因素和多水平的复杂反应分析。
关键词 微流控; 滑移芯片; 双浓度梯度; β-半乳糖苷酶
1 引 言
生命科学的飞速发展对高通量分析技术提出了更迫切的要求。阵列技术以其规模化有序集成的操作方式成为当前高通量技术代表。微流控芯片是近年发展起来的新概念分析技术,以其微型化、集成化和自动化等优点备受瞩目。将微流控芯片技术与阵列技术结合,即阵列微流控芯片或微流控阵列芯片已成为芯片分析的最重要方向之一,广泛应用于生物医学分析。阵列式的微反应器越来越被研究人员重视,各种阵列形成方式得到广泛尝试与验证,如液滴阵列[1,2]、微孔阵列[3~5]、电极阵列[6]、磁珠阵列[7]等,并实际应用于基因组学、蛋白质组学,甚至细胞、组织等分析,如RT PCR[8~10]、DNA甲基化分析[11]、单分子酶的测定[12]、细胞培养[13~15]、胚胎研究[16,17]、单细胞研究[18~20]、病毒检测与基因分型[21,22]等。
滑移芯片是Ismagilov研究组提出的一种新微反应阵列平台。这种组合芯片通过两块芯片之间的相对滑动实现指定通道和孔的接通与断开,从而实现样品和反应物的进样、混合、洗脱及反应等功能。该研究组采用滑移芯片实现了单种样品和多种试剂的多路同时反应[23,24],在此基础上进一步实现了蛋白质结晶条件筛选[23,25]、PCR[26,27]、免疫测定[28]、细菌培养[29]等高通量分析。
浓度梯度是实现多路高通量反应的方式之一,可以减少多浓度试剂需求实验中的样品准备时间,并且更加精确和易于调整。微流控芯片可以形成精确的浓度梯度,且通过改变网络通道的构型设计及初始液流的浓度和组合顺序,可获得一系列复杂的浓度梯度。在芯片上形成双浓度梯度的难点在于每种浓度梯度的形成需要一个独立不受干扰的区域或平面,而两种试剂的混合可能会造成流体的互相干扰和通道的互相影响。Hung等[30]在垂直交叉的芯片通道交叉处用阀的开关控制流体方向,可使两个方向的试剂分别形成浓度梯度,但同时形成两种浓度梯度仍有困难。滑移芯片为解决同一平面的两种浓度梯度互相干扰的情况提供了全新思路,即通过两块不同平面的芯片分别形成浓度梯度,再通过芯片滑移操作将两种浓度梯度的试剂进行接触混合反应。两种浓度梯度同时形成, 且互不影响,形成后也能使不同浓度的两种试剂以正交的形式交叉反应。
本研究发展了一种基于滑移芯片的双浓度梯度反应阵列平台,可通过简单的样品注入,同时形成两种试剂的多水平的浓度梯度,并将其以正交的方式相互接触与混合,形成正交浓度的微反应阵列,从而简单地同时实现多组反应。在色素与荧光素对该平台进行表征的基础上,成功实现了β-半乳糖苷酶与底物反应优化条件的测定。此系统有结构简单、操作方便、消耗小等特点,广泛适用于多因素、多指标(水平)的生物及化学反应研究与分析。
2 实验部分
2.1 材料与试剂
荧光素、NaCl、EDTA、Tris等(上海国药集团化学试剂有限公司);β-半乳糖苷酶及底物FDG(Fluorescein di-β-D-galactopyranoside)购自北京博奥森生物有限公司;FC-40(3M公司)。除特殊说明外,所有试剂均为分析纯,实验用水均来自Direct-Q system (Millipore, Bedford, MA, USA)所产的超纯水,在使用前所有溶液均用0.45 μm滤头先行过滤。
2.2 芯片设计与制作
本实验的滑移芯片由两块相同的PDMS/玻璃芯片组成,并通过PMMA夹子使两块芯片的玻璃面相互接触与固定(图1c)。每块PDMS/玻璃芯片都包括PDMS上的通道部分和玻璃上凿空的孔阵列,其中PDMS通道包括浓度梯度形成部分及多路平行的非连续通道部分,玻璃基底上包括用作反应孔的大孔阵列和用于连接另一块芯片反应孔的小孔阵列;将玻璃和对应的PDMS芯片键合后,非连续通道的末端与小孔一一对应,再将芯片底面进行疏水处理。PMMA夹子包括两片有螺纹孔及滑道的PMMA板,通过四角的螺丝可以将两块芯片固定和压紧,PMMA板上的斜向滑道可以准确的限定芯片滑动的方向和距离。芯片通道高50 μm,宽300 μm,连接孔与反应孔直径分别为1.0 和1.5 mm。
2.3 芯片实验操作
将两块疏水处理后的芯片玻璃底面用全氟化合物FC-40浸润,再将两底面对准,使得每块芯片上的大孔均匀连接另一块芯片上的小孔。将对准后的芯片用PMMA夹子夹紧,两片PMMA板正好与两块芯片的PDMS面相接触。
用PMMA夹子将两块芯片组装到一起后(图1c),芯片上的大孔阵列可以将另一块芯片上的小孔阵列连接起来,进而将芯片上的非连续通道接通,可以实现两块芯片的同时进样,并同时产生浓度梯度(如图1a所示)。通过微泵将样品和反应物分别与缓冲液一起注入两块芯片中,控制流速,即可在两块芯片上分别形成样品和反应物的浓度梯度。由于两种浓度梯度是在不同的芯片平面上产生的,因此互不干扰,并且使得每块芯片上的大孔即反应孔阵列都充满了另一块芯片上形成的浓度梯度溶液,为下一步混合做好准备。
进样完成后,沿着PMMMA夹子上层四角预留的滑道进行滑动,由于PMMA与PDMS之间的摩擦力远大于中间有FC-40润滑的玻璃与玻璃之间的摩擦力,因此上层PDMS芯片会随着PMMA板一起,沿着滑道移动,从而断开两块芯片的通道,同时使得分别充满两类浓度梯度溶液的反应孔阵列一一对应,样品和反应物进行混合并反应(图1b)。
2.4 芯片表征与β-半乳糖苷酶反应
分别用色素和荧光素对此芯片形成双浓度梯度的效果进行评估。评估分别采用肉眼可见的色素溶液和肉眼不可见的荧光素溶液进行定性和定量分析。首先测试了单层芯片的浓度梯度形成效果,用黄色和蓝色色素溶液分别注入单块芯片的两个入口,观察4条通道的色素颜色以判断混合情况;对组合好的芯片,上层芯片两个入口分别注入绿色色素溶液和水,下层芯片两个入口分别注入红色色素溶液和水。完成了色素对芯片的表征后,同样用荧光素溶液进行了实验。芯片入口分别注入1.0×104 mol/L 的荧光素溶液和水,待形成稳定浓度梯度后进行荧光强度的测定。
此芯片还用于β-半乳糖苷酶与底物FDG的反应测定。在确定了合适的反应时间和反应浓度范围后,上层芯片注入45 nmol/L β-Gal溶液和水,下层芯片注入45 μmol/L FDG溶液和水,待形成稳定浓度梯度后,将芯片进行滑移,接触反应1 h后,对反应孔的反应产物进行光强测定。
3 结果与讨论
3.1 有限元模拟
采用Fluent软件对芯片通道进行了有限元模拟,以验证此设计是否能形成符合要求的浓度梯度。以水为对象,采用与实际实验中相同的通道尺寸和立体结构,模拟流体在上下层通道间的流动和混合情况。流体流速分别设置为0.1, 0.5, 1.0, 5.0和10.0 μL/min,模拟浓度场分布如图2所示(流速为0.5 μL/min)。结果表明,流体在由不同平面的通道和孔连接而成的芯片通道中能够很好地扩散混合,此通道设计理论上能很好地形成稳定连续的浓度梯度。
3.2 芯片表征
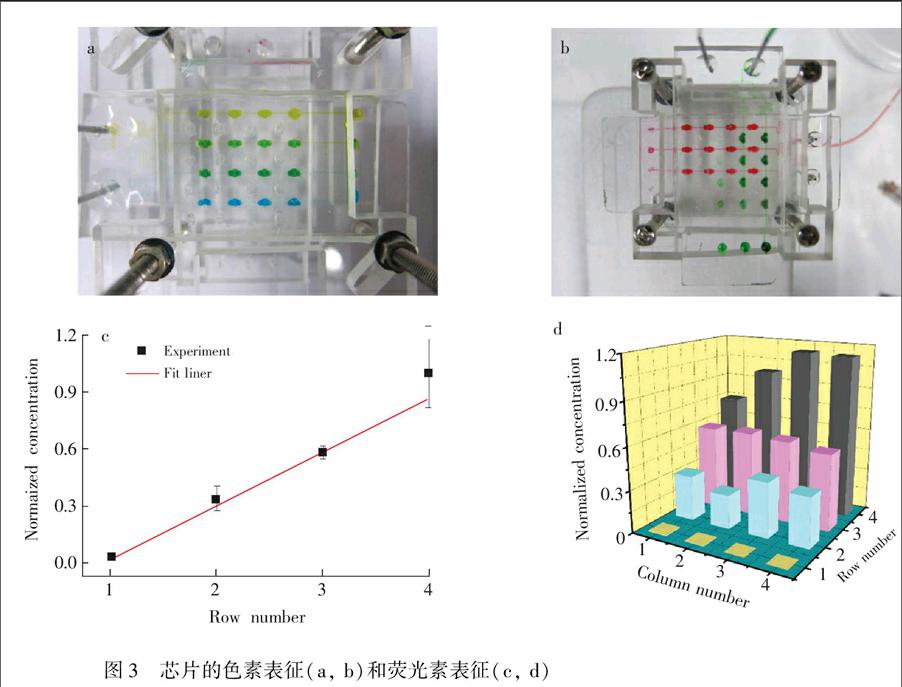
芯片组装完成后,首先对单层芯片的浓度梯度形成情况进行了实验,往上层芯片的两个入口分别注入黄色色素溶液和蓝色色素溶液,黄色和蓝色色素混合会形成绿色。结果表明,单层芯片能较好的形成符合预期的浓度梯度(如图3a)。此后,用色素对双层芯片进行了验证。上层芯片分别注入绿色色素溶液和水溶液,同时,下层芯片分别注入红色色素溶液和水溶液,经过一段时间后,两层芯片分别独立的形成了基本符合要求的浓度梯度(如图3b所示)。
在用色素溶液对芯片浓度梯度进行定性表征后,采用荧光素溶液对芯片的浓度梯度情况进行了定量表征。芯片中分别注入1.0×104 mol/L荧光素溶液和水,待稳定后,在荧光场下用显微镜观察和测量,并用Image Pro Plus和Origin Pro进行数据处理,绘制标准曲线图和3D柱形图(图3c和3d)。结果表明,此芯片平台能形成符合预期的浓度梯度。
3.3 β-半乳糖苷酶反应
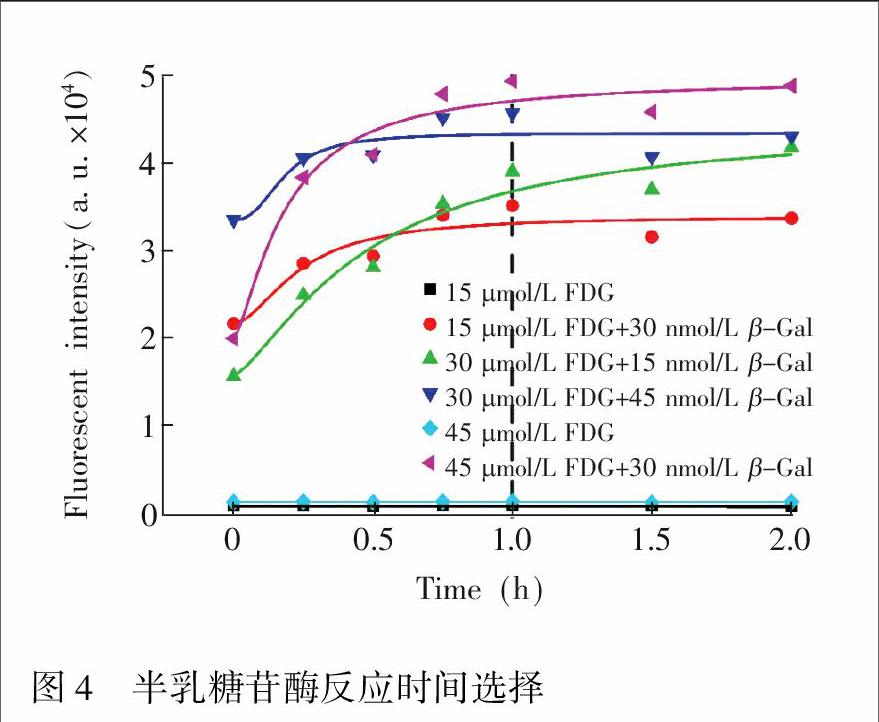
采用此芯片进一步进行了β-半乳糖苷酶和底物FDG的反应测定。首先在多孔板上探索了酶反应时间对反应产物的影响。实验中,选取了不同浓度的β-半乳糖苷酶(15, 30和45 nmol/L)和不同浓度的底物FDG(15, 30和45 μmol/L),分别进行混合后,相隔不同时间(0, 0.25, 0.5, 0.75, 1.0, 1.5和2.0 h)后测量反应产物光强(图4)。随着反应时间延长,产物光强逐渐上升,约1 h后,产物光强到达平台期。因此,选择1 h作为反应时间,既能保证反应充分进行,也给测量预留了足够的时间,不会出现光强明显衰减的情况。
确定反应时间后,在多孔板和芯片上分别进行了酶反应的测定。根据多次筛选,确定了合适的酶浓度(0, 15, 30和45 nmol/L)和底物浓度(0, 15, 30 和45 μmol/L)。在多孔板上,分别加入4个浓度的β-Gal和4个浓度的FDG,形成不同浓度组合,反应1 h后测量光强。在芯片中,上层芯片注入45 nmol/L β-Gal和水,下层芯片注入45 μmol/L FDG和水,待形成稳定浓度梯度后,滑动芯片,使反应孔接触,反应1 h后测量光强。用Image Pro Plus和Origin Pro对测量数据进行处理,并绘制了2D和3D柱形图(图5)。
由图5可知,随着底物浓度增大,反应产物逐渐增多;随着酶浓度增大,产物逐渐增多,但很快到达平台期(当酶浓度为30和45 nmol/L时,产物光强基本一致)。芯片上的酶反应与多孔板上的反应趋势基本一致,酶和底物浓度对反应的影响也基本一致,这表明此芯片平台对β-半乳糖苷酶反应条件的测定是可靠的。
4 结 论
浓度梯度技术是科学研究中优化实验条件的重要手段。在微流控芯片上研究浓度梯度具有自动化、微型化、高通量的优点,因而在药物筛选、免疫分析、细胞刺激等方面得到了广泛应用。但多数研究都限于单一条件的浓度梯度形成,而不能同时形成两个或多个条件的浓度梯度,无法应对多因素复杂反应的需要。本研究建立了一种基于滑移芯片的反应阵列平台,并应用于双浓度梯度研究。此芯片系统包含上下两块相同的PDMS/玻璃芯片,两种试剂分别通过芯片进样,能同时各自形成不同平面上的浓度梯度,再经过两块芯片的滑动,两个平面上不同类别的试剂接触、混合并反应,从而实现多路不同浓度条件下的反应。用色素和荧光素对系统进行了表征,确认本方法的可靠性,并进一步实现了β-半乳糖苷酶反应条件的优化测定。该芯片具有结构简单、操作简便、消耗低、速度快等特点,适用于多因素和多水平的复杂反应分析。
References
1 Shen H, Fang Q. Talanta, 2008, 77(1): 269-272
2 Zhu Y, Zhang Y X, Liu W W, Ma Y, Fang Q, Yao B. Sci. Rep., 2015, 5: 9551
3 Park E S, Brown A C, DiFeo M A, Barker T H, Lu H. Lab Chip, 2010, 10(5): 571-580
4 Lindstrom S, Mori K, Ohashi T, Andersson-Svahn H. Electrophoresis, 2009, 30(24): 4166-4171
5 Park S, Bassat D B, Yossifon G. Biomicrofluidics, 2014, 8(2): 024117
6 Hirano Y, Yasukawa T, Sawayashiki Y, Shiku H, Mizutani F, Matsue T. Electrochemistry, 2010, 78(2): 175-177
7 Yang X H, Zhao X, Zuo X B, Wang K M, Wen J H, Zhang H. Talanta, 2009, 77(3): 1027-1031
8 Zhang Y X, Zhu Y, Yao B, Fang Q. Lab Chip, 2011, 11(8): 1545-1549
9 Ramalingam N, Rui Z, Liu H B, Dai C C, Kaushik R, Ratnaharika B, Gong H Q. Sensor. Actuat. B-Chem., 2010, 145(1): 543-552
10 Wong W, Farr R, Joglekar M, Januszewski A, Hardikar A. J. Vis. Exp., 2015, (98): e52586
11 Zhang Y, Bailey V, Puleo C M, Easwaran H, Griffiths E, Herman J G, Baylin S B, Wang T H. Lab Chip, 2009, 9(8): 1059-1064
12 Sakakihara S, Araki S, Iino R, Noji H. Lab Chip, 2010, 10(24): 3355-3362
13 Liu M C, Tai Y C. Biomed. Microdevices, 2011, 13(1): 191-201
14 Frimat J P, Becker M, Chiang Y Y, Marggraf U, Janasek D, Hengstler J G, Franzke J, West J. Lab Chip, 2011, 11(2): 231-237
15 Wilson J L, Suri S, Singh A, Rivet C A, Lu H, McDevitt T C. Biomed. Microdevices, 2014, 16(1): 79-90
16 Kang E, Choi Y Y, Jun Y, Chung B G, Lee S H. Lab Chip, 2010, 10(20): 2651-2654
17 Chung K, Kim Y, Kanodia J S, Gong E, Shvartsman S Y, Lu H. Nat. Methods, 2011, 8(2): 171-176
18 Li Y W, Feng X J, Du W, Li Y, Liu B F. Anal. Chem., 2013, 85(8): 4066-4073
19 Wang Y, Tang X L, Feng X J, Liu C, Chen P, Chen D J, Liu B F. Anal. Bioanal. Chem., 2015, 407(4): 1139-1148
20 Kumar P T, Vriens K, Cornaglia M, Gijs M, Kokalj T, Thevissen K, Geeraerd A, Cammue B P A, Puers R, Lammertyn J. Lab Chip, 2015, 15(8): 1852-1860
21 Zhang H, Xu T, Li C W, Yang M S. Biosens. Bioelectron., 2010, 25(11): 2402-2407
22 Ahlford A, Kjeldsen B, Reimers J, Lundmark A, Romani M, Wolff A, Syvanen A C, Brivio M. Analyst, 2010, 135(9): 2377-2385
23 Du W B, Li L, Nichols K P, Ismagilov R F. Lab Chip, 2009, 9(16): 2286-2292
24 Li L, Du W B, Ismagilov R F. J. Am. Chem. Soc., 2010, 132(1): 106-111
25 Li L, Du W B, Ismagilov R F. J. Am. Chem. Soc., 2010, 132(1): 112-119
26 Shen F, Du W B, Davydova E K, Karymov M A, Pandey J, Ismagilov R F. Anal. Chem., 2010, 82(11): 4606-4612
27 Shen F, Du W B, Kreutz J E, Fok A, Ismagilov R F. Lab Chip, 2010, 10(20): 2666-2672
28 Liu W S, Chen D L, Du W B, Nichols K P, Ismagilov R F. Anal. Chem., 2010, 82(8): 3276-3282
29 Ma L, Datta S S, Karymov M A, Pan Q C, Begolo S, Ismagilov R F. Integr. Biol., 2014, 6(8): 796-805
30 Hung P J, Lee P J, Sabounchi P, Lin R, Lee L P. Biotechnol. Bioeng., 2005, 89(1): 1-8

