发芽对糜子酚类化合物及抗氧化活性的影响
郑 璐,王兴国,韩 飞,梁亚静,第文龙,陈 曦,李爱科,管 骁(1.江南大学食品学院,江苏无锡141;.国家粮食局科学研究院,北京10007;.上海理工大学医疗器械与食品学院,上海0009)
发芽对糜子酚类化合物及抗氧化活性的影响
郑璐1,2,王兴国1,*,韩飞2,*,梁亚静2,第文龙2,陈曦2,李爱科2,管骁3
(1.江南大学食品学院,江苏无锡214122;2.国家粮食局科学研究院,北京100037;3.上海理工大学医疗器械与食品学院,上海200093)
探讨了发芽时间对糜子中酚类化合物含量、存在形式及抗氧化活性的影响。将经过表面灭菌的糜子种子放入25℃,相对湿度95%的人工气候箱中避光发芽6 d,每天取样,测定其中酚、黄酮含量及抗氧化指标(DPPH、ABTS、FRAP、ORAC)的变化。结果显示,从发芽2 d起,酚、黄酮含量及各项抗氧化指标明显增高。发芽6 d后,内糜8号总酚、总黄酮含量分别为发芽前的5.9和1.9倍,西农10-04号则分别为发芽前的4.6和1.9倍,抗氧化能力均显著增强(p<0.05)。此外,发芽4 d后芽中总酚、总黄酮含量及抗氧化能力显著高于(p<0.05)相应种子。总酚、总黄酮与抗氧化能力间均显示出极强的相关性,其中以总黄酮与FRAP相关性最高(r=0.985)。研究表明,发芽是一种有效提高糜子中酚类化合物含量及抗氧化活性的加工方式。
发芽,糜子,酚类化合物,抗氧化活性
糜子(Panicum miliaceum L.)又名稷、黍、糜,是人类最早驯化的作物之一,远在10000多年前新石器时期的中国北部,就已经被作为主食食用[1]。我国糜子种植总面积约100万公顷,主要分布在长城沿线等土壤贫瘠,气候干旱或半干旱地区[2]。糜子营养丰富,富含蛋白质、淀粉、脂肪、维生素和矿物质,其中籽粒中含蛋白质10.4%~17.4%,高于小麦等作物,具有很高的营养价值[3]。近年来的研究发现,糜子中还含有丰富的天然活性物质,如酚类物质、植酸等,这些活性物质具有降血糖、降血脂、抗氧化等功能。因此,糜子的加工及抗氧化特性越来越受到关注。
发芽会导致糜子中营养成分、生物活性物质及抗营养因子发生显著变化。Pradeep等[4]发现发芽会导致细柄黍中总酚、总黄酮和单宁含量显著升高,抗氧化能力也有所提高。Parameswaran等[5]的研究表明,发芽会导致糜子中游离氨基酸和总糖含量上升,而淀粉及干基含量则下降。目前关于发芽对糜子中酚类物质的影响研究鲜有报道。本文研究了糜子萌发过程中酚、黄酮含量及抗氧化活性的变化,分析了总酚、黄酮含量与抗氧化能力之间的相关性,以期为糜子深加工研究提供基础数据。
1 材料与方法
1.1材料与仪器
糜子样品內糜8号(以下简写为NM8)样品由鄂尔多斯农科所提供,2012年产于鄂尔多斯达拉特旗;西农10-04号(以下简写为XN)样品由西北农林科技大学提供,2012年产于陕西榆林;样品均在国家粮食局科学研究院冷库中保存;福林酚试剂、没食子酸、香兰素、儿茶素、DPPH、Trolox、ABTS、2,4,6-三吡啶基三嗪(TPTZ)、荧光素钠、AAPH西格玛奥德里奇(上海)贸易有限公司;芦丁国药集团化学试剂有限公司;过硫酸钾、乙酸、丙酮、NaOH、HCl、NaCl、乙酸乙酯、甲醇、Na2CO3、NaNO2、硝酸铝、硫酸钠、三水醋酸钠、三氯化铁北京化工厂。
DZF-6050型真空干燥箱上海博迅实业有限公司医疗设备厂;3K15型冷冻高速离心机Sigma公司;DW-86L338型立式超低温保存箱青岛海尔特种电冰柜有限公司;BUCHI旋转蒸发仪瑞士Buchi公司;BETA 2-8 LO plus CHRIST冷冻干燥机德国CHRIST公司;MD200-2型氮气吹扫仪杭州奥盛仪器有限公司;PHSJ-3F实验室pH计上海精科;IKA MS3 digital涡旋振荡器德国IKA;ML204型电子天平梅特勒-托利多仪器(上海)有限公司;TU-1810型紫外可见分光光度计北京普析通用仪器有限责任公司;PRX-350C型智能人工气候箱宁波海曙赛福实验仪器厂;2104 Multilabel Reader酶标仪PerkinElmer。
1.2实验方法
1.2.1样品的萌发采用Donkor等[6]的方法略有修改,糜子种子室温下浸泡于1.25%NaClO溶液(w/v=1∶5)中30 min,以去除表面的微生物,然后用自来水冲洗种子表面20~30 min,以去除残留的NaClO,再将种子浸泡于去离子水中24 h后用于发芽。取适量种子均匀铺于铺有无菌纱布的平皿中后放入预消毒的培养箱中,在相对湿度95%,温度25℃环境中避光发芽6 d,每12 h喷洒去离子水,每24 h取样处理,种子取样后立即保存于-80℃。
1.2.2样品处理发芽样品经冷冻干燥后粉碎,粉末采用超声辅助萃取法去脂。向样品中加入正己烷(w/v=1∶5)后置于超声仪中萃取5 min,间歇涡旋混匀,萃取过程中向超声仪中加入冰块保持低温,离心后弃去上清,重复3次,得到的固体于45℃真空烘箱中干燥,得到的粉末保存于-20℃待测。
1.2.3游离酚的提取参照Anoma等[7]的方法,略有改动,准确称取2 g脱脂样品于离心管中,加入20 mL 80%丙酮,将管盖拧紧并混匀,然后置于超声30 min,超声期间加入冰块保持低温,每隔2 min取出涡旋混匀,超声之后6000 r/min离心10 min,将上清收集到新的离心管,提取过程重复三次,将三次的提取液合并,45℃旋转蒸发后冷冻干燥,粉末用70%甲醇定容至2 mL,保存于-80℃待用。每个样品共提取3份。
1.2.4结合酚的提取参考ADOM等[8]的方法,略有改动,使用上述游离型的提取方法进行处理,弃掉上清液,保留固形物备用。之后将残渣氮吹2 min,接着室温下向残渣中加入2 mol/L NaOH 20 mL,振荡1 h进行消化处理。消化结束后的悬液加入6 mol/L盐酸进行中和并调pH至2。之后加入乙酸乙酯,振荡混匀,静置10 min,2500×g离心10 min,收集上层溶液(乙酸乙酯部分),重复使用乙酸乙酯萃取5次。收集上述所有溶液在45℃旋转蒸发至干,用70%甲醇定容至2 mL。提取产物存储于-80℃。每个样品共提取3份。
1.2.5酚含量测定酚含量测定采用Folin-Ciocalteu法[9],以没食子酸为标准品制作标准曲线,样品酚含量以每克干基中所含没食子酸当量的毫克数表示(简写为mg GAE/g DW)。
1.2.6黄酮含量测定黄酮的测定采用NaNO2-Al(NO3)3比色法[10],以芦丁为标准品制作标准曲线,样品黄酮含量以每克干基中所含芦丁当量的毫克数表示(简写为mg RE/g DW)。
1.2.7DPPH法测定抗氧化能力采用Brand[11]和Thaipong[12]的方法稍作修改,200 μL适当稀释的提取液加入3.8 mL 0.1 mmol/L的DPPH溶液中,涡旋混匀后避光处放置30 min,在515 nm处测定吸光度,以Trolox(水溶性维生素E)为标准品制作标准曲线,结果以每克干基中所含Trolox当量的微摩尔数表示(简写为μmol TE/g DW)。
1.2.8ABTS法测定抗氧化能力采用Arnao[13]和Thaipong[12]的方法,适当稀释的提取液150 μL加入2.85 mL配制的ABTS+·溶液,涡旋混匀后避光处放置30 min,在734 nm处测定吸光度,以Trolox(水溶性维生素E)为标准品制作标准曲线,结果以每克干基中所含Trolox当量的微摩尔数表示(简写为μmol TE/g DW)。
1.2.9FRAP法测定抗氧化能力采用Benzie[14-15]的方法稍作修改,适当稀释的提取液150 μL加入2.85 mL配制的FRAP溶液,涡旋混匀后避光处放置30 min,在593 nm处测定吸光度,以Trolox(水溶性维生素E)为标准品制作标准曲线,结果以每克干基中所含Trolox当量的微摩尔数表示(简写为μmol TE/g DW)。
1.2.10ORAC法测定抗氧化能力采用Huang等[16]的方法,向96孔板中加入20 μL适当稀释的提取物和200 μL荧光素钠溶液,盖上96孔板于37℃预热20 min,向各孔中加入20 μL AAPH溶液,立即用酶标仪测定各孔的荧光强度(激发波长485 nm,吸收波长520 nm),每5 min测定一次,共循环测定35次,以Trolox(水溶性维生素E)为标准品制作标准曲线,结果以每克干基中所含Trolox当量的微摩尔数表示(简写为μmol TE/g DW)。
1.3数据处理
数据以均数±标准差表示,使用SPSS 17.0进行显著性分析及相关性分析,使用Origin 8.6作图。
2 结果与分析
2.1发芽对糜子酚含量的影响
由图1可知,发芽导致糜子中游离酚、结合酚及总酚含量显著增加(p<0.05)。从发芽开始到2 d,游离酚、结合酚及总酚含量增加比较平缓,从2~5 d,游离酚、结合酚及总酚含量显著增加,5~6 d则趋于平缓。发芽6 d后,NM8游离酚、结合酚及总酚含量分别为发芽前12.7、3.1、5.9倍,游离酚占总酚比例由29.0%增加到62.8%;XN游离酚、结合酚及总酚含量则分别为发芽前10.7、2.6、4.9倍,游离酚占总酚比例由28.3%增加到61.9%,表明游离酚增长速度远高于结合酚。
Ti等[17]在对发芽糙米的研究过程中也发现了发芽导致游离酚、结合酚升高的现象。原因可能为发芽过程中产生的酶破坏了细胞壁等结构,释放了与细胞壁等结构相结合的酚类物质,导致游离及结合酚含量升高[18]。其中增加的游离酚可能来源于发芽过程中酚的合成与转化,如葡糖苷酶可以调控从糖苷中释放苷配基,从而释放或合成酚;结合酚在酶作用下释放成为游离酚[17]。结合酚增加的可能原因是碱水解法无法完全提取结合酚,发芽过程中由于酶裂解细胞壁等作用导致一部分原本无法通过碱水解法提取的结合酚被提取出来,导致含量的升高。
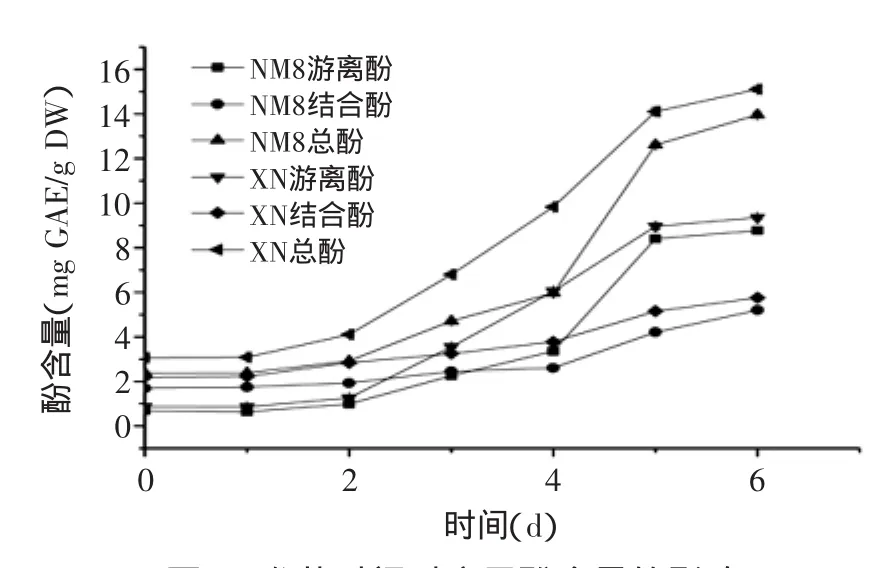
图1 发芽时间对糜子酚含量的影响Fig.1 Influence of germination time on content of phenolics
2.2发芽对糜子黄酮含量的影响
由图2可知,发芽导致糜子中游离黄酮、结合黄酮及总黄酮含量显著增加(p<0.05),与酚含量趋势相似。从发芽2 d起,结合黄酮及总黄酮含量呈不断上升趋势,而游离黄酮含量在增长到4 d后趋于平缓甚至出现下降。发芽6 d后,NM8游离黄酮、结合黄酮及总黄酮含量分别为发芽前1.6、2.2、1.9倍;XN游离黄酮、结合黄酮及总黄酮含量则分别为发芽前2.2、1.7、1.9倍。
Kim等[19]的研究发现,燕麦、大麦、黑麦和小麦发芽后黄酮含量均上升,其中发芽小麦黄酮含量为发芽前2.22倍,这与笔者的研究结果有相似之处。发芽导致黄酮含量上升的原因与酚含量上升相似。
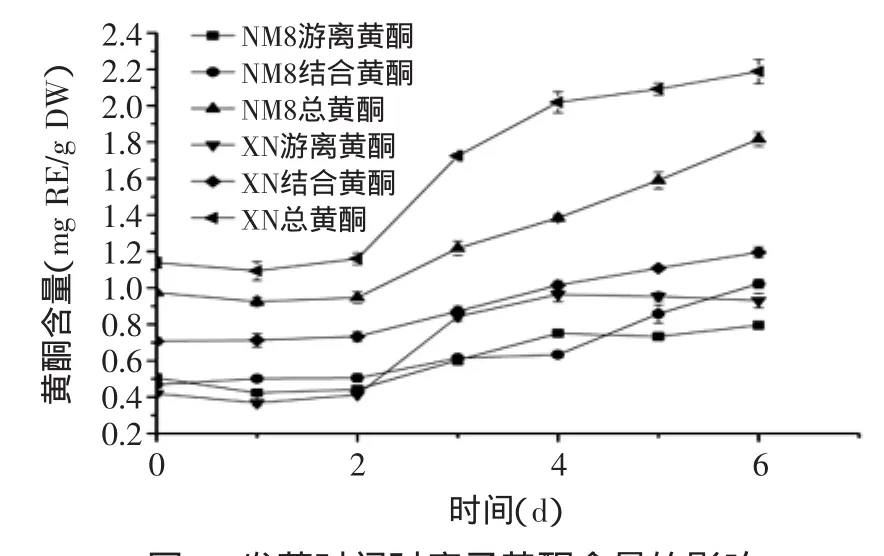
图2 发芽时间对糜子黄酮含量的影响Fig.2 Influence of germination time on content of phenols
2.3发芽对糜子抗氧化能力的影响
由图3~图6可知,在发芽过程中,糜子提取物抗氧化能力显著增强,其中DPPH、ABTS及FRAP值表现出相似的增加趋势,ORAC值则略有不同,可能与所清除的自由基不同有关。
由图3可知,DPPH值随发芽时间增加而升高,从发芽开始到2 d,游离酚DPPH值、结合酚DPPH值及总酚DPPH值升高比较平缓,从2~5 d则显著增加,5~6 d趋于平缓,XN游离酚DPPH值反而有所下降。此趋势与发芽对酚含量影响相似,表明DPPH值的升高与酚含量的增加有直接关系[4]。从图中还可以发现,发芽6 d后NM8和XN游离酚含量占总酚比例分别为62.8%和61.9%,但对总酚DPPH值的贡献率仅分别为37.5%和41.5%,表明结合酚对DPPH的清除能力高于游离酚,可能与所含酚的种类不同,而不同种类酚对DPPH自由基清除能力不同有关。
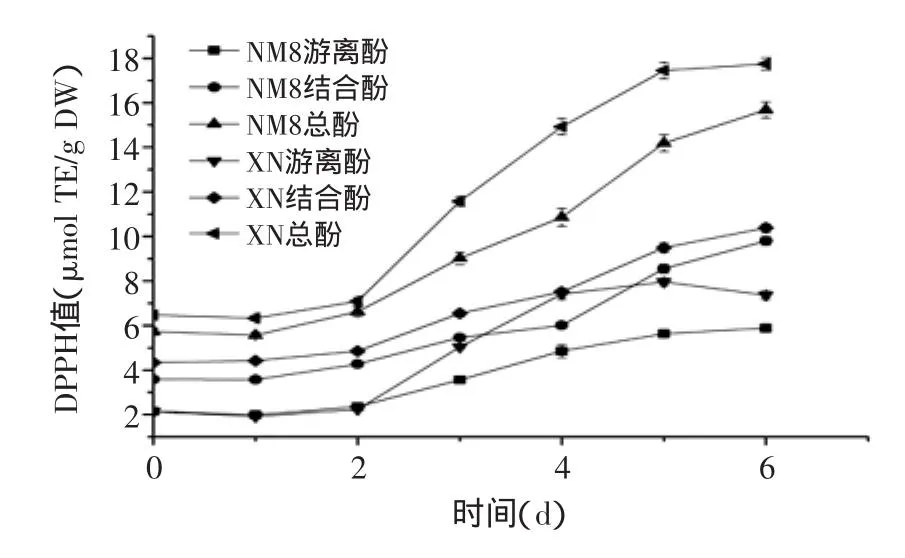
图3 发芽时间对糜子提取物DPPH值的影响Fig.3 Influence of germination time on DPPH value of extracts
发芽可以提高糜子提取物抗氧化能力,在对其他谷物的研究中也得出了相似的结果。Pradeep等[20]研究了发芽、蒸以及微波处理对食用稗、谷子和糜子中酚类物质及抗氧化性的影响,发现经过发芽处理后,提取物酚、黄酮含量增加最为显著,较其他加工方式表现出更强的抗氧化能力。
由图4、图5可知,发芽时间对ABTS及FRAP值的影响趋势与酚含量趋势相似。至发芽6 d,NM8游离酚、结合酚ABTS值分别为发芽前3.7和2.7倍,对总ABTS值的贡献率分别为30.2%和69.8%;NM8游离酚、结合酚FRAP值分别为发芽前3.3和2.8倍,对总FRAP值的贡献率分别为26.0%和74.0%;XN游离酚、结合酚ABTS值分别为发芽前3.3和2.2倍,对总ABTS值的贡献率分别为32.1%和67.9%;XN游离酚、结合酚FRAP值分别为发芽前3.3和2.2倍,对总FRAP值的贡献率分别为28.7%和71.3%。
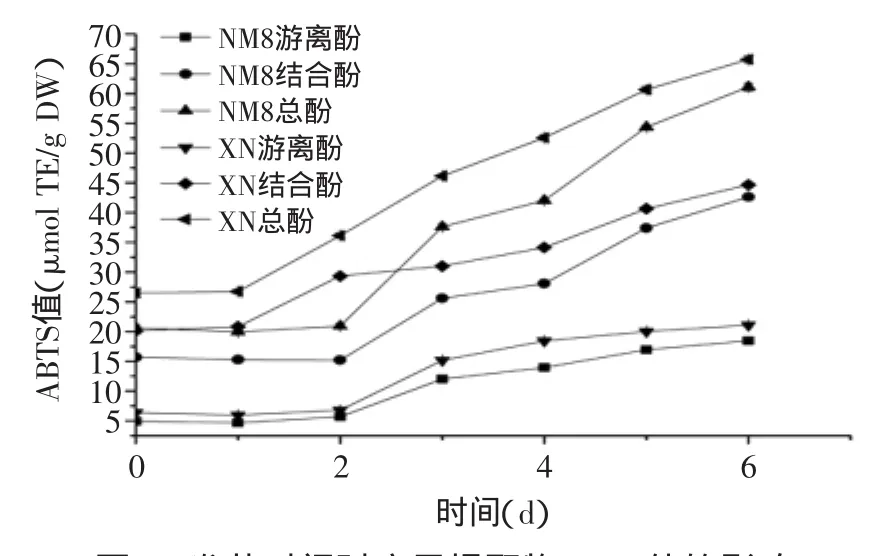
图4 发芽时间对糜子提取物ABTS值的影响Fig.4 Influence of germination time on ABTS value of extracts
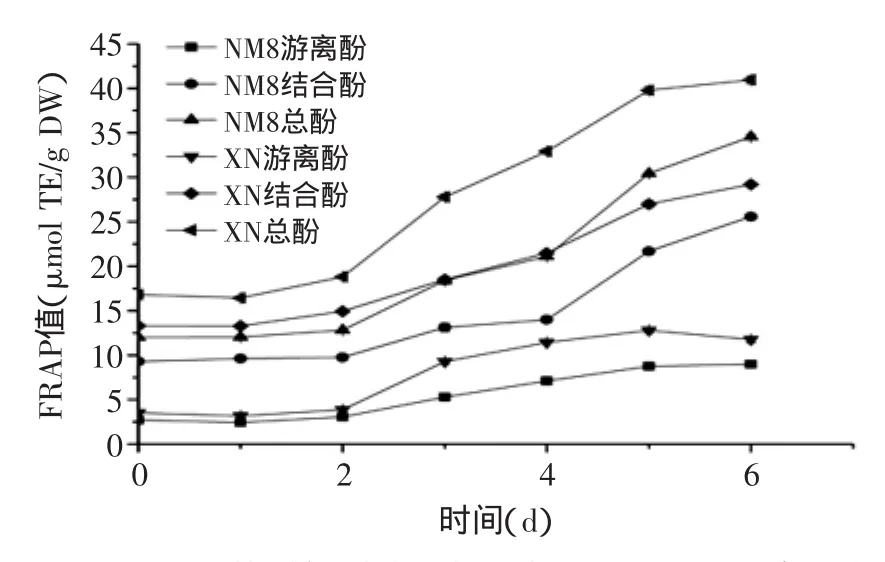
图5 发芽时间对糜子提取物FRAP值的影响Fig.5 Influence of germination time on FRAP value of extracts
由图6可知,ORAC值随发芽时间增加而升高,至6 d时达到最高。游离酚ORAC值自2 d起显著升高,其中XN在第5~6 d时略有增加,而NM8则持续升高;相较于游离酚ORAC值,结合酚ORAC值升高较为平缓。至发芽6 d,NM8游离酚、结合酚ORAC值分别为发芽前16.5和2.0倍,对总ORAC值的贡献率分别为68.1%和31.9%;XN游离酚、结合酚ORAC值分别为发芽前9.6和2.6倍,对总ORAC值的贡献率分别为53.4%和46.6%。表明发芽6 d后,游离酚对总ORAC值的贡献率高于结合酚,与游离酚占总酚比值接近,与前三个抗氧化指标的结果不一致。原因可能为,ORAC法与其他三种抗氧化方法机理存在不同,ORAC法基于氢原子转移,而其他三种抗氧化方法以及福林-酚法是基于电子转移;游离酚与结合酚中所含酚种类不同,对不同自由基清除能力不同;ORAC法考虑了抗氧化剂的动力学反应,与其他方法不同[21]。
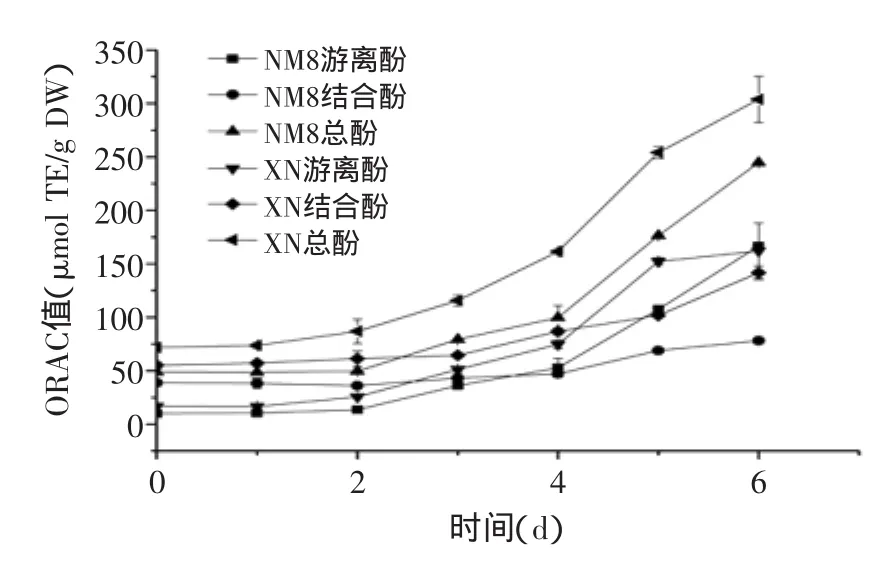
图6 发芽时间对糜子提取物ORAC值的影响Fig.6 Influence of germination time on ORAC value of extracts
2.4芽中酚类物质及抗氧化活性
由表1及图1~图6可知,发芽4 d后芽中游离酚、总酚、游离黄酮、总黄酮及相应抗氧化能力显著(p<0.05)高于籽粒,结合酚、结合黄酮及其抗氧化能力因指标及糜子品种不同而显示出不同的变化。以NM8酚含量为例,发芽4 d籽粒中游离酚、结合酚及总酚含量分别为3.36、2.61、5.97mg GE/g DW,芽中含量则分别为40.41、4.14、44.55 mg GE/g DW,分别增加11.0、0.59、6.5倍,然而在XN中,结合酚含量反而较籽粒中低36.8%,此现象也同时出现在4个抗氧化指标结果中。
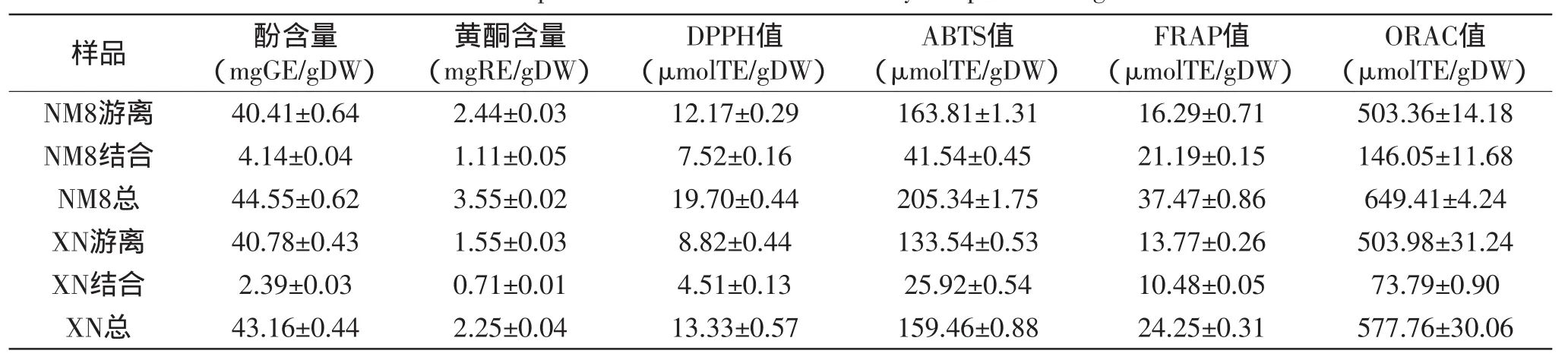
表1 发芽4d后糜子芽中酚类物质含量及抗氧化活性Table 1 Content of phenolics and antioxidant activity in sprout after germination 4d
Pająk等[22]在对绿豆、胡萝卜、花椰菜和葵花籽的萌发研究中发现,芽中总酚、总黄酮含量远高于籽粒中含量,相应的抗氧化能力也显著高于籽粒,这与我们的研究结果一致。表明籽粒只是为发芽提供蛋白质、淀粉等必需物质的储存库[23],酶反应的主要场所在芽中,导致芽中的酚类物质等含量显著高于籽粒。
2.5发芽过程中糜子总酚、总黄酮含量与抗氧化能力之间的相关性
对发芽过程中糜子总酚、总黄酮含量与抗氧化能力之间做相关性分析,结果如表2所示,总酚、总黄酮及各项抗氧化能力间均存在极显著的相关性(r均大于0.9,p<0.01),其中以总黄酮与FRAP之间的相关性最高(r=0.985)。在与相关文献[12,21]对比中发现,除本文得到的ORAC与其他指标的相关性均很高外,研究结果基本一致。原因可能与提取、检测方法及作物种类不同有关。
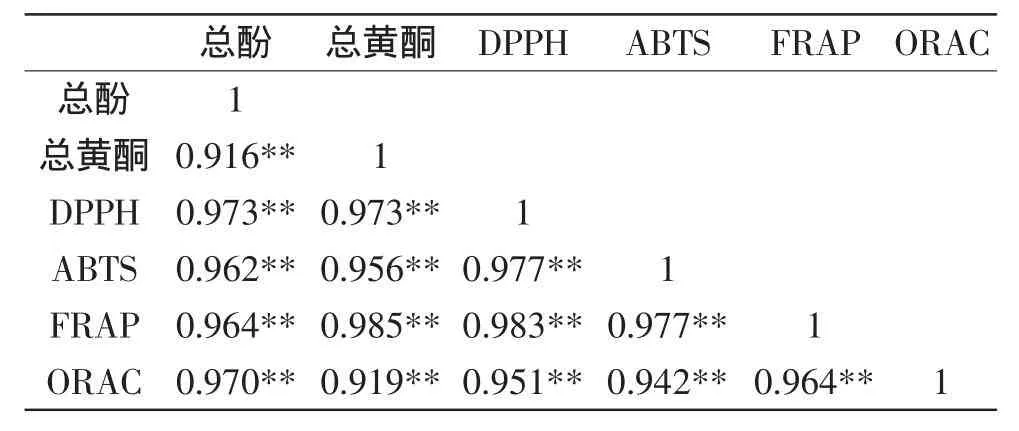
表2 总酚、总黄酮与抗氧化能力Pearson相关性分析Table 2 Pearson’scorrelationcoefficientsbetweentotalphenolics content,total flavonoids content and antioxidant activities
3 结论
糜子酚、黄酮含量及抗氧化能力在发芽过程显著升高。游离酚含量随发芽时间的增长速率高于结合酚,但对于总DPPH、ABTS和FRAP抗氧化能力的贡献率低于结合酚,仅对于总ORAC抗氧化能力贡献率高于结合酚。芽中游离酚、总酚、游离黄酮、总黄酮及相应抗氧化能力显著(p<0.05)高于籽粒,其中酚、黄酮的主要存在形式为游离型。发芽过程中总酚、总黄酮及各项抗氧化能力间存在极显著的相关性(r均大于0.9,p<0.01)。总体而言,发芽是一种可以有效提高糜子中生物活性物质含量以及抗氧化能力的处理方式。
[1]Lu H,Zhang J,Liu K,et al.Earliest domestication of common millet(Panicum miliaceum)in East Asia extended to 10,000 years ago[J].Proceedings of the National Academy of Sciences,2009,106(18):7367-7372.
[2]柴岩.糜子(黄米)的营养和生产概况[J].粮食加工,2009,34(4):90-91.
[3]姚亚平,田呈瑞,张国权,等.糜子淀粉理化性质的分析[J].中国粮油学报,2009(9):45-52.
[4]Pradeep S R,Guha M.Effect of processing methods on the nutraceutical and antioxidant properties of little millet(Panicum sumatrense)extracts[J].Food Chemistry,2011,126(4):1643-1647.
[5]Parameswaran K P,Sadasivam S.Changes in the carbohydrates and nitrogenous components during germination of proso millet(Panicum miliaceum)[J].Plant Foods for Human Nutrition,1994,45(2):97-102.
[6]Donkor O N,Stojanovska L,Ginn P,et al.Germinated grains-Sources of bioactive compounds[J].Food Chemistry,2012,135(3):950-959.
[7]Anoma C,Marian N,Fereidoon S.Effect of processing on the antioxidant activity of millet grains[J].Food Chemistry,2012,133(1):1-9.
[8]Adom K K,Liu R H.Antioxidant activity of grains[J].Journal of Agricultural and Food Chemistry,2002,50(21):6182-6187.
[9]Singleton V L,Rossi J A.Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J].American journal of Enology and Viticulture,1965,16(3):144-158.
[10]Bao J S,Cai Y Z,Sun M,et al.Anthocyanins,flavonols,and free radical scavenging activity of Chinese bayberry(Myrica rubra)extracts and their color properties and stability[J].Journal of Agricultural and Food Chemistry,2005,53(6):2327-2332.
[11]Brand-Williams W,Cuvelier M E,Berset C.Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Science and Technology,1995,28(1):25-30.
[12]Thaipong K,Boonprakob U,Crosby K,et al.Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].Journal of Food Composition and Analysis,2006,19(6):669-675.
[13]Arnao M B,Cano A,Acosta M.The hydrophilic and lipophilic contribution to total antioxidant activity[J].Food Chemistry,2001,73(2):239-244.
[14]Benzie I F F,Strain J J.The ferric reducing ability of plasma(FRAP)as a measure of“antioxidant power”:the FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[15]Benzie I F F,Strain J J.Ferric reducing/antioxidant power assay:Direct measure of total antioxidant activity of biological fluids and modified version for simultaneous measurement of total antioxidant power and ascorbic acid concentration[J]. Methods in Enzymology,1999,299:15-27.
[16]Huang D,Ou B,Hampsch-Woodill M,et al.High-throughput assay of oxygen radical absorbance capacity(ORAC)using a multichannel liquid handling system coupled with a microplate fluorescence reader in 96-well format[J].Journal of Agricultural and Food Chemistry,2002,50(16):4437-4444.
[17]Ti H,Zhang R,Zhang M,et al.Dynamic changes in the free and bound phenolic compounds and antioxidant activity of brown rice at different germination stages[J].Food Chemistry,2014,161:337-344.
[18]Kaukovirta-Norja A,Wilhelmson A,Poutanen K.Germination:a means to improve the functionality of oat[J].Agricultural and Food Science,2004,13(1-2):100-112.
[19]Kim H Y,Lee S H,Hwang I G,et al.Antioxidant and antiproliferation activities of winter cereal crops before and after germination[J].Food Science and Biotechnology,2013,22(1):181-186.
[20]Pradeep P M,Sreerama Y N.Impact of processing on the phenolic profiles of small millets:Evaluation of their antioxidant and enzyme inhibitory properties associated with hyperglycemia[J].Food Chemistry,2015,169:455-463.
[21]Dudonne S,Vitrac X,Coutiere P,et al.Comparative study of antioxidant properties and total phenolic content of 30 plantextracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC assays[J].Journal of Agricultural and Food Chemistry,2009,57(5):1768-1774.
[22]Pająk P,Socha R,Gałkowska D,et al.Phenolic profile and antioxidant activity in selected seeds and sprouts[J].Food Chemistry,2014,143:300-306.
[23]Pérez-Balibrea S,Moreno D A,García-Viguera C.Genotypic effects on the phytochemical quality of seeds and sprouts from commercial broccoli cultivars[J].Food Chemistry,2011,125(2):348-354.
Effect of germination on phenolics and antioxidant activity of proso millet
ZHENG Lu1,2,WANG Xing-guo1,*,HAN Fei2,*,LIANG Ya-jing2,DI Wen-long2,CHEN Xi2,LI Ai-ke2,GUAN Xiao3
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Academy of State Administration of Grain,Beijing 100037,China;3.School of Medical Instruments and Food Engineering,University of Shanghai for Science and Technology,Shanghai 200093,China)
The influence of germination on antioxidant activity,phenolics content and form of proso millet were studied.The changes of phenolics,flavonoids and antioxidant properties(DPPH and ABTS,FRAP,ORAC)of surface sterilized proso millet seeds during germination were determined in artificial climate box for 6 d at 25℃and RH 95%.The result showed that the contents of phenolics,flavonoids and antioxidant properties increase obviously from 2 d.Germination after 6 d,the total content of phenolics and flavonoids of NM8 increase 5.9 and 1.9 times respectively,and 4.6 and 1.9 times for XN10-04,meanwhile,its antioxidant capacity increase significantly(p<0.05).In addition,total content of phenolics and flavonoids and antioxidant capacity of the sprouts were significantly higher(p<0.05)than that of seeds after 4 d.Correlation coefficients between total phenolics content,total flavonoids content and antioxidant activities were positively high,the highest correlation coefficient was found between total flavonoids content and FRAP(r=0.985).This study showed that germination was an effective method to increase the content of phenolic compounds and antioxidant activity of proso millet.
germination;proso millet;phenolics;antioxidant activity
TS213
A
1002-0306(2015)16-0124-06
10.13386/j.issn1002-0306.2015.16.017
2014-11-18
郑璐(1990-),男,硕士研究生,研究方向:粮油营养,E-mail:zhenglujd@163.com。
王兴国(1962-),男,博士,教授,研究方向:脂质深加工,E-mail:wxg1002@qq.com。韩飞(1973-),女,博士,副研究员,研究方向:粮油营养,E-mail:hf@chinagrain.org。
粮食公益性行业科研专项(201313011-6)。

