淡水鱼肠道中抗芽孢杆菌性乳酸菌的筛选与鉴定
缪璐欢,杜静芳,马欢欢,吕欣然,李 莹,白凤翎,仪淑敏,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州121013)
淡水鱼肠道中抗芽孢杆菌性乳酸菌的筛选与鉴定
缪璐欢,杜静芳,马欢欢,吕欣然,李莹,白凤翎*,仪淑敏,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州121013)
从淡水鱼肠道中筛选对芽孢杆菌具有较强拮抗活性的乳酸菌,结果表明:从鲤鱼肠道分离的菌株LY-19对蜡样芽孢杆菌和地衣芽孢杆菌的抑菌直径分别为16.89 mm和17.43 mm,活性主要来自无细胞上清液,在pH3.0~4.5范围内保持抗菌活性,经中性蛋白酶、胃蛋白酶、木瓜蛋白酶处理后丧失部分抑菌活性,对α-淀粉酶不敏感,在40~121℃范围内处理30 min后其拮抗活性基本不变,初步判定乳酸菌产生的抑菌物质为II型非糖基化类细菌素。根据生理生化特性和16S rDNA鉴定为清酒乳杆菌(Lactobacillus sakei)。
淡水鱼肠道,乳酸菌,拮抗,芽孢杆菌,鉴定
芽孢杆菌在不利条件下能够形成具有特殊抵抗力的芽孢,污染食品后因具有耐热性而易残留,其中嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)和地衣芽孢杆菌(B.licheniformis)是导致食品腐败的主要因素[1]。仪淑敏等[2]研究发现地衣芽孢杆菌(B. licheniformis)是冷藏金线鱼鱼丸中的优势腐败菌,Rahmati等[3]研究表明海产品中存在导致食源性疾病的蜡样芽孢杆菌(B.cereus)。我国相关食品的标准中并没有明确蜡样芽孢杆菌(B.cereus)的残留限量值,爱尔兰对其在碎肉卷、丸状肝灌肠和烟熏鱼中的残留限量有明确的规定:满意值<102CFU/g,临界值103~104CFU/g,不满意值104~105CFU/g,大于105CFU/g时不可接受[4]。
对水产品而言,控制食品中芽孢杆菌的传统方法明显存在不足,物理法会影响产品的品质,化学法则存在一定的残留安全隐患。比较而言,生物防腐具有无损无毒的特点,可提高食品的安全性与稳定性,是控制食品中芽孢杆菌的最佳选择。乳酸菌(lacticacid bacteria,LAB)通过生态位竞争、形成酸性环境和产生拮抗性代谢产物等方式较好地控制食品中的腐败和致病微生物[5],细菌素如乳酸链球菌素能有效杀死或抑制引起食品腐败的革兰氏阳性菌,如肉毒杆菌(Clostridium botulinum)、单增李斯特氏菌(Listeria monocytogenes)等[6]。Yang等[7]研究表明在米粉发酵中通过添加乳酸菌可有效抑制蜡样芽孢杆菌菌株YSP-A3-2的生长。Mentes等[8]从酵头中分离的植物乳杆菌(Lactobacillus plantarum)LMO25和食品乳杆菌(L.alimentarius)LMO7在全麦面包中具有抑制地衣芽孢杆菌(B.licheniformis)的活性。水产品中致病菌主要来自环境、加工过程中污染以及本身固有的天然细菌类群,包括单增李斯特氏菌(L.monocytogenes)、沙门氏菌(Salmonella sp.)、埃希氏大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)和致病性弧菌等[9]。Robertson等[10]从大西洋鲑鱼中分离1株肉食杆菌(Carnobacterium sp.),研究发现它对杀鲑气单胞菌(Aeromonas salmonicida)、弧菌(Vibrio sp.)和鲁氏耶尔森菌(Yersinia ruckeri)等鱼类致病菌具有抑制作用。发酵乳制品、泡菜、发酵香肠、酵头和发酵鱼制品等都是拮抗性乳酸菌的重要来源,非发酵食品如鱼肠道也是拮抗鱼类致病菌乳酸菌的栖息地[11-16]。本文从淡水鱼肠道中分离筛选对芽孢杆菌具有拮抗活性的乳酸菌,从中筛选热稳定性菌株,为控制水产品中芽孢杆菌引起的腐败和食源性疾病奠定基础。
1 材料与方法
1.1材料与仪器
鲫鱼、鲤鱼、鲢鱼、草鱼、鳙鱼和镜鲤锦州市水产市场;地衣芽孢杆菌(Bacillus licheniformis)ACCC 11091中国农业微生物菌种保藏管理中心;蜡样芽孢杆菌(Bacillus cereus)CMCC 63301中国医学微生物菌种保藏管理中心;MRS培养基、LB培养基北京奥博星生物技术有限公司;胃蛋白酶、中性蛋白酶、木瓜蛋白酶和α-淀粉酶华蓝化学有限公司;乳酸菌生化鉴定管杭州天和微生物试剂有限公司;细菌基因组DNA快速抽提试剂盒、DNA marker-D、Taq PCR Master Mix上海生工生物工程有限公司。
DL-CJ-2N型超级洁净工作台东联哈尔(北京)仪器制造有限公司;LRH系列生化培养箱上海一恒科学仪器有限公司;MOTIC BA300数码显微镜日本麦克奥迪(MOTIC);5804R冷冻高速离心机、PCR仪德国Eppendorf公司;Quantity one凝胶成像系统美国Bio-Rad公司;GI54DS立式高压蒸汽灭菌锅致微(厦门)仪器有限公司;IKA Vortex GENIUS 3振荡器德国IKA公司;水系针筒过滤器上海兴亚净化材料厂。
1.2实验方法
1.2.1乳酸菌菌株分离在无菌条件下,分别刮取鲫鱼、鲤鱼、鲢鱼、草鱼、鳙鱼、镜鲤肠粘膜及内容物10 g置于90 mL灭菌生理盐水中,应用IKA Vortex GENIUS 3振荡器充分振荡5 min后在1%CaCO3的MRS培养基划线接种,37℃培养48 h。挑取有溶钙圈的白色菌落进一步分离纯化,挑取单菌落进行革兰氏染色和过氧化氢酶实验。
1.2.2拮抗性乳酸菌菌株筛选分别取分离菌株24 h MRS培养液10.0 mL,经8000 r/min 4℃离心5 min的菌体溶于10 mL无菌生理盐水中,取上清液用0.45 μm滤器过滤获得无细胞上清液(cell-free supernatants,CFS),参照文献[17]利用牛津杯打孔法对供试菌株B.licheniformis ACCC 11091和B.cereus CMCC 63301进行拮抗性实验,其中供试菌株菌液浓度为106CFU/mL,筛选对芽孢杆菌具有拮抗活性的菌株。
1.2.3乳酸菌无细胞提取物抗菌作用研究酶活性测定[18-19]:将乳酸菌CFS调至pH7.0,分别加入中性蛋白酶、木瓜蛋白酶和α-淀粉酶,使终浓度为1 mg/mL;将乳酸菌CFS调pH2.0,加入胃蛋白酶,使终浓度为1 mg/mL。在37℃水浴中孵育2 h,调pH与乳酸菌CFS相同,按1.2.2方法测定拮抗活性。
pH耐受性测定:用1 mol/L HCl调MRS液体培养基至与乳酸菌CFS分别相同的pH,用1 mol/L HCl或NaOH将乳酸菌CFS分别调节pH至3.0、3.5、4.0、4.5、5.0,按1.2.2方法测定拮抗活性。
热稳定性测定:对乳酸菌CFS分别在40、60、80、100、121℃条件下处理30 min后,按1.2.2方法测定拮抗活性。
1.2.4乳酸菌菌株鉴定生理生化鉴定:对筛选的乳酸菌菌株参照《乳酸细菌分类鉴定及实验方法》和《常见细菌系统鉴定手册》进行生理生化实验鉴定[20-21]。
分子生物学鉴定:取对数期的乳酸菌培养物,DNA快速抽提试剂盒提取DNA。通用引物为:27f:5′-AGAGTTTGATCCTGGCTCAG-3′,1492r:5′-TACGG YTACCTTTGTTACGACTT-3′。PCR扩增反应体系(25 μL):上下游引物各1.0 μL,DNA模板1.0 μL,Taq PCR Master Mix 12.5 μL,超纯水9.5 μL。PCR扩增反应程序:94℃2 min,94℃1 min,60℃1 min,72℃90 s,循环30次,4℃保温。扩增产物经1%琼脂糖凝胶电泳分析后送生工生物工程(上海)股份有限公司测序。测序序列登陆GenBank进行BLAST同源性比较,应用MEGA 5.0软件构建系统发育进化树。
应用SPSS12.0分析数据。计量数据以±s表示,用t检验;计数资料以百分数(%)表示,率的比较采用)X2检验。P<0.05为差异具有统计学意义,P<0.01为有显著统计学意义。
1.2.5实验数据处理实验数据采用Origin 8.0软件进行分析处理。
2 结果与讨论
2.1菌株分离
从鲫鱼、鲤鱼、鲢鱼、草鱼、鳙鱼和镜鲤肠道中共分离获得137个菌落,经革兰氏染色和过氧化氢酶实验初步鉴定出44株乳酸菌,纯化后按来源和挑取顺序命名。
2.2拮抗性乳酸菌菌株筛选
从44株乳酸菌中筛选出21株对B.cereus CMCC 63301和B.licheniformis ACCC 11091具有拮抗作用的乳酸菌,图1中A图是菌株LY-19的菌体和CFS对106CFU/mL B.cereus CMCC 63301的抑菌效果图,可以看出CFS具有明显的抑菌作用,菌体没有拮抗活性。图1中B图是菌株LY-19和LY-7的CFS对106CFU/mL B.licheniformis ACCC 11091的抑菌作用结果,可以看出水平方向菌株LY-19的抑菌圈明显,而垂直方向的菌株LY-7没有抑菌活性。

图1 乳酸菌菌体及CFS对蜡样芽孢杆菌和地衣芽孢杆菌的拮抗作用Fig.1 Antagonistic effects of LAB on B.cereus CMCC 63301 and B.licheniformis ACCC 11091
表1是21株乳酸菌CFS对B.cereus CMCC 63301和B.licheniformis ACCC 11091的拮抗作用结果,从中可以看出,菌株LY-19、LY-21、JY-22、JL-18对芽孢杆菌的拮抗作用较强,其中,4株菌对B.cereus CMCC 63301和B.licheniformis ACCC 11091的平均抑菌直径分别为16.89 mm和16.47 mm,菌株LY-19的抑菌直径分别为16.89 mm和17.43 mm,因此,选择菌株LY-19进行抑菌活性研究。
2.3拮抗作用研究
2.3.1酶对抑菌活性的影响菌株LY-19 CFS经中性蛋白酶、胃蛋白酶、木瓜蛋白酶处理后的抑菌结果见表2,从中可以看出拮抗活性均有不同程度下降,与CFS存在显著性差异(p<0.05),其中对木瓜蛋白酶的敏感性最高,对B.cereus CMCC 63301和B.licheniformis ACCC 11091抑制活性分别降低了12.55%和29.03%,对蛋白酶敏感表明该抑菌活性物质是蛋白质[22]。而经α-淀粉酶处理的拮抗活性基本不变,表明该菌株的抑菌物质为非糖基化类蛋白质[19]。因此,可初步判断菌株LY-19形成的拮抗物质可能是乳酸菌素。
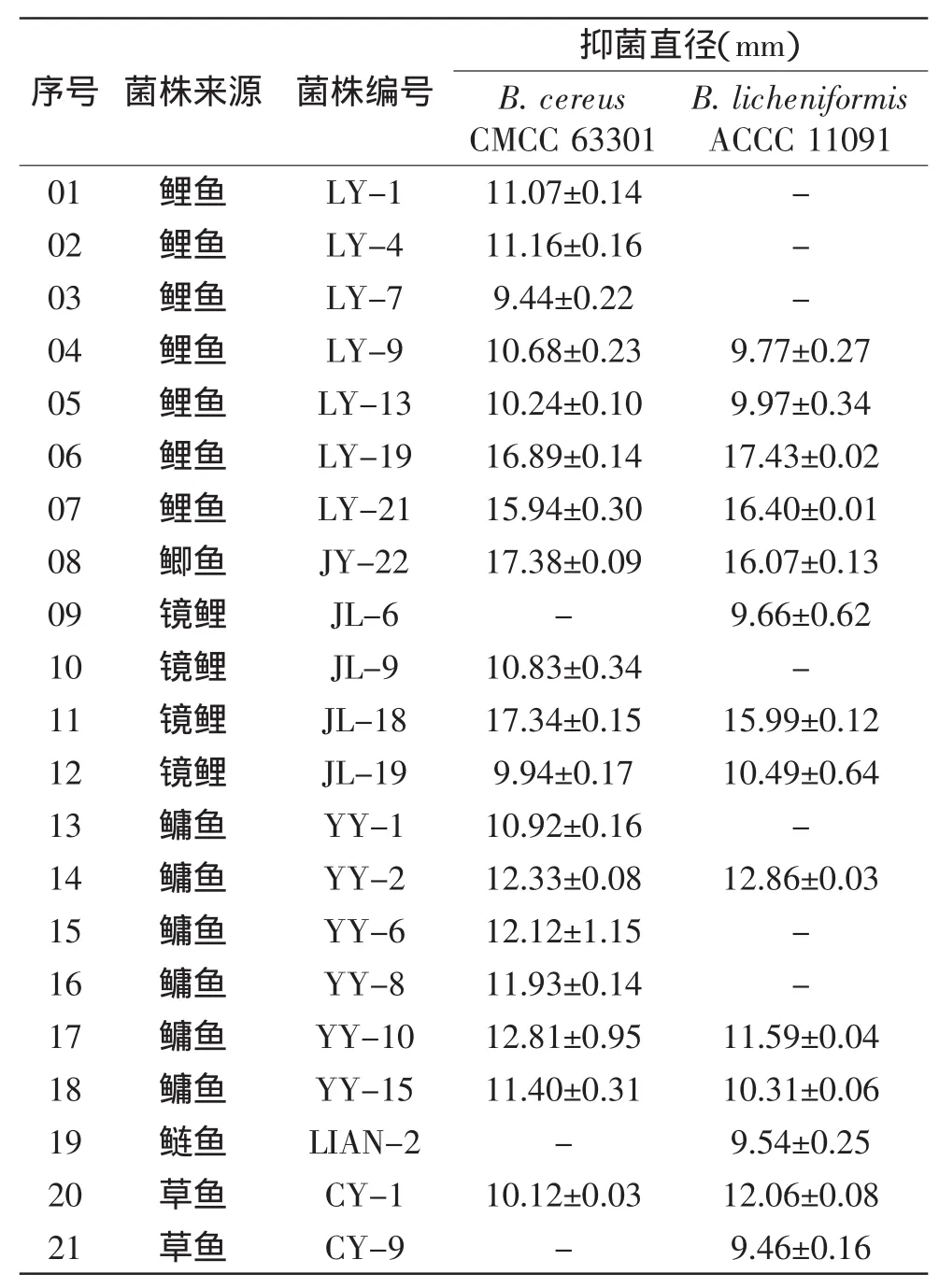
表1 淡水鱼肠道中乳酸菌CFS对芽孢杆菌的拮抗作用Table 1 Antagonistic effects against Bacillus spp.of LAB CFS from freshwater fish intestinal

表2 酶处理对菌株LY-19拮抗芽孢杆菌活性的影响Table 2 Effect of proteases treatment on the antagonistic activity of strain LY-19 CFS against Bacillus spp.
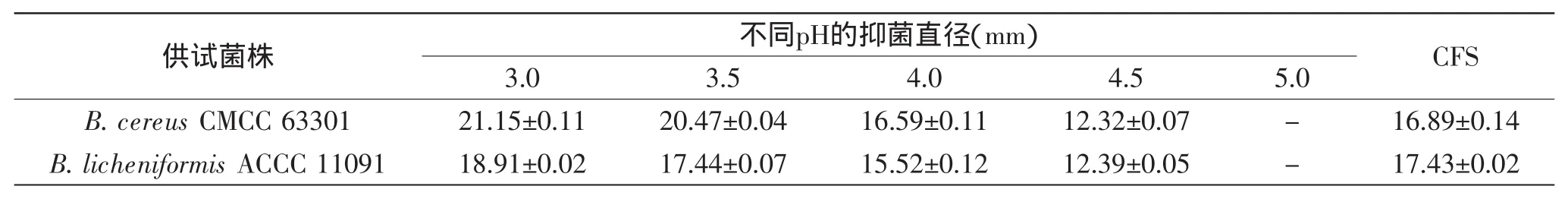
表3 pH对菌株LY-19拮抗芽孢杆菌活性的影响Table 3 Effect of pH on the antagonistic activity of strain LY-19 CFS against Bacillus spp.
2.3.2pH对抑菌活性的影响表3是LY-19 CFS在不同pH条件下对芽孢杆菌的拮抗结果,从中可以看出,与CFS(pH3.8)相比对两株芽孢杆菌的拮抗作用随着pH升高而逐渐下降,当上升至pH5.0时,抑菌圈消失。当pH低于3.8时,其抑菌效果高于CFS,表明其抑菌作用来自CFS和酸性物质的叠加效应;当pH高于3.8时,由于pH升高减弱了CFS中抑菌物质的活性,可能由于该抑菌物质在酸性条件下比较稳定[23]。同时也表明,LY-19的抑菌活性不只来源于乳酸菌的酸性代谢产物。Campos等[24]报道了来自大菱鲆的乳酸菌是通过产生细菌素抑制病原菌单增李斯特氏菌(L.monocytogenes)和金黄色葡萄球菌(St.aureus)的生长,而非乳酸或乙酸等有机酸的作用结果。
2.3.3热处理对抑菌活性的影响图2为菌株LY-19 CFS经40、60、80、100、121℃加热处理30 min后的抑菌活性变化情况,从中可以看出,热处理后的CFS抑菌活性变化不大。其中,经121℃处理30min对B.cereus CMCC 63301的抑制活性稍有下降,而对B.licheniformis ACCC 11091的抑制活性基本不变。Chahad等[25]从鲈鱼和海鲤中分离的乳酸菌对肉食杆菌(Carnobacterium sp.)、芽孢杆菌(Bacillus sp.)和单增李斯特氏菌(L.monocytogenes)等致病菌具有拮抗活性,经热处理后仍具有抑菌活性,经鉴定其活性物质为Ⅱ型乳酸菌素,与本文研究结果相符。

图2 热处理对菌株LY-19拮抗芽孢杆菌活性的影响Fig.2 Effect of thermal treatment on the antagonistic activity of strain LY-19 CFS against Bacillus spp.
2.4菌株鉴定
生理生化鉴定:对菌株LY-19的生理生化鉴定结果见表4,查阅文献[20-21]可初步断定菌株为清酒乳杆菌(Lb.sakei)。

表4 菌株LY-19的生理生化鉴定结果Table 4 Physiological and biochemical test results of strain LY-19
分子生物学鉴定:图3是菌株LY-19的16S rDNA基因扩增电泳图,从图3中可以看到在1500 bp处出现特异性亮带,表明目标片段被成功扩增。扩增产物送至生工生物工程(上海)股份有限公司测序,将菌株测序结果与NCBI数据库中已知序列进行比对,构建系统发育树,结果见图4。从图4中可以看出,菌株LY-19与Lb.sakei(KJ 560867、KJ 531395和KJ 812206)在同一个分支上,同源性为100%,因此结合生理生化鉴定结果,确定菌株LY-19为清酒乳杆菌(Lb.sakei)。
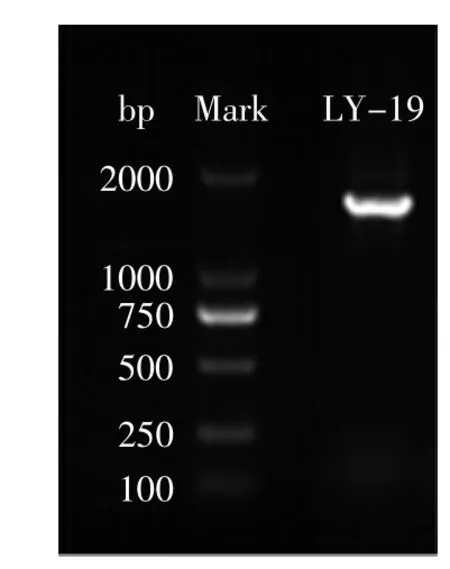
图3 菌株LY-19的16S rDNA基因扩增电泳图Fig.3 PCR amplification of 16S rDNA gene of strain LY-19

图4 菌株LY-19的16S rDNA系统发育树Fig.4 The phylogenetic tree for sequences of strain LY-19
3 结论
从淡水鲤鱼肠道中分离出一株对蜡样芽孢杆菌和地衣芽孢杆菌具有拮抗活性的乳酸菌LY-19,通过形态学、生理生化分析和16S rDNA序列测定,鉴定该菌株为清酒乳杆菌(Lb.sakei)。菌株LY-19 CFS的抑菌活性在酸性条件下比较稳定,经蛋白酶处理可降低抑菌作用,对121℃热处理十分稳定,初步判定该菌株的抑菌物质为非糖基化类的乳酸菌素类物质。
[1]CotonM,DenisC,CadotP,etal.Biodiversityandcharacterization of aerobic spore-forming bacteria in surimi seafood products[J]. Food Microbiology,2011,28(2):252-260.
[2]仪淑敏,王雪琦,励建荣,等.鱼糜制品细菌菌群多样性的PCR-DGGE方法建立[J].中国食品学报,2014,14(7):192-198.
[3]Rahmati T,Labbe R.Levels and toxigenicity of Bacillus cereus and Clostridium perfringens from retail seafood[J].Journal of Food Protection,2008,71(6):1178-1185.
[4]吕志平.国内外技术法规和标准中食品微生物限量[M].北京:中国标准出版社,2002,136-138.
[5]Jamuna M,Jeevaratnam K.Isolation and partial characterization of bacteriocins from Pediococcus species[J].Applied Microbiology and Biotechnology,2004,65(4):433-439.
[6]Abdollahzadeh E,Rezaei M,Hosseini H,et al.Antibacterial activity of plant essential oils and extracts:The role of thyme essential oil,nisin,and their combination to control Listeria monocytogenes inoculated in minced fish meat[J].Food Control,2014,35(1):177-183.
[7]Rossland E,Andersen Borge G I,Langsrud T,et al.Inhibition of Bacillus cereus by strains of Lactobacillus and Lactococcus in milk[J].International Journal of Food Microbiology,2003,89(2):205-212.
[8]Mentes O,Ercan R,Akcelik M.Inhibitor activities of two Lactobacillus strains,isolated from sourdough,against ropeforming Bacillus strains[J].Food Control,2007,18(4):359-363.
[9]Tomé E,Gibbs P A,Teixeira P C,et al.Growth control Listeria innocua 2030c on vacuum-packaged cold-smoked salmon by lactic acid bacteria[J].International Journal of Food Microbiology,2008,121(3):285-294.
[10]Robertson P A,Burrels C,Williams P,et al.Use of Carnobacterium sp.as a probiotic for Atlantic salmon(Salmo salar L.)and rainbow trout(Oncorhynchus mykiss,Walbaum)[J]. Aquaculture,2000,185(3-4):235-243.
[11]LeiteAMO,LeiteDCA,DelAguilaE M,et al.Microbiological and chemical characteristics of Brazilian kefir during fermentation and storage processes[J].Journal of Dairy Science,2013,96(7):4149-4159.
[12]Hong Y,Yang H S,Chang H C,et al.Comparison of bacterial communitychangesinfermentingkimchiattwodifferent temperatures using a denaturing gradient gel electrophoresis analysis[J].Journal of Microbiology and Biotechnology,2013,23(1):76-84.
[13]Tran K,May B K,Smooker P M,et al.Distribution and genetic diversity of lactic acid bacteria from traditional fermented sausage[J].Food Research International,2011,44(1):338-344.
[14]Moroni A V,Arendt E K,Bello F D.Biodiversity of lactic acid bacteria and yeasts in spontaneously-fermented buckwheat and teff sourdoughs[J].Food Microbiology,2011,28(3):497-502.
[15]Pringsulaka O,Thongngam N,Suwannasai N,et al.Partial characterisation of bacteriocins produced by lactic acid bacteria isolated from Thai fermented meat and fish products[J].Food Control,2012,23(2):547-551.
[16]Balcázar J L,Vendrell D,de Blas I,et al.Characterization of probiotic properties of lactic acid bacteria isolated from intestinal microbiota of fish[J].Aquaculture,2008,278(1):188-191.
[17]于娜,陈忠军.具有抑菌作用乳酸菌的筛选及其抑菌物质特性的研究[J].食品科技,2011,36(5):13-17.
[18]朱军莉,王晔,励建荣.生物保鲜乳酸菌的筛选及其细菌素特性研究[J].中国酿造,2010,29(5):42-46.
[19]Sip A,Wieckowicz M,Olejnik-Schmidt A,et al.Anti-Listeria activity of lactic acid bacteria isolated from golka,a regional cheese produced in Poland[J].Food Control,2012,26(1):117-124.
[20]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:130-137.
[21]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:289-294.
[22]Ghanbari M,Jami M,Kneifel W,et al.Antimicrobial activity and partial characterization of bacteriocins produced by lactobacilli isolated from Sturgeon fish[J].Food Control,2013,32(2):379-385.
[23]Ponce A G,Moreira M R,del Valle C E,et al.Preliminary characterization of bacteriocin-like substances from lactic acid bacteria isolated from organic leafy vegetables[J].Food Science and Technology,2008,41(3):432-441.
[24]Campos C A,Rodriguez O,Calo-Mata P,et al.Preliminary characterizationofbacteriocinsfromLactococcuslactis,Enterococcus faecium and Enterococcus mundtii strains isolated from turbot(Psettamaxima)[J].Food Research International,2006,39(3):356-364.
[25]Chahad O B,Bour M E,Calo-mata P,et al.Discovery of novel biopreservation agents with inhibitory effects on growth of food-borne pathogens and their application to seafood products[J].Research in Microbiology,2012,163(1):44-54.
Screening and identification of lactic acid bacteria with antagonistic Bacillus spp.derived from freshwater fish intestine
MIAO Lu-huan,DU Jing-fang,MA Huan-huan,LV Xin-ran,LI Ying,BAI Feng-ling*,YI Shu-min,LI Jian-rong
(College of Food Science and Technology,Bohai University,Food Safety Key Lab of Liaoning Province,National&Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China)
Lactic acid bacteria(LAB)strains with strong antagonistic activity to Bacillus spp.were isolated from freshwater fish intestine in the study.The results showed that the diameters of inhibiting Bacillus cereus and Bacillus licheniformis by strain LY-19 from carp intestinal were 16.89 mm and 17.43 mm,respectively.The antagonistic activity was mainly from cell-free supernatants(CFS).The antibacterial activity of CFS kept within pH3.0~4.5,and lowered by treating with neutral protease,pepsin and papain,but was not sensitive to α-amylase. The antagonistic activity remained by thermal treatment from 40℃to 121℃for 30 min.The inhibitory substance of LAB produced was preliminary determined as type II non-glycosylation bacteriocin.Strain LY-19 was identified as Lactobacillus sakei according to physiological and biochemical characteristics and 16S rDNA sequence analysis.
freshwater fish intestine;lactic acid bacteria;antagonism;Bacillus spp.;identification
TS254.4
A
1002-0306(2015)16-0188-05
10.13386/j.issn1002-0306.2015.16.030
2014-11-18
缪璐欢(1991-),女,硕士研究生,研究方向:食品质量与安全控制,E-mail:miaoluhuan2013@163.com。
白凤翎(1964-),男,博士,教授,研究方向:食品质量与安全控制和食品微生物学,E-mail:baifling@163.com。
“十二五”国家科技支撑计划课题(2012BAD29B06);辽宁省高校学校创新团队课题(LT2014024)。

