红曲黄色素的分离纯化与表征
杨 强,郎天丹,岳建明,程 雷,张 婵,王成涛,*
(1.北京工商大学北京市食品添加剂工程技术研究中心,北京100048;2.食品质量与安全北京实验室,北京100048)
红曲黄色素的分离纯化与表征
杨强1,2,郎天丹1,岳建明1,程雷2,张婵1,2,王成涛1,2,*
(1.北京工商大学北京市食品添加剂工程技术研究中心,北京100048;2.食品质量与安全北京实验室,北京100048)
采用硅胶柱层析法对菌体内醇溶性红曲黄色素进行分离、纯化,并对纯化后的红曲黄色素结构及纯度进行液相质谱鉴定表征,得到柱层析最佳洗脱条件:洗脱剂配比正己烷∶乙酸乙酯(v/v)=1∶8,上样量1.5 mL,洗脱流速50 mL/h。分离纯化所得的红曲色素经液相质谱检测含红斑胺素、红曲素、红斑素三种色素组分,采用相对定量法对分离所得的红曲黄色素组分进行纯度表征,结果显示其纯化保存率达85%。
红曲黄色素,硅胶柱层析,分离纯化,液相质谱
红曲色素是红曲霉的一种次级代谢产物,其结构为一种聚酮类化合物[1-2]。红曲色素是一种复合色素,目前已被鉴定并且命名的红曲色素主要有6种,其中呈现红色的是红斑玉红胺(Monascorubramine)和红斑红曲胺(Rubropunctamine);橙色的是红曲玉红素(Monascorubrine)和红斑红曲素(Rubropunctatine);黄色的是安卡红曲黄素(Ankaflavine)和红曲素(Monascine)[3-7]。红曲色素是由微生物发酵制得,经毒性实验证明其安全无毒[8]。目前,红曲色素已被应用于食品、药品、化工等众多行业[9-10]。红曲色素中含量最高的是红色素组分,虽然红曲黄色素组分在红曲色素中的含量较低,但黄色素作为一类重要的食用色素品种占有市场需求比的60%,因此开发利用红曲黄色素具有极广阔的商业前景。目前国内外研究分离纯化红曲色素的方法主要有萃取法、薄层层析法、高效液相色谱法、树脂法等。张慧娟等[11]采用薄层层析法分离红曲色素,尝试了不同的展开剂配比,得到几种色素条带,经HPLC定性定量分析确定其中橙色素为红斑红曲素。屈炯等[12]利用薄层层析法分离纯化红曲米中红曲色素,采用不同的展开剂分离得到红曲红色组分7种、黄色组分4种和橙色组分2种,经液相色谱检测可知采用该法分离得到的红色素组分为单一峰,证明此法制备的红色素组分较纯。泰国学者Mukherjee G等[13]采用柱层析、薄层层析法对发酵液色素进行分离纯化,并用液相色谱进行纯度表征。目前纯化色素的方法都存在处理量小、程序复杂且难实现单一组分分离等缺陷。要快速粗分得到红曲黄色素并将其更好的应用于食品工业化生产,需找到一种便捷、高效的工业化方法实现对红曲黄色素的分离纯化,硅胶柱层析法分离速度快、纯化率高、操作简便[14-16]。采用柱层析法分离纯化菌体内醇溶性红曲黄色素,并对纯化后的样品成分及纯度进行液相质谱鉴定与表征,为红曲黄色素的开发和实际生产应用提供了科学参考。
1 材料与方法
1.1材料与仪器
硅胶、海砂、乙酸乙酯、石油醚、正己烷国药集团化学试剂有限公司;甲醇、无水乙醇北京化工厂;以上试剂均为国产分析纯。
HZQ-F160型全温振荡培养箱太仓市实验设备厂;UV-2450型紫外可见分光光度计日本岛津;FD-1B-80型冷冻干燥机美国LABCONCO公司;6530型液相色谱串联四级杆飞行时间质谱仪安捷伦科技有限公司;R201型旋转蒸发器上海申胜生物科技有限公司。
1.2实验方法
1.2.1黄色素粗提液的制备收集摇瓶发酵液菌体,烘干后研磨成粉末。采用70%乙醇溶剂超声提取红曲色素,提取液于旋转蒸发器中50℃、100 MPa条件下真空浓缩去除乙醇溶剂,旋蒸后的浓缩液进行预冻处理,最后置于冷冻干燥机中冷冻干燥成粉末。称取2 g红曲色素粉末溶于10 mL正己烷溶剂,于超声中50℃提取1 h,过滤除去粉末残余杂质得黄色素混合粗提液。
1.2.2柱层析的预处理硅胶的预处理:称取14 g硅胶于110℃活化1 h后放入干燥的烧杯中冷却,加适量的溶剂溶解并浸泡30 min(浸泡硅胶的溶剂与洗脱黄色组分的溶剂相同)。
硅胶装柱:清洗干净玻璃层析柱,干燥后,湿法装柱,本实验层析柱规格(ψ20 mm×200 mm)。将层析柱垂直固定在铁架台上,将浸泡好的硅胶连同溶剂均匀倒入层析柱内。待柱子上端的悬浮液慢慢下降到需要的高度,铺一层海砂防止加样与洗脱时扰动柱表面,最后用洗脱剂平衡2个柱体积。
上样:平衡柱子后,待平衡液的弯月面正好与硅胶床面持平时,将用洗脱溶剂提取后的红曲黄色素粗提液加到柱表面,操作时要小心谨慎以免扰动柱表面。
样品的洗脱:洗脱红曲黄色素选用正己烷、石油醚、乙酸乙酯三种常用低极性溶剂,按一定体积配比混合后作为洗脱剂,收集黄色组分,经一系列操作后浓缩干燥得红曲黄色素。
1.2.3洗脱体系的确定硅胶湿法装柱后,以石油醚、乙酸乙酯、正己烷三种常用的低极性洗脱溶剂设计体积配比分别洗脱[17]。10 mL一管收集洗脱液,固定上样量1 mL,洗脱剂流速50 mL/h,以洗脱液流出的体积为横坐标,流出组分的吸光值为纵坐标作图。根据收集到的流分测定410 nm处吸光值,绘成图谱分析并选择出最优的洗脱剂配比,各配比如表1所示。
表1 洗脱剂配比表Table 1 The eluent composition
1.2.4上样量的确定硅胶层析柱上分别用移液管沿柱壁滴加0.5、1、1.5、2 mL的样品,即硅胶填料量与上样量之比分别为135∶1、68∶1、45∶1、34∶1。以1.2.3实验得出的最优洗脱剂配比作为流动相,5 mL一管收集洗脱液,洗脱剂流速50 mL/h,以洗脱液流出的体积为横坐标,流出组分的吸光值为纵坐标作图,根据图谱分析并选择出最优的上样量。
1.2.5洗脱流速的确定分别控制洗脱剂流速为30、40、50、60 mL/h,以1.2.3实验得出的最优洗脱剂配比作为流动相,1.2.4得出的最优上样量,5 mL一管收集洗脱液,以洗脱液流出的体积为横坐标,流出组分的吸光值为纵坐标作图,根据图谱分析并选择出最优的洗脱流速。
1.2.6分离纯化结果的HPLC-MS分析收集柱层析分离纯化后得到的黄色洗脱液,经旋蒸后去除有机溶剂得到红曲黄色素黏状物,甲醇超声复溶黄色素组分过滤膜待测。再分别将菌体粉末甲醇超声复溶;正己烷提取后的黄色素粗提物进行甲醇超声复溶,保持样品的处理浓度一致。最后将各个样品用孔径为0.45 μm的有机微孔滤膜微滤后直接用于HPLCMS分析。通过液相质谱检测,得出红曲黄色素分离纯化结果的液相色谱、质谱图,并对纯化的效果进行分析表征。
液相质谱条件为:色谱柱为Aglilent Eclipse Plus C18(2.1 mm×50 mm,1.8 μm);柱温:30℃;进样量:1 μL;流动相:甲醇∶水(80∶20,v/v);流速:0.4 mL/min;分析时间30 min。离子源ESI正电离方式;扫描模式为全扫描;雾化气温度:300℃;离子源温度:110℃;锥孔电压:3500 V;干燥气流速:8 L/min。
2 结果与讨论
2.1洗脱体系的确定
硅胶湿法装柱后,以石油醚、乙酸乙酯、正己烷三种常用的低极性洗脱溶剂设计不同的体积配比对样品分别进行洗脱。按1.2.3的实验方法,以洗脱液流出的体积为横坐标,流出组分的410 nm处吸光值为纵坐标,结果如图1~图5所示。
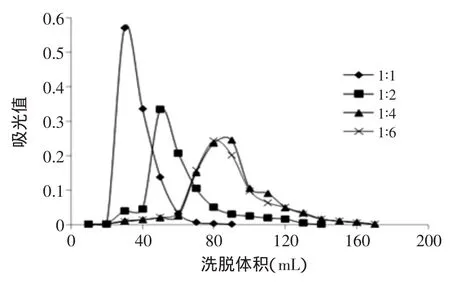
图1 不同比例乙酸乙酯和石油醚对分离效果的影响Fig.1 The influence of different ratio of Petroleum ether and ethyl acetate on the separation
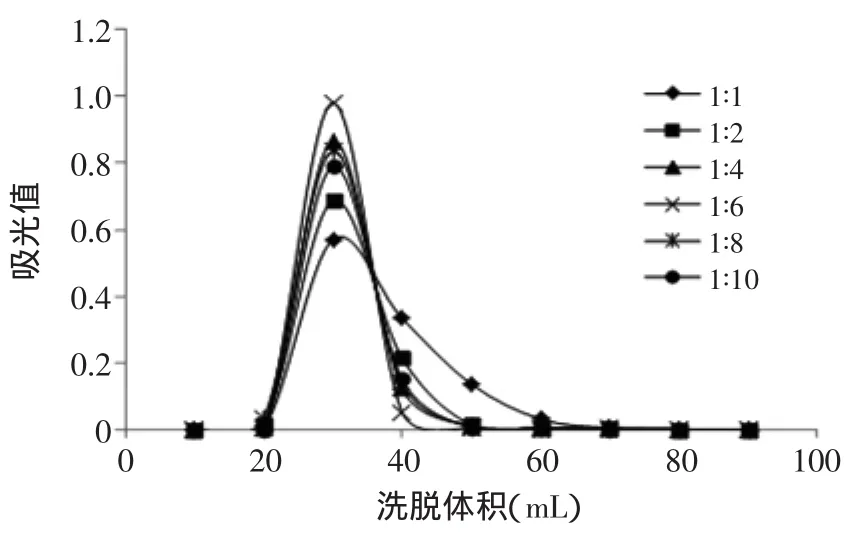
图2 不同比例石油醚和乙酸乙酯对分离效果的影响Fig.2 The influence of different ratio of Petroleum ether and ethyl acetate on the separation

图3 不同比例乙酸乙酯和正己烷对分离效果的影响Fig.3 The influence of different ratio of ethyl acetate and N-hexane on the separation

图4 不同比例正己烷和乙酸乙酯对分离效果的影响Fig.4 The influence of different ratio of N-hexane and ethyl acetate on the separation

图5 不同比例正己烷、乙酸乙酯和石油醚对分离效果的影响Fig.5 The influence of different ratio of N-hexane,ethyl acetate and petroleum ether on the separation
由图1和图2可知,随着石油醚含量的增加,洗脱效果明显变差,硅胶吸附严重且所消耗的洗脱剂体积增加至170 mL。当增加乙酸乙酯的用量后,洗脱相同样品量所需的洗脱剂体积减少至90 mL,且基本无拖尾现象,当石油醚∶乙酸乙酯(v/v)=1∶6时分离效果最好。同样如图3和图4可知,增加乙酸乙酯的用量比增加正己烷用量后所消耗的洗脱体积少,分离峰型更好,且基本无拖尾现象。当正己烷∶乙酸乙酯(v/v)= 1∶8时分离效果最好。石油醚和正己烷的极性均小于乙酸乙酯,提高乙酸乙酯的用量,使洗脱体系的极性更接近于黄色素组分,因此有利于提高分离效果。图5反映出正己烷、乙酸乙酯、石油醚三者混合配比后的洗脱效果明显变差,由纵坐标的吸光值可知收集到的黄色素组分很少,且都存在一定的拖尾现象。因此最终综合比较石油醚∶乙酸乙酯(v/v)=1∶6及正己烷∶乙酸乙酯(v/v)=1∶8的这两个分离效果较好的洗脱配比,分别根据图2和图4的纵坐标可知,正己烷∶乙酸乙酯(v/v)=1∶8所纯化得到的黄色素含量更高,分离效果更好,因此本实验选用正己烷∶乙酸乙酯(v/v)=1∶8的洗脱剂配比。
2.2上样量的确定
分别用移液管沿柱壁滴加0.5、l、1.5、2 mL的样品,即硅胶填料量与样品量之比分别为135∶1、68∶1、45∶1、34∶1。以2.1实验得出的最优洗脱剂配比作为流动相,5 mL一管收集洗脱液,洗脱剂流速50 mL/h,以洗脱液流出的体积为横坐标,流出组分的吸光值为纵坐标作图,结果如图6所示。

图6 不同上样量对分离效果的影响Fig.6 The influence of different sample weight on the separation
由图6可知,当上样量为0.5 mL,即硅胶量与样品量之比为135∶1时,由于上样量太少,因此柱子吸附严重,洗脱下来的黄色素含量非常少,反应出图中的吸光值很低。随着上样量的增加,收集到的黄色素含量明显增加,分离效果也越来越明显。当上样量为1.5 mL(45∶1)时收集到的黄色素组分吸光值最高,且基本无拖尾现象。但当上样量为2 mL(34∶1)时由于样品量多,硅胶吸附量接近饱和导致拖尾现象比较严重,因此选取最优上样量为1.5 mL(45∶1)。
2.3洗脱流速的确定
分别控制洗脱剂流速为30、40、50、60 mL/h,以2.1实验得出的最优洗脱剂配比作为流动相,2.2得出的最优上样量,5 mL一管收集洗脱液,以洗脱液流出的体积为横坐标,流出组分的吸光值为纵坐标作图,结果如图7所示。
由图7可知,随着流速增加,分离周期明显缩短,分离效果得到提高。当洗脱剂流速为30 mL/h时,由于流速较慢使得样品全部洗脱完毕所消耗的时间过长,不利于实际应用。但当流速达到60 mL/h后,可能由于洗脱流速过快,导致硅胶无法充分吸附,因此造成拖尾现象明显。50 mL/h洗脱收集的黄色素含量高于40 mL/h,因此综合考虑分离周期、分离效果及试剂用量,选取最佳流速50 mL/h。
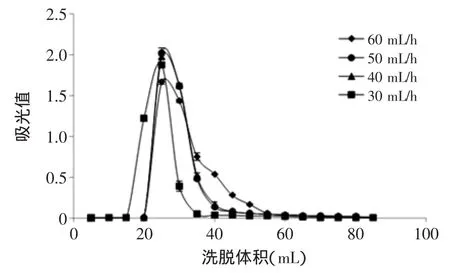
图7 不同流速对分离效果的影响Fig.7 The influence of different velocity of flow on the separation
2.4分离结果的HPLC-MS表征
根据相关文献资料查询可知,红曲色素中的橙色素组分红斑素的分子式为C21H22O5,相对分子质量M=354;黄色素组分红曲素的分子式为C21H26O5,相对分子质量M=358;红色素组分红斑胺素的分子式为C21H23NO4,相对分子质量M=353[18]。对样品中几种红曲色素组分进行液相质谱的ESI+离子源提取,得到各组分的液相色谱图和一级质谱图如图8~图13所示。
由图8可知,ESI+离子源提取后的目标物质红斑胺素可能为0.65 min出的峰,其正离子模式一级质谱图如图9所示,由图可清晰的看出[M+H]+质荷比为354.1707的准分子离子峰,从而确定其分子量为353 u,这与文献上报道的红色素组分红斑胺素的分子量相同。
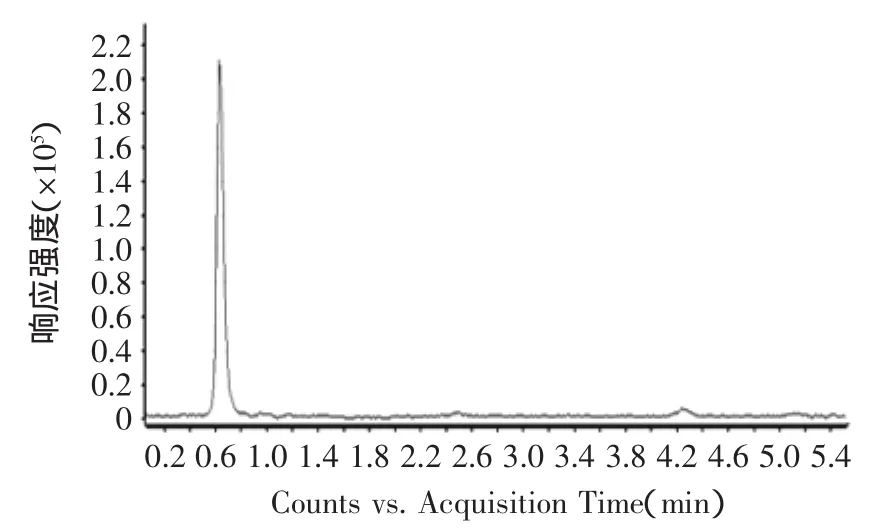
图8 红斑胺素的液相色谱图Fig.8 HPLC chromatogram of rubropunctamine
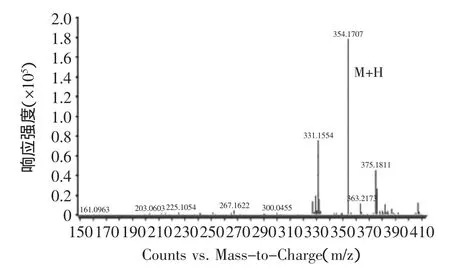
图9 红斑胺素的一级质谱图Fig.9 The primary mass spectrogram of rubropunctamine
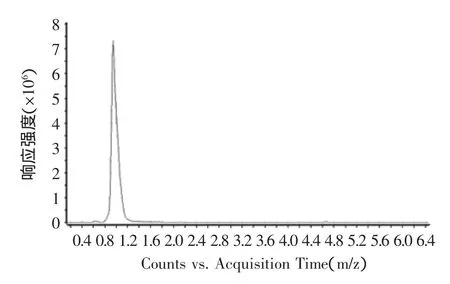
图10 红斑素的液相色谱图Fig.10 HPLC chromatogram of rubropunctatin
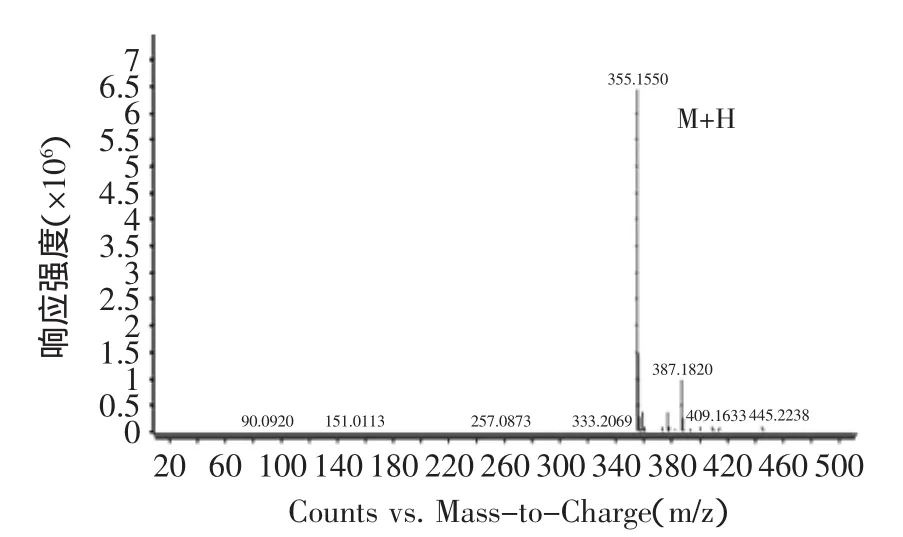
图11 红斑素的一级质谱图Fig.11 The primary mass spectrogram of rubropunctatin

图12 红曲素的液相色谱图Fig.12 HPLC chromatogram of Monascine
由图10可知,ESI+离子源提取后的目标物质红斑素可能为1.1 min出的峰,其正离子模式一级质谱图如图11所示,由图11可清晰的看出[M+H]+质荷比355.1550的准分子离子峰,从而确定其分子量为354 u,这与文献上报道的橙色素组分红斑素的分子量相同。
由图12可知,ESI+离子源提取后的目标物质红曲素可能为0.9 min出的峰,其正离子模式一级质谱图如图13所示,由图13可清晰的看出[M+H]+质荷比为359.1846的准分子离子峰,从而确定其分子量为358 u,这与文献上报道的黄色素组分红曲素的分子量相同。由此可证明经液相质谱ESI+离子源提取分析的三种色素组分红斑胺素、红曲素、红斑素在样品中可检测出,且检测方法可行,可用此检测方法来获得三种色素组分在分离前后的峰面积之比,从而采用相对定量法表征分离纯化的效果。
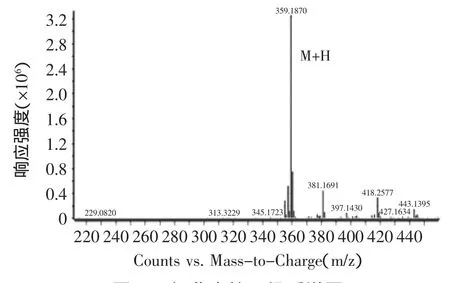
图13 红曲素的一级质谱图Fig.13 The primary mass spectrogram of Monascine

图14 红斑胺素正己烷提取前后峰面积比较图Fig.14 N-hexane extraction peak area before and after comparison chart of rubropunctamine
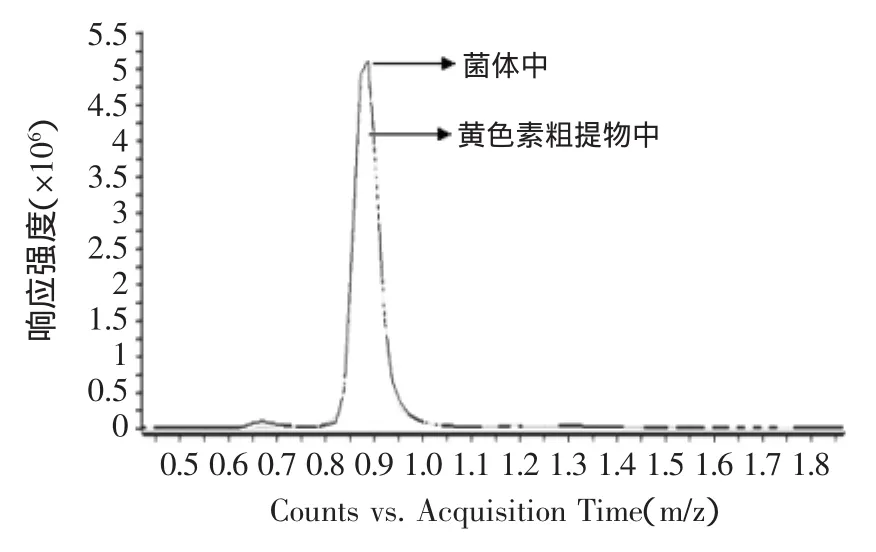
图15 红曲素正己烷提取前后峰面积比较图Fig.15 N-hexane extraction peak area before and after comparison chart of Monascine

图16 红斑素正己烷提取前后峰面积比较图Fig.16 N-hexane extraction peak area before and after comparison chart of rubropunctatin
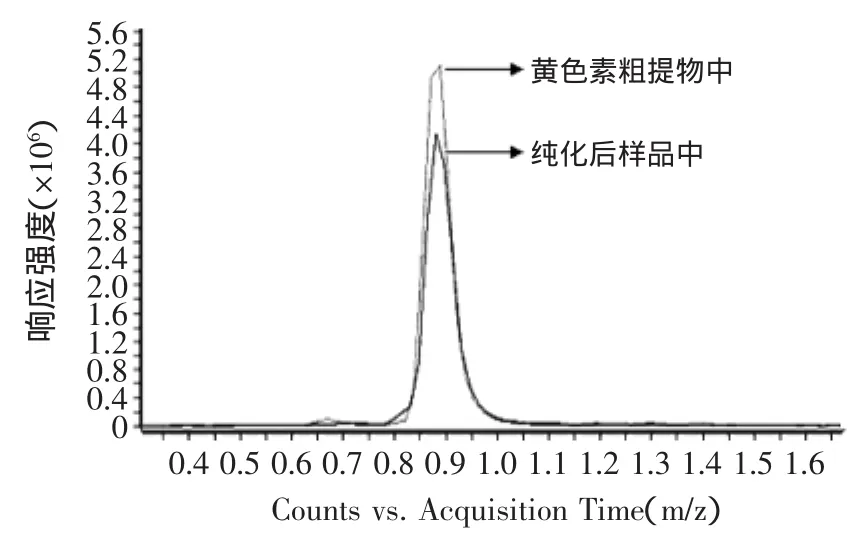
图17 红曲素柱层析前后峰面积比较图Fig.17 Column chromatography peak area before and after comparison chart of Monascine

图18 红斑素柱层析前后峰面积比较图Fig.18 Column chromatography peak area before and after comparison chart of rubropunctatin
本实验对于红曲黄色素的分离纯化主要由两部分组成,分别是菌体粉末经正己烷提取得到黄色素粗提物;黄色素粗提物经硅胶柱层析分离纯化后得黄色素纯品样品。因此分别采用液相质谱检测三种色素组分在菌体粉末中、黄色素粗提物中及纯化后的样品中的相对峰面积比变化,由相对定量法分析比较对分离纯化效果进行表征,结果如图14~图18所示。
由图14可知,红色素组分红斑胺素在菌体粉末中与正己烷提取后的峰面积大小相对变化较大,经丰度值计算后可知峰面积相对减少了89%,这说明经正己烷提取后已基本除去了菌体粉末中的红色素组分红斑胺素。由图15可知,黄色素组分在菌体粉末中与正己烷提取后的相对含量基本变化不大,由此证明正己烷提取已基本将菌体粉末中的黄色素组分提取出来,且提取中基本无损失。由图16可知,橙色素组分在菌体粉末与正己烷提取后的峰面积相对减少了45%,可见正己烷提取后的样品中为黄色素与橙色素的混合组分,因此要分离纯化黄色素则需进一步通过硅胶柱层析去除橙色素组分,从而得到较纯的黄色素产品。
硅胶柱层析的纯化后的样品进行液相质谱检测,由图17可知,黄色素组分红曲素在黄色素粗提物与柱层析纯化后的样品中回收率达到了85%,说明硅胶柱层析对于黄色素的分离效果理想且保留率很高。由图18可知,经丰度值计算后可知橙色素组分红斑素峰面积相对减少了约71%,与原始菌体粉末样品中的含量比较相对减少了86%。由于相同提取及分离条件下,被测组分的峰面积与含量之间存在一定正相关,因此本实验采用相对定量法分析比较色素组分分离前后相对峰面积变化从而验证纯化效果,结果证明本实验所得硅胶柱层析纯化红曲黄色素方法可行,得到的黄色素产品较纯,具有一定的实际应用价值。
3 结论
硅胶柱层析法得到最佳分离条件为:最佳洗脱剂配比为正己烷∶乙酸乙酯(v/v)=1∶8;最佳上样量为1.5 mL;最佳流速为50 mL/h。液相质谱ESI+离子源提取检测到三种色素组分红斑胺素、红曲素、红斑素,经液相色谱及一级质谱图分析证实与文献报道一致。分别考察红曲黄色素组分在菌体粉末、黄色素粗提物、纯化后样品的相对峰面积含量,采用相对定量法验证了红曲黄色素组分的纯化保存率达到了85%,红色素组分经正己烷提取已基本去除89%,橙色素组分经正己烷提取及柱层析分离后去除86%。由此验证了本实验的分离纯化方法具有明显效果,柱层析法粗分红曲黄色素基本满足了工业化生产需要的快速、高效、便捷等硬性需求,本实验通过优化分离条件来提高红曲黄色素组分的纯化效果,效果显著,可进一步研究并扩展应用于工业化之中。
[1]陈小林.红曲菌液态发酵产Monacolin K和红曲色素之研究[D].杭州:浙江工业大学,2007.
[2]石文娟.红曲色素高产菌株的高通量选育[D].上海:华东理工大学,2012.
[3]王金字,董文宾,杨春红,等.红曲色素的研究及应用新进展[J].食品科技,2010,35(1):245-248.
[4]屈炯.红曲色素组分分离及其功能的初步研究[D].武汉:华中农业大学,2008.
[5]Zheng Y Q,Guo Y H.Study on the pigment metabolites produced by Monascus sp.MFL06[J].Journal of Biotechnology,2008,136(S):515.
[6]Silveira T S.Pigment production by Monascus purpureus in grape waste using factorial design[J].LWT-Food Science and Technology,2008,41(1):170-174.
[7]Broder C U.Pigments produced by Monascus purpureus with regard to quality and Quantity[J].Journal of Food Science,1980,45(3):567-569.
[8]周波,王菊芳,吴振强,等.高产红曲黄色素菌株的选育[J].微生物学通报,2008,35(12):1909-1914.
[9]赵燕,温辉梁,胡晓波.红曲色素及其在食品工业中的应用[J].江西食品工业,2004(3):28-30.
[10]Fabre C E,Santerre A L,Loret M O,et al.Production and Food Applications of the Red Pigments of Monascus ruber[J]. Journal of Food Science,1993,58(5):1-5.
[11]张慧娟,陶冠军,陈蕴,等.红曲色素的制备及HPLC和LC/ MS检测方法[J].食品研究开发,2006(4):112-115.
[12]屈炯.红曲色素组分分离及其功能的初步研究[D].武汉:华中农业大学,2008.
[13]Mukherjee G,Singh S K.Purification and characterization of a new red pigment from Monascus purpureus in submerged fermentation[J].Process Biochemistry,2011,46(1):188-192.
[14]钱敏,梁彬霞.红曲色素提取及分离纯化研究[J].中国调味品,2012,37(3):17-21.
[15]徐伟,范志诚,马思慧.柱层析分离红曲色素及其组分的抑菌性对比[J].酿酒,2010,37(6):49-52.
[16]李明起.红曲色素的制备、分离及黄色素结构表征[D].武汉:武汉工业学院,2011.
[17]代春华,邓思珊,甘纯玑.红曲黄色素的分离、纯化及光稳定性探讨[J].中国食品学报,2004,4(3):66-70.
[18]殷军帅.红曲色素和功能性红曲的菌种选育和生产工艺的优化[D].泰安:山东农业大学,2012.
The separation and purification of monascus yellow pigment and characterization
YANG Qiang1,2,LANG Tian-dan1,YUE Jian-ming1,CHENG Lei2,ZHANG Chan1,2,WANG Cheng-tao1,2,*
(1.Beijing Engineering and Technology Research Center of Food Additives,Beijing 100048,China;2.Beijing Laboratory for Food Quality and Safety,Beijing Technology and Business University(BTBU),Beijing 100048,China)
Silica gel column chromatography was used to separate monascus yellow pigment in mycelia,and the structure and purity of monascus yellow pigment were identified by HPLC-MS.The separation conditions were researched and determined.The best separation conditions were as follows:the mixture of n-hexane and ethylacetate(volume ratio of 1∶8),the best sample was 1.5 mL,the best elution agents velocity was 50 mL/h. Rubropunctamine,Rubropunctatin and Monascine were detected by HPLC-MS after separation of the sample. The relative quantitative method was used to verify the yellow pigment component of purified amounted to 85%.
monascus yellow pigment;Silica gel column chromatography;separation and purification;HPLC-MS
TS202.3
A
1002-0306(2015)16-0308-06
10.13386/j.issn1002-0306.2015.16.054
2015-01-06
杨强(1990-),女,硕士,助理实验师,研究方向:食品微生物与发酵技术,E-mail:yq_0314@126.com。
王成涛(1969-),男,博士,教授,研究方向:食品生物技术,E-mail:wct5566@163.com。
国家自然科学基金青年基金项目(31401669、31301411);北京市科技计划项目和北京市属高等学校食品科学创新团队项目(IDHT20130506)。

