新辅助放化疗后肿瘤部位及手术方式对进展期中低位直肠癌患者预后的影响
王凯辉,李文强,陈建华
直肠癌是临床常见消化道恶性肿瘤之一,发病率呈上升趋势[1]。我国以中低位直肠癌为主,约占总数 70%~80%,是治疗效果较差的部位[2]。近年来,针对中低位直肠癌推荐治疗前精准分期、个体化选择手术方案和综合性治疗方式尤其是术前新辅助放化疗已在临床上获得了广泛共识[3]。追求R0切除,科学客观地选择适宜术式正在成为关注的热点问题。肿瘤位置是决定手术方式选择的关键因素之一。但对肿瘤位置和手术方式对进展期中低位直肠癌患者生存预后影响的相关研究尚比较少见[4]。该研究回顾性分析术前接受新辅助放化疗的进展期中低位直肠癌患者的临床资料,探讨肿瘤距肛缘距离及手术方式对患者预后的影响,希望能为进展期中低位直肠癌患者的治疗提供一定的参考。
1 资料与方法
1.1 研究对象 2006年4月—2013年4月123例在笔者所在医院行术前新辅助放化疗的进展期中低位直肠癌手术患者,男73例,女50例;年龄49~72 岁,平均(56.35±13.29)岁。 肿瘤下缘距肛缘距离2.5~7.2 cm,平均(5.13±2.04) cm。 纳入标准:①病理证实为直肠腺癌;②年龄 18~75岁,KPS>70分;③肿瘤下缘距肛缘<10 cm;④术前AJCC分期:T3~T4或N+患者;⑤临床评价可采取根治性手术治疗;⑥术前接受新辅助放化疗患者;⑦临床及随访资料完整者。排除标准:①有其他原发恶性肿瘤病史者;②有盆腔放疗史者;③有严重的并发症者;④术前无法进行TN分期者;⑤术前有远处转移者。
1.2 方法
1.2.1 肿瘤分期判定方法 新辅助放化疗前肿瘤分期主要依据直肠腔内超声检查结果进行判定,标记为uTNM。术后病理分期主要依据组织病理切片检查结果进行判定,标记为ypTNM;病理切片包括:原发病灶、淋巴结、环周切缘(CRM)。以CRM距离肿瘤≤1mm判定为CRM阳性;以手术切除组织标本中无肿瘤残余判定为病理完全缓解(pCR)。
1.2.2 肿瘤下缘距肛缘距离判定方法 根据直肠指检和(或)纤维结肠镜进行检查结果进行判定,分为 2~3 cm、4~5 cm、6~7 cm 及≥8 cm 四个组。
1.2.3 治疗方案 术前新辅助放疗方案:采用三维适形放疗技术,总剂量46Gy分为23次完成者102例,30Gy分为10次完成者5例,50Gy分为25次完成者4例。新辅助化疗方案:采用同步放化疗,化疗方案采用FOLFOX 2~3个周期 (氟尿嘧啶+四氢叶酸钙+奥沙利铂)者63例;XELOX 2个周期(希罗达+奥沙利铂)者60例;术前新辅助放化疗后4~8周实施手术治疗;术后继续采用术前化疗方案化疗4~6个周期。
手术方式:所有手术均由同一组医师完成,按照TME手术原则实施根治性手术,直肠及其系膜要求游离至接近盆底直肠裂孔处,区域淋巴结要求清扫至第3站。根据是否保留肛门括约肌将前切除术(AR)、结肠肛管吻合术(Parks术)、经腹直肠癌切除、近端造口、远端封闭手术(Hartmann术)、经前会阴超低位直肠前切除术(APPEAR术)归为肛门括约肌保留组,将经腹会阴联合切除术(APR)和内括约肌切除术(ISR)归为肛门括约肌切除组。
1.2.4 术后随访 手术后2年内每3个月复查1次,包括:胸片、腹部超声及癌胚抗原(CEA)、糖蛋白抗原 19-9(CA19-9)等肿瘤标志物;每半年增强CT扫描1次胸腔腹腔盆腔;每年结肠镜复查1次;手术2年后,每半年复查1次CT。术后随访截止时间为2014年4月,随访时间12~83个月,平均随访39.3个月。观察3年无瘤生存(DFS)情况,观察终点为局部复发或远处转移。
1.2.5 统计学方法 采用 SPSS15.0版统计学软件进行处理,计数资料以百分率表示,计量资料以均数加减标准差表示;采用Kaplan-Meier法计算生存率,Log-rank法进行3年DFS率影响因素的单因素分析,Cox回归模型进行多因素分析,以P<0.05表示差异具有统计学意义。
2 结 果
2.1 预后影响因素的单因素分析 123例患者3年 DFS 率为 84.55%(104/123); 单因素分析结果显示:新辅助放化疗后T分期降期、术后淋巴结阴性、环周切缘阴性患者的3年DNF率明显升高(P<0.05),性别、年龄、肿瘤距肛缘距离、不同手术方式之间3年DFS率比较差异无统计学意义(P>0.05);肿瘤距肛缘距离2~3 cm组与4~5 cm组、6~7 cm组之间的3年DFS率存在升高的趋势,但差异无统计学意义(P>0.05),见表 1。 将肿瘤距肛缘距离各亚组按不同手术方式进行对比结果显示:6~7 cm组保留括约肌手术患者的3年DFS率(91.89%)与 2~3 cm组切除括约肌手术患者的3年DFS率 (80.95%)比较差异无统计学意义(χ2=2.043,P>0.05),但明显高于4~5 cm组保留括约肌手术患者的3年DFS率(72.97%), 差异具有统计学意义 (χ2=4.437,P<0.05),见表 2。
2.2 预后影响因素的多因素分析 Cox回归模型多因素分析结果显示:术后淋巴结及病理环周切缘状况是预后的独立影响因素(χ2=12.459、15.283,P<0.05),见表 3。

表 1 进展期中低位直肠癌预后影响因素的单因素分析
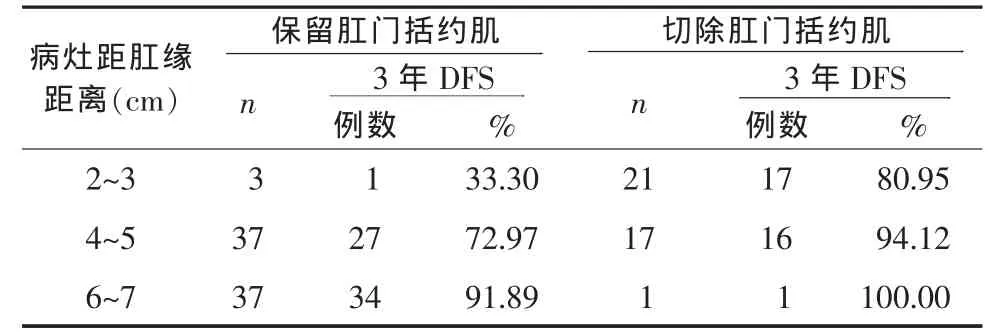
表 2 肿瘤距肛缘距离各亚组不同手术方式治疗3年DFS率比较

表 3 进展期中低位直肠癌预后影响因素的Cox回归模型多因素分析
3 结 论
100余年来,直肠癌的外科治疗经历了从姑息治疗到R0切除,直至R0切除与提高生活质量并重的个体化阶段[5]。现阶段遵循TME原则是保证中低位直肠癌原发肿瘤器官R0切除的基础,而术前严谨的影像学检查获得精准的分期诊断尤为重要[6]。针对进展期低位直肠癌局部复发率相对较高的特点,研究探讨合理的治疗方案,以降低局部复发率不容忽视,不可回避,更充满挑战。自2007年起,NCCN直肠癌临床实践指南明确推荐,T3~T4期中低位直肠癌患者术前联合实施新辅助放化疗,以降低肿瘤分期,提高CRM阴性率和R0切除率,最终降低局部复发率[7]。新辅助放化疗的实施为保肛手术的实施提供了机会,使保肛手术成为了中低位直肠 癌 的主 流术 式[8]。Perez 等[9]学 者 调 查发现仅 有20%左右的直肠癌患者接受了APR手术,主要是低位直肠癌患者。甚至有部分回顾性研究报道中低位直肠癌患者APR手术的5年生存率低于前切除手术(AR),分析原因与APR手术标本在直肠系膜末端与肛管交界处存在缺乏直肠旁组织被覆的薄弱区和狭窄区有关,这一解剖特点是导致APR手术CRM阳性率和术中肿瘤或肠管破裂发生率更高的根本原因[10]。因此,柱状ARP及肛提肌外腹会阴联合切除术(ELAPE)等“扩大APR”术式研究获得越来越多的关注,同时也掀起了对中低位直肠癌切除范围的争议[11]。面对这些争议,应认识到这些回顾性研究的缺陷,即接受APR手术的患者以低位(肿瘤距肛缘<6 cm)直肠癌为主,而接受AR手术的患者的病灶往往位于中低位(肿瘤距肛缘<10 cm);其中位于中位(6~10 cm)的直肠肿瘤由于有直肠系膜包绕,因此,CRM阳性率要明显低于低位直肠。将ARP与AR手术笼统的进行比较有失公允。
肿瘤位置是决定手术方式的关键因素。笔者回顾以往文献,很少有研究对肿瘤的位置进行过仔细分层分析。新辅助放化疗能够降低肿瘤分期,提高CRM阴性率和R0切除率,但以往APR手术与AR手术疗效比较的研究未将新辅助放化疗患者纳入其中。经过新辅助放化疗的进展期中低位直肠癌患者APR手术与AR手术疗效是否还存在差距,尚未见相关报道[12]。因此,该研究对术前接受新辅助放化疗的进展期中低位直肠癌患者的肿瘤位置和手术方式进行分层研究。从理论上讲对有直肠系膜包绕的中位直肠癌实施AR手术,其疗效应优于低位直肠癌的APR手术。该研究结果也显示肿瘤距肛缘距离6~7 cm组患者保留肛门括约肌手术的3年DFS率(91.89%)虽然高于 2~3 cm 组患者切除肛门括约肌手术的3年DSF率(80.95%),但差异并无统计学意义(P>0.05),分析原因可能与新辅助放化疗降低了肿瘤T分期有关。生存分析结果显示:是否保留肛门括约肌对患者的预后无显著影响,对于肿瘤距肛缘4~5 cm的患者而言,保留肛门括约肌手术虽然保留肛门,但却并不能使患者从生存期中获益。COX回归模型多因素分析结果显示:术后淋巴结状况与CRM状况仍然是进展期中低位直肠癌患者生存预后的主要影响因素,提醒临床医师术前新辅助放化疗降低了肿瘤分期,提高了T0和T1患者的比例,可能弱化了ELAPE手术对低位直肠癌的治疗对用,但对于T3~T4期的低位直肠癌患者还是应该遵循肛提肌外切除的原则,以保证R0切除率和CRM阴性率。
综上所述,术前新辅助放化疗是进展期肿瘤获得R0切除及CRM阴性的有力保障。尽管技术发展和理念更新明显提高了中低位直肠癌保肛手术的比例,但是,对于低位(肿瘤距肛缘<6 cm)直肠癌,尤其是侵犯肛门括约肌的超低位直肠癌,APR手术仍然毋庸置疑成为首选术式。而对于中位(肿瘤距肛缘>6 cm)直肠癌以及部分低位直肠癌(未侵及肛门括约肌者),前切除术(AR)理应优先考虑。
[1]李 明,高 鸿,李高峰,等.术前同期放化疗治疗局部进展期中低位直肠癌疗效分析[J].中华放射肿瘤学杂志,2014,23(4):286-290.
[2]丛进春,陈春生,马明星,等.新辅助治疗对局部进展期直肠癌患者的生活质量的影响[J].中国普通外科杂志,2014,23(4):451-457.
[3]王振军,钱 群,戴 勇,等.肛提肌外腹会阴联合切除术治疗低位进展期直肠癌的前瞻性多中心研究[J].华外科杂志,2014,1(3):11-15.
[4]叶卫华,王贵英,韩若凌,等.经直肠超声在评价直肠癌术前新辅助放化疗疗效中的价值[J].中国超声医学杂志,2013,29(4):351-354.
[5]帖晓静,田永巍,高 岭,等.卡培他滨联合放疗治疗局部进展期直肠癌的疗效观察[J].中国全科医学,2013,16(11):1301-1303.
[6]郜永顺,钱国武,张云飞,等.局部进展期直肠癌术前全身静脉联合区域动脉灌注化疗栓塞的疗效评价[J].世界华人消化杂志,2013,4(5):367-372.
[7]王仲照,周志祥,毕建军,等.新辅助同步放化疗联合全系膜切除对局部进展期中低位直肠癌的治疗价值[J].肿瘤防治研究,2012,39(8):910-913.
[8] Lim SH,Chua W,Cheng C,et al.Effect of neoadjuvant chemoradiation on tumor-infiltrating/associated lymphocytes in locally advanced rectal cancers[J].J Anticancer Res,2014,34(11):6505-13.
[9] Perez K,Safran H,Sikov W,et al.Complete neoadjuvant treatment for rectal cancer:The Brown University Oncology Group CONTRE Study[J].Am J Clin Oncol,2014,11(4):763-765.
[10] García-Albéniz X,Gallego R,Hofheinz RD,et al.Adjuvant therapy sparing in rectal cancer achieving complete response after chemoradiation[J].World J Gastroenterol,2014,20(42):15820-15829.
[11]肖 毅,吴 斌,邱辉忠,等.肿瘤距肛缘距离和手术方式对进展期低位直肠癌新辅助治疗生存预后的影响[J].中华医学杂志,2014,22(4):1705-1709.
[12]边志民,王成锋,田艳涛,等.新辅助治疗对进展期直肠癌手术及术后的影响[J].中国肿瘤临床,2012,29(10):698-701.

