松花江流域沉积物ATP微生物量的分布特征
刘 杰,屠 腾,纪玉蕊,王莹莹(南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071)
松花江流域沉积物ATP微生物量的分布特征
刘 杰,屠 腾,纪玉蕊,王莹莹*(南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071)
分析松花江流域沉积物中三磷酸腺苷(ATP)微生物量的分布,结果表明,ATP分布具有显著的空间特征,在河流发源地及部分城市地区河流段沉积物中具有高的ATP含量,统计分析(主成分分析,多元回归树分析和响应模型分析)表明:ATP是沉积物的主要成分性质之一,在本研究所涉及11个因子中,影响ATP分布变异的第一因子是空间位置(纬度,39.79%),然后是环境因子(总氮,18.49%;硝氮,16.24%),其中ATP随纬度呈二次曲线变化(P<0.001),与总氮呈显著正相关(P=0.027),和硝氮呈显著负相关(P<0.01).同时ATP也随有机质、总磷和海拔的增加而呈增加趋势(P<0.05).沉积物ATP与多种营养元素及其不同形态具有显著相关性,表明通过ATP活性微生物量可以反映水体环境的营养水平.
松花江;沉积物;微生物;三磷酸腺苷;多元回归树分析
沉积物中微生物能够促进河流养分循环、维持河流生态平衡和净化水质,同时,由于微生物对环境变化比较敏感,能够较早地指示生态系统功能的变化[1],河流沉积物中微生物的变化能够反映水生态系统的健康状况[2],而微生物的活性直接反映了微生物对营养物质循环的影响,因此研究了解河流沉积物的活性微生物具有着重要的作用.由于自然界中微生物群落的活性评估极具复杂性,而传统的培养方法已经被证实在检测微生物时具有很大的局限性(极大地低估了环境中的微生物量,不能真实反映微生物的实际状况),已经不能适应当前微生物生态的研究[3].作为辅酶及基质的三磷酸腺苷(ATP)存在于所有活的微生物细胞内,而在失活的细胞中迅速分解.在细胞生物学中ATP被称为“能量货币”,是表征微生物活性[4]及活性生物量[5,6]的一个有效、独立参数.ATP分析法以其快速、准确、有效等优点在环境研究中得到了广泛的认可和应用[7-9],Pedersen等[8]在研究芬兰Olkiluoto地区地下水中微生物量及群落多样性的报道中显示,ATP含量与总细胞数量(TNC)具有极显著的相关性(lg(ATP)=0.831lg(TNC)+0.45,r=0.78,p=0.0001,n=49);在国内,已有将ATP方法应用于河流湖泊等水体的报道,张秋卓等[10]利用ATP快速测定河流中细菌总数来检测水质情况.
松花江是我国的主要水系之一,流经黑龙江、吉林及内蒙古东部地区,属于典型的温带气候湿地,在维持生物多样性和碳储存等方面具有重要的生态价值[11],其生态系统的安全和稳定对维持东北地区的发展具有重要意义[12-13].目前,大部分关于松花江流域微生物的研究是在某一区域下开展的,且多集中于水体微生物多样性及污染物降解性能的研究上[14-15],而关于沉积物中的微生物则仅有少量的报道[16-17].为开展松花江流域水生态功能分区研究,建立水生态系统分区指标体系和基础数据库,本文研究了松花江流域沉积物中ATP微生物量的地理分布特征,同时结合沉积物的理化性质,通过多元统计分析探讨ATP与环境因子的关系,以期为评价河流生态系统的健康提供参考.
1 材料与方法
1.1 样品采集
松花江流域是我国第三大流域,位于我国东北地区,东经l19°52′~132°31′,北纬41°42′~ 51°38′,流域东西长约920km,南北宽约1070km,流域面积约为55.7万km2,占东北地区总面积的44.9%,占全国总面积的5.8%[11-12],其上游有南北二源,北源嫩江发源于黑龙江省大兴安岭伊勒呼里山,南源第二松花江发源于安图县、抚松县和朝鲜交界处的长白山主峰长白山天池,南北二源在黑龙江省和吉林省交界三岔河附近汇合,以后始称松花江干流.河流沉积物采样方法按照《水质采样技术指导》(HJ 494-2009)[18]进行,采样时间为2010年6~8月,属于松花江的丰水期.样品均于常温下采集并储存于50mL离心管中,4℃冰盒保存运回实验室,于4℃冰箱保存.实验共设置71个采样点,其分布如图1所示.
图1 松花江流域采样点分布示意Fig.1 Sampling map in the Songhua River basin
1.2 沉积物ATP测定
沉积物中ATP采用GloMax®-Multi Jr 检测系统(Promega,美国)以及Bac Titer-GloTM试剂盒(Promega,美国)进行检测.ATP Bac Titer-GloTM缓冲液在室温下平衡48h,同时,冻干粉Bac Titer-GloTM酶底物混合物在室温下平衡24h后,将缓冲液和酶底物混合制成ATP反应试剂,室温下平衡至少15min,然后1mL分装,-20℃下保存.
ATP标准曲线的制作.在培养基中配制1μmol/L ATP (100μL的1μmol/L ATP含10-10mol ATP)标准液,进行10倍系列稀释(1μmol/L到10pmol/L;100μL体积将含有10-10到10-15mol的ATP)制备不同浓度的ATP标准溶液.在多孔板中加入与ATP标准液等体积(100μL)的ATP反应试剂.在定轨振荡器上快速混合内容物,孵育1min(由于不需要裂解释放ATP,所以不需要长时间孵育),记录荧光值.所有步骤均在室温下完成.
样品ATP的测定.称取100mg沉积物样品置于2mL离心管中,加入100μL磷酸缓冲液(3mg/LKH2PO4,7mg/L K2HPO4,pH 7),30℃恒温水浴3min.另取300μL ATP反应试剂于新的离心管中,30℃恒温水浴3min.将反应试剂加入沉积物样品中混合5s,30℃恒温水浴1.5min,每隔30s轻轻混匀一次.水浴后立即低速(500r/min)离心,取200μL上清液,孵育30s后进行测样,记录荧光值,每个样品重复三次平行.通过标准曲线计算得出沉积物中ATP浓度(CA).
1.3 数据处理与分析
测定沉积物中的有机质(OM)、总磷(TP)、氧化还原电位(Eh)、pH值、氨氮(AON)、硝氮(NON)、总氮(TN)、速效磷(QAP)等环境参数,其测定方法参照鲁如坤[19]和金相灿等[20].数据标准化后进行主成分分析(PCA)提取沉积物性质的主要因子,同时采用等高图探讨ATP的流域分布特征,然后通过多元回归树(MRT)用环境因子来解释ATP变异[16,21],最后通过响应模型分析进一步建立ATP随环境因子的变化.沉积物ATP与环境因子的关系通过R(Version 3.0.2)软件“mvpart”和“vegan”程序包进行分析.用Origin软件通过采样点的地理位置经度(LO)、纬度(LA)和海拔(AL)绘制流域ATP分布图,并用高斯模型分析ATP浓度的频率分布.响应模型用F统计学检验,同时,用方差分析(ANONA)统计数据之间的差异.
2 结果与分析
2.1 沉积物性质的主成分分析
通过对ATP和理化性质进行主成分分析提取沉积物的主要性质因子,如图2,前4个主成分轴对沉积物性质变异的累计解释比重达80.07%,沉积物的主成分性质有ATP、氨氮、硝氮、氧化还原电位和速效磷.各主成分轴的特征值、解释比例以及各因子在主成分轴的权重见表1,其中,第1轴主要主要代表ATP、氨氮和硝氮,第2轴主要代表氧化还原电位,第3轴主要代表速效磷.
2.2 ATP流域分布特征
沉积物ATP表征了细菌、真菌、放线菌等活性微生物的生物量.如图3a所示,沉积物微生物ATP分布具有明显的地域特征,在松花江流域中ATP平均浓度为146.86nmol/g(图3b).嫩江和第二松花江河流段沉积物ATP要显著高于松花江干流地区(P=0.021),其中,在长白山河流发源地区ATP浓度最高,同时在嫩江发源地ATP浓度也高于其下游地区(P<0.01),此外,在城市地区沉积物中具有较高的ATP含量,如齐齐哈尔和吉林市等河流段.

图2 沉积物性质的主成分分析Fig.2 Principal component analysis of sedimental characteristics
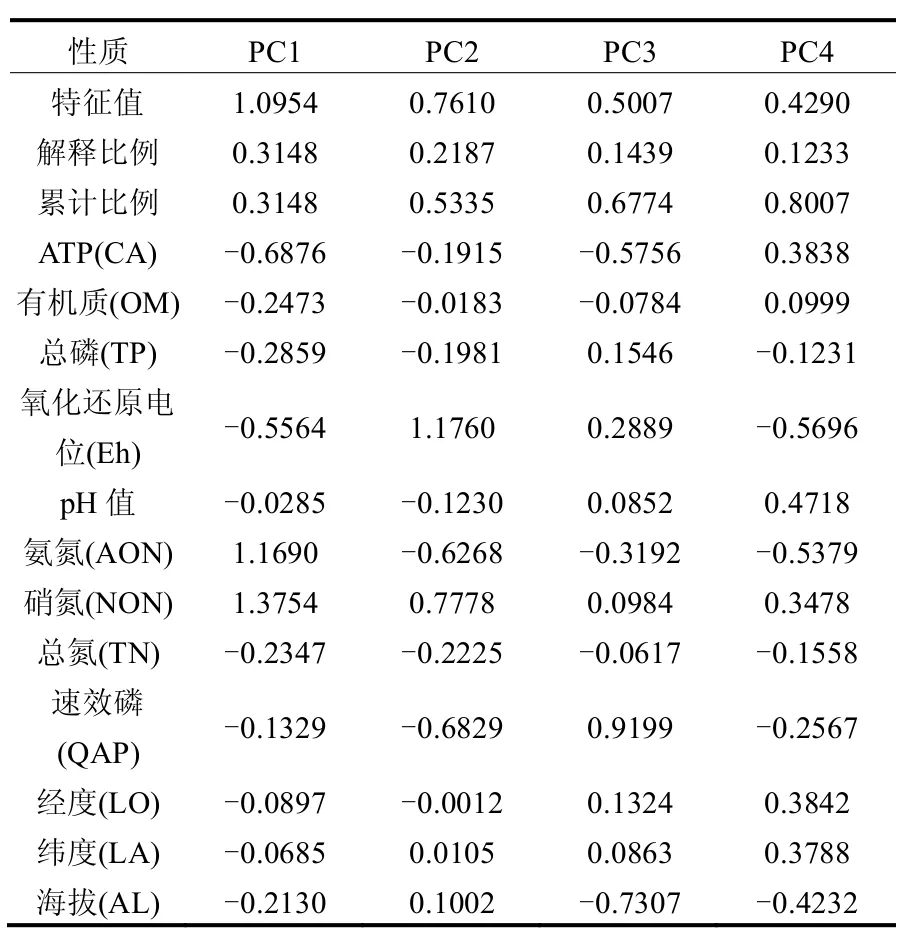
表1 各主成分轴的特征值及与沉积物性质的相关性Table 1 Eigenvalue of each principal axis and their correlation to sedimental characteristics
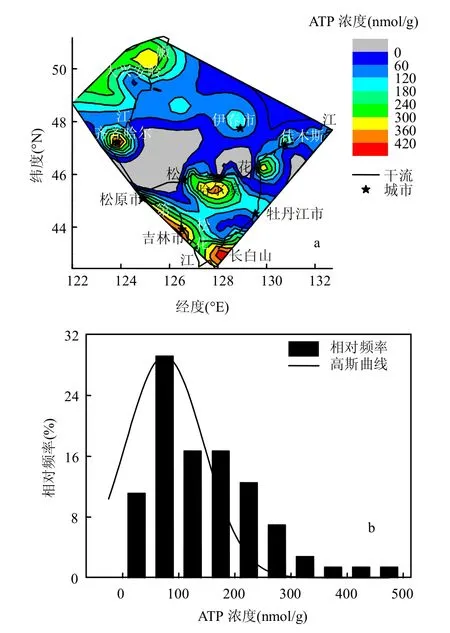
图3 松花江流域ATP微生物量的分布Fig.3 Distribution of microbial ATP-biomass in the Songhua River basin
2.3 ATP与环境因子的关系
多元回归树分析沉积物ATP微生物量随沉积物理化性质及采样点位置的变化,图4显示了各变量因子对ATP微生物量变异的解释.实验所涉及的因子能解析74.52%的ATP微生物量变异,分别为纬度(39.79%)、总氮(18.49%)和硝氮(16.24%),其它因子对ATP变异影响很小,因此没有在回归树上显示.
ATP与各因子的广义线性响应模型进一步表明(图5),在松花江流域范围内,沉积物ATP与纬度呈二次曲线变化(CA=8.7480LA2-823.3140LA+19480.5, F=10.20, P=0.00013),与总氮呈正相关(CA=54.7152TN+89.8454, F=5.15,P=0.027),而与氨氮呈负相关(CA= -44.8361NON+168.6470, F=7.63, P=0.0075)关系;同时ATP也与有机质(CA=5.2388OM+83.6194,F=4.23, P=0.044)、总磷(CA=0.3577TP+78.7651,F=5.15, P=0.027)、海拔(CA=0.2392AL+94.5875,F=9.01, P=0.0037)呈正相关关系.

图4 沉积物ATP微生物量变异的多元回归分析Fig.4 Multivariate regression tree analysis of the microbial ATP-biomass variation in the sediment
3 讨论
主成分分析方法可以从大量的环境观察数据中筛选出具有代表性的主导因子,用于沉积物中污染物质的源解析[22]以及微生物群落动态等研究,娄焕杰等[23]采用主成分分析方法分析了环境因子对长江口滨岸沉积物反硝化速率的影响;董黎明[24]运用磷脂脂肪酸(PLFA)技术和主成分分析研究了白洋淀沉积物中微生物生物量和群落结构的区域分布特征.在本研究中,沉积物性质的主成分分析结果显示,前4个主成分轴能解释80.07%的沉积物特性,其中,ATP、氨氮、硝氮、速效磷和氧化还原电位是沉积物的主要性质.ATP作为主成分出现,说明表征微生物量的ATP能作为沉积物的主要特性之一,此外,氧化还原电位反映沉积物中的溶氧情况,氨氮、硝氮和速效磷表示不同形态的营养物质成分.这一结果与水质特性具有类似性,李一平等[25]在研究太湖水质时空分布时发现,水体营养(氮、磷和有机物)、溶解氧、色度和酸碱度是水质的主要特征,这种相似性可能是由于沉积物与水体之间相互紧密的联系所导致.
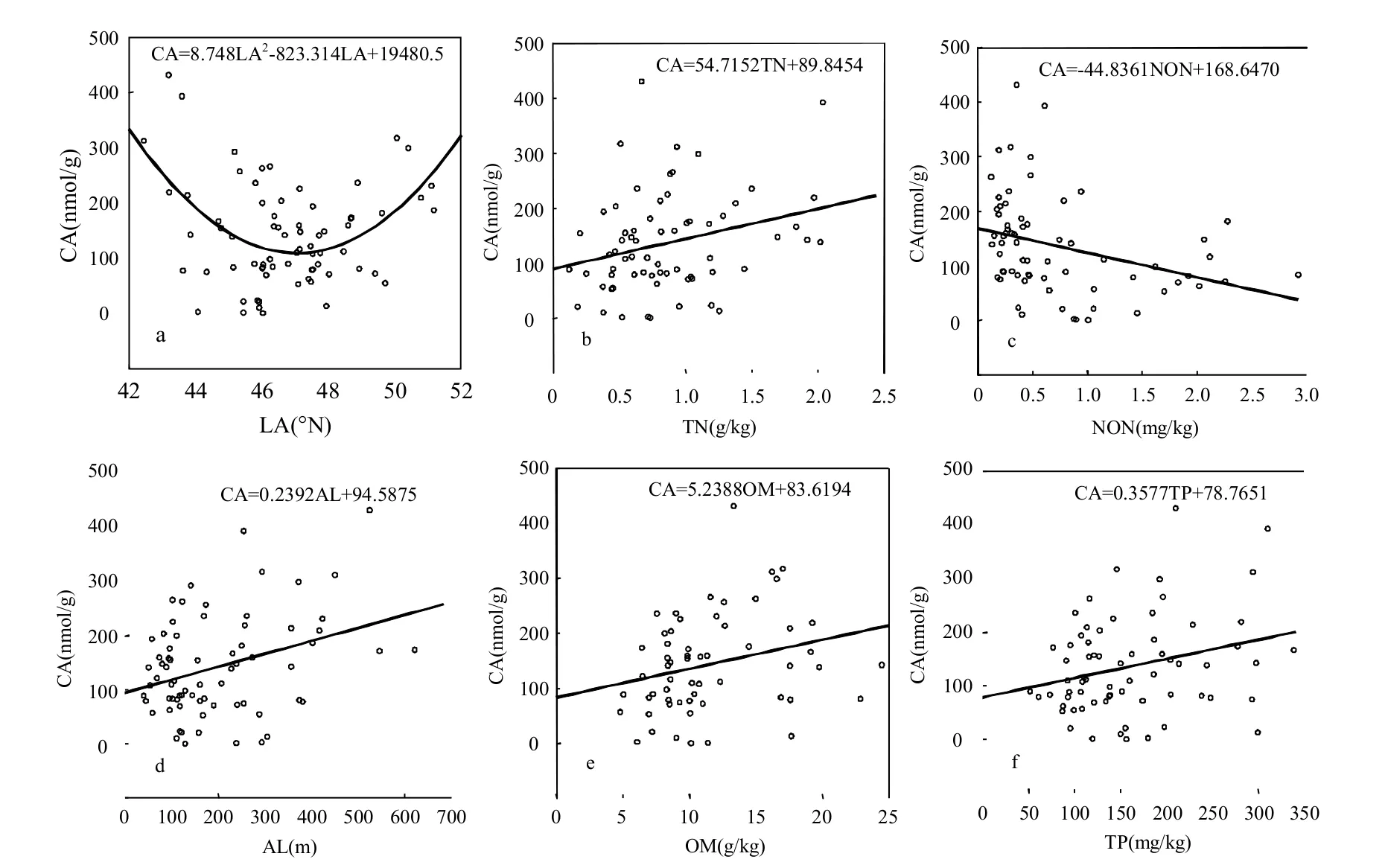
图5 沉积物ATP与各变量的响应模型Fig.5 Response model of sedimental ATP to the variables
ATP在松花江流域具有明显的地理空间分布特征(图 3a),在齐齐哈尔和吉林市城市地区的河流段沉积物中具有较高的ATP含量,表明该地区活性微生物的生物量要高于其它地区.在城市河流段,受人类活动的影响,外源物质的输入在一定程度上促进了适应性较强的微生物生长,使其成为环境优势菌群[26],从而现出较高ATP活性微生物量.在靠近人类活动的水体中具有较高的ATP生物量,史君贤等[27]研究了长江口及其附近海域ATP的时空分布特征,发现ATP浓度从长江口内河段向外海逐渐降低;叶树明等[7]也发现在西湖近岸其ATP生物量要高于湖心.多元回归分析结果表明(图 4),在本研究中所涉及的11个因子中,影响ATP微生物量变异的第一因子是纬度,其次是沉积物中的总氮和硝氮,即ATP的分布主要受空间位置的影响.在水平方向上,ATP随纬度呈二次曲线变化(图 5a),其现象解释为,长白山和大兴安岭发源地分别属于松花江流域的低纬度和高纬度地区(图3a),这两地区ATP均较高,而在流域的中纬度地区具有较低的ATP含量;在垂直方向上,这两地区都属于山林地区,具有较高的海拔,这表明ATP与海拔也具有一定的分布关系,同时,响应模型分析进一步显示ATP随海拔呈正相关(图5d).在河流发源地,由于是山区林地,营养物质等通过地表径流逐渐在溪流中富集,使得河流具有较高的营养物质转送和保持能力[28-29],活性微生物量总体较高,因而具有高的ATP.此外,ATP与总氮、总磷和有机质的正相关也进一步证明了这一推断(图5b、e、f).纬度和海拔的梯度变化可以从光照、气候、温度、降水及水力条件等多方面作用于生境,从而直接导致沉积物的理化性质发生变化,进而影响生物的群落结构组成及多样性,在区域范围内,本研究中的纬度作为一个综合性的环境因子对河流沉积物ATP的分布变异起主要贡献作用.地理位置上的空间距离是影响微生物ATP分布的主导因子,这一结论与Wu等[16]分析长江流域沉积物真菌群落变化驱动因子的研究相一致,在土壤中,空间位置对细菌多样性影响也要大于环境因子干扰的影响[21].
Wu等[16,21]指出,在大区域范围内,营养物质(C、N、P)对微生物的影响很小,而本研究中,ATP微生物量分布除了具有上述明显的地理特征外,营养物质对其变异解释也占有很大比重,随着营养物质浓度(总氮P=0.027、总磷P=0.027和有机质P=0.044)的增加,微生物也变得活跃,ATP也随之增加.这与冯峰等[30]在研究国内东湖沉积物中微生物量与有机质含量、总氮和总磷相关性的结论也相同.有机质的增加能够促进环境中非自养型微生物多样性和丰度的提高[31],有机碳含量越高,微生物自身合成与代谢作用也越活跃,从而总生物量也增加,因此ATP与有机碳表现出正相关[8].磷能显著促进土壤中微生物的生长[32],董黎明[24]研究表明,磷是影响沉积物中微生物生物量及丰富度的限制性营养因素.在磷源和氧气充足的条件下,微生物可以储存聚磷酸盐将其转化为ATP[33],因此ATP随总磷的增加而增加.值得注意的是,与其他营养物质不同,氮的形态对微生物的活性有着不同的影响,ATP与总氮呈正相关(图5b),但与硝氮呈负相关(图5c).这一结果与之前松花江沉积物真菌的研究相一致:可培养真菌浓度与有机物和总氮呈显著正相关,而与硝态氮呈显著的负相关[17].微生物在生长的过程中,除了碳源外,还需要一定量的氮源,氮的适当增加能提高微生物分解有机质的速率,因而ATP生物量与总氮呈显著正相关.在厌氧条件下,硝酸盐和亚硝酸盐通过反硝化作用还原为含氮气体,此外,氨氮和亚硝态氮还可进行厌氧氨氧化作用生成氮气,这两个过程属于放热反应,生成的能量可以转换成ATP. Stief等[34]在缺氧条件下研究Aspergillus terreus的还原性能时发现,在硝酸盐还原成铵盐、一氧化氮和亚硝酸盐的过程中产生了大量的细胞ATP,在微生物代谢作用将硝酸盐还原减少过程中,ATP浓度得到增加.但是,Rousk等[35]发现,氮肥的添加会减少可利用有机碳的矿化速率、抑制微生物的生长和呼吸作用,从而减少微生物的生物量,这种影响对真菌更加显著[36];宋洪宁等[37]发现558bp T-RF(限制性酶切片段)细菌丰度与总氮、铵态氮和硝态氮含量呈负相关,而543bp T-RF丰度则与前述几种因子呈正相关,上述研究表明不同形态的氮会对不同基因型微生物有着不同的影响,在本文中,ATP含量随着硝态氮的增加而减少,这表明在河流沉积物中反硝化和氨氧化过程都很微弱,而硝态氮对微生物活性主要起抑制作用.
微生物ATP也能反映环境污染的变化. Sayler等[38]发现,在煤焦化废水污染的沉积物中,总的微生物浓度、ATP和碱性磷酸酶受到明显的抑制,而当污染被去除时,能很快恢复并接近至对照组;Yang等[39]发现丁草胺的降解速率与微生物ATP呈正相关;Novitsky等[6]通过ATP研究分析了夏威夷Oahu岛海岸污水汇入对附近沉积物中微生物活性的影响;此外,通过测量ATP还可以评估沉积物对底栖无脊椎动物的毒性[9].响应模型显示,ATP与总氮、总磷和有机质营养物质呈显著正相关,这表明ATP与水体环境的营养程度具有密切的联系,因此,在一定程度上,通过ATP活性微生物量可以反映水体环境的营养水平.在本研究中,仍有一部分ATP变异尚未解析(本文共解释了74.52%),表明除了文章中所涉及的变量因子外,还存在着一些因素影响ATP生物量的变化,尚待进一步研究分析.
4 结论
4.1 松花江流域沉积物中ATP生物量具有明显的地理分布特征,在长白山和大兴安岭河流发源地以及齐齐哈尔和吉林市城市地区的河流段沉积物中具有较高的ATP含量.
4.2 统计分析(主成分分析、多元回归树分析和响应模型分析)表明ATP、硝氮、氨氮、速效磷和氧化还原电位是沉积物性质的主要代表成分.
4.3 沉积物中ATP变异的主要解释因子有纬度(39.79%)、总氮(18.49%)和硝氮(16.24%),在松花江流域,ATP随纬度呈二次曲线变化,与总氮呈显著正相关,而与硝氮呈显著负相关,同时,ATP也随有机质、总磷和海拔的增加而呈增加趋势.
4.4 沉积物ATP与多种营养元素及其不同形态具有显著的相关性,这表明通过ATP活性微生物量可以反映水体环境的营养水平.
[1]Dauvin J C, Alizier S, Rolet C, et al. Response of different benthic indices to diverse human pressures [J]. Ecological Indicators, 2012,12(1):143-153.
[2]Liu L M, Yang J, Zhang Y Y. Genetic diversity patterns of microbial communities in a subtropical riverine ecosystem(Jiulong River, southeast China) [J]. Hydrobiologia, 2011,678(1): 113-125.
[3]Hammes F, Goldschmidt F, Vital M, et al. Measurement and interpretation of microbial adenosine tri-phosphate (ATP) in aquatic environments [J]. Water Research, 2010,44(13):3915-3923.
[4]Velten S, Hammes F, Boller M, et al. Rapid and direct estimation of active biomass on granular activated carbon through adenosine tri-phosphate (ATP) determination [J]. Water Research, 2007,41(9):1973-1983.
[5]Magic-Knezev A, van der Kooij D. Optimisation and significance of ATP analysis for measuring active biomass in granular activated carbon filters used in water treatment [J]. Water Research, 2004,38(18):3971-3979.
[6]Novitsky J A, Karl D M. Influence of deep ocean sewage outfalls on the microbial activity of the surrounding sediment [J]. Applied and Environmental Microbiology, 1985,50(6):1464-1473.
[7]叶树明,楼凯凯,杨俊毅,等.利用ATP生物发光法测定西湖水体微生物量 [J]. 浙江大学学报(农业与生命科学版), 2006,32(5): 500-504.
[8]Pedersen K, Arlinger J, Eriksson S, et al. Numbers, biomass and cultivable diversity of microbial populations relate to depth and borehole-specific conditions in groundwater from depths of 4-450m in Olkiluoto, Finland [J]. ISME Journal, 2008,2(7):760-775.
[9]Goedkoop W, Widenfalk A, Haglund A L, et al. Microbial characterization of artificial sediment and comparisons with natural sediments - Implications for toxicity testing [J]. Environmental Toxicology and Chemistry, 2005,24(11):2725-2733.
[10]张秋卓,毛映丹,杨 洁,等.利用ATP生物发光法快速检测丽娃河中细菌总数 [J]. 环境科学与技术, 2011,34(7):152-155.
[11]Sun X, Zhou Q, Ren W, et al. Spatial and temporal distribution of acetochlor in sediments and riparian soils of the Songhua River Basin in northeastern China [J]. Journal of Environmental Sciences (China), 2011,23(10):1684-1690.
[12]Sun X, Zhou Q, Wang Y, et al. Influence of hydrogeomorphology, land-use and riparian zone characteristics on herbicide occurrence and distribution in sediments in Songhua River Basin, northeastern China [J]. Geoderma, 2013,193:156-164.
[13]赵钟楠,张天柱.基于生态系统水平的河流风险评价 [J]. 中国环境科学, 2013,33(3):516-523.
[14]屠 腾,李 蕾,毛冠男,等.利用细胞计数手段和DGGE技术分析松花江干流部分地区的细菌种群多样性 [J]. 生态学报,2012,32(11):3505-3515.
[15]路永正,阎百兴.微生物对沉积物主要化学组分吸附重金属能力的影响 [J]. 中国环境科学, 2011,31(1):105-110.
[16]Wu B, Tian J, Bai C, et al. The biogeography of fungal communities in wetland sediments along the Changjiang River and other sites in China [J]. ISME Journal, 2013,7(7):1299-1309.
[17]刘 杰,丁艳丽,冯 伟,等.松花江底泥真菌的分离培养及分子鉴定 [J]. 农业环境科学学报, 2013,32(2):354-362.
[18]HJ 494-2009 水质采样技术指导 [S].
[19]鲁如坤.土壤农业化学分析方法 [M]. 北京:中国农业科学出版,1999:108-110.
[20]金相灿,屠清英.湖泊富营养化调查规范 [M]. 2版.北京:中国环境科学出版社, 1990:218-229.
[21]Ge Y, He J Z, Zhu Y G, et al. Differences in soil bacterial diversity: driven by contemporary disturbances or historical contingencies?[J]. ISME Journal, 2008,2(3):254-264.
[22]王 泰,黄 俊,余 刚.海河河口表层沉积物中PCBs和OCPs的源解析 [J]. 中国环境科学, 2009,29(7):722-726.
[23]娄焕杰,王东启,陈振楼,等.环境因子对长江口滨岸沉积物反硝化速率影响 [J]. 环境科学与技术, 2013,36(4):114-118+140.
[24]董黎明.利用磷脂脂肪酸表征白洋淀沉积物微生物特征 [J].中国环境科学, 2011,31(11):1875-1880.
[25]李一平,逄 勇,向 军.太湖水质时空分布特征及内源释放规律研究 [J]. 环境科学学报, 2005,25(3):300-306.
[26]Wittebolle L, Marzorati M, Clement L, et al. Initial community evenness favours functionality under selective stress [J]. Nature,2009,458(7238):623-626.
[27]史君贤,陈忠元,宁修仁,等.长江口及其附近海域细菌和三磷酸腺苷的分布特征 [J]. 海洋与湖沼, 1992,23(3):288-296.
[28]Harner M J, Ramsey P W, Rillig M C. Protein accumulation and distribution in floodplain soils and river foam [J]. Ecology Letters,2004,7(9):829-836.
[29]Peterson B J, Wollheim W M, Mulholland P J, et al. Control of nitrogen export from watersheds by headwater streams [J]. Science, 2001,292(5514):86-90.
[30]冯 峰,王 辉,方 涛,等.东湖沉积物中微生物量与碳、氮、磷的相关性 [J]. 中国环境科学, 2006,26(3):342-345.
[31]Wouters K, Moors H, Boven P, et al. Evidence and characteristics of a diverse and metabolically active microbial community in deep subsurface clay borehole water [J]. FEMS Microbiology Ecology, 2013,86(3):458-473.
[32]白 震,张 明,闫 颖,等.长期施用氮、磷及有机肥对农田黑土PLFA的影响 [J]. 浙江大学学报(农业与生命科学版), 2008,34(1):73-80.
[33]姜登岭,张晓健.饮用水中磷对微生物生长的限制作用 [J]. 中国给水排水, 2004,20(1):26-28.
[34]Stief P, Fuchs-Ocklenburg S, Kamp A, et al. Dissimilatory nitrate reduction by Aspergillus terreus isolated from the seasonal oxygen minimum zone in the Arabian Sea [J]. BMC Microbiology,2014,14:35.
[35]Rousk J, Brookes P C, Baath E. Fungal and bacterial growth responses to N fertilization and pH in the 150-year 'Park Grass' UK grassland experiment [J]. FEMS Microbiology Ecology,2011,76(1):89-99.
[36]Henriksen T M, Breland T A. Nitrogen availability effects on carbon mineralization, fungal and bacterial growth, and enzyme activities during decomposition of wheat straw in soil [J]. Soil Biology and Biochemistry, 1999,31(8):1121-1134.
[37]宋洪宁,杜秉海,张明岩,等.环境因素对东平湖沉积物细菌群落结构的影响 [J]. 微生物学报, 2010,50(8):1065-1071.
[38]Sayler G S, Sherrill T W, Perkins R E, et al. Impact of coal coking effluent on sediment microbial communities: a multivariate approach [J]. Applied and Environmental Microbiology, 1982,44(5):1118-1129.
[39]Yang C M, Wang M M, Li J H. Influence of rhizosphere microbial ecophysiological parameters from different plant species on butachlor degradation in a riparian soil [J]. Journal of Environmental Quality, 2012,41(3):716-723.
致谢:本研究得到中国科学研究院沈阳应用生态研究所和东北农业大学的帮助,在此特别感谢.
Distribution pattern of microbial ATP-biomass in the sediment of the Songhua River basin.
LIU Jie, TU Teng, JI Yu-rui, WANG Ying-ying*(Key Laboratory of Pollution Processes and Environmental Criteria, Ministry of Education,Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China). China Environmental Science, 2015,35(1):171~178
The distribution pattern of microbial ATP-biomass was analyzed in the sediment of the Songhua River basin. The results indicated that ATP exhibited a significant geographical distribution pattern. There was a higher ATP content in the river source and urban areas than in other parts of the river basin. Statistical analysis, including principal component analysis, multivariate regression tree and response model analysis, showed that ATP was one of the main principal characteristics in sediment. Among 11factors measured in the present study, the distribution variance of ATP can be explained first by geographic distance (latitude, 39.79%), and then by environmental factors (total nitrogen, 18.49%;nitrate nitrogen, 16.24%). The ATP content changes with latitude were fit to a quadratic curve (P<0.001). It was positively correlated to total nitrogen content (P=0.027) and negatively correlated to nitrate nitrogen content (P<0.01). Meanwhile,a significant correlation was also observed between ATP content and organic matter, total phosphorus and altitude(P<0.05). The significant correlation to multiple nutrients suggests that ATP monitoring has considerable potential for the evaluation of nutrient levels in aquatic environments.
Songhua River;sediment;microbe;adenosine triphosphate (ATP);multivariate regression tree (MRT)analysis
X524
A
1000-6923(2015)01-0171-08
刘 杰(1987-),男,湖南益阳人,南开大学博士研究生,主要研究方向为环境微生物生态学、土壤生态修复等.发表论文4篇.
2014-05-05
国家自然基金项目(31270545);国家水专项项目(2008ZX07526-002-01)
* 责任作者, 教授, wangyy@nankai.edu.cn

