猪圆环病毒 2 型Cap蛋白在杆状系统中的表达与纯化
张 晓,尹秀凤,徐 凯,李 淑
(南京天邦生物科技有限公司生物技术研究所,南京 211102)
·简 报·
猪圆环病毒 2 型Cap蛋白在杆状系统中的表达与纯化
张 晓,尹秀凤,徐 凯,李 淑
(南京天邦生物科技有限公司生物技术研究所,南京 211102)
猪圆环病毒2型(Porcine circovirus type 2,PCV2)基因有两个主要的开放阅读框(open reading frame,ORF)。其中,ORF2编码病毒的主要结构蛋白核衣壳蛋白(Cap)。为了在昆虫细胞中表达Cap蛋白,本研究将重组穿梭质粒Bacmid-iel-ORF2经脂质体转染至昆虫细胞中,获得重组杆状病毒。经过噬斑克隆实验,获得稳定、高效表达Cap蛋白的重组杆状病毒,病毒滴度可达到1×109pfu/mL。免疫印迹实验表明重组Cap蛋白可与PCV2 阳性血清发生特异性反应, 证明该重组蛋白具有良好的免疫活性反应。本研究为提高PCV2灭活疫苗病毒滴度及免疫原性奠定了基础。
猪圆环病毒2型;杆状病毒;噬斑;纯化
猪圆环病毒2型(Porcine circovirus type 2,PCV2)感染可引起断奶仔猪多系统综合征(postweaning multisystemic wasting syndrome,PMWS)、繁殖障碍、“无名高热症”等[1]。在临床上PCV2感染猪存在普遍的免疫抑制和免疫激活现象,引起其他各类疾病大规模爆发[2,3],对养猪业造成很大的危害。目前对PCV2感染没有特别有效的治疗方法,以疫苗进行预防为主。国内已有灭活疫苗上市,但由于PCV2在细胞上增值滴度低,灭活疫苗成本高,不易纯化,体外培养比较困难等[3,4],给疫苗生产带来了一定的困难。
昆虫细胞-杆状病毒表达系统具有表达外源蛋白量高,抗原性好,易于培养且成本较低等特点,在多种疾病研究中得到广泛应用[5,6]。本研究通过对表达Cap蛋白的重组杆状病毒的噬斑纯化来提高Cap蛋白的表达量和纯度,为进一步提高亚单位疫苗的病毒滴度和免疫原性奠定基础。
1 材料与方法
1.1 重组质粒、细胞及试剂 重组穿梭质粒Bacmidiel-ORF2、SF-9细胞、PCV2阳性血清均为南京天邦生物技术有限公司生物技术研究所制备并保存;HRP标记的羊抗猪IgG二抗购自Sigma公司;DNA Marker(DL 2000)、DNA提取试剂盒、PCR Buffer、dNTP、Taq 酶均购自TaKaRa公司;FITC标记的葡萄球菌A蛋白购自武汉博士德生物工程有限公司;低熔点琼脂糖购自Bio Link公司;低分子量蛋白质Marker购自Thermo SCIENTIFIC公司。
1.2 重组杆状病毒的获得 对提取的Bacmid质粒浓度进行测定后,转染昆虫细胞。将培养在SF-900II培养液中的对数期昆虫细胞(培养48h)接种于6孔板中,27℃温箱中培养,待细胞长至60%~70%时进行细胞转染。首先,准备两个无菌1.5mL离心管A和B,A管加入200μL SF-900II 培养液和10μL脂质体,室温条件下充分混匀,静置5 min;B管加入200 μL SF-900II 培养液和10μg Bacmid质粒,静置5min。将A管和B管中液体混合,室温条件下静置20min。用移液器吸掉6孔板中的细胞培养液,以SF-900II细胞培养液洗涤细胞3次,吸掉培养液,将无菌离心管中的混合液滴加于细胞上,补充SF-900 II培养液600 μL,置于27℃温箱中孵育5~7h。移去6孔板中的转染混合液,加SF-900II 培养液3 mL,继续培养3 d。待细胞出现肿胀病变后,收集上清液,得到重组杆状病毒。
1.3 杆状病毒的噬斑筛选 将悬浮培养在SF-900II培养液中的对数期昆虫细胞(培养48 h)用无菌离心管进行浓缩,稀释至5×105个/mL,并将稀释好的昆虫细胞接种于6孔板中,置于27℃恒温培养箱中进行培养。细胞长至90%以上的单层后,将培养基弃掉,PBS洗涤细胞3次。将重组杆状病毒进行10倍梯度稀释,以1mL的接种量将10-4~10-8五个稀释梯度接种6孔板中的昆虫细胞,对照孔接入1 mL SF-9细胞培养液、27℃温箱中孵育2~3 h后,弃掉感染液,加入3mL含有终浓度为1%低熔点琼脂糖的SF-900II细胞培养液,室温静置20min。待琼脂糖凝胶凝固后倒置于27℃温箱中连续培养7d,并在3d后每天进行观察,看是否出现噬斑。
1.4 重组蛋白质的表达 用巴氏德管和曲颈瓶挑取清澈的噬斑,将含有病毒的琼脂糖盖子转入装有1 mL SF-9细胞培养液的1.5mL无菌离心管中,漩涡震荡混匀后,接种于长满单层SF-9细胞的100mL细胞培养瓶中,放置于27℃恒温培养箱中培养,3d后收获上清液,得到纯化后的重组杆状病毒。收获的细胞经PBS离心洗涤3次后,以100 μL的PBS重悬细胞,经反复冻融3次后,加入25 μL 5×SDS-PAGE上样缓冲液,煮沸10 min后,以5%的浓缩胶和12.5%的分离胶进行SDS-PAGE电泳。一块胶用考马斯亮蓝R250染色过夜后,30 min更换1次脱色液,脱色3次;另一块胶进行免疫印记实验。两组实验中均以培养3d的未接种病毒的SF-9细胞作为对照组。
1.5 间接免疫荧光(indirect immunofluorescence assay, IFA) 测定纯化效率以病毒量1%的接种浓度接种状态良好的SF-9细胞,同时设未接种病毒的细胞为对照组。72 h后收获感染细胞和对照组细胞,以PBS洗涤5次,冰乙醇固定30 min;加入1:200稀释的猪圆环病毒2型阳性血清,37℃恒温培养箱中放置2 h后,PBS洗涤5次,每次5 min;加入1:64稀释葡萄球菌A蛋白,避光37℃恒温培养箱中放置40 min,同样以PBS洗涤5次,每次5 min;最后,将其以PBS重悬后滴加于96孔细胞培养板中,在荧光显微镜下进行观察。
2 结果与讨论
2.1 重组杆状病毒的克隆筛选结果 经噬斑克隆,在培养周期d6,10-6稀释度的病毒开始出现肉眼可见的白色噬斑,在光学显微镜下可见噬斑中细胞已经裂解(如图1A),而噬斑周围细胞及正常对照组细胞则状态良好(如图1B)。挑取噬斑接种状态良好的SF-9细胞,27℃温箱中培养3 d即可得到1株稳定、高效表达PCV2 Cap蛋白的重组杆状病毒,病毒滴度达到1×109pfu/mL。
2.2 重组蛋白质的表达 用特异性引物对挑取的6株噬斑毒进行PCR鉴定,结果见图2。第3泳道的噬斑毒为PCV2 阳性,其大小为702 bp。将收集到的感染细胞体,进行SDS-PAGE检测,在约35 kDa位置出现1条浓染蛋白条带(图3)。Western blot结果也表明在约35 kDa处存在蛋白条带(图4)。
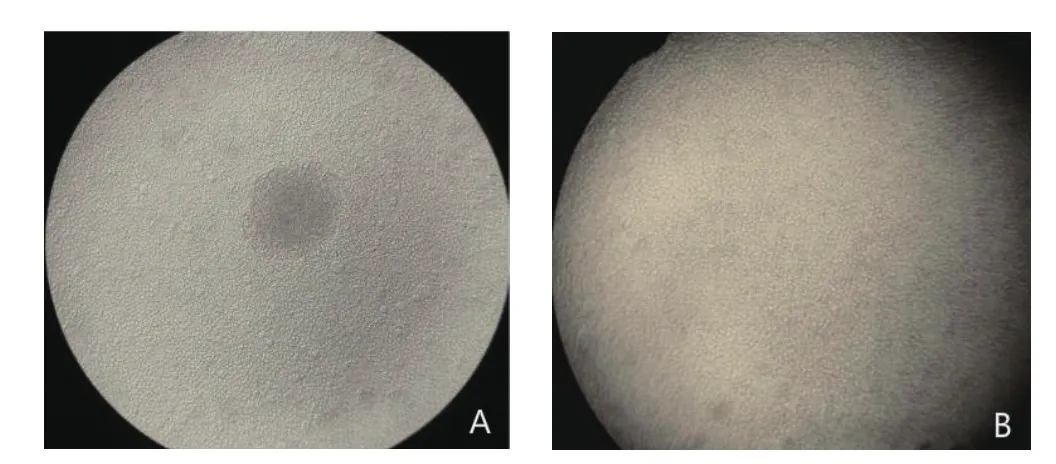
图1 噬斑(A)和正常SF-9细胞(B)Fig.1 Plaque (A) and normal SF-9 cells(B)
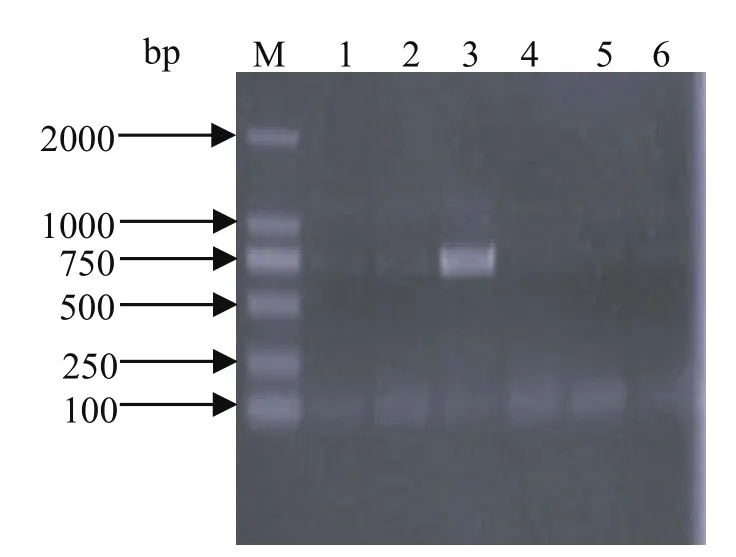
图2 重组杆状病毒的PCR鉴定Fig.2 PCR identification of recombinant baculovirus

图 3 杆状病毒表达Cap 蛋白的 SDS-PAGE 分析Fig.3 Analysis of recombinant baculovirus expressing Cap protein by SDS-PAGE

图 4 重组杆状病毒表达 Cap 蛋白的 Western blot 分析结果Fig.4 Analysis of the recombinant baculovirus expresting cap protein by Western blot
2.3 间接免疫荧光 重组杆状病毒接种SF-9细胞,27℃恒温培养3 d后,1000×g离心收集细胞体,以猪抗PCV2 Cap免疫血清为一抗,采用IFA对感染细胞中的Cap蛋白进行检测。结果表明,抗体能与感染后的昆虫细胞发生阳性反应,且噬斑纯化后重组杆状病毒的纯度及对细胞的感染力增强,而对照组细胞却无阳性反应(图5)。结果表明,噬斑纯化可提高病毒滴度。
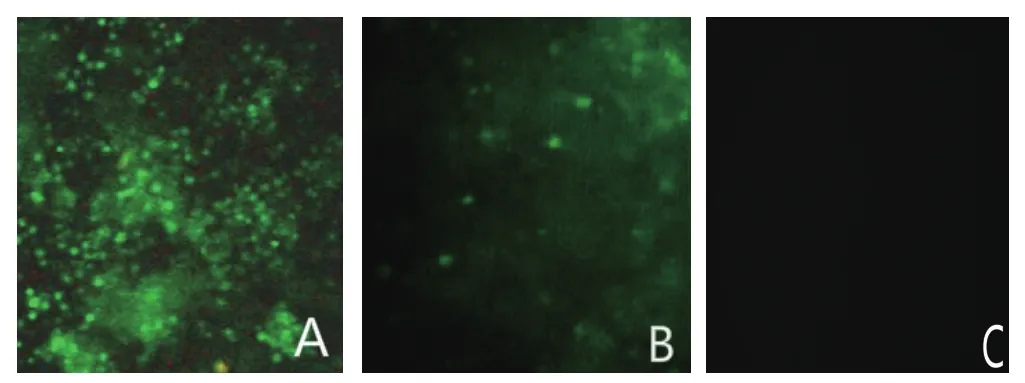
图 5 重组杆状病表达Cap蛋白的间接免疫荧光检测Fig. 5 IFA analysis of Cap protein in insect cell inoculated with recombinant baculovirus
2.4 PCV2可引起断奶仔猪多系统综合症(PMWS)[7]。自1991年该疾病在加拿大被首次报道以来[8],给养猪业带来了巨大的损失。目前,世界范围内诸多机构都在开展PCV2疫苗的研究。商品化的PCV2灭活苗2010年在中国上市。但PCV2在猪肾(PK15)细胞上的培养周期长,培养成本高且增殖滴度低等因素,给生产和研究带来了一定的困难。因此,利用杆状病毒表达系统获得高效、安全、廉价的疫苗成为我国PCV2疫苗研究的方向[9,10]。
本研究以Bacmid-iel-ORF2 质粒转染SF-9细胞获得了重组杆状病毒,并进一步对杆状病毒介导的PCV2型进行噬斑纯化,获得了在昆虫细胞中高效表达PCV2 Cap蛋白的重组杆状病毒。
重组蛋白有不同程度的融合,PCV2-Cap的大小在26~42 kDa之间均为正确表达。本研究获得的重组蛋白分子量约为35kDa,与文献报道基本一致。对重组杆状病毒感染昆虫细胞的效率进行IFA,结果进一步表明噬斑纯化后重组杆状病毒的纯度和感染效率有了较为明显的提升。获得的Cap蛋白经Western blot分析,结果显示Cap蛋白可以和猪PCV2阳性血清发生特异性反应,表明表达的Cap蛋白具有良好的免疫原活性。本研究结果为进一步提高亚单位疫苗的病毒滴度和免疫原性奠定了基础。
[1]Allan G M, Joun A. Porcine circovirus: a review[J]. J Vet Diagn Invest, 2000, 12: 3-14.
[2]朗洪武, 张广川, 吴发权, 等. 断奶猪多系统衰竭综合征血清抗体检测[J]. 中国兽医科技, 2000, 30(3): 3-5.
[3]朱鹏, 张小飞, 徐延伟, 等. 猪圆环病毒2 型Cap 蛋白表达及免疫原性鉴定[J].中国动物传染病学报, 2014, 22(5): 28-34.
[4]Sanchez R E Jr, Nauwynck H J, McNeilly, et al. Porcine circovirus 2 infection in swine foetuses inoculated at different stages of gestation[J]. Vet Microbiol, 2003, 83(2): 169-176.
[5]Chae C. Postweaning multisystemic wasting syndrome: a review of aetiology, diagnosis and pathology[J]. Vet J, 2004,168(1): 41-49.
[6]胡少敏, 王海, 吴忠道. 杆状病毒作为哺乳动物细胞表达载体及其在医学中的应用[J].国外医学寄生虫病分册, 2004,31(5): 222-226.
[7]Grau-Roma L, Fraile L, Segales J. Recent advances in the epidemiology, diagnosis and control of disease caused by porcine circovirus type 2[J]. Vet J, 2010, 187(1): 23-32.
[8]Liu Q, Willson P, Attoh-poku S, et al. Bacterial expression of an immunologically reactive PCV2 ORF2 fusion protein[J]. Protein Expr Purif, 2001, 21(1): 115-120.
[9]Zhou J Y, Wu J, Cheng L Q, et al. Expression of immunogenieS1 glyeoprotein of infections bronchitis virus intransgenic potatoes[J]. J Virol, 2003, 77(16): 9090-9093.
[10]殷震, 刘景华. 动物病毒学[M]. 2版. 北京: 北京科技出版社, 1997.
EXPRESS ION AND PURIFICATION OF CAPSID PROTEIN OF PORCINE CIRCOVIRUS TYPE 2 BY BACULOUIRUS
ZHANG Xiao, YIN Xiu-feng, XU Kai, LI Shu
(Biotechnology Research Institute, Nanjing Tianbang Bio-industry Co. Ltd., Nanjing 211102, China)
The genes sequence of Porcine circovirus type 2(PCV2) has two main open reading frams(ORF). The ORF2 gene of PCV2 is the main region encoding the structural protein-capsid protein(Cap).In order to express capsid protein in insect cells, a recombinant baculovirus were by transfecting the recombinant plasmid- Bacmid-iel-ORF2 into insect cells with lipofectin transfection. A recombinant baculovirus was obtained which could express Cap protein stably and efficiently through the plaques cloning experiments. The virus titer could reach 1×109pfu/mL. The expressed Cap protein was analyzed in Western blot, which proved that the recombinant protein could reacted with PCV2 positive serum. This study provides the basis for the further improvement the inactivated virus titer and immunogenicity.
Porcine circovirus type 2; baculovirus; viral plaque; purification
S852.659.2
B
1674-6422(2015)04-0053-04
2015-04-07
张晓,女,硕士,主要从事动物疾病研究
尹秀凤,E-mail:wo881223@126.com

