荸荠对铜绿微囊藻的化感抑制作用研究
李 江,刘云国*,曾光明,祝志林,蔡晓曦,刘少博,尹怡诚,柳思勉,胡新将,谭小飞(1.湖南大学环境科学与工程学院,湖南 长沙 10082;2.湖南大学环境生物与控制教育部重点实验室,湖南 长沙10082;.中国建筑一局集团建设发展有限公司,北京 100102;.中南大学建筑与艺术学院,湖南 长沙 10082)
荸荠对铜绿微囊藻的化感抑制作用研究
李 江1,2,刘云国1,2*,曾光明1,2,祝志林3,蔡晓曦1,2,刘少博4,尹怡诚1,2,柳思勉1,2,胡新将1,2,谭小飞1,2(1.湖南大学环境科学与工程学院,湖南 长沙 410082;2.湖南大学环境生物与控制教育部重点实验室,湖南 长沙410082;3.中国建筑一局集团建设发展有限公司,北京 100102;4.中南大学建筑与艺术学院,湖南 长沙 410082)
采取植物种植水培养、植物浸提液培养及植物共培养3种培养方式研究了荸荠对铜绿微囊藻生长的影响.结果发现:荸荠植株种植水、荸荠浸提液以及荸荠与铜绿微囊藻共培养均对铜绿微囊藻的生长产生了化感抑制作用.100%浓度的荸荠浸提液对铜绿微囊藻生长抑制率达到91.40%,而荸荠与铜绿微囊藻共培养时对铜绿微囊藻生长的抑制率为86.83%.这两者之间的差异并不显著,直接验证了荸荠能够通过不断地向水体中释放化感物质来长久、有效地抑制铜绿微囊藻的生长.
荸荠;铜绿微囊藻;种植水;浸提液;共培养;化感作用
蓝藻水华(HABs)是水体富营养化后常见的灾难[1].铜绿微囊藻(Microcystis aeruginosa)是一种典型的水华藻,它能释放有毒藻毒素.微囊藻毒素对水生生物和人类的生存都具有较大威胁[2].通过控制铜绿微囊藻的生长来控制藻毒素的释放是一种有效的防治方法.
国内外针对藻类抑制的方法主要分为:物理法、化学法、生物法等[3].物理除藻法对小范围水体有快速除藻的效果,但对大范围水域,其能耗投入和处理效率则难以满足需求,且不能从根本上解决问题[4].化学除藻法虽能快速杀藻,却在除藻的同时不可避免的危害水生动物和植物,破坏水体生态结构[5-6].生物除藻法通常利用大型水生植物与微藻进行营养、光因子竞争,抑制藻类增殖[7];另一种生物除藻法是利用水生动物滤食作用,以生物驱动抑制藻类;第3种生物除藻法是利用植物释放对本身无害的化学物质到环境来影响藻类的生长[8],释放的化学物质一般是植物的次级代谢产物,易降解而对环境无较大影响[9].目前已发现多种水生植物对水华藻类具有一定的化感抑制作用[10-11].
荸荠(Eleocharis dulcis),俗称马蹄、地栗、地梨等,是莎草科荸荠属的水性宿根草本植物,原产于中国南部和印度.荸荠既可作为水果食用,又可作为蔬菜熟食.研究发现荸荠皮具有一定的抑菌作用,其具有较强的清除自由基效果[12-13].荸荠作为常见的挺水草本植物,已被广泛运用到恒流人工湿地中[14].Overall等[15]发现在恒流人工湿地中生长的荸荠生长状况较好,其平均直径达5mm,长度达2m.而在利用荸荠化感作用抑藻方面的研究则较为鲜见.本文以荸荠为研究对象,考察了荸荠植株种植水[16]、荸荠浸提液[17]和荸荠与铜绿微囊藻共培养[18]等3种培养方式对铜绿微囊藻生长的影响,以期为铜绿微囊藻生物防治提供基础资料.
1 材料与方法
1.1 材料
1.1.1 荸荠样品 荸荠购于江苏某花卉基地,每株株长近1.2m.干样为在背阴处晾干的鲜活样品.
1.1.2 实验藻株 铜绿微囊藻(M. aeruginosa)(编号FACHB-905)购于武汉水生生物研究所淡水藻种库.正式实验前利用MA培养基在智能人工气候箱中进行培养,保持50µmol/(m2·s)的光照强度,光暗比12h/12h,温度(25±1)°C,相对湿度75%.
1.1.3 仪器与设备 人工气候培养箱、奥林巴斯显微镜、血球计数板、旋转蒸发仪、岛津紫外-可见分光光度计、共培养箱等.其中共培养箱是自行制作的一个能有效隔离微生物、营养物质和光照干扰进行共培养试验研究的装置,其主要包括一个正方体培养箱和相关辅助设备.该装置外部是艾力克板立方体,内部含一个艾力克圆筒;圆筒上方设计了一个可移动的盖子,盖子上装有2个防滑把手,便于打开和关闭培养装置.盖子上开圆孔,装有定植篮,便于固定植物和恒流泵.圆筒外部四周开有3个小圆孔,圆孔上装有可拆卸式的0.45μm微孔滤膜,便于水分和营养物质的交流,并同时阻止藻和可能的微生物直接接触.立方体底部装有一个可拆卸式的0.45μm微孔滤膜,并设置一个阀门,便于释放培养液.
1.2 方法
1.2.1 培养基的配置 实验所用培养基为MA培养基,每升MA培养基分别加入如表1所示物质,采用超纯水进行培养基的配制.培养基配制完成后,用1mol/L的NaOH或者HCl置于灭菌锅调节培养基的pH值至7.0~7.1之间即可.然后将培养基置于灭菌锅灭菌后放置在无菌操作台冷却备用.

表1 MA培养基的组分和用量(1L)Table 1 The components and their dosages of 1L MA medium
1.2.2 荸荠植株种植水对铜绿微囊藻的抑制实验 选择前述实验准备的生长状况良好的荸荠数株,吸去植物体表面的水分后称量每棵荸荠的湿重并作好记录.选择湿重约100g的荸荠于3L超纯水中培养20d得到种植水,然后经0.22μm滤膜过滤后加入MA培养基配制成种植水培养基保存在冰箱备用.本实验设置3个浓度梯度,将种植水培养基和超纯水按照1:9、5:5、10:0(V/V)的比例配制1L藻细胞培养基,分别编号为10%荸荠植株种植水培养基、50%荸荠植株种植水培养基、100%荸荠植株种植水培养基.同时对照组亦设置3个浓度梯度,将纯水培养基和超纯水也按照1:9、5:5、10:0(V/V)的比例配制1L藻细胞培养基,分别编号为10%纯水培养基、50%纯水培养基、100%纯水培养基.接种铜绿微囊藻,使各组初始藻密度达1.3×106cells/mL,每组设3个平行样.每天在取样后通过底部阀门释放100mL培养液到外部环境中,并通过恒流泵输送100mL MA培养基,输送速度稳定在1mL/min,维持营养物质和氧气的有序供应.该共培养装置安放在一个智能人工气候箱中,保持50µmol/(m2·s)的光照强度,光暗比12h/12h,温度(25±1)℃,相对湿度75%,均置于智能人工气候箱下培养.每天取少许藻液采用血球计数板进行计数.
1.2.3 荸荠浸提液对铜绿微囊藻的抑制实验 选取生长良好的荸荠球茎,用自来水洗净,然后再用超纯水冲洗数次,去除表面杂质和附着生物.将洗净的球茎放入恒温鼓风干燥箱中于50℃干燥至恒重,称取约40g,剪碎至不超过10mm的小块,用粉碎机粉碎.将荸荠球茎干粉与超纯水按1:40(W/V)比例混合,置于锥形瓶中,用封口膜密封瓶口,至于水浴恒温振荡器振荡提取40min,过滤掉植物干粉,减压抽滤去掉植物残渣,得到荸荠浸提液,将其转移到玻璃瓶中,低温避光密封保存.取上述荸荠浸提液配制培养基,分别配制成10%、50%、100%浓度的浸提液培养基.培养条件和测定方法均同种植水实验.
1.2.4 荸荠和铜绿微囊藻共培养实验 共培养实验包括2个实验组:1)荸荠和铜绿微囊藻共培养组(实验组),2)具有与荸荠类似外形的塑料制品代替荸荠与铜绿微囊藻共培养组(对照组).共培养箱圆筒内部种植荸荠,圆筒外部空间养殖铜绿微囊藻.荸荠种植密度是35g鲜重/L,接近于自然环境下荸荠的种群密度.圆桶外部空间接种的藻密度近1.3×106cells/mL.共培养初始加入2000mL MA培养基,在智能人工气候箱中培养7d,每天取样测定藻密度.每组设置3个平行样本. 1.2.5 数据处理 铜绿微囊藻生长的抑制率IR用公式来计算:IR=1-N/N0.其中,N为处理组的藻密度,N0为空白对照组的藻密度.数据分析时取3个平行样的平均值进行计算,使用SPSS18.0软件进行数据处理与显著性差异分析.
2 结果与分析
2.1 荸荠植株种植水对铜绿微囊藻的抑制作用
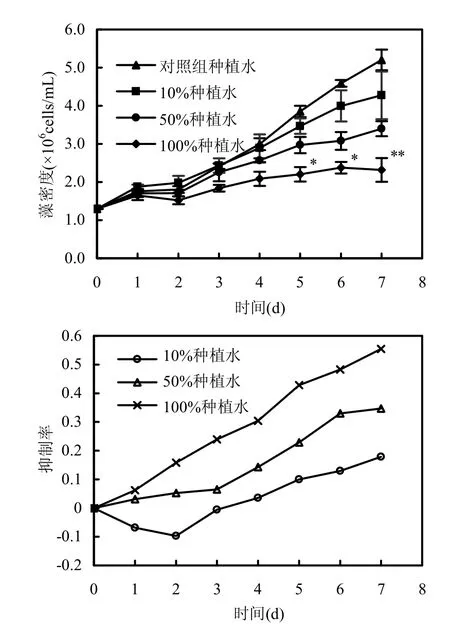
图1 荸荠植株种植水对铜绿微囊藻生长的影响Fig.1 The influence of cultural water of E. dulcis on M. aeruginosa growth
由图1可知,10%荸荠植株种植水培养基中的铜绿微囊藻在培养的第0~4d抑制率为负,说明第0~3d内荸荠植株种植水促进了铜绿微囊藻的生长,受荸荠植株种植水的影响,生长程度较对照组迅速;而50%荸荠植株种植水培养基对铜绿微囊藻生长的抑制效果则优于10%荸荠植株种植水培养基,但抑制效果也不明显(P>0.05);100%浓度荸荠植株种植水培养基则对铜绿微囊藻体现出了较好的抑制效果,其抑制效果在半数左右,说明荸荠植株种植水培养基半数效应浓度约为35g鲜重/L.其中,10%浓度下的荸荠植株种植水培养基对铜绿微囊藻最大生长抑制率仅为17.82%(P>0.05),而100%浓度下荸荠植株种植水培养基对铜绿微囊藻生长抑制率则达到55.45%(P<0.01).从图1可看出,荸荠植株种植水对铜绿微囊藻的生长具有一定的抑制作用,且不同浓度的种植水抑制效果不一,总体表现为随种植水在培养基中的浓度的提高抑制效果不断增强.
2.2 荸荠浸提液对铜绿微囊藻的抑制作用

图2 荸荠浸提液对铜绿微囊藻生长的影响Fig.2 The influence of aqueous extract of E. dulcis on M. aeruginosa growth
由图2可知,荸荠浸提液培养基对铜绿微囊藻生长具有较强的抑制效果,在100%浓度的荸荠浸提液培养基中培养的铜绿微囊藻在培养末期已基本死亡,抑制率达到了91.4%.从3组数据可看出,不同浓度的荸荠浸提液培养基均有相当的抑藻效果,都呈现出随着时间的延长抑藻效果不断增强的现象.培养第7d,10%浓度、50%浓度和100%浓度的荸荠浸提液培养基的抑藻效率为46.24%(P<0.05)、76.13%(P<0.01)和91.40% (P<0.01).荸荠浸提液培养基的抑藻效果优于荸荠植株种植水培养基.
2.3 荸荠与铜绿微囊藻共培养时对铜绿微囊藻的抑制作用
由图3可以看出,在荸荠和铜绿微囊藻共培养的情况下,铜绿微囊藻的生长明显被荸荠抑制,且随着培养时间的延长,抑制效果越来越好,最终抑制效率达到了86.83%(P<0.01).培养第1d,荸荠对铜绿微囊藻的生长主要起到促进作用,随着培养时间的延长,铜绿微囊藻的藻密度不断降低,生长速度不断下降;培养第4~7d,藻密度下降十分明显,其最终藻密度仅为5.24×106cells/mL,远低于初始藻密度,铜绿微囊藻的生长被荸荠极大抑制.共培养条件下,排除了营养元素、光照和微生物等因素的干扰[19],铜绿微囊藻抑制率提高的现象说明是荸荠确实对铜绿微囊藻的生长产生了抑制作用,并进一步表明是荸荠的化感作用对铜绿微囊藻产生了抑制作用,荸荠具有化感抑藻作用.

图3 共培养时荸荠对铜绿微囊藻生长的影响Fig. 3 Effects of E. dulcis on M. aeruginosa growth under co-cultural condition
3 讨论
3.1 荸荠对铜绿微囊藻生长的影响
通过3种不同培养方式考察了荸荠对铜绿微囊藻生长的影响.从图1可知,荸荠植株种植水对铜绿微囊藻生长的抑制率从第1d的6.25%(P>0.05)到第7d的55.45%(P<0.01);从图2可知,荸荠浸提液对铜绿微囊藻生长的抑制率从第1d的25.71%(P>0.05)到第7d的91.40% (P<0.01);从图3可知,荸荠与铜绿微囊藻共培养时对铜绿微囊藻生长的抑制率从第1d的-1.25%(P>0.05)到第7d的86.83%(P<0.01);荸荠对铜绿微囊藻生长的影响表现为随时间延长影响越大,可见抑制效果和藻密度具有较大关联.荸荠释放的化感物质对铜绿微囊藻的生长具有双重效应[20],一方面化感物质能通过影响铜绿微囊藻体内某些亲和力高的兴奋性受体,使其产生兴奋效应,进而促进藻细胞的生长;另一方面化感物质影响铜绿微囊藻体内某些亲和力低的抑制性受体,使兴奋效应逐渐中和,综合表现为抑制藻细胞的生长[21].培养初期藻密度小,营养物质充分,荸荠释放的化感物质相对浓度低,能与藻细胞体内的兴奋性受体发生结合,能促进藻细胞的生长;随着营养物质的消耗,藻密度会发生下降,而当藻密度降低到一定程度后,培养基中的化感物质相对浓度不断提高,就会抑制了藻细胞体内的兴奋性受体的活性,并与藻细胞体内的抑制性受体发生结合,使藻细胞的密度降低,直接抑制藻细胞的生长.
3.2 不同培养方式对铜绿微囊藻生长的影响
选择植物种植水、植物器官浸提液以及植物与铜绿微囊藻共培养等3种方式作用于铜绿微囊藻,表现出不同的抑藻效果.种植水培养基最大抑藻率为55.45%(P<0.01),浸提液培养基最大抑藻率为91.40%(P<0.01),共培养最大抑藻率为86.83%(P<0.01),3种培养方式中浸提液培养基对铜绿微囊藻生长的抑制效果最佳,其半数效应浓度约为0.5g干重/L.种植水培养基中所含的化感物质在培养过程中不断消耗,且本身浓度较低,因此其抑藻效果并不明显[10,22-24].浸提液培养基中所含的化感物质浓度较高,且经过高温灭菌后效果依然很好,说明荸荠球茎中所含的化感物质性质相对稳定,抑藻效果较好[10,25-27].通过共培养实验直接验证了荸荠能够通过化感作用抑制铜绿微囊藻的生长[16],说明荸荠具有高效抑藻作用.

表2 荸荠对铜绿微囊藻的抑制率(%)Table 2 The inhibition ratio of M. aeruginosa treated by E. dulcis (%)
3.3 荸荠铜绿微囊藻化感作用的研究意义
荸荠抑制铜绿微囊藻生长,不仅可以通过吸收铜绿微囊藻生长所需的营养物质来实现控制铜绿微囊藻的效果,还可以通过释放体内的化感物质来直接抑制铜绿微囊藻的生长,2者共同发生作用,比向水体中直接投放抑藻的化感物质或荸荠浸提液将更加长久、有效地控制铜绿微囊藻.
4 结论
4.1 荸荠植株种植水和荸荠浸提液对铜绿微囊藻的抑制作用随荸荠化感物质浓度的增加而不断增强.
4.2 荸荠植株种植水、荸荠浸提液和共培养对铜绿微囊藻的抑制作用随时间的延长不断增强.
4.3 共培养实验的最大抑藻率(86.83%)与浸提液培养基最大抑藻率(91.40%)之间的差异并不显著,直接验证了荸荠能够通过不断地向水体中释放化感物质来长久、有效地抑制铜绿微囊藻的生长.
[1]孔繁翔,宋立荣.蓝藻水华形成过程及其环境特征研究 [B]. 北京:科学出版社, 2011.
[2]Oh H M, Lee S J, Jang M H, Yoon B D. Microcystin production by Microcystis aeruginosa in a phosphorus-limited chemostat [J]. Applied Environmental Microbiology, 2000,66:176-179.
[3]杨清海.中国富营养化水体修复技术进展 [J]. 辽东学院学报自然科学版, 2008,15(2):71-77.
[4]王国祥,濮培民.若干人工调控措施对富营养化湖泊藻类种群的影响 [J]. 环境科学, 1999,20:71-74.
[5]Caffrey J M, Monahan C. Filamentous algal control using barley straw [J]. Hydrobiologia, 1999,415:315-318.
[6]和丽萍.利用化学杀藻剂控制滇池蓝藻水华研究 [J]. 云南环境科学, 2001,20(2):43-44.
[7]洪 喻,胡洪营.水生植物化感抑藻作用研究与应用 [J]. 科学通报, 2009,54(3)287-293.
[8]Yalew Addisie, Andrea Calderon Medellin. Allelopathy in aquatic macrophytes: Effects on growth and physiology of phytoplanktons [J]. African Journal of Plant Science, 2012,6(10): 270-276.
[9]Whittaker R. The biochemical ecology of higher plants[M]//Soudheimer E, Simeone J B, eds. Chemical Ecology. New York: Academic Press Inc, 1970
[10]HU Hongying, HONG Yu. Algal-bloom control by allelopathy of aquatic macrophytes—A review [J]. Frontiers of Environmental Science and Engineering in China, 2008,2(4):421-438.
[11]Nakai S, Inoue Y, Hosomi M, et al. Growth inhibition of blue-green algae by allelopathic effects of marophytes [J]. Water Science and Technology, 1999,39(8):47-53.
[12]贾冬英,曹冬冬,姚 开.荸荠皮提取物对DPPH自由基清除活性 [J]. 天然产物研究, 2007,19:745-747.
[13]李行任,罗杨合,何 隽,等.荸荠皮酚性成分及其抗氧化活性研究 [J]. 天然产物研究, 2013,25:1615-1620.
[14]Jan Vymazal. Emergent plants used in free water surface constructed wetlands: A review [J]. Ecological Engineering, 2013,61:582-592.
[15]Overall R A, Parry D L, The uptake of uranium by Eleocharis dulcis (Chinese water chestnut) in the Ranger Uranium Mine constructed wetland filter [J]. Environmental Pollution, 2004,132: 307-320.
[16]孙文浩,俞子文,余叔文.水葫芦对藻类的克制效应 [J]. 植物生理学报, 1988,14(3):294-300.
[17]Hong Y, Hu H Y. Effects of the aquatic extracts of Arundo donax L. on the growth of freshwater algae [J]. Allelopathy Journal,2007,20(2):315-325.
[18]何池全,叶居新.石菖蒲(Acorus tatarinowii)克藻效应的研究 [J].生态学报, 1999,19(5):754-758.
[19]Havens K E, James R T, East T L, et al. N: P ratios, light limitation, and cyanobacterial dominance in a subtropical lake impacted by non-point source nutrient pollution [J]. Environmental Pollution, 2003,122(3):379-390.
[20]Stebbing A R D. Hormesis-the stimulation of growth by low levels of inhibitors [J]. Science of the Total Environment, 1982,22(3):213-234.
[21]Calabrese E J, Baldwin L A. Hormesis: the dose-response revolution [J]. Annual Review of Pharmacology and Toxicology,2003,43(1):175-197.
[22]李锋民,胡洪营.芦苇抑藻化感物质的分离及其抑制蛋白核小球藻效果研究 [J]. 环境科学, 2004,25(5):89-92.
[23]吴 程.高等水生植物化感抑藻效应及其影响因素和机理研究[D]. 昆明:云南大学, 2008.
[24]侯 明.高等水生景观植物化感抑藻作用研究 [D]. 北京:华北电力大学, 2012.
[25]张 涛.粉绿狐尾藻对铜绿微囊藻的化感抑藻物质的分离及鉴定 [D]. 昆明:云南大学, 2011.
[26]陈丁立.凤眼莲对铜绿微囊藻的抑制作用及其机理研究 [D].扬州:扬州大学, 2011.
[27]杜胜蓝.富营养化水体藻类去除方法研究 [D]. 天津:南开大学,2011.
Study on allelopathic effects of Eleocharis dulcis to Microcystis aeruginosa.
LI Jiang1,2, LIU Yun-guo1,2*, ZENG Guang-ming1,2, ZHU Zhi-lin3, CAI Xiao-xi1,2, LIU Shao-bo4, YIN Yi-cheng1,2, LIU Si-mian1,2, HU Xin-jiang1,2, TAN Xiao-fei1,2(1.College of Environmental Science and Engineering, Hunan University, Changsha 410082, China;2.Key Laboratory of Environmental Biology and Pollution Control, Ministry of Education, Hunan University, Changsha 410082,China;3.China Construction First Division Group Construction and Development Co.,Ltd., Beijing 100102, China;4.School of Architecture and Art, Central South University, Changsha 410082, China). China Environmental Science,2015,35(5):1474~1479
Three cultural modes including Eleocharis dulcis planting water, aqueous extract of Eleocharis dulcis and Eleocharis dulcis co-culture with Microcystis aeruginos were studied to explore the effects of Microcystis aeruginosa growth. It is found that Eleocharis dulcis planting water, aqueous extract of Eleocharis dulcis and Eleocharis dulcis co-culture with Microcystis aeruginosa had inhibited the growth of Microcystis aeruginosa, and the inhibitory effects was caused by allelopahty. The inhibitory ratio of aqueous extract of Eleocharis dulcis with 100% concentration was 91.40%,and the ratio of co-culture mode was 86.83%. According to this research, it can be found that Eleocharis dulcis has a certain application prospect in the field of ecological algal inhibition as an emergent plant.
Eleocharis dulcis;Microcystis aeruginosa;planting water;aqueous extract;co-culture;allelopathy
*P<0.05表示差异显著, **P<0.01表示差异极显著
X171.5,Q948
A
1000-6923(2015)05-1474-06
李 江(1984-),男,湖南浏阳人,博士,主要从事水质保持与生态修复技术研究.
2014-09-23
国家自然科学基金资助项目(41271332);湖南省科技计划项目(2012SK2021)
* 责任作者, 教授, liuyunguo@hnu.edu.cn

