Cd2+胁迫下中肋骨条藻细胞内多胺的生理响应
栾红艳,赵卫红,苗 辉(.中国科学院海洋研究所,海洋生态与环境科学重点实验室,山东 青岛 26607;2.中国科学院大学,北京 00049)
Cd2+胁迫下中肋骨条藻细胞内多胺的生理响应
栾红艳1,2,赵卫红1*,苗 辉1(1.中国科学院海洋研究所,海洋生态与环境科学重点实验室,山东 青岛 266071;2.中国科学院大学,北京 100049)
通过室内添加Cd2+培养中肋骨条藻(Skeletonema costatum),开展了Cd2+胁迫对中肋骨条藻生长的影响及藻细胞内超氧化物歧化酶(SOD)、二胺氧化酶(DAO)、多胺氧化酶(PAO)的活性以及丙二醛(MDA)和各形态多胺含量变化的实验,以探究多胺对于海洋微藻在重金属胁迫下的响应及生理作用.结果显示,Cd2+对中肋骨条藻的生长产生胁迫作用,且Cd2+浓度越大对藻细胞生长的抑制作用越强.Cd2+胁迫下中肋骨条藻细胞内MDA含量略有升高,SOD活性显著降低,DAO和PAO活性分别增强.随着Cd2+胁迫作用的增强,藻细胞内游离态腐胺(Put)、亚精胺(Spd)、精胺(Spm)含量先降低后升高;结合态Put、Spd和Spm含量先升高后降低;束缚态Put、Spm和Spd含量及Put总量和Spm总量升高.表明Cd2+胁迫会导致中肋骨条藻细胞产生氧化损害,同时细胞内DAO和PAO活性的增强以及游离态Put、束缚态Spd和Spm、Put总量和Spm总量的升高可能会增强藻细胞抵抗Cd2+胁迫的能力.
Cd2+胁迫;中肋骨条藻(Skeletonema costatum);多胺
多胺是一类含有两个及两个以上氨基的小分子含氮化合物,广泛存在于动物、植物、藻类及微生物体内.常见的多胺有腐胺、亚精胺和精胺.根据其在高氯酸中的溶解性分为游离态、高氯酸可溶性结合态、高氯酸不溶性束缚态[1].多胺在细胞内以聚阳离子态存在,因此能与一些带负电荷的大分子如核酸、蛋白质或小分子如酚酸结合[2],参与细胞的生长,衰老以及胁迫反应等生理过程[3],对于生物体的生长发育具有重要作用.目前对于多胺在高等植物体抵抗渗透胁迫、温度胁迫、盐度胁迫、重金属胁迫等方面都有深入的研究[4-7],但是对于海洋微藻在重金属胁迫下细胞内多胺变化的研究很少.Cd2+是海洋中一种常见的重金属污染物,对于海洋生物的生长具有严重的毒害作用,而中肋骨条藻(Skeletonema costatum)是海洋中常见的硅藻,分布较为广泛,因此研究Cd2+胁迫下中肋骨条藻细胞的生理响应及各种形态多胺的变化,对于了解海洋微藻在重金属胁迫下的响应机制,增进对多胺生理作用的认识具有重要的意义.
1 材料与方法
1.1 实验材料
培养用海水为人工海水,经φ47mm GF/F(whatman)滤膜过滤,添加f/2配方,煮沸灭菌冷却后备用.研究选取的中肋骨条藻(Skeletonema costatum)由中国科学院海洋研究所藻种库提供,采自东海.培养于1L的锥形瓶中,培养温度为(20±1)℃,光照强度为4000~5000lx,光暗比为L:D=12:12.
1.2 实验设计
Cd2+浓度设置5个水平,分别为0, 0.5, 0.8,1.0, 1.2mg/L,每个水平设置3个平行样.对照组Cd2+浓度设置为0mg/L.初始接种藻的密度为1.72×104cell/mL,培养至指数生长期时添加不同浓度的Cd2+溶液(分析纯的CdCl2·2.5H2O配制1g/L的储备液),每隔24h测定藻细胞密度,72h后停止培养,离心提取藻细胞以测定MDA、SOD、DAO、PAO及多胺.
1.3 生理指标的测定
1.3.1 藻细胞密度和相对增长率(K) 通过721E型分光光度计测定藻液在440nm (对含中肋骨条藻细胞的藻液进行光谱扫描所得的最大吸收波长)的吸光值,然后根据预实验中做出的一系列稀释藻液的藻细胞数(N)与对应吸光值(A)关系的标准曲线: N(105cell/mL)=8.075A-0.007,(n=5,R=0.998)计算得到藻细胞密度(105cell/mL).相对增长率的计算:K=(lnNt-lnN0)/t,其中,Nt为t时刻藻细胞密度(cell/mL),N0为初始细胞密度(cell/mL),t为培养时间(d).以藻细胞密度及细胞相对增长率来表示藻的生长状况.
1.3.2 丙二醛(MDA)含量 丙二醛(MDA)采用硫代巴比妥酸(TBA)法[8]并略有改动.取50mL藻液3000r/min离心10min,去上清液,沉淀中加入2mL磷酸缓冲液(0.05mol/L,pH7.8),超声波破碎藻细胞(冰浴),然后3000r/min,4℃下离心10min,取上清液作酶活分析.取1.5mL酶提取液,加入2.5mL含0.5%硫代巴比妥酸的20%三氯乙酸溶液,混合物于沸水浴中反应30min,迅速冰浴冷却,4000r/min离心10min,上清液分别在532nm,600nm测定吸光度值.MDA含量以mol/cell表示.
1.3.3 超氧化物歧化酶(SOD)活性 SOD测定采用氮蓝四唑光化学还原反应法[9].粗酶液的提取同1.3.2 丙二醛的提取方法 反应液包括2mL磷酸缓冲液(0.05mol/L, pH7.8), 0.3mL甲硫氨酸溶液(130mmol/L),0.3mL氮蓝四唑溶液(750μmol/L), 0.3mLEDTA溶液(100μmol/L),0.3mL核黄素溶液(20μmol/L),再加入0.1mL酶液后于4000lx光照下反应15min,反应结束后采用TU-1810型紫外-可见分光光度计在560nm处测定吸光度值.以能引起反应初速度(指不加酶时)半抑制时的酶用量为1个酶活单位(U).
1.3.4 DAO和PAO活性 DAO和PAO采用汪天等[10]改进的方法并略有改动.反应混合液包括
2.5mL磷酸缓冲液(0.1mol/L,pH6.5)、0.2mL显色液(0.1mol/L, pH6.5磷酸缓冲液配制,100mL磷酸缓冲液中含有25μL N,N-二甲基苯胺、10mg氨基安替吡啉)、0.1mL过氧化物酶溶液(250U/mL)、0.2mLDAO或PAO提取液. DAO和PAO分别用0.1mLPut(20mmol/L), 0.1mLSpd(20mmol/L)启动反应,30℃水浴反应60min,反应结束后用TU-1810型紫外-可见分光光度计测定550nm处的吸光值,以0.001△OD550/(min×cell)为1个酶活单位(U).
1.3.5 三种形态多胺 多胺的测定采用高效液相色谱法[11],色谱条件采用付敏等[12]的测定条件.取50mL藻液, 3000r/min离心10min,去上清液,沉淀中加入2mL 5%的高氯酸溶液,超声波破碎细胞,然后在4000r/min离心10min.上清液中包含游离态和结合态多胺,沉淀用来测定束缚态多胺.取1mL上清液进行游离态多胺的测定,加入10µL 1,6-己二胺标液(10-5mol/L),涡旋振荡30s,加入70µL硼酸缓冲液和适量的2mol/L的氢氧化钠溶液调节pH值,使pH值达到9.8左右,涡旋混匀,再加入2mL丹磺酰氯的丙酮(5mg/mL)溶液,涡旋混匀,40℃下水浴避光衍生45min,加入25%的浓氨水100µL中止反应并除去多余的丹磺酰氯,涡旋混匀30s,避光静置30min,用乙醚萃取,氮气吹干,加入500µL乙腈溶解残留物,最后用0.22µm有机针头微孔滤膜过滤,进样分析.将另1mL上清液及沉淀,分别用等体积的12mol/L 的HCl混合,封装于安瓿瓶中,在110℃水解18h后,70℃旋转蒸干,再用1mL 5%高氯酸溶解,然后按游离态多胺的测定方法测定结合态和束缚态多胺.
1.4 数据统计分析
数据处理采用SPSS19.0统计分析软件进行ANOVA,用Origin8.5作图.
2 结果与讨论
2.1 过量Cd2+对中肋骨条藻生长的影响
图1A表明添加过量Cd2+能抑制中肋骨条藻的生长.培养至72h,Cd2+浓度大于0.8mg/L时藻细胞密度均显著低于对照组(P<0.01).
由图1B可见,中肋骨条藻细胞的相对增长率会随着培养液中添加Cd2+浓度的增大而降低.添加浓度到1.0mg/L时藻细胞相对增长率降低了37.8%.由此看来向培养液中添加过量Cd2+对中肋骨条藻的生长产生了胁迫作用.
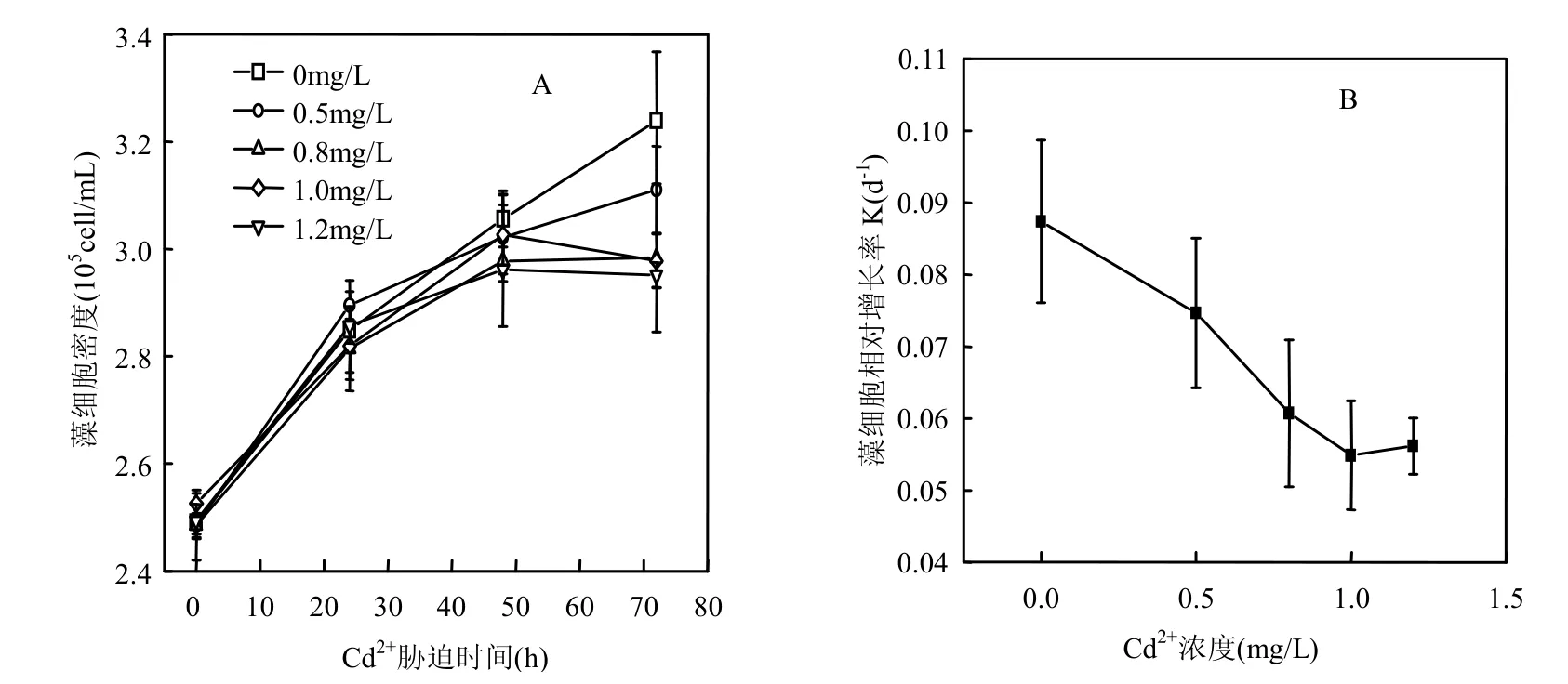
图1 Cd2+对中肋骨条藻细胞密度和相对生长率的影响Fig.1 The effect of Cd2+on the cell density and relative growth rate of Skeletonema costatum
2.2 Cd2+胁迫下中肋骨条藻细胞内MDA含量与SOD活性的变化
向培养液中添加Cd2+培养中肋骨条藻72h后,藻细胞内MDA含量略有升高(P=0.619).添加Cd2+浓度为0.8mg/L时MDA含量比对照组升高了12.1%(图2A).相反,添加Cd2+后,中肋骨条藻细胞内SOD活性比对照组显著降低(P<0.001).添加1.0mg/L Cd2+时SOD活性比对照组降低了37.3%;添加1.2mg/L Cd2+时SOD活性比对照组降低74.7%(图2B).
MDA是膜脂过氧化产物,其含量可以作为衡量细胞所受的氧化损害程度大小的指标.Cd2+胁迫下中肋骨条藻细胞内MDA含量略有升高,表明添加Cd2+对藻细胞产生了一定的氧化损害.有研究表明,重金属胁迫能够影响电子正常的易位迁移,导致大量的自由基产生,从而引起膜脂过氧化[13].SOD是细胞自身的一种抗氧化酶,能够通过歧化反应清除自由基,降低活性氧对细胞所产生的氧化损害,从而减少细胞内MDA的产生.实验中Cd2+胁迫下中肋骨条藻细胞内SOD活性随Cd2+浓度的增大而降低,表明藻细胞抵抗氧化损害的能力减弱,从而导致MDA的积累.
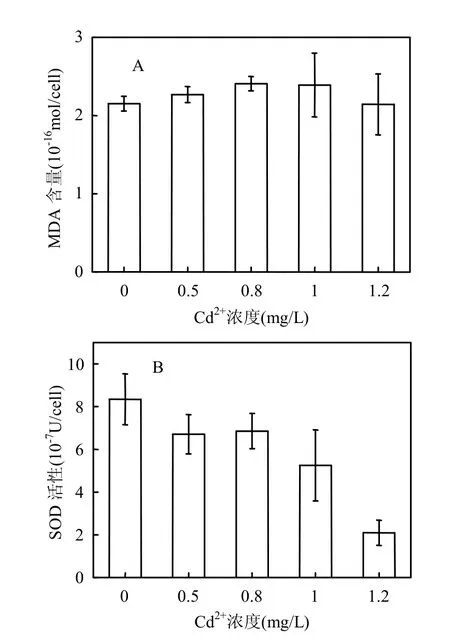
图2 Cd2+胁迫下中肋骨条藻细胞内MDA含量及SOD活性变化Fig.2 Changes of intracellular MDA contents and SOD activity of Skeletonema costatum under Cd2+stress
2.3 Cd2+胁迫下中肋骨条藻细胞内DAO与PAO活性变化
添加Cd2+培养72h后中肋骨条藻细胞内DAO和PAO活性升高,且PAO活性变化较DAO明显.Cd2+浓度为0.5mg/L组DAO活性比对照升高34.5%,其他组DAO活性较对照组升高幅度较小(图3A).PAO活性随Cd2+浓度增加而升高,与对照组相比,Cd2+浓度为1.2mg/L组比对照组升高61.7%(图3B).
Cd2+胁迫下中肋骨条藻细胞内DAO和PAO活性增强对于Put、Spd及Spm的氧化分解起着重要作用.Besford 等研究发现,DAO和PAO活性增强时,可能会促进多胺的分解反应,通过生成1,3-二氨基丙烷来调节渗透胁迫下燕麦叶类囊体膜的稳定性[14].因此,DAO和PAO的活性对于维持膜的稳定性及改善藻细胞抵抗Cd2+胁迫的能力具有重要意义.
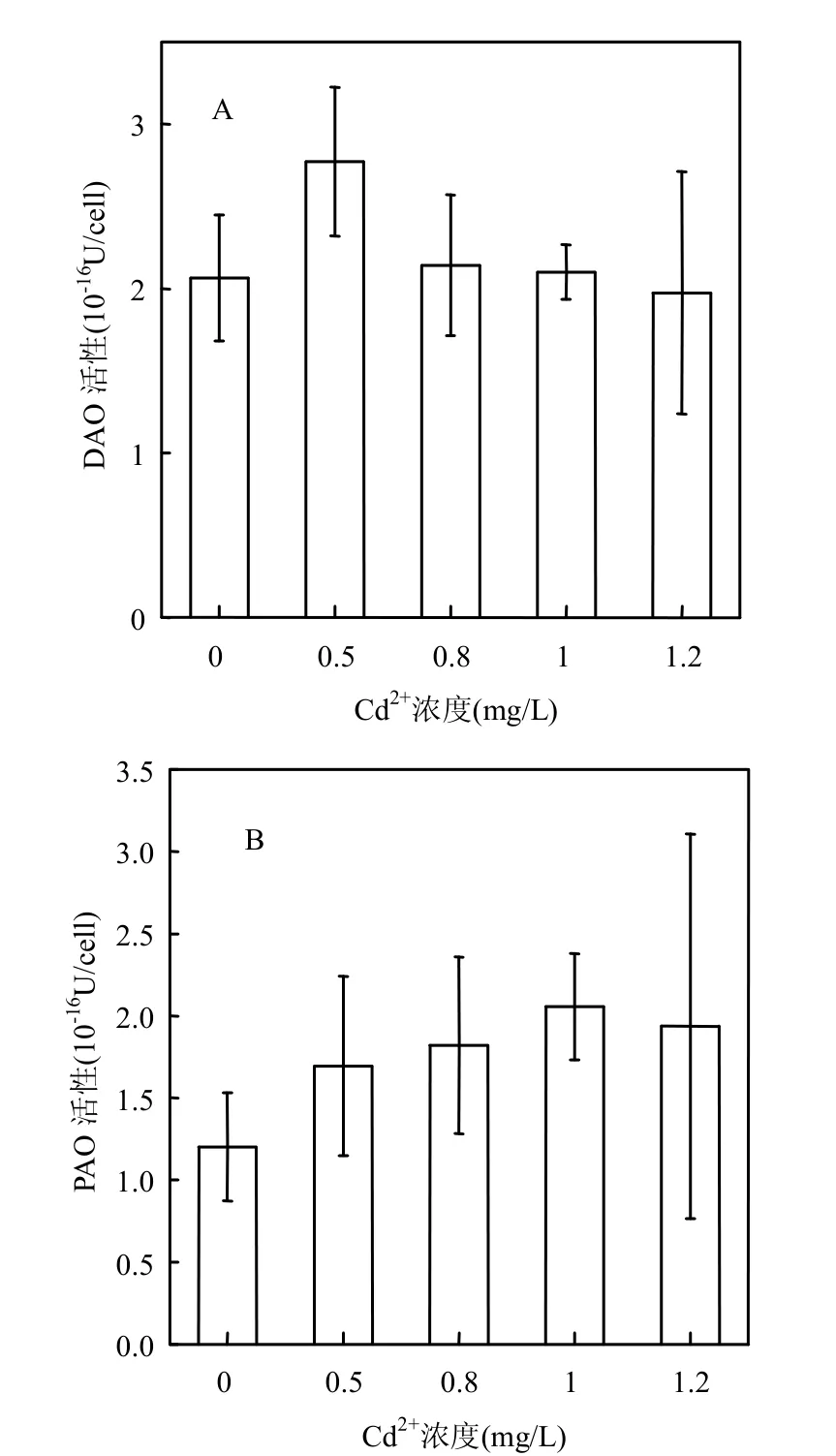
图3 Cd2+胁迫下中肋骨条藻细胞内DAO, PAO活性变化Fig.3 Changes of intracellular DAO, PAO activity of Skeletonema costatum under Cd2+stress
2.4 Cd2+胁迫下中肋骨条藻细胞内各形态多胺含量及所占百分比的变化
由图4A可见,中肋骨条藻细胞内游离态Put的含量随添加Cd2+浓度的增加先降低后升高,呈U型变化;结合态Put含量随添加Cd2+浓度的增大先升高后降低,呈峰型变化,Cd2+浓度为0.5mg/L组结合态Put含量比对照组升高了58.1%;束缚态Put含量随添加Cd2+浓度的增加而升高.中肋骨条藻细胞内游离态Put所占Put总量的比例随Cd2+浓度的增大呈先降低后升高的趋势,束缚态Put所占比例的变化趋势与游离态Put相似,而结合态Put所占比例的变化趋势与两者相反.
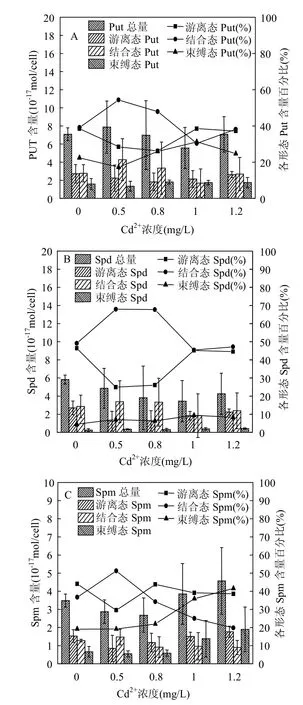
图4 Cd2+胁迫下中肋骨条藻细胞内各形态Put, Spd,Spm含量与所占百分比Fig.4 Histogram of different forms of intracellular Put,Spd, Spm contents and the line charts for their percentage of Skeletonema costatum under Cd2+stress
图4B表明,中肋骨条藻细胞内游离态Spd含量随添加Cd2+浓度的增加先降低后升高,呈U型变化;结合态Spd含量随Cd2+浓度的增大先升高后降低,呈峰型变化;束缚态Spd含量比对照组略有升高.藻细胞内游离态Spd所占Spd总量的比例随Cd2+浓度的增大呈先降低后升高的趋势,而结合态Spd所占比例的变化趋势与之相反;束缚态Spd所占Spd总量的比例最低.
如图4C所示,中肋骨条藻细胞内游离态Spm含量随着Cd2+浓度的增大先降低后升高,呈U型变化,1.2mg/L组游离态Spm比0.5mg/L组含量增加了80%(P<0.05);结合态Spm含量随Cd2+浓度的增大先升高后降低,呈峰型变化;束缚态Spm含量随Cd2+胁迫的增强而升高.添加Cd2+浓度为1.2mg/L组束缚态Spm含量比对照组升高了近2倍,比0.5mg/L组增加了20% (P<0.05).藻细胞内游离态Spm所占Spm总量的比例先降低后升高,结合态Spm所占比例的变化趋势与之相反,束缚态Spm所占比例随Cd2+浓度的增大呈升高趋势.
对于多胺的总量而言,Cd2+胁迫下Put总量较对照组升高,Spd总量随Cd2+浓度的增大呈降低趋势,Spm总量随添加Cd2+浓度的增大先降低后升高.添加Cd2+浓度为0.5mg/L组的Put总量比对照组升高了27%;1.2mg/L组Spm总量比对照组升高了31.3%.
中肋骨条藻细胞内游离态Put、束缚态Spd和Spm以及Put总量和Spm总量随Cd2+胁迫的增强呈升高趋势,对于藻细胞抵抗Cd2+胁迫,降低活性氧伤害具有重要作用[15].Wang[16]和李阳[17]等研究发现重金属对植物细胞产生毒害作用的方式可能有以下几种:(1)降低细胞内抗氧化酶的活性,导致大量的活性氧物质产生(2)导致膜脂过氧化(3)破坏膜的稳定性和完整性(4)破坏细胞内多胺的内稳态.而多胺由于其在细胞内以聚阳离子态存在,因此能够与带负电荷的核酸、蛋白质及膜上的磷脂等结合,对于维持膜的稳定性和完整性发挥着积极的作用[18].此外研究表明,多胺能够有效清除自由基,降低膜脂过氧化的伤害,增强植物体抵抗胁迫的能力[19].因此,Cd2+胁迫下中肋骨条藻细胞内游离态Put、束缚态Spd和Spm以及Put总量和Spm总量的升高,对于提高藻细胞对Cd2+胁迫的耐受力具有一定的积极作用.
2.5 Cd2+胁迫下中肋骨条藻细胞内多胺含量与酶活性变化的相关关系
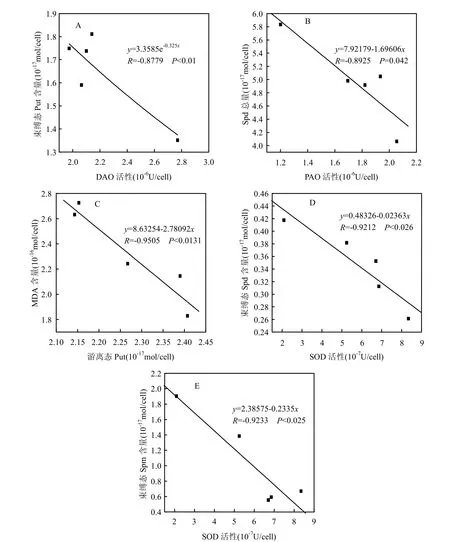
图5 Cd2+胁迫下中肋骨条藻细胞内多胺含量与酶活性的相关性Fig.5 The relationship between intracellular polyamines contents and enzyme activities of Skeletonema costatum under Cd2+stress
由图5可知,Cd2+胁迫下中肋骨条藻细胞内束缚态Put含量与DAO活性呈显著指数负相关(R=-0.8779, P<0.01),随着DAO活性增强,束缚态Put含量呈降低趋势;而Spd总量与PAO活性,MDA含量与游离态Put含量,束缚态Spd含量与SOD活性,束缚态Spm含量与SOD活性均呈显著线性负相关.
Cd2+胁迫下中肋骨条藻细胞内MDA含量与游离态Put含量呈显著线性负相关,随着添加Cd2+浓度的增大,游离态Put含量的增加会抑制MDA含量的升高,表明游离态Put能够缓解细胞的膜脂过氧化损害.
随着添加Cd2+浓度的增大,藻细胞内束缚态Spd及束缚态Spm含量均比对照组升高,且均与SOD活性呈显著线性负相关,可能是Cd2+胁迫下藻细胞内SOD活性降低,进而刺激了束缚态Spd和Spm含量的升高.Lomozik等认为,束缚态多胺以共轭或交联的方式与核酸、蛋白质等大分子结合可以增强核酸和蛋白质的稳定性,对于植物抵抗外界胁迫能起到积极作用[20];也有研究发现,Spd和Spm能分别提高水鳖叶对铜胁迫及荇菜对汞胁迫的耐受性[19,21];Besford等[14]研究发现Spd,Spm,丙二胺或它们的代谢物含量升高,对于膜的稳定性具有保护作用.而且Spm在胁迫反应中发挥着重要作用,其通过调节离子通道活性或是在病菌感染及其他胁迫时生成H2O2传递信号的方式起作用[22-23].因此Cd2+胁迫下束缚态Spd和Spm含量的升高可能会增强藻细胞抵抗Cd2+胁迫的能力.
2.6 Cd2+胁迫下中肋骨条藻细胞内游离态(Spd+Spm)/Put比值的变化
培养液中添加少量的Cd2+,会使中肋骨条藻细胞内游离态(Spd+Spm)/Put比值比对照组降低,0.5mg/L组比对照组降低了43.8%,然而随着添加Cd2+浓度的继续增加, (Spd+Spm)/Put的比值又有所回升,1.0mg/L组和1.2mg/L组的(Spd+Spm)/ Put比值又回升到对照组的水平.
有文献报道, (Spd+Spm)/Put比值的减小对于渗透胁迫下谷类叶片组织具有毒害作用[4,24].本实验添加少量Cd2+会使中肋骨条藻细胞内游离态(Spd+Spm)/Put比值降低,这可能会对藻体生长产生不利影响,但随着添加Cd2+浓度的增大,(Spd+Spm)/Put比值又有所回升以缓解这种不利影响.
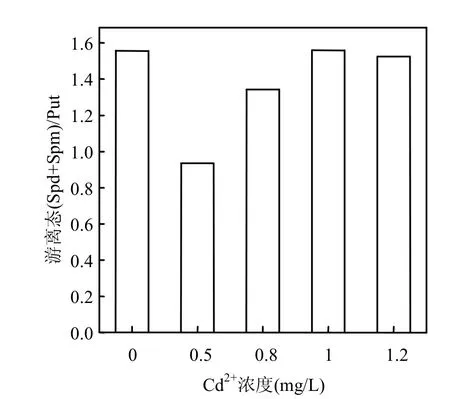
图6 Cd2+胁迫下中肋骨条藻细胞内游离态(Spd+Spm)/Put比值的变化Fig.6 Changes of the intracellular free (Spd+Spm)/Put ratio of Skeletonema costatum cells under Cd2+stress
3 结论
3.1 在培养过程中,随着向培养液中添加Cd2+浓度的增大,中肋骨条藻的生长受到抑制.藻细胞内MDA含量略有升高,而SOD活性显著降低,藻细胞可能遭受到一定程度的膜脂过氧化损害.
3.2 添加过量Cd2+后,中肋骨条藻细胞内DAO和PAO活性升高,对于多胺的氧化分解起到一定的促进作用,从而对提高藻细胞抵抗Cd2+胁迫的能力具有一定的积极作用.
3.3 随着添加Cd2+浓度的增大,中肋骨条藻细胞内各形态多胺的变化不同,其中游离态Put,束缚态Spd和Spm以及Put总量和Spm总量升高,可能会提高藻细胞抵抗Cd2+胁迫的能力.
[1]赵福庚,刘友良.高等植物体内特殊形态多胺的代谢及调 [J].植物生理学通讯, 2000,36(1):1-6.
[2]Galston A W, Sawhney R K. Polyamines in plant physiology [J]. Plant Physiol., 1990,94(2):406-410.
[3]Alcáza R, Marco F, Cuevas J C, et al. Involvement of polyamines in plant response to abiotic stress [J]. Biotechnol. Lett., 2006,28(23):1867-1876.
[4]Liu H P, Dong B H, Zhang Y Y, et al. Relationship between osmotic stress and the levels of free, conjugated and bound polyamines in leaves of wheat seedlings [J]. Plant Science,2004,166:1261-1267.
[5]Scoccianti V, Penna A, Penna N, et al. Effect of heat stress on polyamine content and protein pattern in Skeletonema costatum[J]. Marine Biology, 1995,121(3):549-554.
[6]Legocka J, Kluk A. Effect of salt and osmotic stress on changes in polyamine content and arginine decarboxylase activity in Lupinus luteus seedlings [J]. Journal of Plant Physiology, 2005,162: 662-668.
[7]Hsu Y T, Kao C H. Cadmium-induced oxidative damage in rice leaves is reduced by polyamines [J]. Plant and Soil, 2007,291(1/2):27-37.
[8]宫相忠,唐学玺,黄 健,等.球等鞭金藻8701的耐低温机理 [J].水产学报, 2001,25(1):20-25.
[9]高俊凤.植物生理学实验指导 [M]. 北京:高等教育出版社,2006:211-213.
[10]汪 天,郭世荣,刘 俊,等.多胺氧化酶检测方法的改进及其在低氧水培黄瓜根系中的应用 [J]. 植物生理学通讯, 2004,40(3): 358-360.
[11]Aziz A, Larher F. Changes in Polyamine titers associated with the Proline response and osmotic adjustment of rape leaf discs submitted to osmotic stress [J]. Plant Science, 1995,112:175-186.
[12]付 敏,赵卫红,苗 辉,等.高效液相色谱法测定海水中游离态腐胺、亚精胺和精胺 [J]. 分析化学, 2010,38(10):1445-1449.
[13]Atal N, Saradhi P P, Mohanty P. Inhibition of the chloroplast photochemical reactions by treatment of wheat seedlings with low concentration of cadmium: analysis of electron transport activities and changes in fluorescence yield [J]. Plant and Cell Physiology,1991,32(7):943-951.
[14]Besford R T, Richardson C M, Campos J L, et al. Effect of polyamines on stabilization of molecular complexes in thylakoid membranes of osmotically stressed oat leaves [J]. Planta, 1993,189(2):201-206.
[15]徐勤松,施国新,王红霞,等.外源亚精胺对槐叶苹耐镉胁迫的增强效应 [J]. 应用生态学报, 2008,19(11):2521-2526.
[16]Wang X, Shi G X, Xu Q S, et al. Exogenous polyamines enhance copper tolerance of Nymphoides peltatum [J]. Journal of Plant Physiology, 2007,164:1062-1070.
[17]李 阳,施国新,王红霞,等.外源亚精胺可缓解荇菜镉毒害 [J].植物学报, 2009,44(5):571-577.
[18]Groppa M D, Benavides M P. Polyamines and abiotic stress: recent advances [J]. Amino Acids, 2008,34:35-45.
[19]王 学,徐恒戬.精胺对荇菜抗氧化酶系汞毒害的缓解作用 [J].生态学杂志, 2008,27(10):1744-1748.
[20]Lomozik L, Gasowska A, Bregier-Jarzebowska R, et al. Coordination chemistry of polyamines and their interactions in ternary systems including metal ions, nucleosides and nucleotides[J]. Coordination Chemistry Reviews, 2005,249:2335-2350.
[21]王红霞,胡金朝,施国新,等.外源多胺对铜胁迫下水鳖叶片多胺代谢、抗氧化系统和矿质营养元素的影响 [J]. 生态学报,2010,30(10):2784-2792.
[22]Takahashi T, Kakehi J I. Polyamines: ubiquitous polycations with unique roles in growth and stress responses [J]. Annals of Botany,2010,105(1):1-6.
[23]Walters D. Resistance to plant pathogens: possible roles for free polyamines and polyamines catabolism [J]. New Phytologist,2003,159(1):109-115.
[24]Tiburcio A F, Masdéu M A, Dumortier F M, et al. Polyamine metabolism and osmotic stress. I. Relation to protoplast viability[J]. Plant Physiol, 1986,82(2):369-374.
致谢:本实验的样品测定是在王江涛教授实验室进行的,在此表示感谢.
Polyamines response to Cd2+stress and their physiological roles in Skeletonema Costatum.
LUAN Hong-yan1,2,ZHAO Wei-hong1*, MIAO Hui1(1.Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;2.University of Chinese Academy of Sciences,Beijing 100049, China). China Environmental Science, 2015,35(5):1487~1494
Culture experiments were carried out about the effects of Cd2+stress on the growth of Skeletonema costatum, in the meanwhile, the activity of dismutase (SOD), diamine oxidase (DAO), polyamine oxidase (PAO), and the contents of malondialdehyde (MDA) and various forms of polyamines extracted from algae cells were monitored. It aimed to explore the response and physiological roles of polyamines to the heavy metal stress in microalgae. The results showed that Cd2+inhibited the growth of Skeletonema costatum, and the greater the concentration was, the stronger the inhibition would be. With the enhancement of Cd2+stress, MDA content in the Skeletonema costatum cell increased slightly, SOD activity reduced significantly and DAO, PAO activity enhanced respectively. As the effect of Cd2+stress strengthen, the contents of free putrescine (Put), spermidine (Spd) and spermine (Spm) decreased firstly and increased subsequently; conjugated Put, Spd and Spm contents increased at first and then decreased. However, bound Put, Spm and Spd as well as total Put and total Spm kept increasing. It suggested that Cd2+stress caused oxidative damage to Skeletonema costatum cells. Meanwhile, the enhancement of DAO and PAO activity as well as the increasement of free Put, bound Spd and Spm, total Put and total Spm would enhance the resistance ability of Skeletonema costatum to Cd2+stress.
Cd2+stress;Skeletonema costatum;polyamines
X503.23
A
1000-6923(2015)05-1487-08
栾红艳(1988-),女,山东青岛人,中国科学院海洋研究所硕士研究生,主要研究方向为海洋化学.
2014-10-08
国家自然科学基金项目(41276118)
* 责任作者, 研究员, whzhao@qdio.ac.cn

