太湖流域河流及溪流大型底栖动物群落结构及影响因素
张 又,刘 凌,蔡永久,尹洪斌,高俊峰,高永年(.中国科学院南京地理与湖泊研究所,江苏 南京0008;.河海大学水文水资源学院,江苏 南京 0098;3.南京水利科学研究院,江苏 南京 009)
太湖流域河流及溪流大型底栖动物群落结构及影响因素
张 又1,2,刘 凌2,蔡永久1,3*,尹洪斌1,高俊峰1,高永年1(1.中国科学院南京地理与湖泊研究所,江苏 南京210008;2.河海大学水文水资源学院,江苏 南京 210098;3.南京水利科学研究院,江苏 南京 210029)
2012年10月对太湖流域93个样点大型底栖动物进行调查,分析西部丘陵水生态功能区和东部平原水生态功能区底栖动物群落结构及其与环境因子的关系.共采集到底栖动物104种,隶属4门8纲19目46科85属.各样点的底栖动物总密度差别很大,介于1.33~39080ind./m2.西部丘陵区的物种丰富度、物种多样性均高于东部平原区.东部平原区的优势种主要为铜锈环棱螺和霍甫水丝蚓等耐污种,而西部丘陵区的优势种中包括清洁种(毛翅目和蜉蝣目幼虫).相似性分析结果表明2个生态区底栖动物群落具有显著差异,铜锈环棱螺、霍甫水丝蚓、锯齿新米虾、大沼螺、苏氏尾鳃蚓等是造成2生态区之间群落结构差异的主要原因.典范对应分析结果表明影响底栖动物群落结构的主要因素为栖境多样性、营养状态及底质异质性.Goodnight-Whitley指数和BPI指数评价结果表明西部丘陵区整体处于轻污染状态,而东部平原区大部分采样点处于轻污染状态和中污染状态,部分采样点处于重污染状态.
太湖流域;水生态功能区;人为干扰;栖息地质量;生物多样性
大型底栖动物是淡水生态系统的一个重要生物类群,对大型底栖动物的研究一直是河流生态学研究的重要部分.大型底栖动物在淡水生态系统中发挥着重要的作用,包括促进有机碎屑分解、调节泥水界面物质交换、维持生物完整性等[1-2].此外,底栖动物具有相对较长的生命周期、活动范围小,且不同物种对环境变化的敏感程度不同,当水体受到污染时,底栖动物群落结构也随之发生变化.因此,大型底栖动物群落结构特征常被用于生物监测和水质评价[3].
太湖流域是我国经济最发达的地区之一,随着高速发展的工业化与城市化及居民生活水平的提高,流域用水总量逐年上升.工业废水排放量随着工业产值增加虽有下降趋势,但生活污水的排放量却大幅上升.不合理的农业生产方式[4],农业化肥的使用、畜禽和水产养殖对水环境的影响越来越大.太湖流域水生态系统受到了不同程度的破坏,水环境面临巨大的压力[5].
“生态区”的概念于1967年首次提出,生态区是指具有相对一致的水生态系统组成、结构、格局、过程和功能的水体或具有“水陆一致性”的陆水联合体[6].生态分区已被相关政府部门应用到日常的水资源管理中去,成为水资源管理的常用基本单元.生态区的自然特征变化可能决定了生物群落的差异,如海拨、水文特征等,并且以生态区来研究河流底栖动物群落的分布格局,可以协助淡水生态系统的有效管理[7-8]. 2010年,高永年等[9]将太湖流域共划分为2个一级水生态功能区即西部丘陵水生态功能区(简称西部丘陵区,E1)和东部平原水生态功能区(简称东部平原区,E2),为太湖流域的管理提供了新的空间单元.
目前,针对太湖流域溪流和河流大型底栖动物已有一些研究,如高欣等[10]对太湖流域37个采样点的调查,分析大型底栖动物群落结构及其与环境因子的关系.吴召仕等[11]对太湖流域苕溪、南河、洮滆、黄浦江、沿江5个主要水系底栖动物进行对比研究.王备新团队[12-13]对太湖上游西苕溪底栖动物群落结构及影响因素进行了研究.然而,已有研究主要集中于太湖流域的部分区域,而对全流域的研究布点数量较少,还不能完全反映全流域的情况.本文于2012年10月对太湖全流域范围内的河流和溪流进行了采样调查,以太湖流域一级水生态功能区(以下简称生态区)为研究单元,分析底栖动物群落结构特征,初步探讨2个生态区间底栖动物差异的原因,并用生物学指数评价2个生态区的水质状况.
1 材料与方法
1.1 研究区概况与样点布设
太湖流域地处长江三角洲,北抵长江,东临东海,南滨钱塘江,西以天目山、茅山为界,介于东经119°3′1″~121°54′26″、北纬30°7′19″~32°14′56″之间,总面积为36900km2.太湖流域中部地势低洼,大小湖泊星罗棋布,以太湖为中心,河流与湖泊相互交错形成我国著名的水网地区.太湖流域也是全国河道密度最大的地区,河道总长约120000km,河道密度达3.25km/km2.
本研究在太湖流域主要溪流和河流上共布设93个采样点.考虑到2个生态区面积大小及河网密度,西部丘陵区(E1)和东部平原区(E2)分别布设22个和71个采样点,如图1所示.
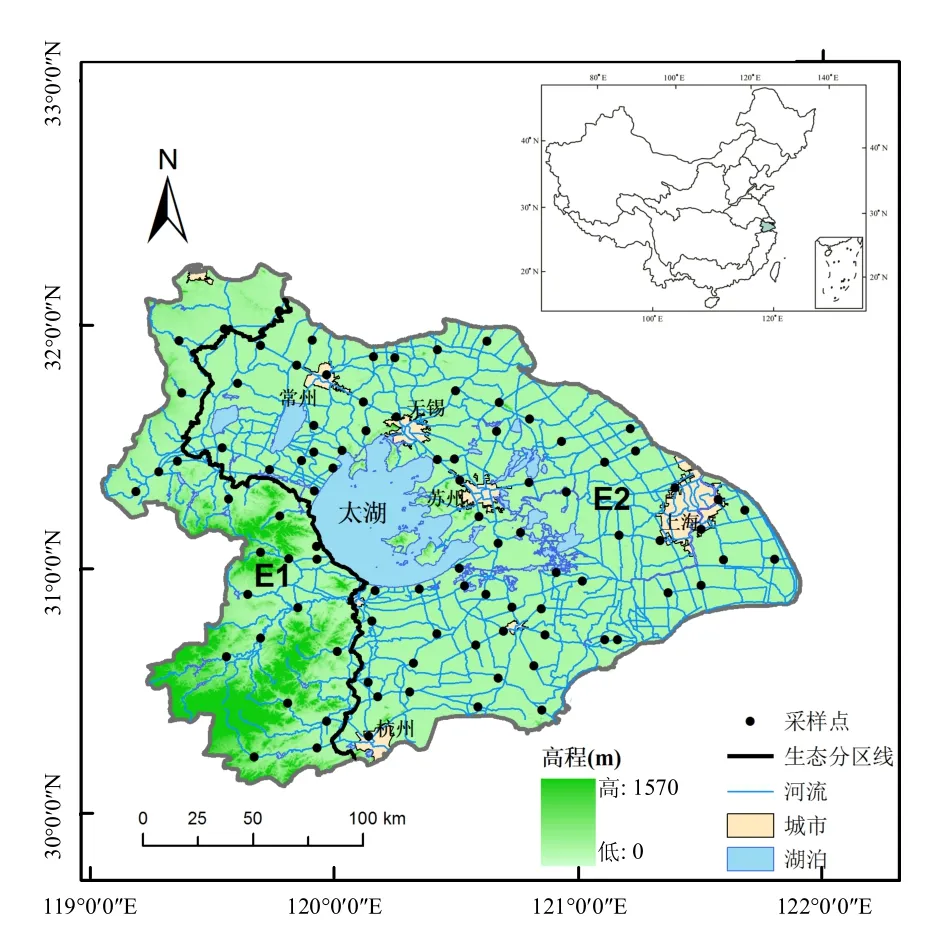
图1 太湖流域底栖动物采样点分布Fig.1 Location of the sampling sites in Lake Taihu Basin
1.2 底栖动物样品采集
底栖动物样品采集时间为2012年10月.采用D形抄网进行底栖动物样品采集,每个采样点采集10个样方(30×50cm)并混合成一个样品.这10个样方涵盖100m河段内的主要生境,如激流、缓流、沉水植物区、挺水植物区、无水生植物区域.因为每个采样点所包含的生境不同,所以采样时应尽可能将10个样方按生境比例分配至不同的生境.对于无法涉水的大型河流,采用1/16m2的彼得逊采泥器采集底栖动物,每个样点采集6次混合成一个样品.所采得的泥样经过60目尼龙筛网现场筛洗,剩余物带回实验室进行分拣.实验室中,将剩余物置入白色盘中,将底栖动物逐一挑出,并用7%福尔马林溶液固定保存.所有样品都鉴定至尽可能低的分类单元[14-17],每个采样点所采到的底栖动物按不同种类准确地统计数量,然后用滤纸吸去表面固定液,置于电子天平上称重,最终换算出单位面积的密度(ind./m2)和生物量(g/m2).
1.3 环境因子测定
采集底栖动物样品时,同时现场测定环境指标,并采集水样分析化学参数.现场用多参数水质监测仪(YSI 6600V2)测定pH值、电导率、溶解氧(DO)和浊度.采集水样冷冻保存带回实验室,铵态氮(NH4+-N)、硝态氮(NO3--N)、正磷酸盐(PO43--P)用微量流动注射仪测定,总悬浮颗粒物(TSS)、叶绿素a(Chl-a)、总氮(TP)、总磷(TP)、及高锰酸盐指数(CODMn)的测定方法参考《水和废水监测分析方法》[18].
栖息地生境质量评价选用栖境多样性、河道变化、水生植被覆盖、人为干扰强度、河岸带土地利用和底质指数(SI)六个参数.水生植被覆盖的值反映的是河道水生植被的覆盖率,用百分比(%)表示.栖境多样性、河道变化、人为干扰强度和河岸带土地利用的值介于0~20之间,通过现场调查,目测评分的方法获取.具体做法是,根据质量状况优劣程度,将指标分成4个级别,4个级别的分值范围为:20~16(好)、15~ 11(较好)、10~ 6(一般)、5~ 1(差)[19-20],具体的打分标准见表1.底质指数(SI)是一个反应底质异质性的综合指数,其数值介于1(淤泥)与7(大石块)之间,计算公式为:

式中:底质划分依据[21-22]如下: <0.5mm 淤泥(mud/silt)、0.5~2mm 沙(sand)、2~16mm 砾石(gravel)、16~64mm小卵石(pebble)、64~256mm大卵石(cobbles)、256~512mm 石块(boulder)和>512mm大石块(large boulder).

表1 太湖流域河流栖息地生境指标评价标准Table 1 Indicators' criteria of river habitat in Lake Taihu Basin
1.4 数据处理
1.4.1 优势种 优势种是指群落中占优势的对整个群落具有控制性影响的生物种类,本文采用相对重要性指数(IRI)进行优势种的确定[23],该指数的计算将每种生物的个体重量、丰度及出现频率均考虑在内,能够较为全面的反映出每种生物在整个群落中的地位,其计算公式为:式中:W为某一种类的生物量占各点大型底栖动物总生物量的百分比;N为该种类的密度占各点总密度的百分比;F为该种类在各点出现的相对频率.

1.4.2 多样性指数 生物多样性指数用于定量表述环境的生物多样性程度,本文运用Simpson优势度指数(D)、Margalef丰富度指数(dma)、Shannon-Wiener多样性指数(H′)及Pielou均匀度指数(J′)这4个多样性指数计算各样点的底栖动物多样性.
Simpson优势度指数(D):

Margalef丰富度指数(dma):
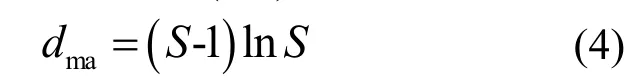
Shannon-Wiener多样性指数(H′):
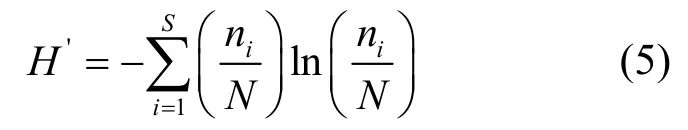
Pielou均匀度指数(J′):
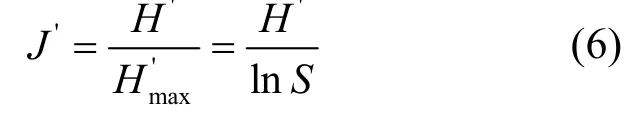
式中:S为群落中的总物种数,N为观察到的总个体数,ni为第i个物种的个体数.
1.4.3 多元分析 主成分分析(PCA)是一种非约束的排序方式,是为寻找潜在的、虚拟的梯度(排序轴)代表最优的解释变量来拟合参与排序的响应变量的排序方法[24].本文采用PCA分析理化数据,将23个环境指标重新组合,从而提取出可以尽可能多的反应原来变量信息的综合变量,寻找个采样点环境因子的潜在梯度.
采用相似性分析(ANOSIM)检验2个生态区的底栖动物群落组成的差异显著性,进一步利用相似百分比分析(SIMPER)找出对底栖动物群落差异贡献最大的种类,同时找出每个生态区的特征种及其相应的贡献率.采用典范对应分析(CCA)分析底栖动物群落与环境因子之间的关系.分析时,物种数据进行平方根转换,环境因子进行lg(x+1)转换(pH值除外).环境因子的筛选采用向前引入法,保留能通过蒙特卡罗置换检验的显著因子(P<0.01).用CCA排序图将物种、样点和环境因子绘出,直观地呈现出种类组成及群落分布与环境因子之间的关系.
本文中ANOSIM和SIMPER在PRIMER 5.0软件中完成,PCA和CCA分析在CANOCO 4.5软件中完成.仅出现次数大于5的物种参与ANOSIM和CCA分析,即有32个物种参与了ANOSIM和CCA分析.
1.4.4 水质生物学评价 选取Goodnight-Whitley指数和BPI生物学污染指数这2个生物指数进行水质生物学评价,其评价标准见表2.

式中:N1为寡毛类、蛭类和摇蚊幼虫个体数;N2为多毛类、甲壳类、除摇蚊幼虫以外的其他水生昆虫个体数;N3为软体动物个体数.
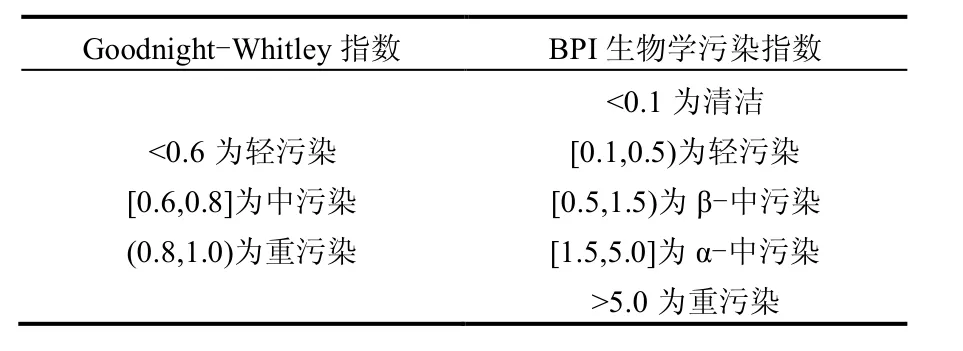
表2 2种生物学指数评价标准Table 2 The standard of two biological indices
2 结果与分析
2.1 水体理化特征
理化分析结果表明,2个生态区水质差异较大(表3),东部平原区(E2)的营养盐浓度高于西部丘陵区(E1),而东部平原区的溶解氧浓度低于西部丘陵区.此外,西部丘陵区的生境指标分值明显高于东部平原区.
主成分排序图显示93个采样点环境因子梯度变化的空间分布格局(图2).第1主成分与TN、CaCO3、CODMn、盐度、电导率成显著负相关,与河岸带土地利用、河道变化、栖境多样性、人为干扰强度和河道植被呈显著正相关.表明PC1主要反映水体的营养状态及栖息地质量.第2主成分与TSS和浊度具有显著相关性.前2个主成分的方差解释率分别为33.1%和12.2%.西部丘陵区的采样点主要分布于右侧,而东部平原区的采样点主要分布于左侧,反映了营养盐及生境退化程度从西向东依次升高的趋势.
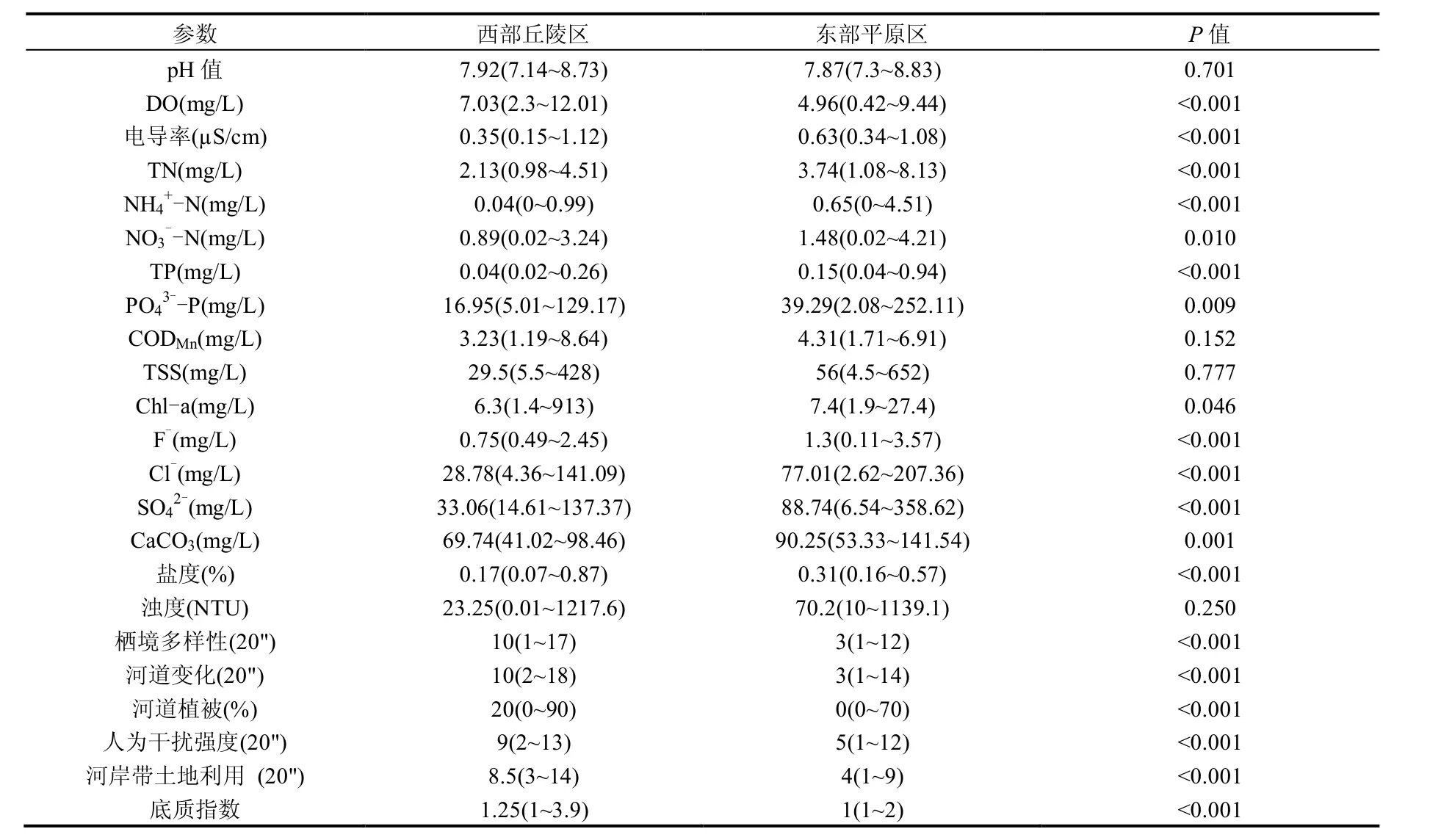
表3 太湖流域一级生态区的理化特征Table 3 Physicochemical characteristics in the two ecoregions of Lake Taihu Basin
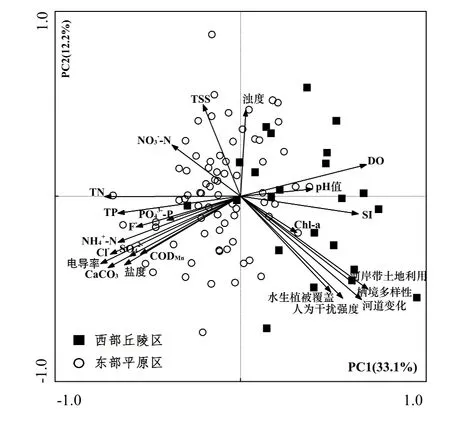
图2 各采样点理化因子主成分分析Fig 2 Principal components analysis of physicochemical parameters in the 93 sampling sites
2.2 种类组成及优势种
本次采样共采集到底栖动物104种,隶属4门8纲19目46科85属.从全流域调查结果看,出现率超过10%的种类共有20种,其中环节动物门3种,节肢动物门4种,腹足纲和双壳纲分别7种和6种(图3).在所有的底栖动物中,铜锈环棱螺(Bellamya aeruginosa)的出现率最高,达到76.34%,霍甫水丝蚓(Limnodrilus hoffmeisteri)、河蚬(Corbicula fluminea)、苏氏尾鳃蚓(Branchiura sowerbyi)、大沼螺(Parafossarulus eximius)次之,分别为52.69%、45.16%、44.09%和44.09%.2个生态区的种类数量和组成具有较大差异.各样点物种数均值为7.65种,最小值和最大值分别为1种和24种.西部丘陵区物种丰富度相对较高,共采集到底栖动物85种.而东部平原区(65种)较低.东部平原区发现的寡毛类和双壳类种类数(3和8种)稍多于西部丘陵区(2和7种),但西部丘陵区发现的水生昆虫种类数(28种)远多于东部平原区(11种).
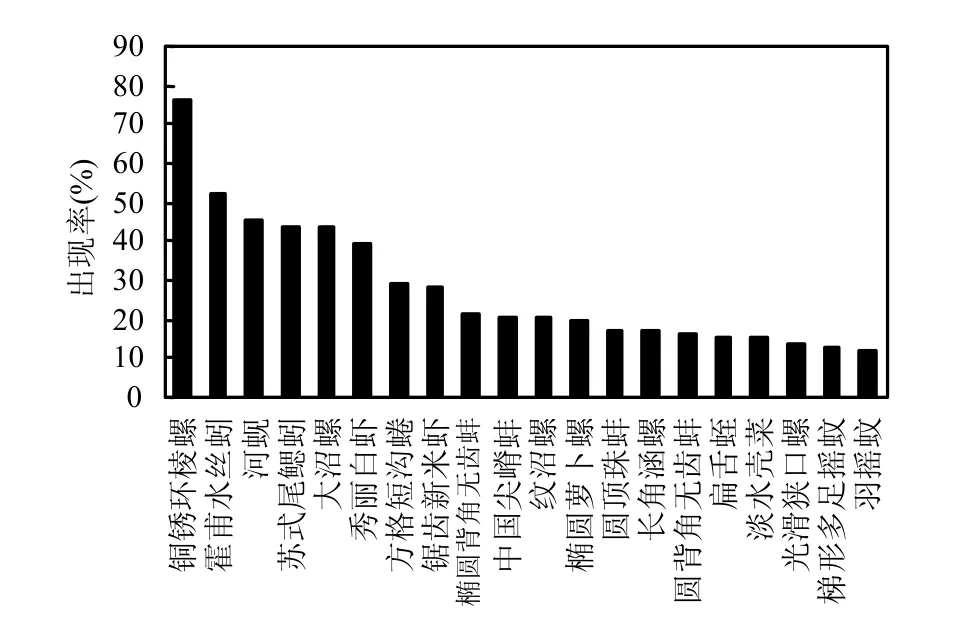
图3 太湖流域出现率高的底栖动物种类Fig.3 Macroinvertebrates taxa with high occurrence in Lake Taihu Basin

表4 太湖流域主要大型底栖动物的IRITable 4 IRI of the dominated taxa in the two ecoregions
铜锈环棱螺的IRI值在2个生态区均处于第一位(表4),且与其他物种的IRI值相差较大,可见铜锈环棱螺在2个生态区中均处于优势地位.霍甫水丝蚓的IRI值在东部平原区也很高,但不是西部丘陵区的优势种.此外,在西部丘陵区的优势种中包括对水质要求较高的毛翅目和蜉蝣目幼虫,这些物种在东部平原区都未采集到.
2.3 密度与多样性
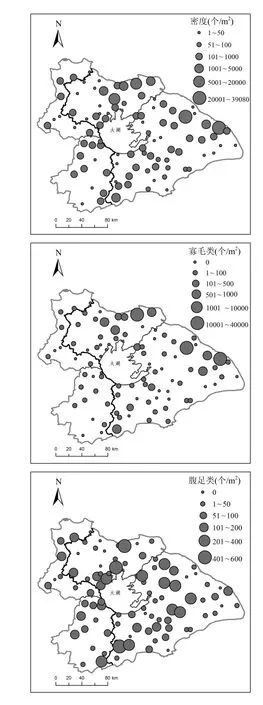
图4 太湖流域底栖动物总密度及主要类群密度空间格局Fig.4 Spatial patterns of abundance for total macroinvertebrate and two dominant taxa in Lake Taihu Basin

图5 2个生态区中5种常见底栖动物类群的相对密度、相对种类数及物种数量Fig.5 Relative abundance and taxa number of the five common taxonomic groups in the two ecoregions
全流域内各采样点的底栖动物总密度差别很大,最高可达39080ind./m2,但最低仅为1.33ind./m2(图4).总密度高值的采样点多为城市河流,主要是因为这些采样点的寡毛类密度较高.各采样点底栖动物类群的密度组成呈现显著的空间差异.整体而言,寡毛类分布是最广泛,占全流域总密度的89.42%,腹足类(7.57%)次之.霍甫水丝蚓占全流域总密度的86.3%,占寡毛类总密度的96.56%,为太湖流域最主要的优势种.从相对密度(图5)看,寡毛类在西部丘陵区所占比例较少,但在东部平原区占有绝对优势.铜锈环棱螺是腹足类的重要贡献者,占腹足纲总密度的70.8%,其次为大沼螺(8.8%),方格短沟蜷(6.4%),纹沼螺(5.5%)及长角涵螺(3.6%).
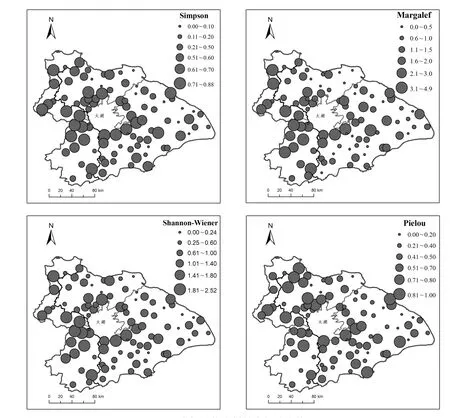
图6 底栖动物多样性空间分布格局Fig.6 Spatial patterns of four diversity indices in Lake Taihu Basin

表5 西部丘陵区和东部平原区底栖动物相似百分比分析Table 5 SIMPER analysis of the two ecoregions
太湖流域底栖动物多样性偏低,并呈现显著空间差异(图6).Shannon-Wiener指数均值为0.98,最大值分别为2.52,其在西部丘陵区河流较高,东部平原区较低.Simpson指数均值为0.45,最大值为0.88.Margalef指数均值为1.51、最大值为4.94.其空间格局与Shannon-Wiener指数基本一致,高值出现在西部丘陵区,低值主要出现在东部平原区.t检验分析结果表明Simpson指数(P= 0.016)、Shannon-Wiener指数(P= 0.001)及Margalef指数(P<0.001)在2个生态区间具有显著差异,而Pielou均匀度指数(P=0.172)在2生态区间差异不明显.
2.4 群落结构差异分析
ANOSIM检验结果表明2个生态区间的底栖动物群落结构存在显著差异(P=0.024). SIMPER分析结果显示铜锈环棱螺是造成2个生态区之间底栖动物群落结构差异的主要物种,其次是霍甫水丝蚓、锯齿新米虾(Neocaridina denticulata)、大沼螺、苏氏尾鳃蚓、方格短沟蜷(Semisulcospira cancelata)、秀丽白虾(Exopalaemon modestus)、河蚬和椭圆萝卜螺(Radix swinhoei)(表5).2个生态区的特征种也有所差异.西部丘陵区的主要特征种有9种,包括2种寡毛类、4种腹足类、1种双壳类及1种甲壳类.东部平原区的主要特征种只有4种,分别为霍甫水丝蚓、苏氏尾鳃蚓、铜锈环棱螺和大沼螺,这4种特征种均为耐污种类.
2.5 底栖动物与环境因子的关系
DCA分析结果显示第一排序轴较长(12.12),表明更宜使用单峰模型CCA排序分析.通过蒙特卡罗置换检验最终筛选出能够最大程度解释底栖动物群落组成变化的5个环境变量组合——TN、Chl-a、浊度、栖境多样性和底质指数. CCA分析的第1轴和第2轴的特征值分别为0.261和0.111,分别解释11.6%的物种数据方差变异和74.7%的物种-环境关系变异(表6).从CCA排序图(图7)可以看出,2个生态区的采样点在排序图中能较好的区分开来,其中西部丘陵区的采样点主要位于排序图右侧,而东部平原区的采样点主要位于排序图左侧.
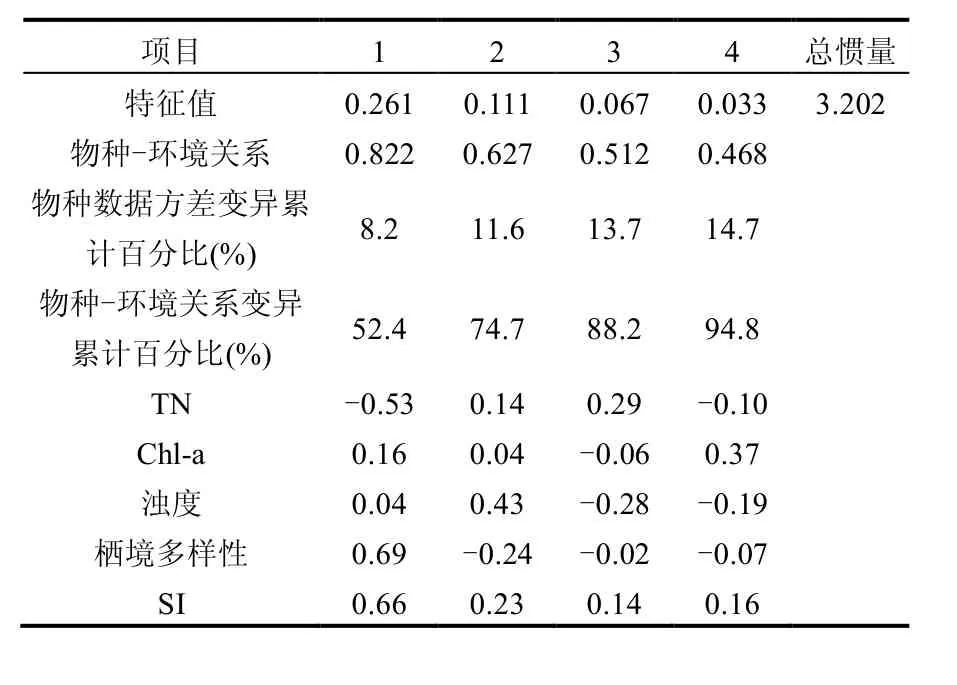
表6 底栖动物群落与环境因子的典范对应分析结果Table 6 Summarized results for the first four axes of the canonical correspondence analysis (CCA) of species-environment
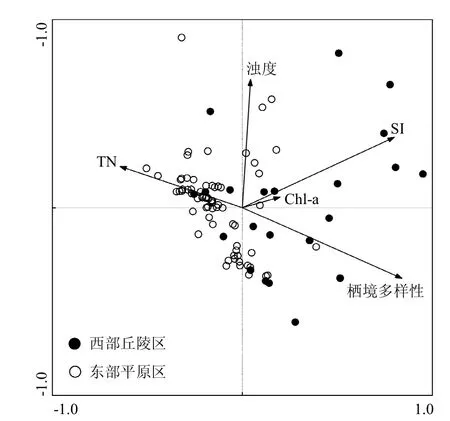
图7 太湖流域底栖动物群落与环境因子的CCA排序Fig.7 CCA biplots of macroinvertebrate assemblages and environmental factors in the two ecoregions
2.6 水质生物学评价
Goodnight-Whitley指数和BPI生物学污染指数评价结果表明太湖流域河流大部分处 于轻污染及以上的状态,且东部平原区的污染程度高于西部丘陵区(表7).总体而言, Goodnight-Whitley指数的评价结果显示西部丘陵区的采样点均处于轻污染状态,而BPI指数的评价结果显示西部丘陵区绝大部分采样点处于轻污染状态,还有13.64%的点位处于β-中污染状态.对于东部平原区,Goodnight-Whitley指数评价结果显示东部平原区的大部分采样点处于轻污染状态,部分采样点处于中污染甚至重污染状态.BPI指数评价结果显示,东部平原区有2.82%的采样点处于清洁状态和56.34%的采样点处于轻污染状态,而处于β-中污染、α-中污染、重污染的比例占40.84%,说明东部平原区河流受到不同程度的污染.相关性分析结果表明,各采样点的Goodnight-Whitley指数和BPI指数之间具有显著相关性,这2个指数与反应水体营养盐浓度的第1主成分(PC1)具有显著负相关性(表8).

表7 太湖流域水质生物学评价结果Table 7 Bioassessment of water quality for the two ecoregions in Lake Taihu Basin
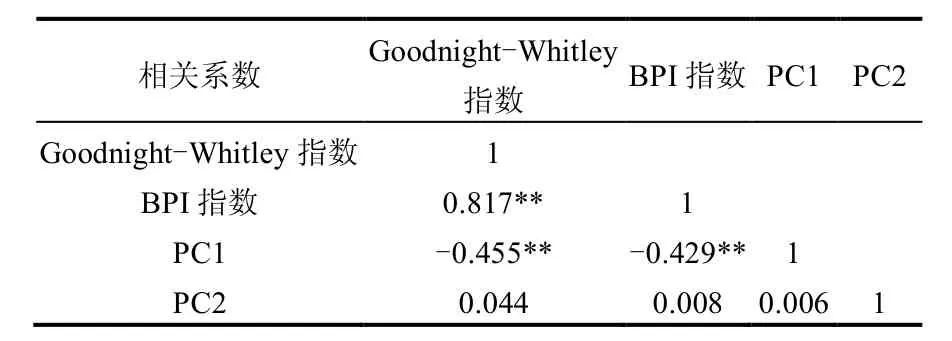
表8 太湖流域水质生物指数与主成分的相关系数Table 8 Pearson correlation coefficients between the two biological indices and PC1, PC2
3 讨论
3.1 底栖动物群落结构与水质生物评价
本次调查结果表明,太湖流域主要河流底栖动物群落结构简单,多样性较低.太湖流域底栖动物的主要优势种为寡毛类(如霍甫水丝蚓)、腹足类(如铜锈环棱螺)和摇蚊幼虫(如环足摇蚊).这些种类都有较强的耐污性,可以在严重污染的环境中生存[25].霍甫水丝蚓和苏氏尾鳃蚓可以在极度缺氧的环境中生存,而其他底栖动物的生长在缺氧条件下往往受到抑制,这2种物种的大量出现常被认为是环境污染严重的标志[26].在富营养化水体中可发现大量霍甫水丝蚓,如在东湖富营养化最严重的区域,霍甫水丝蚓年平均密度达3502ind./m2,最高可达10524ind./m2,占有绝对优势(占总密度的99%)[27].环棱螺的耐污能力也很强,在重度和中度污染的水体中都可以生存.梨形环棱螺(Bellamya purificata)被报道不仅可以在总氮含量极高(2.77%)的环境中生存,而且其生物量也极高(428g/m2)[28].在巢湖富营养化较重的西湖区,环棱螺的生物量高于富营养化较轻的东湖区[29].摇蚊幼虫在全流域范围内广泛分布,高密度的摇蚊也被认为是水体富营养化的一项重要指标[30].
本次调查采样点较多,分布范围更广,涵盖了太湖流域主要河流,共采集到底栖动物104种,高于前期对太湖流域调查时发现的种类数(吴召仕采集到88种).而王备新[12]在研究常州地区太湖流域上游水系大型底栖无脊椎动物群落结构时采集到底栖动物113种,这主要是因为其采集的样点均分布在上游,所采集到的水生昆虫较多.研究结果表明,霍甫水丝蚓在太湖流域处于优势地位,占全流域总密度的86.3%,铜锈环棱螺次之.但铜锈环棱螺的IRI值在西部丘陵区和东部平原区都是最大的,这主要是因为铜锈环棱螺个体较大,占据了生物量的大部分.
本文选用Goodnight-Whitley指数和BPI指数2种标准来评价太湖流域水质状况,2种评价方法侧重点不同,造成评价结果略有差异. Goodnight-Whitley指数主要考虑耐污性高的寡毛类所占底栖动物总密度的百分比,而BPI指数综合考虑了底栖动物的多个类群,包括寡毛类、水蛭、摇蚊幼虫、多毛类、甲壳类、除摇蚊幼虫以外的水生昆虫以及软体动物.这2种评价方法均在一定程度从底栖动物层面上反映了水体的水质状况.评价结果表明,太湖流域西部丘陵区整体处于轻污染状态,而东部平原区大部分采样点处于轻污染状态和中污染状态,部分采样点处于重污染状态.从种类组成来看,西部丘陵区的物种数,特别是水生昆虫的种类数量大于东部平原区.从优势种的种类来看,东部平原区的优势种主要为铜锈环棱螺和霍甫水丝蚓等耐污性种类,而西部平原区的优势种中没有寡毛类,而且包括敏感性种类(毛翅目和蜉蝣目昆虫),说明西部丘陵区受污染程度小于东部平原区.这主要是因为2个生态区的经济发展水平存在差异,城市化程度不同,受到人类干扰的程度不同以及污染程度差异,西部丘陵区的生态结构完整性要高于东部平原区.此外,4个多样性指数也显示出西高东低的趋势,西部丘陵区的生物多样性要远高于东部平原区.底栖动物多样性主要取决于物种的种类及个数.寡毛类的丰度值却呈现相反的趋势,在个别的城市河道中,寡毛类的丰度呈现极高值.一般情况下,极高的寡毛类丰度,特别是极高丰度的霍甫水丝蚓或苏氏尾鳃蚓,被认为是生态系统严重污染的标志[26].各采样点的Goodnight-Whitley指数和BPI指数之间具有显著相关性,这2个指数与反映水体营养盐浓度及栖息地质量的第1主成分(PC1)具有显著负相关性,表明这2个指数能较好地评价太湖流域河流水体营养状态和栖息地质量.
3.2 底栖动物群落结构的主要影响因素
西部丘陵区与东部平原区的自然地质和地理特征差异明显,相应的2个生态区的底栖动物群落结构也呈现显著差异.自然地质和地理特征可能是影响大型底栖动物群落结构的重要因素.2个生态区之间的地理差异,可能会影响人类活动和土地利用方式,这反过来也会放大区域的差异.本研究结果显示,影响太湖流域底栖动物结构特征的主要影响因素为栖境多样性、底质异质性及营养盐浓度.
底栖动物群落结构与栖境多样性关系密切.栖境多样性高的区域可以为底栖动物提供更多的生存空间,密度和多样性会相应比较高[31].因此,生境结构越多样化,底栖动物多样性越高[32].水生植被对底栖动物群落结构的构建也有重要作用.水生植物可以为底栖动物提供生活空间,也可以吸收和消耗水体中的营养物质[33],然后通过收获使得水体营养盐浓度降低[34].东部平原区的河道高度硬质化,无水生植物而且底质多为淤泥,栖境单一.而西部丘陵区具有多种类型的栖境,如有水生植物区、无水生植物区以及不同类型的底质.源头区还有激流生境.这应该也是其底栖动物多样性比西部丘陵区低的原因之一.硬质化河道的河岸带连续性较差,是河流与沿岸带分离开,切断了河道和沿岸带的联系,在一定程度上破坏了生态结构完整性.因此,河道硬质化会降低底栖动物的丰度和多样性[35].
底质大小及底质异质性也可以影响底栖动物群落结构多样性.底质是底栖动物赖以生存的环境,为其提供了摄食、栖息、繁殖及躲避捕食的场所.一般而言,底栖动物多样性随底质的稳定性和异质性的增加而增加[36].此外,不同类群的底栖动物对底质的喜好差异很大,颤蚓类和摇蚊幼虫喜好淤泥底质,研究发现颤蚓类喜欢生活在粒径小于63μm的底质中[37];而软体动物喜好砂质淤泥中,有研究表明细颗粒的沉积物会显著降低螺Reymondia horei的存活率,其主要原因是影响了螺的摄食行为[38].本研究结果表明,太湖流域2个生态区间的底质指数具有显著差异,东部平原区的底质指数低于西部丘陵区,东部平原区的颤蚓类(霍甫水丝蚓和苏氏尾鳃蚓)密度高于西部丘陵区,这2个结果是一致的.
水体营养盐与底栖动物群落组成也具有较高相关性.此外,厌氧环境还会增加沉积物中硫化物的含量,这也增加了对底栖动物的潜在毒性[39].中等生产力假说指出:物种多样性水平在一个中等生产力水平上达到最大,此时物种对食物的竞争减弱,共存生物间的潜在竞争增大[40].可以理解为多样性最高值出现在中等营养水平的水体中,而在贫营养和超富营养水体中多样性却较低,这一假说被许多研究结果所支持[41].伴随着营养物浓度水平的升高,耐污种类逐渐增多,敏感种类逐渐减少,群落结构中物种数越来越少,但是个体数却大量增加.这个过程也加速富营养化进程,并且有机质的增加将导致水体溶解氧的降低,这进一步成为限制敏感性物种生存的因素.此外,随着有机质的增加,大个体逐渐被小个体替代[42].因为小个体的种类多为机会种,一般具有较短的生活年限,因此对环境的适应能力较强.东部平原区城市化程度高,流域内大城市主要位于该区,其水体营养盐浓度较高,该区域检测到的底栖动物种类数少,而且主要是耐污性种类.个别城市河道出现大量霍甫水丝蚓,表明其富营养化较严重.西部丘陵区的水体营养盐浓度较低,该区监测到的底栖动物物种相对较多,并且包括一些敏感性物种.
4 结论
4.1 太湖流域的主要优势种多为耐污种类.底栖动物多样性较低,表明太湖流域河流生态系统受到了严重的人为干扰,生境退化严重.
4.2 西部丘陵区与东部平原区的底栖动物群落结构具有显著差异,2个生态区的底栖动物种类组成、多样性指数等都表明东部平原区的污染程度要高于西部丘陵区,这与理化环境特征结果一致.
4.3 研究显示栖境多样性、底质异质性及营养盐浓度是影响太湖底栖动物的重要因素,研究结果表明控制水体营养盐浓度、恢复生境多样性是保护底栖动物多样性的重要措施.
4.4 Goodnight-Whitley指数和BPI指数评价结果表明西部丘陵区整体处于轻污染状态,而东部平原区大部分采样点处于轻污染状态和中污染状态,部分采样点处于重污染状态.
[1]Covich A P, Austen M C, Bärlocher F, et al. The role of biodiversity in the functioning of freshwater and marine benthic ecosystems [J]. BioScience, 2004,54(8):767-775.
[2]Vanni M J. Nutrient cycling by animals in freshwater ecosystems[J]. Annual Review of Ecology and Systematics, 2002:341-370.
[3]王伟莉,闫振广,何 丽,等.五种底栖动物对优控污染物的敏感性评价 [J]. 中国环境科学, 2013,33(10):1856-1862.
[4]李良忠,杨 彦,蔡慧敏,等.太湖流域某农业活动区农田土壤重金属污染的风险评价 [J]. 中国环境科学, 2013,33(S1):60-65.
[5]林泽新.太湖流域水环境变化及缘由分析 [J]. 湖泊科学,2002,14(2):111-116.
[6]高永年,高俊峰,陈坰烽,等.太湖流域水生态功能三级分区 [J].地理研究, 2012,31(11):1941-1951.
[7]Sandin L, Johnson RK. Ecoregions and benthic macroinvertebrate assemblages of Swedish streams [J]. Journal of the North American Benthological Society, 2000,19(3):462-474.
[8]Kong W, Meng W, Zhang Y, et al. A freshwater ecoregion delineation approach based on freshwater macroinvertebrate community features and spatial environmental data in Taizi River Basin, northeastern China [J]. Ecological Research, 2013,28(4): 581-592.
[9]高永年,高俊峰.太湖流域水生态功能分区 [J]. 地理研究,2010,29(1):111-117.
[10]高 欣,牛翠娟,胡忠军.太湖流域大型底栖动物群落结构及其与环境因子的关系 [J]. 应用生态学报, 2011,22(12):3329-3336.
[11]吴召仕,蔡永久,陈宇炜,等.太湖流域主要河流大型底栖动物群落结构及水质生物学评价 [J]. 湖泊科学, 2011,23(5): 686-694.
[12]王备新,徐东炯,杨莲芳,等.常州地区太湖流域上游水系大型底栖无脊椎动物群落结构特征及其与环境的关系 [J]. 生态与农村环境学报, 2007,23(2):47-51.
[13]吴东浩,张 勇,于海燕,等.影响浙江西苕溪底栖动物分布的关键环境变量指示种的筛选 [J]. 湖泊科学, 2010,22(5):693-699.
[14]刘月英,张文珍,王跃先,等.中国经济动物志-淡水软体动物[M]. 北京:科学出版社, 1979: 1-134.
[15]Morse J C Y L F A. Aquatic insects of China useful for monitoring water quality[M]. Nanjing: Hohai University Press,1994.
[16]王洪铸.中国小蚓类研究(附中国南极长城站附近地区两新种)[M]. 北京: 高等教育出版社, 2002:1-228.
[17]唐红渠.中国摇蚊科幼虫生物系统学研究 [D]. 天津:南开大学,2006.
[18]国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002.
[19]Barbour M T, Gerritsen J, Snyder B D, et al. Rapid bioassessment protocols for use in streams and wadeable rivers [M]. Periphyton,Benthic Macroinvertebrates, and Fish. U.S. Environmental Protection Agency, Office of Water, Washington, DC, USA, 1999.
[20]郑丙辉,张 远,李英博.辽河流域河流栖息地评价指标与评价方法研究 [J]. 环境科学学报, 2007,27(6):928-936.
[21]Kondolf G M. Application of the pebble count notes on purpose,method, and variants [J]. Journal of the American water resources association, 1997,33:79-87.
[22]Jowett I G, Richardson J. Microhabitat preferences of benthic invertebrates in a New Zealand river and the development of in-stream flow-habitat models for Deleatidium spp. [J]. New Zealand Journal of Marine and Freshwater Research, 1990,24(1):19-30.
[23]韩 洁,张志南,于子山.渤海中、南部大型底栖动物的群落结构[J]. 生态学报, 2004,24(3):531-537.
[24]刘大海,李 宁,晁 阳. SPSS 15.0统计分析从入门到精通 [M].北京:清华大学出版社, 2008.
[25]Wang B, Liu D, Liu S, et al. Impacts of urbanization on stream habitats and macroinvertebrate communities in the tributaries of Qiangtang River, China [J]. Hydrobiologia, 2012,680(1):39-51.
[26]王 智,张志勇,张君倩,等.水葫芦修复富营养化湖泊水体区域内外底栖动物群落特征 [J]. 中国环境科学, 2012,32(1): 142-149.
[27]龚志军,谢 平,唐汇涓,等.水体富营养化对大型底栖动物群落结构及多样性的影响 [J]. 水生生物学报, 2001,25(3):210-216.
[28]曹正光,蒋忻坡.几种环境因子对梨形环棱螺的影响 [J]. 上海水产大学学报, 1998,7(3):200-205.
[29]邓道贵,李洪远,胡万明,等.巢湖富营养化对河蚬和环棱螺分布及种群密度影响 [J]. 应用生态学报, 2005,16(8):1502-1506.
[30]Hooper H L, Sibly R M, Hutchinson T H, et al. The influence of larval density, food availability and habitat longevity on the life history and population growth rate of the midge Chironomus riparius [J]. Oikos, 2003,102(3):515-524.
[31]Shostell J M, Williams B S. Habitat complexity as a determinate of benthic macroinvertebrate community structure in cypress tree reservoirs [J]. Hydrobiologia, 2007,575(1):389-399.
[32]Mcgoff E, Aroviita J, Pilotto F, et al. Assessing the relationship between the Lake Habitat Survey and littoral macroinvertebrate communities in European lakes [J]. Ecological indicators, 2013,25:205-214.
[33]向速林,朱梦圆,朱广伟,等.太湖东部湖湾大型水生植物分布对水质的影响 [J]. 中国环境科学, 2014,34(11):2881-2887.
[34]Takamura N, Kadono Y, Fukushima M, et al. Effects of aquatic macrophytes on water quality and phytoplankton communities in shallow lakes [J]. Ecological Research, 2003,18(4):381-395.
[35]Kennedy T L, Turner T F. River channelization reduces nutrient flow and macroinvertebrate diversity at the aquatic terrestrial transition zone [J]. Ecosphere, 2011,2(3):t35.
[36]Miyake Y, Nakano S. Effects of substratum stability on diversity of stream invertebrates during baseflow at two spatial scales [J]. Freshwater Biology, 2002,47(2):219-230.
[37]Sauter G, Güde H. Influence of grain size on the distribution of tubificid oligochaete species [J]. Hydrobiologia, 1996,334(1-3): 97-101.
[38]Donohue I, Irvine K. Effects of sediment particle size composition on survivorship of benthic invertebrates from Lake Tanganyika, Africa [J]. Archiv Fur Hydrobiologie, 2003,157(1): 131-144.
[39]De Jonge M, Dreesen F, De Paepe J, et al. Do acid volatile sulfides (AVS) influence the accumulation of sediment-bound metals to benthic invertebrates under natural field conditions? [J]. Environmental Science and Technology, 2009,43(12):4510-4516.
[40]Widdicombe S, Austen M C. The interaction between physical disturbance and organic enrichment: an important element in structuring benthic communities [J]. Limnology and Oceanography, 2001,46(7):1720-1733.
[41]Frouin P. Effects of anthropogenic disturbances of tropical soft-bottom benthic communities [J]. Marine Ecology Progress Series, 2000,194:39-53.
[42]Warwick R M, Collins N R, Gee J M, et al. Species size distributions of benthic and pelagic metazoa: evidence for interaction [J]. Mar. Ecol. Prog. Ser., 1986,34:63-68.
Benthic macroinvertebrate community structure in rivers and streams of Lake Taihu Basin and environmental determinants.
ZHANG You1,2, LIU Ling2, CAI Yong-jiu1,3*, YIN Hong-bin1, GAO Jun-feng1, GAO Yong-nian1(1.State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences,Nanjing 210008, China;2.College of Hydrology and Water Resources, Hohai University, Nanjing 210098, China;3.Nanjing Hydraulic Research Institute, Nanjing 210029, China). China Environmental Science, 2015,35(5):1535~1546
We investigated macroinvertebrate communities at 93 sampling sites across Lake Taihu Basin in October 2012 to reveal the patterns of community structures and the possible determinants. A total of 104 macroinvertebrate taxa from 85 genera, 46 families, 19 orders, 8 classes, 4 phyla were recorded. Total abundance of macroinvertebrate varied greatly between 1.33 and 39080 ind./m2. More taxa were found in the western hills than the eastern plains, and the diversity indices in the western hills were significantly higher than the eastern plains. The benthic communities in the eastern plains were mainly dominated by pollution-tolerant taxa, such as Limnodrilus hoffmeisteri and Bellamya aeruginosa, while the dominant species in western hills included the sensitive taxa (aquatic insects from Ephemeroptera and Trichoptera). ANOSIM analysis showed that macroinvertebrate assemblages differed significantly between the two ecoregions, and B. aeruginosa was primarily responsible for the dissimilarity, followed by L. hoffmeisteri, Neocaridina denticulata,Parafossarulus eximius, and Branchiura sowerbyi. CCA showed that the most important factors regulating the assemblage structure were mainly habitat diversity, trophic state, and substrate heterogeneity. The results of Goodnight-Whitley and BPI indices indicated that rivers in the western hills were mostly at status of slight polluted, and rivers in the eastern plains were mostly at status of slight or intermediate polluted, with several severely polluted sites.
Lake Taihu basin;aquatic ecoregion;anthropogenic disturbance;habitat quality;biodiversity
Q178,X171
A
1000-6923(2015)05-1535-12
张 又(1989-),女,安徽萧县人,博士研究生,主要从事水环境监测与水生生物群落生态学研究.
2014-09-15
国家水体污染控制与治理科技重大专项(2012ZX07501 001-03,2012ZX07506003,2014ZX07101011);中国科学院南京地理与湖泊研究所一三五前沿交叉项目(NIGLAS2012135012);江苏省自然科学基金(BK20131055);国家自然科学基金项目(51279060)
* 责任作者, 助理研究员, caiyj@niglas.ac.cn

