污染河流底泥亚铁氧化硝酸盐还原菌分离及代谢特性
谢小兰,余光伟,种云霄,龙新宪 (华南农业大学资源环境学院,广东高校污水生态处理与水体修复工程技术研究中心,广东 广州 510642)
污染河流底泥亚铁氧化硝酸盐还原菌分离及代谢特性
谢小兰,余光伟,种云霄*,龙新宪 (华南农业大学资源环境学院,广东高校污水生态处理与水体修复工程技术研究中心,广东 广州 510642)
采用常规分离培养方法,从富含亚铁厌氧还原态底泥中分离得到多株亚铁氧化硝酸还原菌,并从中选取1株:FX-Fe5菌株进行详细分析研究.经革兰氏染色、光学显微镜及扫描电镜观察,该菌为革兰氏染色阴性长杆菌,经16SrRNA测序分析确定为:拉乌尔菌属种类(Raoultella sp.).利用亚铁作为单独电子供体和亚铁与不同比例乙酸作为共同电子供体反硝化反应液,研究了FX-Fe5菌株对亚铁、硝酸盐氮和有机物的代谢特点.结果表明,FX-Fe5在24h内可对亚铁进行较大幅度的去除,去除率(%)分别为:89.77±0.47a(亚铁与乙酸盐比例1:1)、87.01±0.22b(亚铁与乙酸盐比例3:1)、86.96±0.07b(仅亚铁)、72.97±0.53c(亚铁与乙酸盐比例1:3),高于文献报道大部分纯菌的亚铁氧化率;亚铁和乙酸盐为共同电子供体时,乙酸和亚铁在硝酸还原过程中同步减少;重复反应的结果发现FX-Fe5菌株在不提供乙酸盐时,不能持续地利用亚铁进行硝酸还原反应.FX-Fe5菌株利用亚铁对硝酸还原过程中没有出现明显的亚硝酸盐氮和氨的积累,各反应体系反应气体中都含有N2O的存在,所占比例都不高,最高的情况不超过0.5%(5000×10-6),但不同电子供体间差别非常大.利用Biology对碳源代谢特点分析表明,FX-Fe5菌株但对单糖/糖苷/聚合糖类优先利用且利用程度较高.
厌氧还原态底泥;亚铁氧化;硝酸还原
厌氧中性条件下,部分异养反硝化菌可以利用亚铁为电子供体进行硝酸还原[1],被称为亚铁氧化硝酸盐还原菌或硝酸依赖型亚铁氧化菌.1996年欧洲学者Straub[1]在底泥样品中分离出3种具有该功能的革兰氏阴性菌株.此后,其他研究者陆续报道了稻田、湿地、湖泊、海洋沉积物及活性污泥中该类反硝化过程的发生,研究表明此过程是典型厌氧环境中铁、氮循环的重要步骤[1-6].此外,由于亚铁氧化形成铁(Ⅲ)氧化物对磷、砷等具有很强的吸附特性,因此该过程对环境中磷、砷等污染物迁移转化具有重要的意义,是目前国内外铁氮循环、污水处理等环境科学与技术领域研究的热点.
目前,我国关于该类功能菌的研究刚刚起步,还没有纯菌分离的报道[7-11].华南地区属于富含铁铝的红壤区[12],相应的河流沉积物中含有大量的铁氧化物,许多城市河流长期接纳生活污水,使得底泥处于厌氧的黑臭状态,其中含有丰富的亚铁,同时上覆水中氨氧化形成硝酸盐氮也会向底泥扩散,是亚铁氧化硝酸盐还原菌生存的典型环境条件.
为了探索亚铁氧化硝酸盐还原菌在污染河道底泥中的分布,本研究以广州典型厌氧还原态(黑臭)河流底泥为研究对象,尝试从中分离纯化具有该类功能的菌株,并分析其对亚铁和硝酸盐氮的代谢特点,为进一步开发黑臭河流底泥原位修复技术提供理论依据.
1 材料与方法
1.1 底泥的选取及特性
选取广州市天河区车陂涌河道底泥,主要理化特征(mg/g鲜重,平均值):有机质为34.583、氨氮0.753、凯氏氮5.796、亚铁11.635、硫化物0.669.
1.2 亚铁氧化硝酸盐还原菌的分离纯化及鉴定
1.2.1 富集过程 首次富集称取100g底泥加入1L四口瓶中,加入900mL常规异养反硝化细菌培养液[13],通氮气形成无氧环境,在30℃振荡培养箱中培养至硝酸盐浓度下降,取100mL上述培养液进行第2次富集,共重复3次,得到混合异养反硝化菌液.
1.2.2 分离纯化 采用平板及斜面划线法,对混合菌液进行多次分离纯化,直至获得形态清晰一致的单菌落,然后每种菌分别接种到液体培养基中进行培养.
1.2.3 亚铁氧化硝酸盐还原菌筛选 利用亚铁替代传统异养反硝化培养液组成[13]中的有机物,形成亚铁为单一电子供体的培养液,对分离出各菌株进行筛选,各菌菌液按20%添加量投入1L的四口孔反应瓶,通氮气创造缺氧环境,在30℃培养箱中培养,不同时间底部取样测定反应中液中亚铁、硝酸盐氮变化量,筛选出能将培养液中亚铁氧化50%以上[1],同时硝酸盐氮相应下降的菌株,从中选取一种命名为FX-Fe5,进行深入菌种鉴定及铁氮代谢特性研究.
1.2.4 FX-Fe5菌种鉴定 形态分析:对数生长期细胞革兰氏染色后光学显微镜观察,并进一步利用扫描电子显微镜观察形态(样品前处理委托广东省微生物研究所菌种鉴定中心完成,扫描电镜观察在华南理工大学分析测试中心完成).
菌株16SrRNA序列的测定及系统发育分析:按文献常规方法提取菌液样品的总DNA,然后以总DNA为模板,采用细菌16SrRNA通用引物进行扩增并测序(整个过程委托广州华大基因公司完成).将测序结果用BLAST软件与Gen-Bank中已登录的16S rRNA 序列进行同源性比较,进行种属鉴定,采用Clustal X1. 8进行多序列比对,MEGA4. 1软件中的NJ 法构建进化树.
1.2.5 FX-Fe5使用不同电子供体进行硝酸还原及亚铁氧化的代谢动力学分析 电子供体类型:研究表明亚铁氧化硝酸还原菌通常可以在2种情况下对亚铁进行氧化[4],单独以亚铁作为电子供体,或亚铁和有机物共同作为电子供体,为了考察FX-Fe5这方面的特点,以常规异养反硝化培养液为基础[13],通过改变电子供体类型及数量比例形成5种不同硝酸还原反应液:
(1)仅乙酸(CH3COO-)做为电子供体
(2)仅亚铁(Fe2+)做为电子供体
(3)乙酸盐与亚铁共同作为电子供体,2者按摩尔比投加,比例按还原1mol硝酸盐氮为氮气,亚铁被氧化三价铁、乙酸被氧化为CO2时,亚铁和乙酸分别提供电子数比例确定,共设定3种典型情况,分别为:
亚铁与乙酸盐比例(Fe2+:CH3COO-):3:1,即还原1mol硝酸盐氮为氮气,由亚铁提供75%电子,乙酸提供25%.
亚铁与乙酸盐比例(Fe2+:CH3COO-):1:1,即还原1mol硝酸盐氮为氮气,由亚铁和乙酸各提供50%电子.
亚铁与乙酸盐比例(Fe2+:CH3COO-):1:3,即还原1mol硝酸盐氮为氮气,由亚铁提供25%电子,乙酸提供75%.
在亚铁与硝酸盐氮氧化还原反应中,若硝酸盐氮被还原为氮气,则2者理论的反应量之比为:5:1(摩尔比),即反应消耗的亚铁量远高于硝酸盐氮,根据前期筛选实验发现较高浓度(高于2mmol/L)的亚铁会对FX-Fe5菌产生抑制作用,反应速度较慢,因此配置反应液时,亚铁浓度控制在2mmol/L以下,这也是底泥间隙水中亚铁离子浓度范围,然后以亚铁浓度为基准,并假定硝酸盐氮全部为还原为氮气,再对应计算不同情况下乙酸盐和硝酸盐氮浓度,由于硝酸盐氮可能会被同化反硝化,因此投加量略高于理论计算反应量.
实验步骤:反应装置采用125mL的3孔瓶,100mL反应液,添加FX-Fe5纯菌培养液20mL,通氮气维持缺氧条件,在30℃培养箱中培养.采用破坏性取样系统,每个反应体系隔4h取3瓶样品测定反应中液中亚铁、硝酸盐氮、乙酸盐、亚硝酸盐氮、氨氮含量,最后剩余3瓶样品,用12mL抽真空的顶空取样瓶抽取反应液上空气体测定其中N2O浓度.
已报道的大部分亚铁氧化硝酸还原菌,在不提供有机碳情况下,不能持续使用亚铁做为电子供体进行硝酸还原[14],为了验证FX-Fe5菌株该方面特点,各反应系统中的菌液在初次反应后结束后,继续抽取20mL反应液作为接种菌液进行再次反应,重复4次.
测定方法:各反应系统中的亚铁(包括溶解的Fe2+、吸附Fe2+及与磷酸根等化学沉淀的结合态亚铁)提取,参考文献研究结果[1,10,15]并结合预实验摸索,最终确定使用0.5mol/L盐酸进行浸提,然后采用邻菲罗林分光光度法测定亚铁(HJ/T 345-2007),原子吸收法测定总铁;硝酸盐氮采用麝香草酚分光光度法(GB/T5750.5-2006);乙酸钠采用高效液相色谱法(GB/T 23383-2009),亚硝酸盐氮采用N-(1-萘)-乙二胺分光光度法(GB/T 7493-1987),氨氮采用纳氏试剂法测定(HJ 535-2009).
N2O测定按照翟晓峰等[16]方法,采用6820型气相色谱仪(Agilent Technologies, USA)测定,气相色谱采用ECD 检测器,HP-PLOT/Q毛细管柱(J&W GC Columns, Agilent Technologies,USA). N2O色谱条件:进样口温度50℃,柱温50℃,ECD检测器温度300℃.用氮气作为载气,流量控制在15mL/min,纯N2O气体用做标准气体,进样量5μL.
1.2.6 碳源利用特点 采用Biology方法分析FX-Fe5碳源利用特性.取稀释后的菌液加入BiologyECO板,每孔150mL,然后将微平板置于30℃培养箱中培养,定期用酶标仪(BIO-RAD Model 550)测定96个孔在590nm下的吸光度,以监测显色反应的进程.
1.3 数据统计处理
实验数据用SPSS11. 5和Exce l进行统计分析.
2 结果与讨论
2.1 FX-Fe5形态分析及种属鉴定
2.1.1 形态分析 FX-Fe5菌株革兰氏染色为阴性,长杆状,直径约0.2μm,长约1μm,见图1.
2.1.2 种属鉴定 将扩增的FX-Fe5菌株16S rDNA序列与GenBank 中相关序列比对,构建系统发育树,发现与拉乌尔菌属(Raoultella)的Raoultella ornithionlyticaB6、Raoultella ornithionlytica strain KNUC607、Raoultella ornithionlytica strain TSA7等多株解鸟氨酸拉乌尔菌同源性达到99%以上,初步确定其为拉乌尔菌属种类:Raoultella sp..
据文献[1,4,6,14]报道,具有亚铁氧化硝酸盐还原功能的菌是比较多样的,但被分离纯化的菌株不多,目前报道较多的纯菌株是属于细菌域变形杆菌门(Proteobacteria)的9株细菌,如Straub[19]从淡水沟渠分离的Acidovorax sp. BrG1和Aquabacterium sp.BrG2菌株、Chaudhuri[18]在猪场氧化塘分离得到Azospiraoryzae strain PS菌株、Edwards等[4]从深海分离的Hyphomonas jannaschiana、Kumaraswamya等[6]从污水处理厂分离的Paracoccus ferrooxidans等.而拉乌尔菌属(Raoultella)还未被研究报道过具有该功能菌株的存在,本研究是首次发现.
2.2 FX-Fe5菌株对亚铁、乙酸、硝酸盐氮代谢特点
由图2看出,FX-Fe5在在有亚铁存在4种情况下,反应24h后亚铁都有较大幅度的去除,去除率(%)分别为:89.77±0.47a(亚铁与乙酸盐比例1:1)、87.01±0.22b(亚铁与乙酸盐比例3:1)、86.96±0.07b(仅亚铁)、72.97±0.53c(亚铁与乙酸盐比例1:3),与仅使用亚铁做电子供体相比,添加乙酸作为共同电子供体3种情况下,亚铁与乙酸1:1和3:1都提高了亚铁去除率,前者达到显著差别,而亚铁与乙酸1:3时,则亚铁去除率显著降低,表明添加乙酸添加量过多,也不利于亚铁的氧化.含有亚铁4个体系中,反应前4h内,单以亚铁做为电子供体情况下,亚铁下降速度快于其他3种情况,其中亚铁和乙酸1:3时,亚铁下降速度最慢,但不管哪种情况,都是前4h亚铁浓度下降速度最快,后面开始变慢;此外,随着亚铁的下降,各反应系统中总铁基本维持不变(数据未列出),但反应液中逐渐出现红棕色悬浮物,应该是亚铁氧化形成的三价铁沉积物.

图2 FX-Fe5在5类不同电子供体初次反应液中亚铁和乙酸钠的变化Fig.2 Variation of ferrous and NaAc concentration in five different electron donor selected systems with strain FX-Fe5
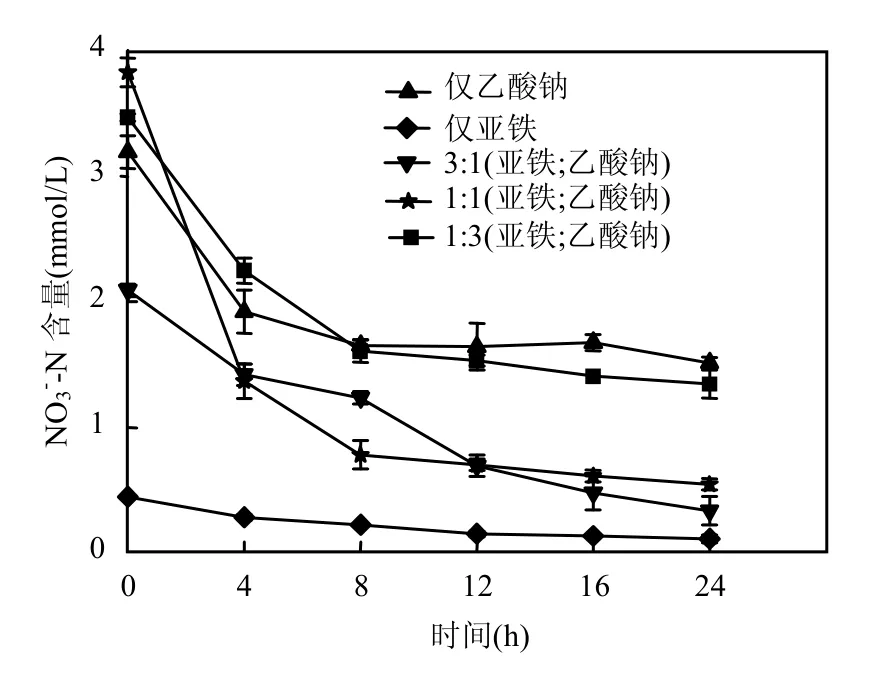
图3 FX-Fe5在5类不同电子供体初次反应液中硝酸盐氮的变化Fig.3 Variation of nitrate concentration in five different electron donor selected systems with strain FX-Fe5
在亚铁和乙酸作为共同电子供体的3种情况下,反应初始4h内2者浓度都快速下降,表明2者在反应时被同步利用,但不管哪种情况,乙酸的消耗速度都略快于亚铁,经过4h后,各系统中乙酸基本都被完全消耗,主要是由于乙酸同时作为细胞合成代谢的有机碳源和能量代谢的电子供体的原因.
由图2和图3中看出,FX-Fe5各反应体系中,反应前4h,随亚铁和乙酸浓度下降,硝酸盐氮浓度也快速下降,到后面浓度降低较缓慢,其中仅亚铁为电子供体情况下,硝酸盐氮下降速度最慢,而亚铁与乙酸1:1时,硝酸盐氮下降速度最快.
重复反应的结果发现(数据未列出),有乙酸存在时,FX-Fe5对硝酸还原反应都可以持续进行,各反应底物消耗速率与初次反应接近,但单独使用亚铁作为电子供体时,亚铁消耗速率开始逐渐变慢,转接到第4次时,24h内消耗速率已降低到50%以下,这表明FX-Fe5菌株与大部分亚铁氧化硝酸还原菌代谢特性相同,在不提供有机碳源时,不能持续地利用亚铁进行硝酸还原反应.已有研究认为主要是2方面原因[19],首先是这些菌不能使用无机碳作为细胞增殖的碳源,因此,没有有机碳源时细胞不能增殖;其次,是亚铁氧化形成的三价铁在pH值中性范围易在细胞表面沉积,在细胞表面形成铁氧化物外壳,阻碍后续反应进行,但也有研究认为,一些菌的细胞可以通过某种机制将表面的铁氧化物外壳移除,反应不能持续进行原因主要是由于菌细胞老化得不到有效增殖,对于FX-Fe5菌株属于那种情况还有待进一步研究.
2.3 硝酸还原产物分析
对于大部分硝酸还原反应来说,亚硝酸盐氮通常是中间产物,产生后会继续被还原,但也有报道发现某些亚铁氧化硝酸还原菌只能把硝酸还原为亚硝酸盐氮[8].图4是FX-Fe5各反应体系中亚硝酸盐氮的浓度变化,在其中3个反应体系(仅使用亚铁、亚铁与乙酸3:1、亚铁和乙酸1:1)中监测到亚硝酸盐氮生成,但浓度都非常低,最高的是仅使用亚铁反应体系,达到0.07mmol/L,但远低于初始投入硝酸氮浓度(0.45mmol/L),且随着反应进行亚硝酸盐氮浓度都很快下降到接近于0,这表明FX-Fe5菌株在这5种情况下对硝酸盐还原时,亚硝酸盐氮都是中间产物而不是最终产物,并且过程中没有出现较高浓度的积累,生成后很快被继续还原.

图4 FX-Fe5在5类不同电子供体初次反应液中亚硝酸盐氮的变化Fig.4 Variation of nitrite concentration in five different electron donor selected systems with strain FX-Fe5
Weber 等[20]曾经使用含有Geobacter and Dechloromonas spp的富集液作为对象,研究厌氧中性条件下,硝酸盐氮对亚铁的氧化,发现反应液中亚铁和硝酸被消耗的同时,氨氮增加,推测可能这两类菌可以利用亚铁把硝酸还原为氨.本研究中5种情况下反应液初始都有氨氮作为FX-Fe5菌株生长的氮源,反应过程中对氨氮监测发现,各体系氨氮浓度均呈现逐渐下降趋势,反应结束时各体系氨氮浓度接近于0,因此,FX-Fe5菌株在使用这5种类型电子供体对硝酸还原时,还原产物都不是氨氮.
在硝酸生物还原过程中,N2O是除了氮气外,被广泛监测到的气态硝酸还原产物,浓度往往取决于电子供体的情况.对分离的多种亚铁氧化硝酸还原菌的研究发现,亚铁做为电子供体时,N2O是硝酸还原的气态产物的组成,但所占比例都不高[17].本研究中,5类电子供体情况下,FX-Fe5对硝酸还原反应气体中都监测到N2O的存在,整体来看,N2O在反应气体中所占比例也都不高,最高的情况不超过0.5%(5000×10-6),但不同电子供体间差别非常大(表1),其中仅使用乙酸钠和亚铁与乙酸钠1:3的情况下,N2O的浓度最低,在20×10-6以下,其余3种情况都远远高于这个浓度,亚铁与乙酸钠1:1情况最高,达到4717.9×10-6;这些结果表明,FX-Fe5使用亚铁作为电子供体还原硝酸盐氮更容易产生N2O,而且添加乙酸作为共同电子供体、添加量不大时,相比单独使用亚铁又更容易产生N2O.

表1 FX-Fe5在5类不同电子供体反应气体中N2O的浓度(×10-6)Table 1 N2O content in five different electron donor selected systems with strain FX-Fe5(×10-6)
2.4 FX-Fe5菌株碳源代谢特性
采用B IOLOG方法分析FX-Fe5对碳源的利用情况,根据检测结果将所利用的碳源分成6类:Ⅰ酸类、Ⅱ单糖糖苷聚合糖类、Ⅲ氨基酸类、Ⅳ酯类、Ⅴ醇类和Ⅵ胺类.ECO微孔板上共有31种碳源,其中酸类8种,单糖糖苷聚合糖类7种,氨基酸类6种,酯类3种,醇类3种,胺类4种.根据光密度值来判断菌株对碳源的利用程度,分析3株细菌对31种不同碳源的利用情况,结果见表2和表3.
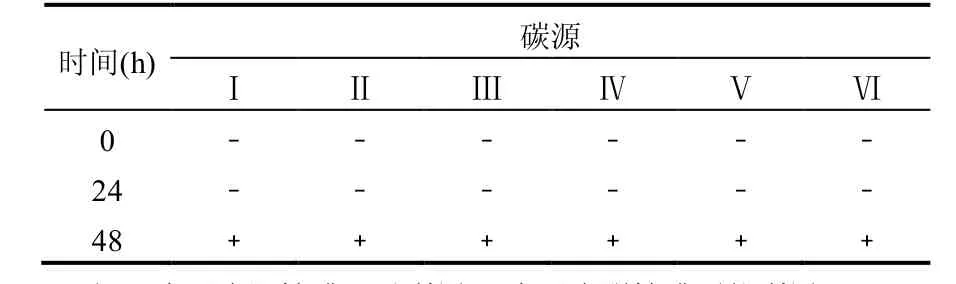
表2 FX-Fe5菌株分别在0h~48h内对碳源的利用情况Table 2 Utilization of carbon sources by strain FX-Fe5 at time of 0, 24 and 48h

表3 菌株在72~168h对碳源的利用程度(以OD590nm表示)Table 3 Utilization of carbon source(shown as OD590nm)by strain FX-Fe5 at time of 72~168h
由表2可知,拉乌尔菌属(Raoultella)FX-Fe5菌株对6类碳源的均可利用,但都需要经过约30h的适应期,其中对单糖/糖苷/聚合糖类利用程度较高(表3),其次是酯类,利用程度较差的是酸类.
3 讨论
3.1 FX-Fe5菌株与其它亚铁氧化硝酸还原菌的系统发育关系
细菌域的变形杆菌门是具有有亚铁氧化硝酸还原功能细菌集中分布的一个大类群[14],目前有详细报道的9株亚铁氧化硝酸还原菌的纯菌都属于这一类群,但分属于不同的纲.本研究FX-Fe5菌株所属的拉乌尔菌属(Raoultella)也属于变形杆菌门,具体是γ-变形杆菌门肠杆菌科[21],因此本研究发现,又进一步丰富了变形杆菌门中该类功能菌组成.已报道的9株菌中,6株集中于α-变形菌纲,其他3株分属于另外3个纲,其中属于γ-变形菌纲的是Straub等[17]分离的热单胞菌属的BrG3菌株(Thermomonas.sp.),可见作为亚铁氧化的硝酸还原菌,FX-Fe5菌株与BrG3菌株有着最近的遗传亲缘关系,但它们分属于不同的科,拉乌尔菌属属于肠杆菌科(Enterobacteriaceae),而热单胞菌属属于黄单胞菌科(Xanthomonadaceae)[20],系统发育学研究认为,这两个科在有机物特别是糖类降解途径方面有着较大的差别,因此,FX-Fe5菌株与BrG3菌株在其他生理代谢方面可能具有较大差异.
3.2 FX-Fe5菌株对硝酸盐氮和亚铁的代谢特点
研究发现,大部分亚铁氧化的硝酸还原菌对硝酸盐氮还原的产物主要是氮气和少部分氧化二氮[17,20],但也有研究发现,有个别菌株可以将硝酸盐氮还原为其他产物,如前述地杆菌属种类将硝酸盐氮还原为氨,分离自潜艇供热系统的Ferroglobus placidus将硝酸还原为亚硝酸盐氮)、二氧化氮(NO2)、一氧化氮(NO)[8],分离自湖泊底泥的Pseudogulbenkiania sp.可以将硝酸还原为四氧化三氮[8].本研究由于实验条件有限,只对氨、亚硝酸盐氮和氧化二氮3种产物做了分析确定,但从微生物反硝化机制和其他亚铁氧化硝酸还原菌的反硝化产物来看,氧化二氮很多时候是反硝化为氮气过程中的中间产物,一定程度上是产氮气的反硝化过程不完全导致的,本研究中各反应体系中所产生气体中都含有氧化二氮,但含量并不高,表明气体产物应该不以氧化二氮为主,而是氮气为主.
本研究中,除了亚铁与乙酸1:3情况,其他含亚铁的反应系统中,亚铁氧化率在24h内达到80%以上,氧化速率和氧化率都高于文献报道大部分亚铁氧化硝酸还原过程[1-6],特别是仅采用亚铁做为电子供体的情况,可能与本研究采用亚铁离子浓度较低(2mmol/L)有关,其他分离纯菌研究多采用5~10mmoL/L亚铁离子浓度,亚铁氧化硝酸还原菌达到50%以上往往需要2d以上时间.
根据已有研究,大部分亚铁氧化硝酸还原菌在提供少量有机物作为共同电子供体时,相比仅使用亚铁做为电子供体,亚铁的氧化速率及氧化率都会提高,如HidR2and BrG1菌株[1],不添加乙酸时在4周内将9mmoL/L的亚铁离子氧化不到50%,而添加1mmoL/L乙酸,则可以1周内将9mmoL/L的亚铁氧化60%,对BoFeN1菌株研究发现,亚铁氧化率随乙酸添加量增加而增加,但超过0.5mmL/L时,则不再增加而是处于基本稳定状态[21].本研究FX-Fe5菌株,提供适当含量的乙酸(亚铁和乙酸各提供50%电子时),亚铁氧化率显著提高,但氧化速率并不比仅使用亚铁作为电子供体时高,同时过高的乙酸浓度(乙酸可提供三分之二电子时)反而降低了亚铁氧化率.
在有机物作为共同电子供体时,2种电子供体被硝酸氧化的顺序,FX-Fe5菌株也与已有研究不同,对Azospira oryzae strain PS和BoFeN1菌株研究[18,22]发现,其在有机物作为共同电子供体时,硝酸盐氮优先氧化有机物,然后再氧化亚铁,即亚铁的消耗在反应开始后有一个滞后期;而本研究FX-Fe5菌株是对2者同步利用,但是乙酸首先被消耗完,由于乙酸也可能是被同化,即用来作为新细胞合成碳源,因此提供的乙酸并不是或不完全是被用作硝酸盐氮还原电子供体,具体机制也有待进一步研究.
3.3 FX-Fe5菌亚铁氧化硝酸还原过程在环境治理中潜在应用
3.3.1 富含亚铁城市污染河流底泥修复 本研究FX-Fe5菌是分离自富含亚铁的城市河流底泥,这种类型的底泥往往是城市河流接受含有大量有机耗氧污染物的生活污水后,水中溶解氧被消耗从而发生厌氧还原的结果,还原形成的亚铁离子是底泥中主要还原态污染物,对多种底栖水生生物具有危害[23],河流要恢复健康生态系统首先要将其氧化形成相对安全的三价铁沉积物.但这种富含亚铁的厌氧还原态底泥往往是广州等华南地区受污染城市河流修复的难点,即使排入河流外源污水被切断,河水中溶解氧逐渐恢复或人为向河流强化曝气充氧,由于溶解氧向底泥间隙水扩散速度较慢,底泥中的亚铁较难被大量氧化,致使底泥仍会长时间保持厌氧还原状态,不利于健康水生生态系统重建.而亚铁氧化硝酸还原过程为这种污染河流底泥的快速原位修复提供了可能,因为处于厌氧还原态底泥中同样富含有机物厌氧水解形成的小分子有机物,有硝酸盐氮存在时可能发生这种伴随亚铁氧化的硝酸还原过程.
与溶解氧相比,硝酸盐氮在水中具有更高的扩散速度,是一个更有效的氧化剂,因此可以基于微生物的亚铁氧化硝酸还原代谢特点,开发相应底泥的原位修复技术.实际上,国内外已经有关的技术尝试,即通过向底泥注入外源硝酸钙氧化底泥[24-25],作者所在研究小组也在进行相关的技术研究,但由于基本生物化学代谢机制缺乏充足的认识,该项技术目前存在较大的不确定性,较难以实际应用,由于硝酸盐氮同样是水体污染物,该项技术面临最主要的问题在于外源硝酸盐氮投入是否会增加水体氮负荷,如何确保其都能够被反硝化为氮气等气态产物?本研究对FX-Fe5菌的亚铁和硝酸盐氮的代谢特性表明在短时间(24h)内,该菌可以将底泥间隙水中亚铁利用硝酸盐氮氧化,参与反应硝酸盐氮主要形成气态产物,但如何利用FX-Fe5菌开发安全环保的底泥硝酸盐氮氧化技术还需要深入研究.
3.3.2 水中其他污染物的去除 亚铁氧化形成三价铁矿物可通过共沉淀或吸附方式固定磷酸盐、砷酸盐、镉离子等污染,因此厌氧中性条件下,生物亚铁氧化硝酸还原过程被发现以来,已有较多的研究尝试利用亚铁氧化硝酸还原菌的代谢进行水中这些污染物的去除,特别是砷的去除一直是关注和研究的热点[26-29].砷是某些地下水或矿山废水中主要污染物,具有较大的污染危害,在我国许多地区饮用水遭受严重的砷污染.本研究的FX-Fe5菌在提供乙酸的情况下可将水中接近90%的亚铁离子氧化生成三价铁氧化物,因此在地下水除砷等方面也具有较大的应用潜力.
4 结论
4.1 从富含亚铁的城市河流底泥中分离出了一株具有亚铁氧化功能的硝酸盐还原菌——FX-Fe5菌.经鉴定,该菌为革兰氏染色阴性长杆菌,属于γ-变形杆菌门肠杆菌科拉乌尔菌属种类(Raoultella sp.).
4.2 FX-Fe5菌株在24h内可对亚铁较大幅度的去除,最高去除率可达到89.77±0.47%(亚铁与乙酸盐比例1:1).当亚铁和乙酸盐为共同电子供体时,乙酸和亚铁在硝酸还原过程中同步减少;而不提供乙酸盐时, FX-Fe5菌株不能持续地利用亚铁进行硝酸还原反应. 此外,FX-Fe5菌株利用亚铁对硝酸还原过程中没有出现明显的亚硝酸盐氮和氨的累积,同时各反应体系反应气体中虽检测到N2O,但所占比例均低于0.5%(5000×10-6),表明气体产物不以氧化二氮为主.
4.3 Biology实验表明FX-Fe5菌株对单糖/糖苷/聚合糖类优先利用且利用程度较高.
[1]Straub K L, Buchholz-cleven B E E. Enumeration and detection of anaerobic ferrous iron-oxidizing, nitrate-reducing bacteria from diverse European sediments [J]. Appl. Environ. Microbiol.,1998,64:4846-4856.
[2]Weber K A, Picardal F W, Roden E E. Microbiolly catalyzed nitrate-dependent oxidation of biogenic solid-phase Fe (II)compounds [J]. Environ Sci. Technol., 2001,35:1644-1650.
[3]Ratering S, Schnell S. Nitrate-dependent iron (II) oxidation in paddy soil [J]. Environ. Microbiol., 2000,3:100-109.
[4]Edwards K J, Rogers D R, Wirsen C O, et al. Isolation and Characterization of Novel Psychrophilic, Neutrophilic, Fe-Oxidizing, Chemolithoautotrophic α- and β-Proteobacteria from the Deep Sea [J]. Applied and Environmental Microbiology,2003,69(5):2906-2913.
[5]Hauck S, Benz M, Brune A, et al. Ferrous iron oxidation by denitrifying bacteria in profundal sediments of a deep lake (Lake Constance) [J]. FEMS Microbiology Ecology, 2006,37(2):328-336.
[6]Kumaraswamya R, Sjollemab K, Kuenena G, et al. Nitratedependent [Fe(II)EDTA]2-oxidation by Paracoccus ferrooxidans sp. nov., isolated from a denitrifying bioreactor [J]. Systematic and Applied Microbiology, 2006,29:276-286.
[7]张 萌,郑 平.铁氧化菌的类型、生境及富集培养方法 [J]. 科技通报, 2012,28(11):72-76.
[8]张 萌,郑 平,季军远.厌氧铁氧化菌研究进展 [J]. 应用生态学报, 2013,24(8):2377-2382.
[9]沈东升,李文兵,姚 俊,等.亚铁厌氧微生物氧化及其在环境污染修复中的作用机制 [J]. 浙江大学学报(农业与生命科学版),37(1):112-118.
[10]冯 欢,梁禹翔,杜 耀,等.填埋场中铁的生物化学循环对反硝化的影响 [J]. 环境科学学报, 2014,34(2):409-416.
[11]胡 敏,李芳柏.土壤微生物铁循环及其环境意义 [J]. 土壤学报, 2014,51(4):683-698.
[12]李芳柏,王旭刚,周顺桂,等.红壤胶体铁氧化物界面有机氯的非生物转化研究进展 [J]. 生态环境, 2006,(6):1343-1351.
[13]张培玉,郭艳丽,于德爽,等.一株轻度嗜盐反硝化细菌的分离鉴定和反硝化特性初探 [J]. 微生物学通报, 2009,(4):581-586.
[14]Hedrich S, Schlomann M, Johnson B D. The iron-oxidizing proteobacteria [J]. Microbiology, 2011,157:1551-1564.
[15]李文兵.填埋场中铁的迁移转化对脱氮的影响和机理 [D]. 杭州:浙江大学, 2012.
[16]翟晓峰,蒋成爱,吴光学,等.以甲醇为碳源生物反硝化过程释放一氧化二氮的试验研究 [J]. 2013,34(4):1421-1427.
[17]Straub K L, Schonhuber W A, Buchholz-Cleven B E E, et al. Diversity of ferrous iron-oxidizing, nitrate-reducingbacteria and their involvement in oxygen-independent ironcycling [J]. Geomicrobiology Journal, 2004,21:371-378.
[18]Chaudhuri S G, Lack J D, Coates J K. Biogenic magnetite formation through anaerobic biooxidation of Fe(II). Applied and Environmental Microbiology, 2001,67(6):2844-2848.
[19]Straub K L, Benz M, Schink B. Iron metabolism in anoxic environments at near neutral pH. FEMS Microbiology Ecology,2001,34:181-186.
[20]Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction[J]. Nat Rev Microbiol., 2006,4:752-764.
[21]陶天申,杨瑞馥,东秀珠.原核生物系统学 [M]. 化学工业出版社,北京: 2007, P 256-348.
[22]Muehe E M, Gerhardt S, SchinkB, et al. Ecophysiologyand the energetic bene¢tof mixotrophic Fe(II) oxidation by various strains of nitrate-reducing bacteria [J]. FEMS Microbiol., Ecol., 2009,70(3):335-343.
[23]刘健康.高级水生生物学 [M]. 北京:科学出版社, 1998.
[24]Murphy T, Moller A, Brouwer H. In situ treatment of Hamilton Harbour sediment [J]. Journal of Aquatic Ecosystem Stress and Recovery, 1995,4(3):195-203.
[25]区凤壮.污染河涌底泥的原位修复与重金属稳定化工程应用研究 [D]. 广州:广东工业大学, 2013.
[26]Senn D B, Hemond H F. Nitrate controls on iron and arsenic in an urban lake [J]. Science., 2002,296:55-77.
[27]Hohmann C, Winkler E, Morin G. Anaerobic Fe(Ⅱ) -oxidizing bacteria show as resistance andimmobilize as during Fe(Ⅲ)mineral precipitation [J]. Environmental Science and Technology,2010,44(1):94-101.
[28]Sun W J, Sierra Alvarez R, Milner L, Arseniteand ferrous iron oxidation linked to chemolithotrophic denitrification for the immobilization of arsenic inanoxic environments [J]. Environmental Science and Technology, 2009,43(17):6585-6591.
[29]刘 琼.铁氧化菌的耐砷性能及除砷特性 [D]. 武汉:中国地质大学, 2012.
Isolation and characterization of metabolic activity of Fe(II)-oxidizing denitrifying bacteria from anaerobic river sediments.
XIE Xiao-lan, YU Guang-wei, CHONG Yun-xiao*, LONG Xin-xian (College of Natural Resource and Environment, South China Agricultural University, Guangzhou 510642, China). China Environmental Science,2015,35(5):1554~1562
Several Fe(II)-oxidizing denitrifying bacteria (FODBs) were isolated from iron-rich anaerobic river sediments using the conventional cultivation method, and one of the FODBs named strain FX-Fe5was selected for further study. Based on the observation of gram staining, optical microscope and scanning electron microscope, and identification by 16s rRNA sequencing, strain FX-Fe5 was as gram-negative bacillus and was most closely related to Raoultella sp., which was the first time to be reported as FODBs. Strain FX-Fe5could efficiently oxide ferrous iron within 24h, when ferrous and acetic acid were supplied as electron donor separately or jointly. The oxidation rates of Fe(II) (%) in different electron donor systems were 89.77±0.47(ratio of ferrous to acetate was 1:1), 87.01±0.22 (ratio of ferrous to acetate was 3: 1), 86.96±0.07 (ferrous only) and 72.97±0.53(ratio of ferrous to acetate was 1:3), respectively. The oxidation rates of Fe(II) were all higher than those of pure isolates reported by other studies. In addition, the concentration of ferrous and acetic acid decreased simultaneously, when both of them were supplied as electron donor during the process of denitrification. However, the Fe oxidation process was limited when ferrous was used as a single electron. Furthermore, during the denitrification process driven by strain FX-Fe5, only N2O gas was observed, without nitrite and ammonium accumulation in the reaction system. Otherwise, the highest content of N2O gas was less than 0.5% (5000×10-6), and varied largely with different electron donor systems. Carbon source metabolism analysis using Biolog EcoplateTM confirmed that strain FX-Fe5 had a higher preference to use monosaccharide, indican and polymerization sugars as carbon source.
anaerobic sediments;Fe-oxidizing;nitrate reduction
X172,X522
A
1000-6923(2015)05-1554-09
谢小兰(1988-),女,广西南宁人,华南农业大学资源环境学院硕士研究生,主要研究方向为水污染防治与控制.
2014-09-21
国家自然科学基金青年科学基金项目(51108196)
* 责任作者, 副教授, cyx04@scau.edu.cn

