氢氟酸酸蚀形成的两种不同微/纳米表面对骨髓间充质干细胞生物活性的影响
申明明, 李艳荣, 齐亚平, 付 亁, 秦东泽, 梁建飞, 赵云转
(1. 河北医科大学第二医院口腔颌面外科, 河北 石家庄 050000; 2. 解放军总医院内分泌科一病区, 北京 100853; 3. 军事口腔医学国家重点实验室,陕西省口腔医学重点实验室, 第四军医大学口腔医院, 陕西 西安 710032)
氢氟酸酸蚀形成的两种不同微/纳米表面对骨髓间充质干细胞生物活性的影响
申明明1, 李艳荣2, 齐亚平1, 付 亁3, 秦东泽3, 梁建飞3, 赵云转1
(1. 河北医科大学第二医院口腔颌面外科, 河北 石家庄 050000; 2. 解放军总医院内分泌科一病区, 北京 100853; 3. 军事口腔医学国家重点实验室,陕西省口腔医学重点实验室, 第四军医大学口腔医院, 陕西 西安 710032)
目的: 评价纯钛样品经12.5 g/L氢氟酸(HF)酸蚀处理不同时间后形成的两种不同表面对骨髓间充质干细胞(BMMSCs)生物活性的影响。方法:将纯钛钛片平均分为3组:A组抛光处理;B组12.5 g/L HF酸蚀1 min;C组12.5 g/L HF酸蚀15 min。X射线能谱仪分析(EDS)其表面化学成分;亲水性试验测量样品表面的接触角;激光共聚焦显微镜计数评价BMMSCs在样品表面的早期黏附;SEM观察观察样品表面形貌及黏附的细胞形态;MTT法检测细胞活性;碱性磷酸酶(ALP)试剂盒测定ALP活性。结果:酸蚀后的两组样品都可形成微/纳米级表面形貌且载入氟元素;酸蚀后的表面接触角明显小于抛光组,且C组小于B组;酸蚀后的纯钛样品表面能够促进BMMSCs的黏附、增殖和ALP活性,且C组优于B组。结论:HF酸蚀使纯钛表面构建了不同结构的微/纳米形貌,载入了氟元素,可促进BMMSCs在纯钛表面的生物活性。
氢氟酸(HF); 酸蚀; 微/纳米; 表面处理; 生物活性
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.08.004
[Chinese Journal of Conservative Dentistry,2015,25(8): 472]
随着口腔种植学的飞速发展,种植牙在临床上受到了患者和医生的普遍欢迎。然而,口腔种植仍面临着治疗周期过长、骨质骨量不佳、种植成功率低等问题。目前认为,种植体的成功率主要取决于种植体与周围骨组织的结合,为提高种植体骨结合效果,缩短骨结合时间,学者们尝试了很多方法,其中对种植体进行表面处理被认为是促进种植体骨结合最有效的方法之一。种植体表面处理的方法有很多种,其中酸蚀法因其操作简单、设备低廉等原因,一直广受关注。目前常用的酸有HCl、HNO3等,由于在酸蚀的同时可载入具有促成骨作用的氟元素,使得氢氟酸(HF)成为目前对种植体进行表面处理的研究热点。然而现有的研究对于HF酸蚀的浓度和作用时间无较精确的标准,加之酸蚀后的表面形貌不能够较精确地控制,所以本实验通过应用12.5 g/L HF对钛片酸蚀不同时间,对其形成的表面形貌及其对BMMSCs生物活性的影响进行研究,以期为HF进一步应用于临床提供实验依据。
1 材料和方法
1.1 样品制备和分组处理
取纯钛片(Φ14 mm×0.5 mm,西安中邦生物钛有限公司)用#200、#800、#1 200、#2 000、#3 000、#5 000水相砂纸依序打磨抛光,再依次用丙酮、无水乙醇及去离子水分别超声清洗15 min。然后将钛片样品随机分为A、B、C 3组,其中A组样品不予任何处理;B组样品置于12.5 g/L HF中酸蚀1 min(30 ℃,200 r/min)、C组样品置于12.5 g/L HF中酸蚀15 min(30 ℃,200 r/min),并于酸蚀完成后,将B、C两组钛片依次用丙酮、无水乙醇及去离子水分别超声清洗15 min。上述所有样品分别经钴60消毒后备用。
1.2 样品表面形貌观察及化学成分检测
分别取A、B、C各组样品,用扫描电镜(JSM-6460,Hitachi,日本)观察其表面形貌;并用X射线能谱仪(JSM- 6460,Hitachi,日本)分析样品表面的化学组成。
1.3 样品表面接触角测量
接触角测量采用液滴法,于室温下在接触角测量系统及其配套软件(Easy-Drop Standard,Kruss,德国)上完成。具体方法如下:取A、B、C各组样品,分别在其表面滴8 μL去离子水,然后采用数字成像技术采集液滴影像,并通过系统附带的DSAl软件分析液滴形状而测得接触角;记录结果为液滴左右双侧接触角的平均值,每个试样各测量5次。
1.4 BMMSCs原代培养
取人的髂骨骨松质(知情同意),PBS冲洗3~5次,将血细胞冲掉,剪刀剪碎,细胞培养液为DMEM, 含100 mL/L新生牛血清(Gibco, 美国)和10 g/L青/链霉素。置于37 ℃、50 mL/L CO2湿润条件下培养,培养至2~5代用于实验。
1.5 细胞形态观察
将各组样品置于24孔板中,接种密度为2×104/孔,细胞培养4 d后PBS和双蒸水轻柔漂洗,然后加入30 mL/L戊二醛、4 ℃过夜,乙醇梯度脱水、干燥和喷金后, SEM观察细胞形态。
1.6 细胞黏附实验
将钴60消毒后的样品置于24孔板内,细胞接种前24孔板紫外线照射30 min。细胞接种密度为2×104/孔,分别于培养30、60、120 min后,将钛片转移至新24孔板,PBS漂洗3次以去掉未黏附的细胞,40 g/L多聚甲醛固定30 min。PBS再次漂洗3次后,每孔加入200 μL DAPI工作液,37 ℃避光孵育15 min;PBS漂洗3次,4 ℃避光保存,激光共聚焦显微镜(FV1000, Olympus, 日本)下随机选择4个视野观察并拍照。
1.7 细胞活性检测
将0.306 g β-甘油磷酸钠溶于10 mL培养液,加20 μL地塞米松和0.167 mL维生素C配制成100 mL成骨诱导液。将各组样品置于24孔板中,接种密度为 2×104/孔,第2天换成骨诱导液后,分别培养1、4、7 d,用MTT法检测细胞活性。到预定时间点后,PBS漂洗3次并转移至新的24孔板内,每孔加入200 μL的MTT(5 mg/mL)和800 μL无血清无酚红的DMEM。37 ℃孵育4 h后弃上清,加入1 mL DMSO,每孔分3份转移至96孔板(每孔200 μL),分光光度计检测各孔490 nm处的吸光度值(OD值)。
1.8 碱性磷酸酶(ALP)活性检测
将各组样品置于24孔板中,接种密度为2×104/孔,细胞分别培养7、14 d后,用ALP试剂盒检测各孔细胞的ALP活性,分光光度计检测各孔405 nm处的OD值。
1.9 统计学分析

2 结果
2.1 不同处理后钛片样品的表面形貌
SEM低倍镜下可见,A组抛光钛片表面出现沿抛光方向平行排列的沟槽;B组酸蚀后表面形成纵横不一的沟壑,同一个晶格内沟壑方向一致,沟壑宽度约0.5 μm;C组酸蚀后表面形成宽度为1.5~2 μm 的沟壑,晶格界限清晰,同一个晶格内沟壑方向一致。高倍镜下可见,A组表面细微的平行排列的沟槽;B组表面形态均一,在微米结构的基础上出现直径为20~40 nm的点状颗粒,邻接紧密,顶部较尖锐;C组表面形态均一,为较疏松的山峰状结节,直径为70~100 nm,边缘较圆钝(图1)。

图1 SEM观察不同处理组钛片表面(a~c为×5 000; d~f为×50 000)
2.2 不同处理组样品表面的化学成分
X射线能谱仪分析结果显示,A组表面主要含Ti元素,以及少量的O、C、Si。B组表面除了O、C、Si、Ti外,还有少量的F,其中F占1.79%,Ti占79.15%。C组与B组类似,其中F占1.81%,Ti占78.47%(表1)。
周家喜让执法船赶紧向渔船靠拢,逼停渔船,登船检查。他发现船上江豚保护区禁止使用的非法捕捞工具,便要依法收缴。船上三人急了,想动手抢夺渔网,拉扯中险些跟周家喜发生冲突。
2.3 样品表面接触角测量
A组接触角最大,B、C组明显小于A组,其中C组最小,B组居中。A组表面接触角为 40.5±0.65,B组为13.7±1.59,C组为11.8±1.07。
2.4 样品表面BMMSCs的形态学观察
SEM观察结果显示,与酸蚀组相比,A组表面细胞伸展更好(图2a);B、C组表面细胞伸出大量伪足,细胞呈现多边形;与B组(图2b)相比,C组(图2c)表面更多的细胞呈现大量伪足的形态,且细胞之间伪足连接较多。
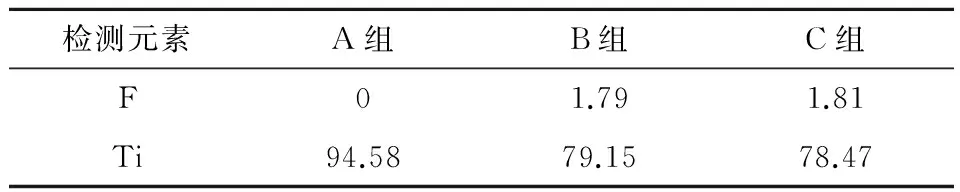
表1 不同处理组表面化学成分 (%)

图2 SEM观察不同处理组钛表面BMMSCs黏附情况(×1 000)
2.5 细胞黏附实验
2.6 细胞活性检测
MTT检测结果显示:3种钛片表面的BMMSCs均呈增长趋势,1、4 d时3组两两相比无统计学差异(P>0.05);7 d时,B、C组显著高于A组,且C组高于B组(P<0.05)(图5)。

图3 不同处理组钛片表面BMMSCs的早期黏附(共原焦显微镜, ×10)
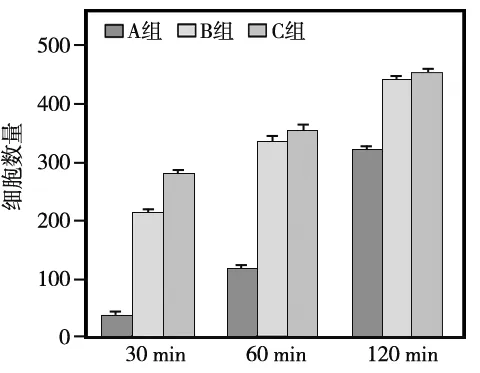
同一时间点组间两两相比P<0.05

7 d时组间两两相比P<0.05
2.7 ALP活性
培养7 d时,3组样品表面BMMSCs的ALP活性检测结果无统计学差异(P>0.05);14 d时,B、C组表面BMMSCs的ALP活性均显著高于A组,且C组高于B组(P<0.05)(图6)。
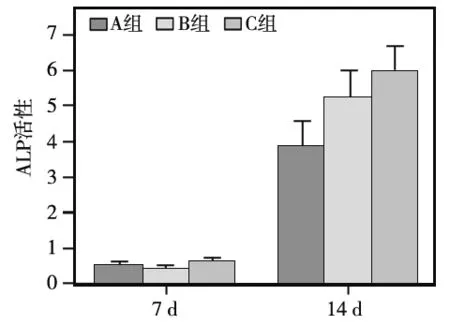
14 d时组间两两组相比P<0.05
3 讨论
目前,用于种植体表面处理的方法多种多样,其中酸蚀作为临床种植体表面处理最简单有效的方法之一,不仅可达到微/纳米的仿生结构,而且表面更为清洁,操作简单,成本低,适用于批量生产。目前常用的酸有HCl、HNO3、HF等,其中HF在酸蚀的过程中可以载入氟元素,研究表明氟化物具有促进成骨基因表达及骨矿化的作用[1],因此能进一步提高种植体的骨结合率。但目前对于HF酸蚀的具体参数以及控制条件尚无统一的标准。
骨组织的微观结构由微米级和纳米级的结构组成[2],因此从仿生学的角度来讲,在种植体表面构建微/纳米梯度有序的表面,能更接近骨的仿生结构特点,提高种植体的骨结合率。本结果发现,经12.5 g/L HF酸蚀后的纯钛表面,在形成微米级结构的基础上还有纳米级结构的存在。这种微、纳米分层的结构使种植体表面更接近骨组织的特点。HF酸蚀除了影响种植体表面形貌以外,还对种植体表面原有的化学成分产生了一定的影响,经过HF酸蚀后,纯钛表面载入了氟元素。氟进入骨组织后能直接刺激成骨细胞增生,促进新骨形成,以充填破骨细胞吸收形成的陷窝,使骨小梁增厚,骨量增加。本结果显示,HF酸蚀后的钛片表面均载入一定的氟元素,随着HF酸蚀时间的增加,氟的含量由1.79%增加到1.81%,但氟元素的量与HF酸蚀的时间以及表面形貌无明显规律,可能由于表面粗糙度的差异,或与氟化物在纯钛表面沉积和结合的方式有关。
种植体的表面形貌对骨结合起重要作用,它不仅直接影响所吸附生物分子的种类、形态和构象,而且影响组织细胞的黏附、增殖、分化和基质的合成、钙化等一系列生理过程。本结果显示:HF酸蚀后的表面形成微/纳米结构,B组表面沟壑宽度约为0.5 μm,颗粒直径为20~40 nm,C组表面沟壑宽度为1.5~2.0 μm,颗粒直径为70~100 nm。有研究发现,当粗糙度值在0.5~2.0 μm时,不仅能够增加种植体-骨接触面积,而且能有效增加早期的种植体-骨界面的生物机械嵌合。体外实验提示,在1.50~3.62 μm 的种植体表面更利于成骨细胞附着生长,微米级涂层可增加种植体与周围骨组织的机械性结合并具有一定的生物学活性[2]。另外,当上皮基底膜的毛孔为70~100 nm,骨表面粗糙度约为32 nm时,可促进成骨基因如Runx2、ALP、骨涎蛋白在纳米级表面表达水平升高,同时IGF-2、BMP2、BMP6也有更强的表达[1],证实了纳米级涂层表面可明显增加新骨的形成以及种植体的骨结合率[3]。本结果显示,抛光组更加有利于细胞的伸展,可能是颗粒的高密度会促进细胞的伸展。细胞最初的伪足在100 nm左右,可能是C组伪足较多的一个原因。因此,种植体表面的纳米改性可更好的模拟细胞环境,促进细胞的黏附生长,微米结构可提供细胞、能量和营养物质的传输通道,微/纳米级结构对于提高骨整合均有其独特的优势,二者协同有助于更好地促进新骨形成[4]。
氟可以TiFx的形式存在,也可以更复杂的TiOxFy或TiFxOH形成存在[5]。氟离子渗透到钛表面形貌后,氟化物可作为储备发挥潜在的成骨作用,刺激成骨细胞的基因表达[6],提高骨整合。有学者认为,HF酸蚀后种植体表面的羟基化合物、氟化物、氢化物和氧化物的含量和存在形式,以及由其产生的微/纳米形貌综合影响生物细胞的生长和骨再生[7], HF处理后的种植体可促进种植体表面骨的快速生成。这其中氟元素是否起到了促进成骨的作用还需进一步研究。
细胞黏附作为良好骨整合的前提条件至关重要。材料表面良好的润湿性可以增加与细胞的接触机会[8]。当种植体植入体内后,首先与体液和组织细胞相接触。有学者发现,影响细胞黏附的蛋白在不同的润湿性表面有不同的量和结构[9]。另有研究发现,疏水性的材料表面和蛋白质表面促进蛋白吸附,这可能是亲水性表面互相吸附时需要置换掉表面吸附的水分子,比疏水性表面多了能量障碍[10]。本结果显示,酸蚀组有更好的亲水性且更加有利于细胞的黏附、增殖和ALP活性,细胞黏附作为细胞与种植材料相互作用的第一步,会影响细胞后期的增殖、分化和骨基质形成,C组表面细胞的增殖和ALP活性均高于B组,这可能与最初的细胞黏附有关,也可能间接受表面吸附蛋白的影响。
纯钛经12.5 g/L HF酸蚀后在载入氟元素的同时形成了微/纳米级的表面形貌,随着酸蚀时间的变化,会影响表面微/纳米形貌的尺寸,从而进一步影响表面黏附细胞的生物学活性。对于体内成骨的效果,以及能否通过改变HF酸蚀参数,进而找到一个最佳浓度和时间的范围,以实现更加有效的成骨作用,有待于进一步研究及探索。
[1]Monjo M, Lamolle SF, Lyngstadaas SP,etal. In vivo expression of osteogenic markers and bone mineral density at the surface offluoride-modified titanium implants [J].Biomaterials, 2008, 29(28): 3771-3780.[2]Kong DS. The influence of fluoride on the physicochemical properties of anodic oxide films formed on titanium surfaces [J].Langmuir, 2008, 24(10): 5324-5331.
[3]Dohan Ehrenfest DM, Coelho PG, Kang BS,etal. Classification of osseointegrated implant surfaces: material, chemistry and topography [J].TrendsBiotechnol, 2010, 28(4): 198-206.
[4]Shalabi MM, Gortemaker A, Van't Hof MA. Implant surface roughness and bone healing: a systematic review [J].JDentRes, 2006, 85(6): 496-500.
[5]Guo J, Padilla RJ, Ambrose W. The effect of hydrofluoric acid treatment of TiO2grit blasted titanium implants on adherent osteoblast gene expression in vitro and in vivo [J].Biomaterials, 2007, 28(36): 5418-5425.
[6]Ellingsen JE, Johansson CB, Wennerberg A. Improved retention and bone-to implant contact with fluoride-modified titanium implants [J].IntJOralMaxilloacImplants, 2004, 19(5): 659-666.
[7]于卫强.种植体表面纳米改性的研究进展[J]. 国际口腔医学杂志, 2008, 35(6): 665-668.
[8]Jimbo R, Coelho PG, Bryington M,etal. Nano hydroxyapatite-caoted implants improve bone nanomechanial properties [J].JDentRes, 2012, 91(12): 1172-1177.
[9]Klein MO, Bijelic A, Ziebart T,etal. Submicron scale-structured hydrophilic titanium surfaces promote earlyosteogenic gene response for cell adhesion and cell differentiation [J].ClinImplantDentRelatRes, 2013, 15(2): 166-175.
[10]Lamolle SF, Monjo M, Rubert M,etal. The effect of hydrofluoric acid treatment of titanium surface on nanostructural and chemical changes and the growth of MC3T3-E1 cells [J].Biomaterials, 2009, 30(5): 736-742.
Effects of hydrofluoric acid-treated titanium micro/nano surface on the biological activity of bone marrow mesenchymal stem cells
SHEN Ming- ming*, LI Yan- rong, QI Ya- ping, FU Qian, QIN Dong- ze, LIANG Jian- fei, ZHAO Yun- zhuan
(*DepartmentofOralandMaxillofacialSurgery,SchoolofStomatology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China)
AIM: To evaluate the effects of hydrofluoric (HF) acid- treated titanium surfaces on the biological activity of bone marrow mesenchymal stem cells (BMMSCs). METHODS: Titanium plates were divided into 3 groups, the suface of the samples was polished in group A, etched by 12.5 g/L HF acid for 1 min group B and etched by 12.5 g/L HF acid for 15 min Group C. The surface of the sample was observed by scanning electron microscopy (SEM). The suxface chemical composition was assessed by energy dispersive X- Ray spectroscopy detector (EDS). Contact angles were detected by drop method . BMMSCs adhesion and morphology were examined by confocal microscopy and SEM. Cell viability and ALP activity were assessed by MTT assay and ALP detection kit. RESULTS: Micro/nano-scale surface structures were formed after HF etching. The sample surfaces of group B and C were loaded with fluorine. Contact angle of etching groups was significantly smaller than that of polishing group. HF- treated titanium surfaces significantly promoted adhesion, proliferation and ALP activity of BMMSCs. Furthermore, the effects of group C was greater than those of group B. CONCLUSION: HF acid-etch may forme different size of micro/nano- scale structures and load with fluorineon on titanium surface; can improve the biological activity of BMMSCs.
HF; acid etching; micro/nano; surface modification; biological activity
2014-09-16;
2015-06-09
国家自然科学基金(81371186)
申明明(1986-),女,汉族,河北人。硕士生(导师:赵云转)
赵云转,E-mail:zhyzh2962@163.com
R780.2
A
1005-2593(2015)08-0472-06

