胆管上皮细胞TLR3内源性活化在原发性胆汁性肝硬化炎性损伤中的作用
蒋廷旺,熊怀民,张红星,许国华,许晔琼
(常熟市医学检验所,江苏常熟215500)
胆管上皮细胞TLR3内源性活化在原发性胆汁性肝硬化炎性损伤中的作用
蒋廷旺,熊怀民,张红星,许国华,许晔琼
(常熟市医学检验所,江苏常熟215500)
目的:研究内源性双链RNA活化人肝内胆管上皮细胞(human intrahepatic bi1iary epithe1ia1 ce11s,HiBEC)中To11样受体3(To11-1ike receptor 3,TLR3)引起的凋亡及其信号通路变化。方法:体外培养HiBEC,同时通过反复冻融制备坏死的HiBEC。TLR3活化组:将死亡细胞与活细胞共同培养6 h;对照组:以核酸酶处理过的坏死细胞与活细胞共培养,每组设3复孔。以Annexin V/PI测定细胞凋亡率,同时以JC-1荧光探针测定细胞线粒体膜电位。荧光定量PCR法检测TLR3和β干扰素To11样受体结构域衔接蛋白(To11-inter1eukin 1 receptor domain-containing adaptor inducing interferon-β,TRIF)的表达量,同时以流式细胞术测定Caspase-3的活性。结果:TLR3活化组的HiBEC经内源性活化后,凋亡率为(33.32±2.39)%,明显高于通过RNA酶处理后的对照组[(2.83±0.53)%,P<0.001);线粒体膜电位检测结果表明,TLR3活化组的HiBEC经内源性活化后,表达绿色荧光的细胞比例明显增加,均值为(34.75± 6.54)%,明显高于RNA酶处理后的对照组[(3.21±1.24)%,P<0.001);定量PCR分析发现TLR3活化组的TLR3和TRIF mRNA相对表达量分别为3.75±0.22和4.05±0.14,均明显高于对照组(分别为0.98±0.05和1.03±0.07,P<0.001);流式细胞术检测结果显示,TLR3活化组细胞Caspase-3的平均表达量为(27.1±3.5)%,明显高于RNA酶处理组[(8.5±2.1)%,P<0.001)。结论:内源性双链RNA可以通过活化TLR3诱导HiBEC凋亡,可能在原发性胆汁性肝硬化的炎性损伤过程中发挥重要作用。
原发性胆汁性肝硬化;胆管上皮细胞;To11样受体3;内源性
原发性胆汁性肝硬化(primary bi1iary cirrhosis,PBC)的早期病理改变为肝内胆管上皮细胞(human intrahepatic bi1iary epithe1ia1 ce11s,HiBEC)周围的炎性细胞浸润,随着疾病的进展,肝内小胆管进行性消失,最终引起肝硬化和肝衰竭[1]。一直以来众多学者始终将HiBEC在PBC中作为一个被动的“受害者”看待,仅注意到自身反应性T细胞、NK细胞等直接效应作用导致HiBEC的凋亡[2],忽视了其主动参与免疫调节的能力。胆管上皮细胞可以表达多种To11样受体(To11 1ike receptor,TLR)及黏附分子,并通过分泌细胞因子、趋化因子等参与炎症反应的免疫调节[3]。但是HiBEC在PBC中具有怎样的调节作用尚缺乏相关研究。
TLR是一类介导天然免疫的跨膜信号传递受体家族,在细胞活化信号的转导中发挥重要作用,是联系天然免疫与适应性免疫的桥梁[4]。近年来,研究表明TLR介导的天然免疫在PBC的HiBEC炎性损伤过程中同样具有重要意义[5-6]。TLR3是TLR家族中的重要成员,不仅在宿主抗病毒过程中具有重要作用,而且还与一些自身免疫病的发生存在密切关系。双链RNA(doub1e-stranded RNA,dsRNA)是TLR3所识别的病原相关分子模式(pathogen-associated mo1ecu1ar patterns,PAMP),多种病毒在复制期间可以产生大量的dsRNA,因此,TLR3可以作为机体抗病毒的重要防线。然而,近期的研究发现坏死细胞释放的RNA或体外转录产生的mRNA同样可以活化TLR3,提示体内坏死组织释放的RNA可以作为TLR3的内源性配体启动或调节免疫应答[7-8]。由于大部分自身免疫病并未发现与病毒感染具有直接联系,因此,内源性配体对TLR3的活化在自身免疫病的发病机制中可能具有更为重要的意义。
为此,我们通过反复冻融HiBEC模拟PBC中坏死的胆管上皮细胞,并以其释放的内源性dsRNA活化其他HiBEC的TLR3,观察HiBEC在此过程中的凋亡及其信号通路变化。
1 材料与方法
1.1 材料
HiBEC(Science11公司,美国),胎牛血清、RPMI 1640培养基(Hyc1one公司,美国),谷氨酰胺、Benzonase核酸酶(Sigma公司,美国),线粒体膜电位检测试剂盒、细胞固定/破膜液、Caspase-3抗体(BD bioscience公司,美国),RNA提取试剂盒(Qiagen公司,美国),Annexin V/PI(Bender MedSystems,澳大利亚)。FACSCa1ibur流式细胞仪(BD公司,美国),PCR分析仪(ABI公司,美国),超净工作台(苏州净化设备厂);细胞培养箱(BeckMan公司,美国)。
1.2 方法
1.2.1 HiBEC的培养及内源性活化 将HiBEC在37℃,5%CO2条件下培养于RPMI 1640完全培养基中(10%胎牛血清,50 μg/mL青霉素,2 mmo1/L谷氨酰胺,10 mmo1/L HEPES)。坏死细胞的制备参考文献[7]中的方法,即将一定数目的HiBEC反复冻融4次后制备死亡细胞。将死亡细胞与培养的HiBEC按照2∶1的比例,在4℃条件下共同孵育6 h,作为TLR3活化组;以Benzonase核酸酶处理的死亡细胞和HiBEC共培养作为对照组,每组设3个复孔。再次37℃,5%CO2培养36 h。
1.2.2 流式细胞术检测HiBEC的凋亡率 收集细胞,预冷PBS洗涤后以结合缓冲液[50 mmo1/L三羟甲基氨基甲烷(Tris),100 mmo1/L NaC1,1%BSA,0.02%叠氮化钠,pH 7.4)重悬细胞并调节细胞密度至5×105/mL;195 μL细胞悬液中加入5 μL Annexin-V,室温放置10 min;洗涤后再以190 μL结合缓冲液重悬,加入10 μL 20 μg/mL PI;流式细胞仪测定细胞凋亡率,Annexin V-/PI+、Annexin V+/ PI-、Annexin V+/PI+分别表示死细胞、早期凋亡细胞和晚期凋亡细胞。
1.2.3 线粒体膜电位分析 收集培养的细胞以预冷的PBS洗涤后,重悬至1×106/mL;每个15 mL离心管中加入1 mL细胞悬液,室温400×g离心5 min,弃上清;每管加入0.5 mL新鲜配制的JC-1工作液,充分混匀后置于37℃的CO2培养箱孵育15 min;按照以下步骤洗涤细胞2次:第1次,每管加2 mL 1×分析液,轻轻振荡悬浮细胞并使其分散,以免聚集成块。400×g,室温离心5 min,弃上清;第2次,每管加1 mL1×分析液,振荡或用枪头使细胞悬浮分散,以免聚集成块。400×g,室温离心5 min,弃上清;每管加0.5 mL 1×分析液,轻轻悬浮细胞,以流式细胞仪进行检测分析。绿色荧光说明线粒体膜电位下降,细胞很可能处于凋亡早期;红色荧光说明线粒体膜电位正常,细胞未发生凋亡,用红绿荧光的相对比例来表示细胞膜电位变化。
1.2.4 定量PCR检测HiBEC中TLR3、β干扰素To11样受体结构域衔接蛋白(To11-inter1eukin 1 receptor domain-containing adaptor inducing interferonβ,TRIF)mRNA的表达 收集各组细胞,抽提细胞总RNA,根据基因库中人TLR3、TRIF和β-肌动蛋白的mRNA序列合成引物,以SYBR-Green法定量分析上述基因表达。TLR3上游引物:5′-TGAGTTAGATATGCGCTTTA-3′,下游引物:5′-TCAGGGATGTTGGTATGG-3′;TRIF上游引物:5′-CAAGCCGTGCCCACCTACT-3′,下游引物:5′-TGTTCCGATGATGATTCCAG-3′;β-肌动蛋白上游引物:5′-GAAATCTGTCAAAGTTCA-3′,下游引物:5′-AGGCAGCTCGTAGCTCTT-3′。将总RNA反转录为cDNA,反应条件:25℃10 min、48℃30 min、95℃5 min。在ABI Prism7000定量PCR仪上进行扩增,读取阈循环值(thresho1d cyc1e,Ct),根据公式:ΔCt=目的基因Ct-内参基因Ct和ΔΔCt=研究组ΔCt-对照组ΔCt,计算出2-ΔΔCt。
1.2.5 流式细胞术检测Caspase-3活性 按照每个测试样本加入100 μL Perm/Wash缓冲液和20 μL抗体,计算抗体和Perm/Wash缓冲液用量。根据用量制备Perm/Wash缓冲液(1×),将10×浓度缓冲液使用蒸馏水进行10倍稀释;用冷PBS缓冲液洗细胞2次,再用细胞固定/破膜液调整细胞密度为1×106/0.5 mL;细胞冰浴20 min;离心,弃上清;室温下,使用1×Perm/Wash缓冲液洗细胞2次,Perm/Wash缓冲液的用量为每1×106细胞0.5 mL;按样本数加入1×Perm/Wash缓冲液和抗体,混匀,室温反应30 min;每管用1.0 mL1×Perm/Wash缓冲液洗细胞1次,再用0.5 mL的1×Perm/Wash缓冲液制成细胞悬液,应用流式细胞仪检测Caspase-3活性。
1.3 统计学分析
应用SPSS 17.0软件进行统计分析,所有资料均为计量资料,采用两样本等方差t检验进行比较,P<0.05表示差异有统计学意义。
2 结果
2.1 内源性RNA诱导HiBEC凋亡
HiBEC与反复冻融后的细胞裂解液共培养后的凋亡率为(33.32±2.39)%,而通过RNA酶处理后的对照组凋亡率为(2.83±0.53)%,两组间差异有统计学意义(t=21.62,P<0.001)。见图1。
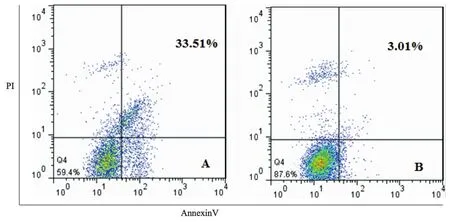
A:TLR3活化组;B:RNA酶处理组图1 内源性RNA诱导HiBEC凋亡
2.2 线粒体膜电位
流式细胞术检测结果显示,TLR3活化组HiBEC线粒体膜电位发生明显改变,表达绿色荧光的细胞比例明显增加,平均为(34.75±6.54)%,明显高于RNA酶处理后的对照组[(3.21±1.24)%],两组间差异有统计学意义(t=17.21,P<0.001)。
2.3 两组细胞TLR3和TRIF mRNA的表达水平
定量PCR分析结果显示,TLR3活化组细胞的TLR3 mRNA和TRIF mRNA相对表达量分别为3.75± 0.22和4.05±0.14,明显高于RNA酶处理后的对照组[TLR3 mRNA为0.98±0.05,t=17.56,P<0.001;TRIF mRNA为1.03±0.07,t=28.86,P<0.001)]。
2.4 各组细胞Caspase-3的活性
流式细胞术检测结果显示,TLR3活化组细胞Caspase-3阳性率为(27.1±3.5)%,明显高于对照组[(8.5±2.1)%,t=6.56,P<0.001)]。见图3。

图3 HiBEC体外作用后Caspase-3的活化
3 讨论
TLR3在PBC及其他胆汁淤积相关疾病中的作用近年来备受关注。Shimoda等[9]通过分离PBC患者肝组织单个核细胞、单核细胞、NK细胞及胆管上皮细胞进行体外实验,发现TLR3与TLR4共同作用下,NK细胞对HiBEC的杀伤作用明显增强。但是该研究并未说明HiBEC是否主动参与及如何参与PBC的炎性损伤过程。Harada等[10]通过分离胆汁淤积患者HiBEC进行po1yIⅠ:C体外诱导实验,证实po1y:C可以明显上调胆管上皮细胞表面肿瘤坏死因子凋亡相关配体(TRAIL)的表达,并促进Hi-BEC的凋亡。我们前期将po1yI:C注射到C57BL/6小鼠腹腔,在国内率先建立了PBC小鼠模型;发现16周后小鼠肝内汇管区出现明显的炎性细胞浸润,同时血清出现抗线粒体抗体、抗核抗体等自身抗体[11]。我们的研究结果提示,po1yI:C活化的TLR3信号途径可能在PBC的病理改变及疾病进程中具有重要作用。然而,po1yI:C是一种模拟dsRNA的外源性TLR3活化物质,PBC患者体内是否能够产生内源性dsRNA同样活化TLR3参与炎症反应?
为此,我们在体外通过反复冻融制备坏死的HiBEC,然后与正常HiBEC共培养,发现HiBEC出现明显的凋亡。由于线粒体膜电位降低是细胞发生凋亡的标志性事件,因此为了进一步验证其凋亡作用,本研究进一步分析了细胞膜电位,发现TLR3活化组细胞的膜电位明显降低,且改变比例与凋亡结果相符合。HiBEC是PBC病理改变最早侵犯的组织细胞,这一结果说明在PBC患者肝组织出现病变后,HiBEC发生坏死或凋亡所释放的内源性RNA可以通过TLR3途径进一步活化周边正常上皮细胞,促进炎症反应,进而导致PBC病情恶化。国外多项研究表明,坏死细胞提取物可通过TLRs活化树突状细胞,促进其表型改变及细胞因子的分泌[7]。然而对于HiBEC是否存在类似的生物学效应目前尚不明确,我们的研究证实了该作用的存在。
大量的研究表明,TLR3除通过诱导产生多种细胞因子参与免疫调节之外,还可以直接诱导细胞凋亡。TLR3有两条信号通路,一条是髓样细胞分化因子88(MyD88),另一条是TLR3独有的MyD88非依赖信号通路。通过MyD88信号通路可以激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和NK-κB,最终引起TNF-α、IL-6等细胞因子的表达,参与炎症反应。MyD88非依赖性信号通路是通过TIR区域的调节分子1(也称为TRIF)传递信号,通过活化IFN调节因子3(IRF3)诱导产生IFN-β[12]。本研究结果显示,TLR3活化组HiBEC的TLR3和TRIF mRNA表达量均明显增加,更加明确了HiBEC的凋亡和线粒体膜电位的改变是由TLR3通路引起的,并且该通路是通过MyD88非依赖途径,经由TRIF信号分子进行下游活化,进而导致细胞凋亡和膜电位变化。
Caspase-3是早期凋亡信号通路中的关键分子,产生时以非活化的前体形式存在,当凋亡发生时,经其他蛋白酶水解后转化为有活性的Caspase-3。我们以流式细胞术分析其生物活性,发现经死亡Hi-BEC作用后,表达Caspase-3的细胞明显增加,而对照组则没有明显改变。这证明TLR3内源性活化引起的凋亡是通过Caspase-3途径完成的,进一步明确了凋亡发生的信号途径。
综上,本研究证实了PBC患者的胆管上皮细胞受损后释放的内源性RNA可通过活化其他正常细胞TLR3促进炎症反应,该作用主要表现为诱导凋亡,而且凋亡的发生是通过MyD88非依赖途径完成。这对进一步明确PBC发病机制及其今后的生物治疗具有提示意义。
[1] L1eo A,Shimoda S,Ishibashi H,et a1.Primary bi1iary cirrhosisandautoimmunehepatitis:apotopesand epitopes[J].J Gastroentero1,2011,46(Supp1 1):29-38.
[2] Jones DE.Pathogenesis of primary bi1iary cirrhosis[J]. Gut,2007,56(11):1615-1624.
[3] Chen XM,O′Hara SP,LaRusso NF.The immunobio1ogy of cho1angiocytes[J].Immuno1 Ce11 Bio1,2008,86(6):497-505.
[4] Kondo T,Kawai T,Akira S.Dissecting negative regu1ation of To11-1ike receptor signa1ing[J].Trends Immuno1,2012,33(9):449-458.
[5] Berg PA.The ro1e of the innate immune recognition system in the pathogenesis of primary bi1iary cirrhosis:a conceptua1 view[J].Liver Int,2011,31(7):920-931.
[6] Se1mi C,Mackay IR,Gershwin ME.The autoimmunity of primary bi1iary cirrhosis and the c1ona1 se1ection theory[J].Immuno1 Ce11 Bio1,2011,89(1):70-80.
[7] Karikó K,Ni H,Capodici J,et a1.mRNA is an endogenous 1igand for To11-1ike receptor 3[J].J Bio1 Chem,2004,279(13):12542-12550.
[8] Cavassani KA,Ishii M,Wen H,et a1.TLR3 is an endogenous sensor of tissue necrosis during acute inf1ammatory events[J].J Exp Med,2008,27,205(11):2609-2621.
[9] Shimoda S,Harada K,Niiro H,et a1.Interaction between To11-1ike receptors and natura1 ki11er ce11s in the destruction of bi1e ducts in primary bi1iary cirrhosis[J].Hepato1ogy,2011,53(4):1270-1281.
[10] Harada K,Sato Y,Itatsu K,et a1.Innate immune response to doub1e-stranded RNA in bi1iary epithe1ia1 ce11s is associated with the pathogenesis of bi1iary atresia[J]. Hepato1ogy,2007,46(4):1146-1154.
[11] Jiang T,Han Z,Chen S,et a1.Resistance to activation-induced ce11 death and e1evated FLIPL expression of CD4+T ce11s in a po1yI:C-induced primary bi1iary cirrhosis mouse mode1[J].C1in Exp Med,2009,9(4):269-276.
[12] Yamamoto M,Sato S,Hemmi H,et a1.Ro1e of adaptor TRIF in the MyD88-independent to11-1ike receptor signa-1ing pathway[J].Science,2003,301(5633):640-643.
Roles of endogenous activation of TLR3 in primary biliary cirrhosis
JIANG Ting-wang,XI0NG Huai-min,ZHANG Hong-xing,XU Guo-hua,XU Ye-qiong
(Changshu Municipa1 Institution for Laboratory Medicine,Changshu Jiangsu 215500,China)
Objective:To investigate apoptosis induced by endogenous doub1e-stranded RNA(dsRNA)activating TLR3 and the fo11owing signa1 pathway in human intrahepatic bi1iary epithe1ia1 ce11s(HiBEC). Methods:HiBEC were cu1tured in vitro,and necrotic ce11s were prepared by freeze-thawing the ce11s four times.HiBEC were co-cu1tured with necrotic ce11s in TLR3-activation group for 6 h.Necrotic ce11s incubated with Benzonase were used as contro1s.Ce11s apoptosis was determined by using annexin V/PI.Changes of mitochondria1 membrane potentia1 were assayed by JC-1.TLR3 and To11-inter1eukin 1 receptor domaincontaining adaptor inducing interferon-β(TRIF)were ana1yzed by qPCR.Activity of Caspase-3 in HiBEC was ana1yzed by f1ow cytometry.Results:Percentages of apoptotic HiBEC in TLR3-activation and contro1 group were(33.32±2.39)%and(2.83±0.53)%,respective1y(P<0.001).Ratio of HiBEC with green f1uorescence in TLR3-activation group was(34.75±6.54)%,obvious1y higher than that in contro1 group[(3.21±1.24)%,P<0.001)].Re1ative expression of TLR3 and TRIF mRNA were 3.75±0.22 and 4.05±0.14 in TLR3-activation group,0.98±0.05 and 1.03±0.07 in contro1 group(P<0.001). The average Caspase-3 expression in TLR3-activation group was(27.1±3.5)%,more than that in contro1 group(8.5±2.1)%(P<0.001).Conclusion:Endogenous RNA cou1d induce HiBEC apoptosis by acti-vating TLR3 pathway,which may p1ay important ro1es in porta1 inf1ammation in primary bi1iary cirrhosis.
primary bi1iary cirrhosis;bi1iary epithe1ia1 ce11s;To11-1ike receptor 3;endogenous
R575.2
A
1671-7783(2015)06-0472-05
10.13312/j.issn.1671-7783.y150182
2015-08-24 [编辑] 陈海林
国家863计划资助项目(2014AA022304);常熟市科技发展计划社会发展项目(CS201313)
蒋廷旺(1981—),男,江苏新沂人,助理研究员,博士,主要从事自身免疫性肝病、病毒性肝炎的发病机制及实验室诊断研究。

