超高效液相色谱-串联质谱法检测棉花和土壤中呋虫胺残留
张雯雯,徐 军,张 盈,董丰收,刘新刚,郑永权*
(1. 东北农业大学农学院,哈尔滨 150030;2.中国农业科学院植物保护研究所,农业部作物有害生物综合治理重点实验室,北京 100193)
超高效液相色谱-串联质谱法检测棉花和土壤中呋虫胺残留
张雯雯1,2,徐 军2,张 盈2,董丰收2,刘新刚2,郑永权2*
(1. 东北农业大学农学院,哈尔滨 150030;2.中国农业科学院植物保护研究所,农业部作物有害生物综合治理重点实验室,北京 100193)
在QuEChERS方法基础上,建立了棉花和土壤中呋虫胺残留的超高效液相色谱-串联质谱(UPLC-MS/MS)快速检测分析方法。方法选用乙腈为提取剂,N-丙基乙二胺(PSA)和石墨化炭黑(GCB)为净化剂,外标法定量。添加回收试验结果表明,不同添加浓度的呋虫胺(0.01、0.05和0.5 mg/kg)在棉花植株、棉籽和土壤中的平均回收率为80.9%~107.5%,变异系数为3.3%~10.3%,定量限(LOQ)分别为4.81、3.41和 2.26 μg/kg。呋虫胺在棉花植株上的消解动态表明,呋虫胺在河南省和山东省两地棉花植株中的降解半衰期分别为1.9 d和1.2 d。
呋虫胺; 棉花; 土壤; 残留; UPLC-MS/MS
棉花被誉为纺织业的“白金”,是重要的纤维作物,在110多个国家商业化种植[1]。棉花害虫猖獗,每年我国棉花虫害造成的经济损失高达60亿元。呋虫胺是第三代新烟碱类杀虫剂,主要作用于烟碱乙酰胆碱受体[2],可以有效防治棉蚜、麦蚜和棉绿盲蝽等农业害虫。呋虫胺的使用可能会污染农田和地下水以及在植物体中累积[3-4]。美国和日本制定呋虫胺在棉籽上的最大残留限量值(MRL)是0.4 mg/kg。我国尚未制定呋虫胺在棉籽上的MRL值,因此研究呋虫胺在棉花上的残留分析方法对该药在我国的残留限量标准的制定以及环境污染监测具有重要意义。
目前有关呋虫胺的残留检测主要集中在果蔬、谷物等食品上。李立等采用石墨化非多孔碳柱(Envi-Carb)/酰胺丙基甲硅烷基硅胶柱(LC-NH2)净化,高效液相色谱-串联质谱(HPLC-MS/MS)测定鱼肉等食品中的呋虫胺的残留量[5];谢文等采用活性炭-Oasis(HLB)柱净化, HPLC-MS/MS检测茶叶上的呋虫胺[6];Liu等采用固相萃取(SPE HLB)净化,超高效液相色谱-串联质谱(UPLC-MS/MS)检测茶叶和水稻上的呋虫胺[7];Zhang等采用分散固相萃取(QuEChERS)法净化,UPLC-MS/MS检测了果蔬等食品上的呋虫胺[8]。然而,关于呋虫胺在棉籽、棉花植株和土壤上的残留分析方法国内外至今尚未见报道。
固相萃取(SPE)前处理技术可很好地使目标化合物与杂质分离,其缺点是溶剂损耗大,步骤繁琐,易造成环境的二次污染[9]。分散固相萃取(QuEChERS)法不但避免了这些弊端,而且与质谱检测结合表现出高选择性、高灵敏度和分析范围广等优点[10-11]。LC-MS/MS 是农药残留定性、定量分析的有效手段。然而,UPLC (色谱填料直径<2 μm)的检测灵敏度是HPLC的2~3倍,使色谱峰容量和分离速度达到新的极限[12]。因此,UPLC-MS/MS 是农药在各种复杂基质中残留检测的更有效的手段。
本文首次在QuEChERS方法的基础上,建立了UPLC-MS/MS快速检测呋虫胺在棉籽、棉花植株和土壤中的残留分析方法,并应用该方法进一步研究了20%呋虫胺可溶粒剂在棉花植株上的残留消解动态,为呋虫胺的科学合理使用提供重要依据。
1 材料与方法
1.1 仪器和试剂
超高效液相色谱-三重四极杆串联质谱联用仪(ACQUITY UPLC-TQD,美国Waters 公司);ACQUITY UPLC BEH HILIC 色谱柱(2.1×50 mm,1.7 μm;Milford,MA,USA);XW-80A漩涡混合器(美国Scientific industries公司);离心机-L550 (湖南湘仪离心机仪器有限公司);氮吹仪(N-EVAP-112, 41 cm×38 cm×84 cm,美国Organomation公司)。
呋虫胺标准品(纯度,99.0%)及20%呋虫胺可溶粒剂(SG)由日本三井化学公司提供;色谱纯乙腈购自美国Honeywell International公司; C18(40 μm)、N-丙基乙二胺(PSA,40 μm)和石墨化炭黑(GCB,40 μm)购自天津博纳艾杰尔科技有限公司;乙腈、NaCl 和无水MgSO4均为分析纯。
1.2 田间试验设计
参照《农药残留试验准则》(NY/T788-2004),于2012年分别在河南省沁阳市柏香乡和山东省潍坊市昌乐县朱刘镇进行20%呋虫胺可溶粒剂在棉花植株上的残留消解动态试验。设6个试验区,其中3个为药剂处理区,3个为空白对照区,每小区面积30 m2,随机排列,小区之间设置保护带。在棉花盛叶期喷施药剂1次,制剂量60 g/667 m2(有效成分,180 g/hm2),对照区喷水。采样时间设置如下:施药前、施药后2 h、1、3、5、7、10 和14 d。随机采集棉花植株样品1.0 kg,切碎混匀,缩分后留样300 g,-20 ℃低温冷冻保存待测。
1.3 分析步骤
标准品的配制:将100 mg/L的呋虫胺标准溶液用色谱纯乙腈稀释配得0.01、0.05、0.1、0.5、1.0 mg/kg 一系列浓度的溶剂标准溶液。相应的基质匹配标准溶液浓度系列(0.01、0.05、0.1、0.5、1.0 mg/L)用对照提取液稀释。所有溶液于-20 ℃保存待用。经进样测试,标准溶液3个月未降解。
样品前处理方法:称取5 g均质后的样品(土壤10 g)加到50 mL聚四氟乙烯离心管中,加5 mL超纯水和10 mL乙腈,涡旋提取3 min,然后加1 g NaCl和 4 g无水MgSO4,迅速涡旋1 min,再以5 000 r/min 离心5 min后,移取1.5 mL上清液(乙腈层)加入装有净化剂(土壤和棉籽的净化剂为50 mg PSA+150 mg 无水MgSO4,棉花植株的净化剂为50 mg PSA+10 mg GCB+150 mg 无水MgSO4)的2 mL微型离心管中,涡旋振荡30 s,再以5 000 r/min离心5 min,吸取上清液过有机滤膜(0.22 μm)到进样小瓶中, 于-20 ℃贮存待测。
1.4 检测条件
色谱柱:ACQUITY UPLC BEH HILIC柱,柱温45 ℃。以水和甲醇为流动相,梯度洗脱条件为:0~0.1 min,10%~45%甲醇;0.1~1.0 min,45%甲醇;1.0~3.0 min,45%~90%甲醇;3.0~3.5 min,90%甲醇;3.5~3.6 min,90%~10%甲醇;3.6~5.0 min,10%甲醇。流速0.30 mL/min,进样量5 μL。
以上案例证实手机对中学生成长的危害是极其严重的,虽然这些都是个例,但至少表明手机或多或少对中学生的学习与身心健康造成一定的影响,下面我来说说中学生在校园玩手机的危害:
质谱条件为:电喷雾离子源,正离子电离模式(ESI+)。毛细管电压3.0 kV, 离子源温度120 ℃,去溶剂气温度 350 ℃,锥孔反吹气50 L/h,去溶剂气流量为600 L/h。锥孔电压20 V采用多反应检测模式(MRM)。以保留时间和两个离子对信息比较进行定性分析,以母离子和响应值最高的子离子组成的离子对进行定量分析。其中,定性离子对为203>129(碰撞电压13 eV)和203>113(碰撞电压15 eV),定量离子对为203>129。呋虫胺的保留时间1.34 min。
2 结果与分析
2.1 检测条件的优化
将1 mg/kg 呋虫胺标准溶液以扫描范围100~500 m/z直接进样,选择合适的离子源。优化最终选择条件如1.4节所示,在电喷雾离子源、正离子电离模式下呋虫胺有较好的电离效果并获得特征离子峰[M+H]。进一步选择合适的监测离子和碰撞能量等质谱参数。结果证明,当锥孔电压20 V,定性离子对为203>129(碰撞电压13 eV)和203>113(碰撞电压15 eV),定量离子对为203>129时,峰形及其重现性较好,灵敏度较高。棉花植株色谱图见图1。

图1 呋虫胺在棉花植株中的色谱Fig.1 Chromatogram of dinotefuran in cotton plants
2.2 净化剂的选择
样品净化过程首先考察了C18和PSA两种典型的净化剂。C18可以从极性样品中提取非极性和中极性化合物,主要用于反相萃取;PSA有较弱的阴离子交换功能,可去除非极性样品中有机酸、极性色素、糖类和脂肪,主要用于正相萃取[13]。呋虫胺(0.05 mg/kg)在棉花植株、棉籽和土壤基质中的添加回收试验结果证明,样品用20 mg C18净化时呋虫胺在各基质中的平均回收率均小于63%,不能满足残留分析的要求;选用50 mg PSA净化时,呋虫胺在棉花和土壤中均能获得满意的回收率,但棉花植株提取液颜色很深。棉花植株基质中色素等杂质较多,批量进样会缩短仪器寿命,GCB是一种弱极性或非极性吸附剂,可以去除疏水性化合物如叶绿素和类胡萝卜素等杂质,所以选用50 mg PSA和10 mg GCB净化棉花植株样品。结果发现,用50 mg PSA和10 mg GCB净化时,呋虫胺在棉花植株中能获得满意的回收率,且待测样品溶液的颜色明显变浅。因此,土壤和棉籽选用PSA做净化剂,棉花植株样品选用PSA和GCB做净化剂。
2.3 方法的线性相关性、准确度、精确度及灵敏度
通过检测溶剂和基质中一系列浓度(0.01、0.05、0.1、0.5、1.0 mg/L)的呋虫胺标准品绘制的曲线来评估方法的线性相关性。在0.01~1.00 mg/L范围内呋虫胺在溶剂和所有基质中的检测反应呈线性关系(r2≥0.999)。通过基质匹配标准溶液与溶剂标准溶液的斜率比得到基质效应,斜率比在90%~110%之间,可视为无基质效应;上下波动范围在20%以内视为较弱的基质效应。由表1可知,呋虫胺在棉籽、棉花植株和土壤中基质效应呈现减弱现象,属于较弱的基质效应。为了获得较真实的残留数据,我们选择基质标准曲线来计算田间实际样品的浓度。以呋虫胺的质量浓度为横坐标,以其相应的峰面积为纵坐标作图,由最小二乘法拟合获得线性回归方程。溶剂标准曲线及基质标准曲线的相关参数见表1。

表1 溶剂标准曲线和基质标准曲线(0.01~1 mg/kg)相关参数的比较
分别采用添加回收率和相应的变异系数来衡量方法的准确度和精密度。在3个水平(0.01、0.05、0.5 mg/kg)上进行呋虫胺的添加回收试验,每个水平5次重复。由表2结果可知,呋虫胺在棉花植株、棉籽和土壤中的平均回收率范围是80.9%~107.5%,变异系数是3.3%~10.3%,符合残留量测定的要求[15]。
方法的检出限LOD和定量限LOQ分别以添加回收试验的最低添加水平0.01 mg/kg的色谱图中噪音信号(S/N)的3倍和10倍确定,得出呋虫胺在棉花植株、棉籽和土壤中的LOD分别是1.44、 1.02和0.67 μg/kg,LOQ 分别是4.81、3.41和2.26 μg/kg。

表2 棉籽、棉花植株和土壤中3个添加水平呋虫胺的平均回收率和变异系数
2.4 呋虫胺在棉花植株中的消解动态
田间消解动态试验结果显示,施药后呋虫胺在河南和山东两地棉花植株上的原始沉积量分别为5.880 mg/kg和7.594 mg/kg。随时间的延长在棉花植株中呋虫胺的残留量逐渐下降。呋虫胺在棉花上的消解动态曲线见图2。棉花植株中呋虫胺的残留浓度与施药后间隔时间的关系符合一级动力学方程,C=AeB t。呋虫胺在棉花植株中消解动态方程和相关参数见表3。由表3可得,呋虫胺在河南和山东两地棉花植株中的半衰期分别是1.9 d和1.2 d。
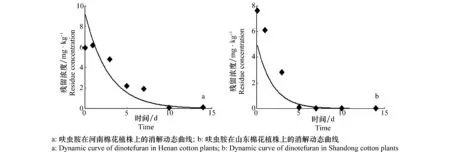
图2 呋虫胺在棉花植株上的消解动态曲线Fig.2 Dynamic curves of dinotefuran in cotton plants

基质Matrix地点Location回归方程(y=)Regressionequation相关系数(r)Coefficientofcorrelation半衰期/dHalf⁃lives棉花植株Cottonplant河南Henan9.445e-0.360x0.9031.9山东Shandong7.058e-0.611x0.9401.2
3 结 论
在QuEChERS方法基础上,建立了采用超高效液相色谱-串联质谱(UPLC-MS/MS)检测棉花和土壤中的呋虫胺残留的分析方法。结果表明该方法杂质干扰小,表现良好的线性、准确性、精确性和较低的检测限。呋虫胺在棉花植株、棉籽和土壤中的平均回收率是80.9%~107.5%,变异系数是3.3%~10.3%,LOD分别是1.44、1.02 和0.67 μg/kg,LOQ分别是4.81、3.41和2.26 μg/kg。20%呋虫胺可溶粒剂在棉花植株中的消解动态表明,呋虫胺在河南省和山东省棉花植株中的半衰期分别是1.9 d和1.2 d。
[1] Honda H, Tomizawa M, Casida J E. Insect nicotinic acetylcholine receptors: neonicotinoid binding site specificity is usually but not always conserved with varied substituents and species [J]. Journal of Agricultural and Food Chemistry, 2006, 54(9): 3365-3371.
[2] Corbel V, Duchon S, Zaim M, et al. Dinotefuran: A potential neonicotinoid insecticide against resistant mosquitoes [J]. Journal of Medical Entomology, 2004, 41(4): 712-717.
[3] Jiries A G, Al Nasir F M, Beese F. Pesticide and heavy metals residue in wastewater, soil and plants in wastewater disposal site near Al-Lajoun Valley, Karak/Jordan [J]. Water, Air, and Soil Pollution, 2002, 133(1-4): 97-107.
[4] Yu Y, Zhou Q X. Adsorption characteristics of pesticides methamidophos and glyphosate by two soils [J]. Chemosphere, 2005, 58(6): 811-816.
[5] 李立,付建,初玉圣,等.食品中呋虫胺残留量的HPLC-MS/MS检测方法研究[J].食品科学,2008,29(11):538-540.
[6] 谢文,钱艳,丁慧瑛,等.液相色谱-电喷雾电离三级四级杆质谱法测定茶叶中6种烟碱类农药残留[J].分析化学,2009,37(4):495-499.
[7] Liu S Y, Zheng Z T, Wei F L, et al. Simultaneous determination of seven neonicotinoid pesticide residues in food by ultraperformance liquid chromatography tandem mass spectrometry [J]. Journal of Agricultural and Food Chemistry,2010,58(6):3271-3278.
[8] Zhang Y, Xu J, Dong F S,et al. Simultaneous determination of four neonicotinoid insecticides residues in cereals, vegetables and fruits using ultra-performance liquid chromatography/tandem mass spectrometry [J]. Analytical Methods, 2013,5(6): 1449-1455.
[9] Liu X G, Wang X, Xu J,et al. Determination of tebuconazole, trifloxystrobin and its metabolite in fruit and vegetables by a Quick, Easy, Cheap, Effective, Rugged and Safe (QuEChERS) method using gas chromatography with a nitrogen-phosphorus detector and ion trap mass spectrometry [J]. Biomedical Chromatography, 2011,25(10): 1081-1090.
[10]盛宇,徐军,刘新刚,等. 分散固相萃取-超高效液相色谱-串联质谱法快速检测棉花和土壤中氟铃脲的残留[J]. 农药学学报, 2010, 12(3): 294-298.
[11]Zhang W W, Xu J, Dong F S, et al. Simultaneous determination of three strobilurin fungicide residues in fruits, vegetables and soil by a modified quick, easy, cheap, effective, rugged (QuEChERS) method coupled with gas chromatography-tandem mass spectrometry [J]. Analytical Methods,2013(5):7102-7109.
[12]Chandra-hioe M V, Bucknall M P, Arcot J. Folate analysis in foods by UPLC-MS/MS: development and validation of a novel, high throughput quantitative assay; folate levels determined in Australian fortified breads [J]. Analytical and Bioanalytical Chemistry, 2011, 401(3): 1035-1042.
[13]Liu X G, Xu J, Dong F S, et al. Residue analysis of four diacylhydrazine insecticides in fruits and vegetables by Quick, Easy, Cheap, Effective, Rugged, and Safe (QuEChERS) method using ultra-performance liquid chromatography coupled to tandem mass spectrometry [J]. Analytical and Bioanalytical Chemistry, 2011, 401(3): 1051-1058.
[14]农业部农药检定所.农药残留实用检测方法手册(第三卷)[M].北京:中国农业出版社,2005:385-387.
Determination of dinotefuran residues in cottons and soils using UPLC-MS/MS
Zhang Wenwen1,2, Xu Jun2, Zhang Ying2, Dong Fengshou2, Liu Xingang2, Zheng Yongquan2
(1. College of Agriculture, Northeast Agricultural University, Harbin 150030, China; 2. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Key Laboratory of Integrated Pest Management in Crops, Ministry of Agriculture, Beijing 100193, China)
A rapid, highly sensitive and selective method was developed for determination of dinotefuran by using QuEChERS coupled with ultraperformance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). Target compounds were extracted with acetonitrile, and cleaned with primary secondary amine (PSA) and graphitized carbon black (GCB). Average recovery for cotton plants, cotton weeds and soils at three levels (0. 01, 0.05 and 0.5 mg/kg) ranged from 80.9%to 107.5%with a variation coefficient of 3.3%-10.3%, and the limits of quantitation (LOQ) were 4.81, 3.41 and 2.26 μg/kg, respectively. The results showed that the half-lives of dinotefuran were 1.9 and 1.2 days in cotton plants in Henan and Shandong, respectively.
dinotefuran; cotton; soil; residue; UPLC-MS/MS
2014-02-21
2014-03-14
国家自然科学基金(31171879,31371968);公益性行业(农业)科研专项(201203098)
S 481.8
A
10.3969/j.issn.0529-1542.2015.02.022
* 通信作者 E-mail: zhengyongquan@ippcaas.cn
——全棉籽的加工与利用

