HPLC-FLD柱前衍生法同时测定烟草中黄曲霉毒素 B1、B2、G1和 G2
王 康,李 韵,肖少红
湖北省烟草产品质量监督检验站,武汉市硚口区宝丰路6号 430030
HPLC-FLD柱前衍生法同时测定烟草中黄曲霉毒素 B1、B2、G1和 G2
王 康,李 韵,肖少红
湖北省烟草产品质量监督检验站,武汉市硚口区宝丰路6号 430030
通过溶剂萃取、免疫亲和柱纯化富集、三氟乙酸柱前衍生、高效液相色谱(HPLC)法分离及荧光检测器检测,建立了同时测定烟草及烟草制品中黄曲霉毒素B1、B2、G1和G2的免疫亲和检测方法.结果表明:①该方法可在20 min内完成测定,4种目标物能够得到很好的分离,线性关系良好,相关系数r值均大于0.99.②方法的回收率为85%~117%,相对标准偏差为0.2%~9.4%(n=6),其中B1的检出限和定量限分别为0.10和0.34 μg/kg.
烟草;黄曲酶毒素;柱前衍生;高效液相色谱法(HPLC)
黄曲霉毒素(Aflatoxin,简称AFT)是20世纪60年代初发现的一类剧毒的真菌代谢产物,主要由黄曲霉菌(Aspergillus flavus)和寄生曲霉菌(Aspergillus parasiticus)等侵染农产品后产生[1],是目前已知最强的致癌物之一.1993年,AFT被世界卫生组织癌症研究机构划定为一级致癌物[2].目前发现的 AFT 有十几种,其中B1、B2、G1和G2较为常见,黄曲霉毒素B1(简称AFB1,其余类推)的毒性最强.黄曲霉毒素广泛地存在于霉变的大米、花生、玉米、棉籽等农产品中,是食品安全和食品国际贸易的巨大威胁[3-4].烟叶在贮藏过程中,也面临着霉变的威胁.
AFT的检测方法主要有薄层层析法[5]、高效液相色谱-荧光检测法(High performance liquid chromatography-fluorescencedetection,HPLC-FLD)[6-7]和酶联免疫法[8]等.薄层层析法过程复杂且灵敏度差,酶联免疫法存在假阳性和培育合适的抗原抗体困难的问题.HPLC-FLD法测定准确、分辨率高,可同时定性、定量测定多种AFT成分[9-10],此方法一般要经过样品的净化和衍生化.目前主要使用免疫吸附柱来纯化萃取液并富集AFT[11-13].免疫吸附柱是通过偶联的抗体对AFT进行特异性吸附而达到富集的效果,其富集效率高,选择性强,是目前AFT最为有效的固相萃取柱.衍生化方法可分为柱前衍生和柱后衍生,柱后衍生对于设备有较高要求,使用不便,不宜普及.目前,有关粮油中AFT的检测研究报道很多[14-15],而烟草中AFT检测方面的相关研究很少[16].因此,采用免疫亲和柱纯化富集、HPLC-FLD柱前衍生法,对衍生化时间、色谱条件等进行了优化,建立了一种简单快速、适用于检测烟草中AFT的方法,旨在为应对未来更为严格的烟草质量安全要求提供参考.
1 材料与方法
1.1 材料、试剂和仪器
烟草样品共16个(其中2012年和2013年湖北省烟草产品质量监督检验站接受的监督检测样品留样各8个).
AFB1、AFB2、AFG1和AFG2的标准样品(3 mg/L苯溶液,上海安谱科学仪器有限公司);甲醇、乙腈、正己烷(色谱纯,德国CNW公司);三氟乙酸(AR,北京百灵威科技有限公司);纯净水(杭州娃哈哈集团有限公司).
Summit P680A高效液相色谱仪(配有RF2000荧光检测器,美国Dionex公司);AL204电子天平(感量0.000 1 g,瑞士Mettler Toledo公司);57044型手动固相萃取仪(美国Supelco公司);KQ-800KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司);黄曲霉毒素免疫亲和柱(1 mL,美国Beacon公司).
1.2 方法
称取2.00 g烟末样品,置于30 mL带盖塑料瓶中,加入20 mL体积分数为80%的甲醇溶液,常温超声提取10 min,每隔2 min振荡1次;提取结束后,过滤,取5 mL滤液,加入20 mL纯水稀释,以1 mL/min的流速通过免疫亲和柱;然后以20 mL纯水分两次淋洗亲和柱;最后用1 mL甲醇洗脱免疫亲和柱上富集的AFT.将甲醇洗脱液用氮气小心吹干,然后加入100µL三氟乙酸和200µL正己烷,涡旋振荡后在40℃恒温箱内衍生1 h,加入0.9 mL体积分数为50%的甲醇溶液,取下层溶液进行HPLC分析.分析条件为:
色谱柱:Agilent ZORBAX Bonus-RP C18柱(4.6 mmX250 mm,5 μm);柱温:30℃;流动相及洗脱方式:乙腈-水(25∶75,体积比)二元流动相等度洗脱分离;流动相流速:1.0 mL/min;检测方式:荧光检测器(Ex 360 nm,Em 440 nm);进样量:100µL.
2 结果与讨论
2.1 条件的优化
2.1.1 衍生化条件
分子发射的荧光与其结构有关[17].黄曲霉毒素 B1、B2、G1、G2、B2a和 G2a的结构如图 1 所示.AFB1和AFG1的双呋喃环结构上具有独立的不饱和双键,二者在紫外光照射下发射的荧光较弱[18].在三氟乙酸的作用下,AFB1和AFG1分子可转化为具有强荧光的AFB2a和AFG2a分子[19-20](图1).AFB2a和AFG2a为AFB1、AFG1与酸反应生成的半缩醛结构.为提高AFB1、AFG1分子检测的灵敏度,可通过衍生化将其转化为AFB2a和AFG2a分子.根据文献[21-22]报道的实验过程,AFT经从免疫亲和柱上洗脱后,所得到的甲醇溶液需先用氮气吹干,加入三氟乙酸衍生化后再经氮气吹干,然后定容、上样分析.但本研究中发现,衍生化后再经氮气吹干,衍生化的效果较差.这可能与AFB2a和AFG2a分子的稳定性低有关,在氮气吹干的过程中,衍生化反应后得到的半缩醛可再次分解,使衍生化效果减弱[23].为了提高衍生化效果,在本研究中,衍生化后未采用氮气吹干.
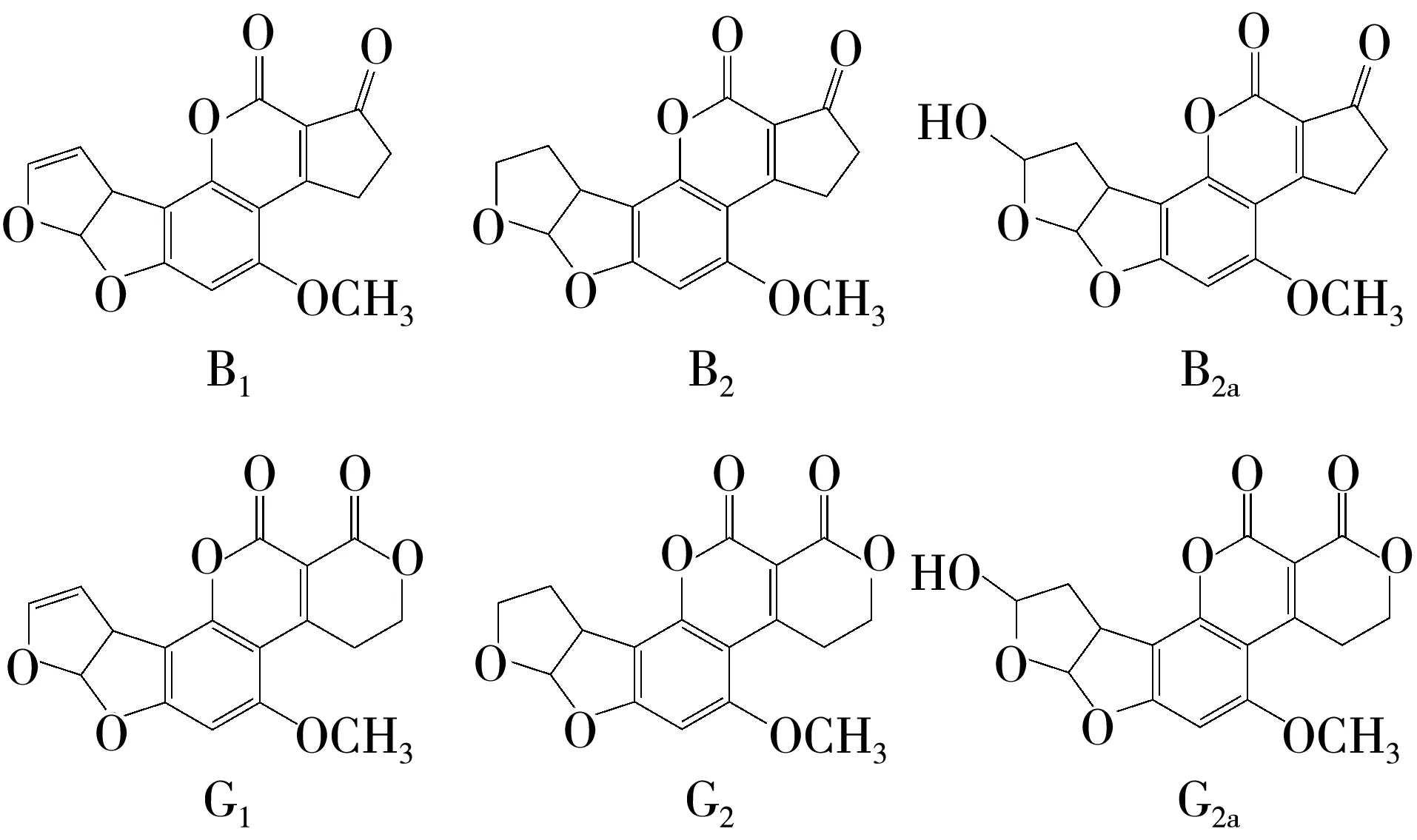
图1 黄曲霉毒素B1、B2、G1、G2、B2a和G2a的结构
随着衍生化过程的推进,AFB1逐渐转化为AFB2a分子,因此通过监测AFB2a的荧光强度变化可以监测衍生化的反应进程.图2是常温下AFB1衍生过程的荧光监控结果.如图2所示,随着反应的进行,AFB2a分子的生成量逐渐增大,荧光强度也随之增强,最终达到平衡状态.如果将平衡状态下的AFB1的转化率设为100%,根据荧光强度的比值即可计算出不同时间AFB1的转化率.根据文献[24-25]报道,加入三氟乙酸后衍生化所需的时间在15~20 min之间.AFB1在不同衍生化温度条件下转化率与反应时间的关系见图3.可知,在常温下,衍生化完全需要3 h以上;在45℃条件下,经过1 h,即可以衍生化完全.
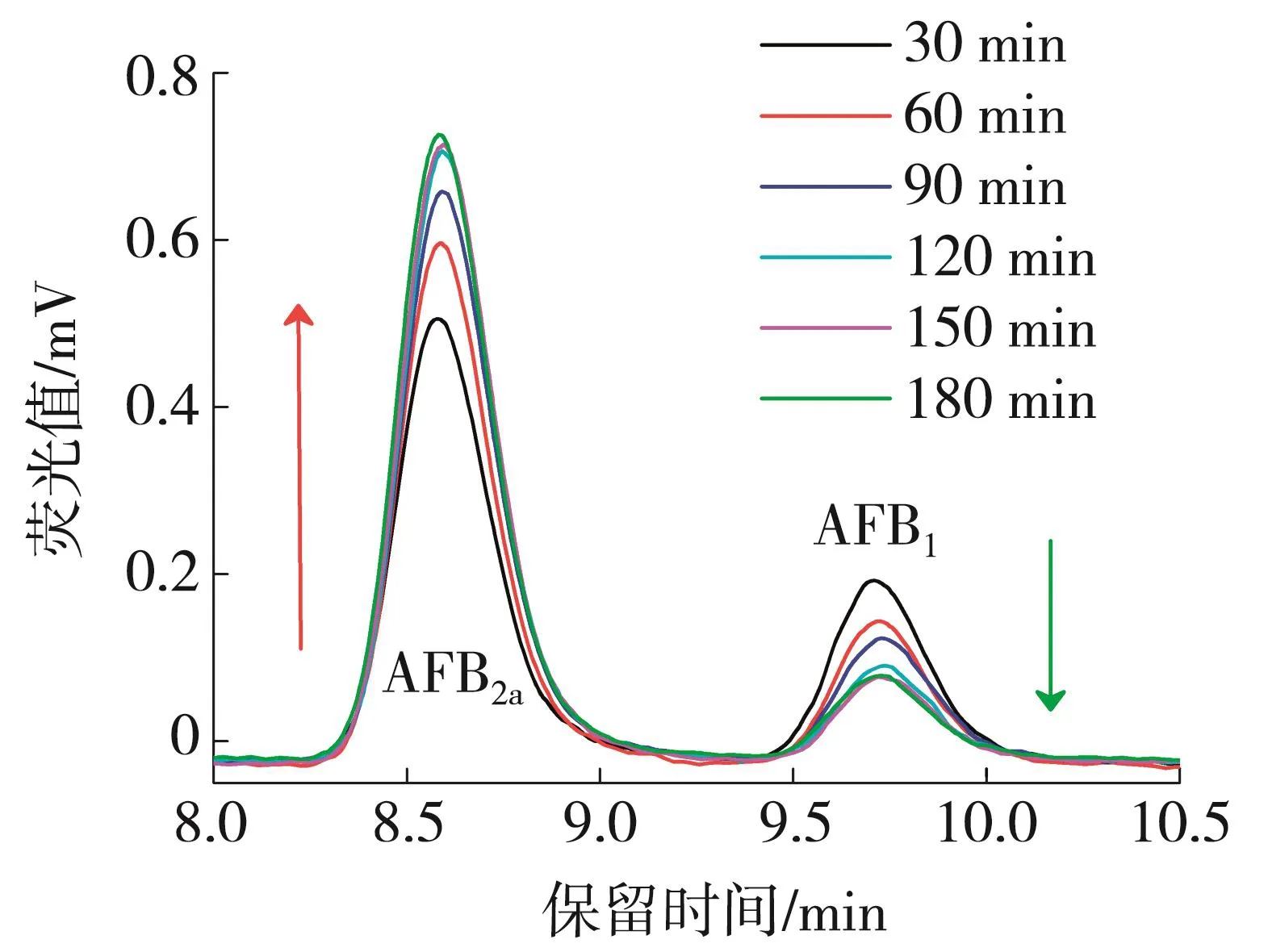
图2 25℃时AFB1衍生化过程中荧光强度随时间的变化
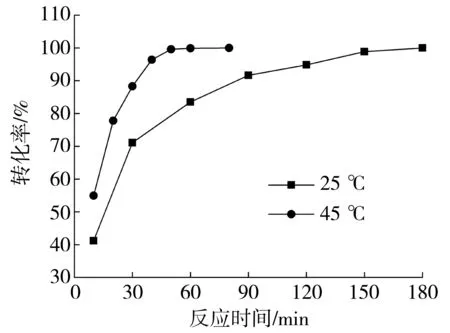
图3 不同温度下衍生化过程中AFB1转化率随时间的变化
2.1.2 色谱条件
流动相的组成会影响分离度和目标物保留时间.考察了流动相组成的影响,通过研究甲醇-水、乙腈-水体系发现AFB2与AFB2a、AFG2与 AFG2a在甲醇-水体系内基线无法分离,而在乙腈-水体系内分离度较好.通过实验优化得到乙腈-水的最佳比例为25∶75(体积比),在20 min内可以得到满意的分离效果.4种黄曲霉毒素的出峰先后顺序为AFG2、AFG1、AFB2、AFB1(图4).
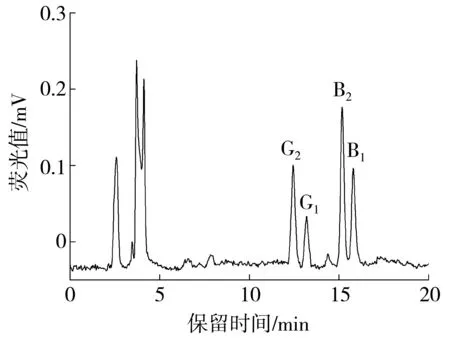
图4 经HPLC分离的4种黄曲霉毒素
2.2 方法的验证
2.2.1 工作曲线、检出限及定量限
配制 AFB1、AFB2、AFG1和 AFG2的标准混合溶液.分别取一定体积的标准混合储备液,经氮气吹干,三氟乙酸衍生化后定容,得到AFT的系列标准混合溶液(AFB1和AFG1转化为 AFB2a和AFG2a的形式存在,为方便计算,后文中仍然以AFB1和AFG1表示),其中 AFB2的浓度为 0.025、0.050、0.100、0.250、0.500、1.000 和 2.500 ng/mL,AFG2、AFG1、AFB1的浓度均为0.05、0.10、0.25、0.50、1.00、2.50和5.00 ng/mL.将所得标准混合溶液进行HPLC-FLD分析,采用外标法定量,以目标物的峰面积Y对其浓度X进行回归分析,并按3倍信噪比(S/N)和10倍信噪比来确定各分析物的检出限和定量限,得到的线性回归方程、相关系数和检测限如表 1 所示.在 0.1~10.0 μg/kg 范围内,AFG2、AFG1、AFB1呈现了良好的线性关系;在0.05~5.00 μg/kg范围内,AFB2呈现了良好的线性关系.其中AFB1的检出限和定量限分别为0.10和0.34 μg/kg,完全可以满足欧盟针对直接食用食物中AFT总量和AFB1分量设定的限量(最大残留限量:AFT总量≤4 μg/kg,AFB1≤2 μg/kg)的检测要求.考虑到烟草的吸食特性,由卷烟烟气摄入人体的量比直接食用少得多.
2.2.2 回收率和重复性
在烟叶样品中分别添加0.2、1.0和5.0 μg/kg水平的 AFB1、AFB2、AFG1和 AFG2标准品,测定该 4种AFT的回收率,每种浓度添加进行6次平行实验,根据结果计算方法的加标回收率及加标后测定值的相对标准偏差(RSD).结果(表2)表明,方法的回收率高、重复性好.
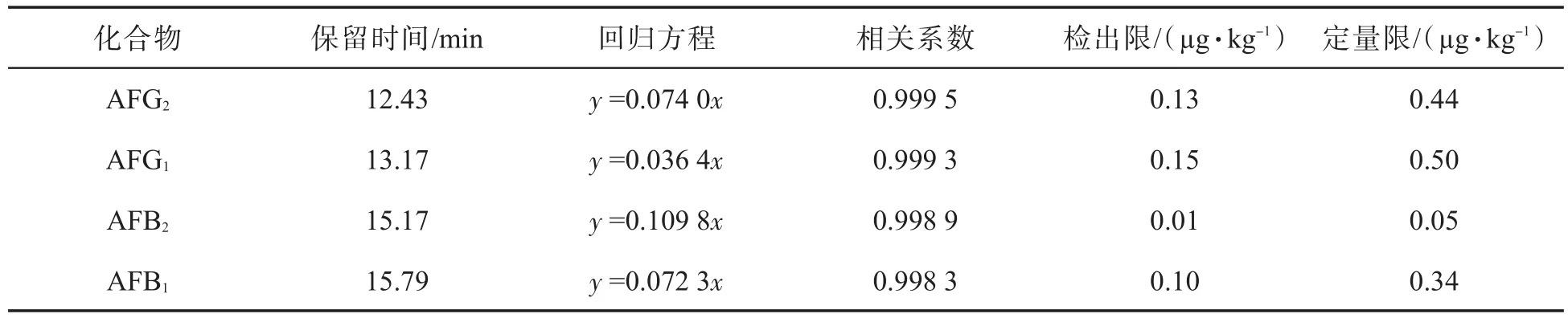
表1 4种黄曲霉毒素的回归方程、相关系数、检出限和定量限
图5为添加5.0 μg/kg水平AFT标准品的烟叶样品的色谱图.可以看出,经免疫亲和柱富集和净化,烟叶萃取液中的大部分杂质均能被有效除去,残留的杂质能与目标物有效分离,对目标物无干扰.
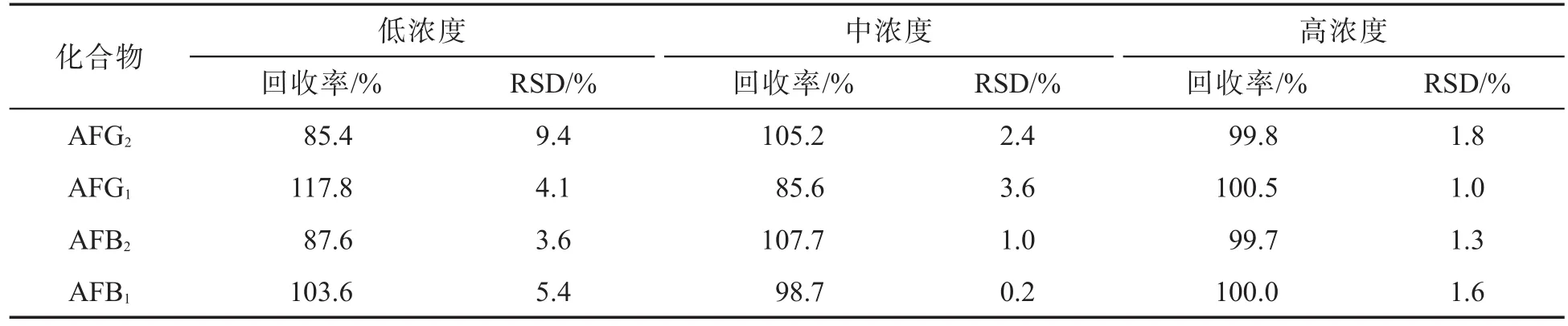
表2 方法的加标回收率及重复性(n=6)

图5 添加5 μg/kg水平黄曲霉毒素标准品的烟叶样品的HPLC图
2.3 实际样品的测定结果
实际样品为2012年和2013年的16个烟草监督检测样品的留样,其中2012年的8个样品保存状态较差,目测已有一定程度的霉变.按照1.2节的步骤处理烟草样品,经HPLC-FLD分析,结果表明:2013 年的 8 个样品中,AFB1、AFB2、AFG1和AFG2均未检出;2012年的8个样品中仅一个样品中检出AFB1,质量分数为0.44 μg/kg,低于欧盟针对直接食用食物的限量要求;其他样品均未检出该4种AFT.
3 结论
建立的检测黄曲霉毒素 B1、B2、G1和 G2的HPLC-FLD柱前衍生法的检出限低,回收率(85.4%~117.8%)和重复性好,相对标准偏差为0.2%~9.4%(n=6),适用于烟草及烟草制品中黄曲霉毒素 B1、B2、G1和 G2的检测.
[1]Gourama H,Bullerman L B.Aspergillus flavus and Aspergillus parasiticus:aflatoxigenic fungi of concern in foods and feed[J].J Food Protect,1995,58(12):1395-1404.
[2] 李培武,马良,杨金娥,等.粮油产品黄曲霉毒素B1检测技术研究进展[J].中国油料作物学报,2005,27(2):77-81.
[3] 孙玲玉,柴同杰.黄曲霉毒素生物降解的研究进展[J].山东农业大学学报:自然科学版,2012,43(4):645-647.
[4] 吴兆蕃.黄曲霉毒素的研究进展[J].甘肃科技,2010,26(18):89-93.
[5] 王宏亮.薄层层析法测定饲料中黄曲霉毒素B1方法的改进[J].粮食与饲料工业,1998(1):40-42.
[6]Blesa J,Soriano J M,Molto J C,et al.Determination of aflatoxins in peanuts by matrix solid-phase dispersion and liquid chromatography[J].J Chromatogr A,2003,1011(1/2):49-54.
[7]FU Zhaohui,HUANG Xuexiang,MIN Shungeng.Rapid determination of aflatoxins in corn and peanuts[J].J Chromatogr A,2008,1209(1/2):271-274.
[8] 陈萍,邓冬云,欧阳静茹,等.酶联免疫吸附法(ELISA)测定花生油中的黄曲霉毒素B1[J].中国卫生检验杂志,2012,22(3):658-659.
[9] 李军,田苗,于一芒,等.免疫亲和-光化学衍生高效液相色谱检测花生及花生制品中黄曲霉毒素[J].分析测试学报,2007,26(1):93-96.
[10]赵宁,郭玉梅,姚妍妍,等.高效液相色谱法测定花生中黄曲霉素的含量[J].科技信息,2009,25:44-45.
[11]Afzali D,Ghanbarian M,Mostafavi A,et al.A novel method for high preconcentration of ultra trace amounts of B1,B2,G1and G2aflatoxins in edible oils by dispersive liquid-liquid microextraction after immunoaffinity column clean-up[J].J Chromatogr A,2012,1247:35-41.
[12]Ghali R,Belouaer I,Hdiri S,et al.Simultaneous HPLC determination of aflatoxins B1,B2,G1and G2in Tunisian sorghum and pistachios[J]. Journal of Food Composition and Analysis,2009,22(7/8):751-755.
[13]ReiteE V,Cichna-MarklM,ChungDH,etal.Immuno-ultrafiltration asanew strategy in sample clean-up of aflatoxins[J].J Sep Sci,2009,32(10):1729-1739.
[14]李书国,陈辉,李雪梅,等.粮油食品中黄曲霉毒素检测方法综述[J].粮油食品科技,2009,17(2):62-65.
[15]韩珍,赵文红,钱敏,等.黄曲霉毒素检测方法研究进展[J].广东农业科学,2011(13):93-96.
[16]陈欢,刘彤,侯宏卫,等.烟草及烟草制品中黄曲霉毒素的酶联免疫测定方法:中国,103063831A[P].2013-04-24.
[17]赵德丰,高欣钦.荧光与分子结构的关系[J].染料工业,1995,32(6):1-5.
[18]Braga S M,de Medeiros F D,de Oliveira E J,et al.Developmentand validation ofa method forthe quantitative determination of aflatoxin contaminants in Maytenus ilicifolia by HPLC with fluorescence detection[J].Phytochem Anal,2005,16(4):267-271.
[19]马良,李培武,张文.高效液相色谱法对农产品中黄曲霉毒素的测定研究[J].分析测试学报,2007,26(6):774-778.
[20]Quinto M,Spadaccino G,Palermo C,et al.Determination of aflatoxins in cereal flours by solid-phase microextraction coupled with liquid chromatography and post-column photochemicalderivatization-fluorescence detection[J].J Chromatogr A,2009,1216(49):8636-8641.
[21]陈玉波,陈长毅,刘洋,等.高效液相色谱法同时测定食品中黄曲霉毒素 B1、B2、G1、G2、M1、M2[J].食品科技,2009,34(9):265-267.
[22]何丰瑞,陈艳,李永波.高效液相色谱法测定袋泡茶叶中的黄曲霉毒素[J].中国卫生检验杂志,2014,24(3):335-336.
[23]Jaimez J,Fente C A,Vazquez B I,et al.Application of the assay of aflatoxins by liquid chromatography with fluorescence detection in food analysis[J]. J Chromatogr A,2000,882(1/2):1-10.
[24]Khayoon W S,Saad B,Yan C B,et al.Determination of aflatoxins in animal feeds by HPLC with multifunctional column clean-up[J].Food Chemistry,2010,118(3):882-886.
[25]Sharma M,Marquez C.Determination of aflatoxins in domestic pet foods(dog and cat)using immunoaffinity columnandHPLC[J].Animalfeedscienceand technology,2001,93(1/2):109-114.
责任编辑 茹呈杰
Simultaneous Determination of Aflatoxins B1,B2,G1and G2in Tobacco by HPLC-FLD Pre-column Derivatization Method
WANG Kang,LI Yun,and XIAO Shaohong
Hubei Province Tobacco Quality Supervisionamp;Test Station,Wuhan 430030,China
An immunoaffinity detection method for simultaneously determining the aflatoxins B1,B2,G1and G2in tobacco and tobacco products was developed via solvent extraction of sample,purifying and concentrating on immunoaffinity column,pre-column derivatization by trifluoroacetic acid,separation by HPLC,and detection by fluorescence detector.The results showed that:1)The determination could be completed within 20 minutes,the four target aflatoxins were well separated and exhibited good linear relations with correlation coefficients rgt;0.99.2)The recoveries of the method ranged from 85%to 117%with the relative standard deviation (RSD)of 0.2%-9.4% (n=6),and the limits of detection and quantification of aflatoxin B1were 0.10 and 0.34 μg/kg,respectively.
Tobacco;Aflatoxin;Pre-column derivatization;HPLC
TS411.1
A
1002-0861(2015)10-0057-05
10.16135/j.issn1002-0861.20151010
2015-02-09
2015-07-09
王康(1986-),博士,工程师,主要从事烟草化学研究.E-mail:wangkang4907@163.com
王康,李韵,肖少红.HPLC-FLD柱前衍生法同时测定烟草中黄曲霉毒素B1、B2、G1和G2[J].烟草科技,2015,48(10):57-61.
WANG Kang,LI Yun,XIAO Shaohong.Simultaneous determination of aflatoxins B1,B2,G1and G2in tobacco by HPLC-FLD pre-column derivatization method[J].Tobacco Scienceamp;Technology,2015,48(10):57-61.

