miRNA-34a靶向抑制Rb/E2F1通路激活增强结肠癌放疗敏感性
金芳玲 蔡忠芳 葛阳丽 张 晓夏 冰
1.浙江省东阳市人民医院放疗科,浙江东阳 322100;2.浙江省杭州市第一人民医院放疗科,浙江杭州 310000
miRNA-34a靶向抑制Rb/E2F1通路激活增强结肠癌放疗敏感性
金芳玲1蔡忠芳1葛阳丽1张 晓1夏 冰2
1.浙江省东阳市人民医院放疗科,浙江东阳 322100;2.浙江省杭州市第一人民医院放疗科,浙江杭州 310000
目的探讨MiRNA-34a在结肠癌细胞化疗敏感性中的作用及机制。方法构建miRNA-34a过表达的慢病毒载体,转染人结肠癌细胞株HT29细胞,经放疗处理后,采用氯丁胶新型交联剂(MTT)、平板克隆和Western blot检测miRNA-34a过表达后对HT29细胞放疗敏感性和Rb/E2F1通路的影响。 结果慢病毒载体转染HT29细胞后miRNA-34a表达出现显著上调[(5.91±1.47)倍],miRNA-34a组HT29细胞对放疗的敏感性显著增强,细胞存活率和克隆形成能力出现显著下降,Rb蛋白磷酸化和E2F1蛋白表达水平也受到miRNA-34a过表达的抑制。结论miRNA-34a靶向抑制Rb/E2F1通路激活增强结肠癌放疗敏感性,证实miRNA-34a-Rb/E2F1通路是结肠癌临床放射治疗相关的有效分子靶点。
MiRNA-34a;Rb/E2F1通路;放射治疗;结肠癌
结肠癌(colon cancer)是我国最常见的消化系统肿瘤之一。据统计,结肠癌发病率位居我国恶性肿瘤第3位,其致死率居第5位,表现出易转移和高复发的特点[1]。辅助治疗常用于提高手术治疗的成功率和生存率(主要是化学药物和放射治疗)。其中放疗虽然能够在短时间内导致肿瘤体积缩小甚至消退,但经过缓解期后,肿瘤对放疗的敏感性下降,从而出现复发甚至转移,被称为放疗抵抗。探索有效的分子靶点以增强结肠癌的放疗敏感性已经成为当前的研究热点。
微小RNA(micro RNA,miRNA)是一种广泛存在于真核生物细胞内,长约22个核苷酸,能与特定靶基因信使RNA(messenger RNA,mRNA)的3'UTR配对结合来调控靶基因表达的非编码RNA[2]。已经可以明确放疗诱导miRNA的差异表达,如非小细胞肺癌细胞在受到放疗诱导后,miRNA-34家族能被抑癌基因p53直接转录生成而诱导细胞凋亡[3]。此外,有研究指出E2F相关通路是miRNA-34诱导癌细胞凋亡的靶标蛋白[4]。但对于miRNA-34a在结肠癌放疗敏感性中的作用及其机制尚未见研究报道。本研究通过慢病毒过表达载体的转染来上调结肠癌细胞内miR-34a的表达,采用氯丁胶新型交联剂(MTT)和细胞克隆形成探究miRNA-34a表达水平改变后对结肠癌细胞放疗敏感性的作用及其对Rb/E2F1通路的调控作用,为结肠癌的临床治疗提供实验依据。
1 材料与方法
1.1 细胞和试剂
人结直肠癌细胞株HT29购自中国科学院上海细胞库;细胞培养试剂(DMEM培养基,胎牛血清、青霉素和链霉素、胰蛋白酶)购自美国Gibco公司;TRI-zol试剂和Realtime PCR试剂盒购自美国Invitrogen公司;hsa-miRNA-34a过表达慢病毒载体和转染增强剂polybrene由上海吉玛基因公司设计合成 (载体为pRI-CMVGFP-miRNA vector);Western blot相关试剂(上样缓冲液,蛋白marker,电泳液和转膜液,显色液等)购自碧云天公司;第一抗体[兔抗人anti-p-Rb、anti-E2F1和甘油醛-3-磷酸脱氢酶(GAPDH)]和辣根过氧化物酶(HRP)标记的第二抗体(羊抗兔)购自Cell signalling Technology公司,其他常用试剂购自Sigma公司。
1.2 实验方法
1.2.1 细胞培养 人结肠癌细胞株HT29培养于含10%胎牛血清、1000 U/mL青链霉素的DMEM培养基,放置于37℃、5%CO2的恒温细胞培养箱内,每2~3天更换培养液,待细胞融合>80%后使用胰蛋白酶消化细胞,种板培养或传代。
1.2.2 miR-34a转染 HT29细胞培养到密度>80%后,使用胰蛋白酶消化重悬,加入DMEM完全培养基稀释到1×105个/mL,取2 mL细胞种到6孔板中,置于37℃、5%CO2的恒温细胞培养箱内。待细胞融合>30%后更换无血清培养基,进行慢病毒转染。使用嘌呤霉素对最佳病毒滴度进行筛选,按照1 μg慢病毒载体(pRI-CMVGFP-miRNA 34a vector)/500 μL DMEM的配比混合均匀,加入polybrene(5 μg/mL)增强病毒转染效率,室温孵育30 min。将混合物加入6孔板中,混匀后继续培养,转染12 h后更换DMEM完全培养液,置于37℃、5%CO2的恒温细胞培养箱内培养用于后续实验。
1.2.3 miR-34a表达检测 培养HT29细胞使用QIAGEN公司miRNA提取试剂盒,提取总miRMA后,使用TaqMan MicroRNA逆转录试剂盒将上述提取的miRNA逆转录成cDNA,反应条件:16℃30 min,42℃30 min,85℃5 min;以TaqMan MicroRNA检测试剂盒对上述制备得到的cDNA进行Real time PCR反应,反应条件:95℃10 min,95℃15 s及60℃1 min,共40个循环。PCR完成后,在罗氏LC480软件上分析基因的扩增情况,得到相应的Ct值。以U6为内参来校正PCR模板的拷贝数,每组设3个复孔,基因相对表达量采用2-ΔΔCt方法计算,空白对照组为未经任何处理的HT29细胞,阴性对照组为空白病毒载体转染的HT29细胞,miRNA-34a过表达组为慢病毒载体(pRI-CMVGFP-miRNA 34a vector)转染的HT29细胞。
1.2.4 Western blot miRNA-34a过表达组使用慢病毒载体(pRI-CMVGFP-miRNA 34a vector)转染24 h、阴性对照组使用空白慢病毒载体转染24 h、空白对照组的HT29细胞不做处理同时培养24 h后,去除培养基,加入预冷的PBS洗涤细胞,加入10 uL的RIPA裂解液,10 min后提取总蛋白,BCA法定量蛋白浓度,各组取50 μg蛋白进行10%SDS-PAGE电泳。电泳结束后转膜到PVDF膜,用5%milk-TBS将膜封闭1 h,加入相应的第一抗体,静置于4℃过夜。次日使用TBST漂洗,HRP标记的二抗室温孵育1 h,显色拍照。
1.2.5 MTT检测细胞的增殖 细胞分组及处理同“1.2.4”项下,转染后的HT29细胞密度>80%后使用胰蛋白酶消化细胞,制成单细胞悬液,按1×106个/孔的密度接种于6孔板中,置于培养箱中孵育12 h后,釆用Varian 2300EX直线加速器6MV-X线垂直辐射结肠癌细胞(上盖1 cm有机玻璃填充物),所用剂量率为3Gy/min,源皮距SSD100cm,照射野10cm×10cm。照射结束后更换培养基,继续培养细胞。不同时间点内按照10 μL/孔的浓度加入MTT试剂,37℃孵育1 h后,酶标仪读取每孔的吸光度值。
1.2.6 细胞辐射处理后检测对克隆形成的影响 细胞分组及处理同 “1.2.4”项下,1×106个/孔的密度接种HT29细胞于6孔板中,分别给予0、2、4、6、8 Gy剂量的X线辐射,辐射结束后更换培养液继续培养细胞。当培养板孔中出现明显的结肠癌细胞克隆时,去除培养液,预冷的PBS洗涤细胞,甲醇固定30 min,结晶紫染色30 min,烘箱烘干后,光学显微镜计算视野内克隆数 (>50个细胞),计算公式如下:克隆形成率(planting efficiency,PE)=克隆数/接种细胞数×100%;存活分数(surviving fraction,SF)受照射细胞的克隆形成率/对照细胞的克隆形成率×100%。运用GraphPad Prism 5.0软件进行L-Q模型和多IE单击模型曲线拟合,绘制剂量存活曲线,计算增敏比。
1.3 统计学方法
采用Graphpad Prism 5.0统计软件对数据处理分析,计量资料以均数±标准差()表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-34a转染增强HT29细胞内miRNA-34a表达
在miRNA-34a的慢病毒表达载体转染HT29细胞24 h后,图1的GFP荧光检测结果可见,miRNA-34a转染和阴性对照组的HT29细胞中可见GFP绿色荧光蛋白,表明慢病毒转染成功。提取HT29细胞总miRNA进行Real time PCR验证,阴性对照组(NS)的miRNA-34a表达水平为(1.02±0.07)倍,转染后的HT29细胞的miRNA-34a表达水平增加到 (5.91± 1.47)倍;阴性对照组与空白对照组的miRNA-34a表达比较,差异无统计学意义(P>0.05)。因此可以明确,miRNA-34a表达质粒转染HT29细胞后能够显著上调miRNA-34a的表达。见表1。
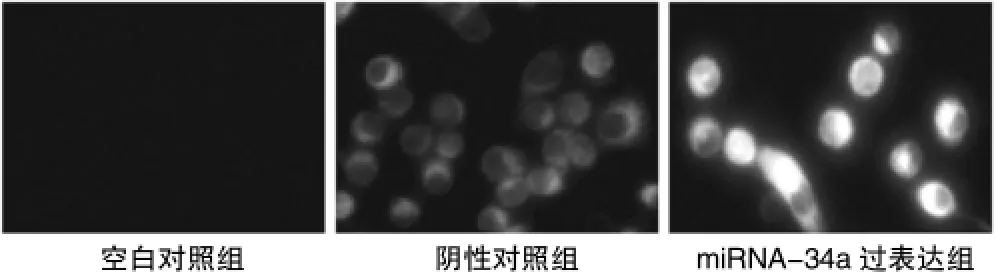
图1 空白对照组、阴性对照组和miRNA-34a过表达组的HT29细胞的荧光照片
表1 Realtime PCR检测空白对照组、阴性对照组和miRNA-34a过表达组的HT29细胞的miRNA-34a表达水平()

表1 Realtime PCR检测空白对照组、阴性对照组和miRNA-34a过表达组的HT29细胞的miRNA-34a表达水平()
注:与空白对照组比较,*P<0.01
组别 miR-34a mRNA表达水平空白对照组阴性对照组miRNA-34a过表达组1.00 1.02±0.07 5.91±1.47*
2.2 miRNA-34a过表达增强结肠癌细胞的放疗敏感性
采用MTT法对miRNA-34a过表达后HT29细胞对体外放疗敏感性的改变进行检测,结果显示,使用3 Gy/min剂量率垂直辐射结肠癌细胞后,miRNA-34a过表达组的生长曲线从培养的第3天开始出现显著差异,miRNA-34a过表达后的HT29细胞生存分数要显著低于空白对照组,其中在第6天空白对照组的细胞存活分数为 (43.76±3.23)%,miRNA-34a过表达组细胞的生存率为(13.2±3.19)%(P<0.01);阴性对照组的细胞存活分数为 (41.57±3.10)%,miRNA-34a过表达组细胞的生存率为(13.2±3.19)%(P<0.01)。表明miRNA-34a过表达组的细胞对射线的敏感性要明显高于对照组细胞。见图2。
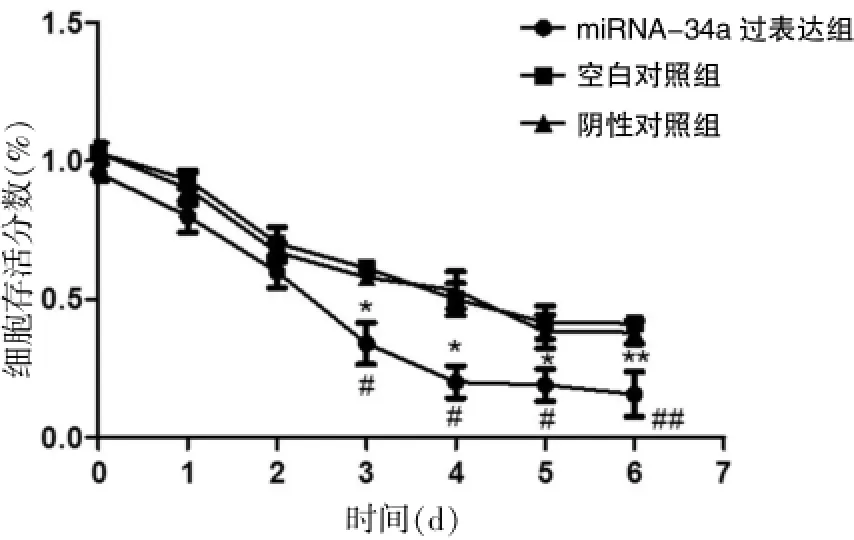
图2 miRNA-34a过表达前后HT29细胞对放疗敏感性的变化
2.3 miRNA-34a过表达抑制放疗处理结肠癌细胞的克隆形成
结肠癌细胞的克隆形成检测结果显示经过放疗处理后,miRNA-34a过表达HT29细胞的单个细胞增殖能力明显强于对照细胞,不同剂量组的克隆数统计结果显示,miRNA-34a过表达显著抑制放疗处理结肠癌细胞的克隆形成。采用GraphPad Prism 5.0软件进行曲线拟合,计算放射增敏比=1.533。见表2。
表2 两组不同剂量X线照射后克隆形成率和存活分数比较()

表2 两组不同剂量X线照射后克隆形成率和存活分数比较()
注:与对照组比较,*P<0.05,**P<0.01
0 Gy克隆形成率(%)组别 存活分数(%)2 Gy克隆形成率(%)存活分数(%)4 Gy克隆形成率(%)存活分数(%)6 Gy克隆形成率(%)存活分数(%)8 Gy克隆形成率(%)存活分数(%)空白对照组miRNA-34a组72.2±5.3 66.4±1.3 100.0 100.0 45.3±8.7 32.3±1.2 56.3 45.6 22.7±0.9 10.4±0.1*21.2 12.1 12.9±0.3 1.5±0.5**10.9 8.7*5.6±0.1 0.1±0.0**2.3 0.1**
2.4 miRNA-34a过表达抑制Rb磷酸化水平和E2F1蛋白表达
最近的研究显示Rb/E2F1蛋白是miRNA-34a调控的关键靶分子。Western blot结果显示,与空白对照组及阴性对照组比较,miRNA-34a过表达组的p-Rb和E2F1蛋白条带灰度明显降低,但空白对照组和阴性对照组比较,差异无统计学意义(P>0.05)(图3),使用Image Pro Plus6.0的条带分析结果如图4所示,以GAPDH表达量作为蛋白定量分析内参,miRNA-34a过表达组的p-Rb和E2F1蛋白表达水平明显降低(与空白对照组比较,P<0.01;与阴性对照组比较,P<0.01),表明miRNA-34a可能通过抑制Rb磷酸化水平和E2F1蛋白表达而增强HT29细胞的放疗敏感性。
3 讨论

图3 Western blot检测空白对照组、阴性对照组和miR-34a过表达组的HT29细胞中p-Rb和E2F1蛋白表达(GAPDH用作内参)
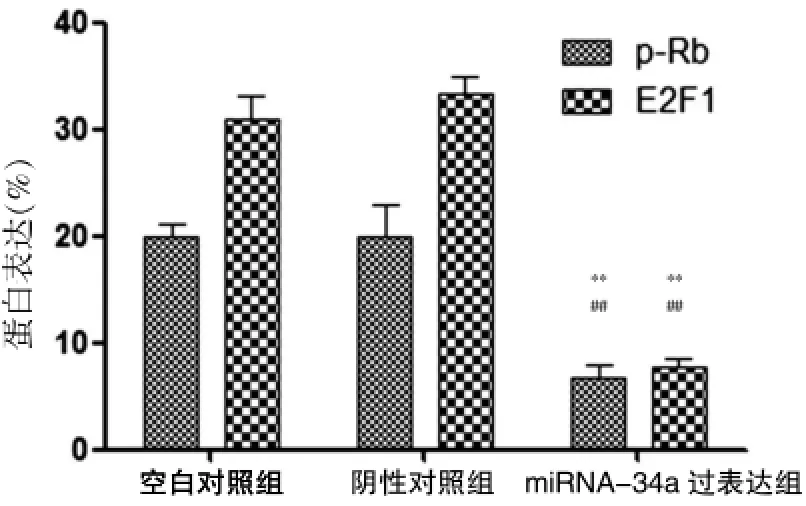
图4 Image Pro Plus 6.0分析Western blot检测条带的光密度(以GAPDH表达量作为蛋白定量分析内参)
随着放疗技术的发展进步,其已成为结肠癌辅助治疗的有效手段之一。但是在临床使用中由于癌细胞对放疗敏感性的降低,导致疗效降低和结肠癌的复发或转移。为增强癌细胞的放疗敏感性,一方面通过开发新型的放疗技术或治疗方案以达到最佳的辅助治疗效果,另一方面,通过分子生物技术揭示癌细胞的放疗抵抗机制以用于临床。随着蛋白组学和高通量技术的发展进步,后者的发现和应用成为可能[5-6]。
研究发现,miRNA作为人体内最大种类的表达调控因子,在人体细胞内具有多种生物功能,包括参与调控细胞的增殖、凋亡和迁移等,尤其是miRNA在癌细胞恶性生物学行为中的作用更是成为了当前的研究热点[7]。已有研究者证实在结肠癌患者体内miRNA表达谱已经出现显著差异,并且对其中差异化表达明显的miRNA进行初步筛选,证实miRNA表达与结肠癌的治疗和预后存在显著相关[8]。而且已经有多项研究明确,癌细胞在受到放射治疗后,会导致miRNA表达变化[9]。例如Wang等[10]的研究发现,肺癌细胞受到放射刺激后,多种miRNA表达异常,其中miRNA-21过表达能够促进肺鳞癌细胞的凋亡。miRNA-34a是一种最近鉴定的与多种癌症发生发展密切相关的miRNA。例如,Yan等[11]发现miRNA-34a能够通过下调c-Met表达而抑制黑色素瘤细胞的增殖,此外也有多项研究证实miRNA-34a与癌细胞的耐药性相关[12-13]。为进一步阐明miRNA-34a在结肠癌放疗中的作用,本研究构建miRNA-34a过表达的慢病毒载体,并稳定转染结肠癌HT29细胞,通过Real time PCR证实转染成功导致miRNA-34a的表达显著上调,并通过功能学研究揭示了miRNA-34a过表达后结肠癌HT29细胞对X线照射的敏感性增强,表现在细胞增殖能力和存活分数下降上,克隆形成能力受到miRNA-34a抑制。此外,还发现miRNA-34a增强结肠癌细胞的放疗敏感性可能与Rb/E2F1通路相关,表现在miRNA-34a过表达后HT29细胞内Rb磷酸化和E2F1表达水平均出现显著上调,这与相关研究[13-14]的结果一致。
然而,在癌细胞的增殖分化和侵袭转移中,往往存在多种基因网络或信号通路的共同参与,例如在miRNA-34a相关的调控通路中也不仅是Rb/E2F1通路,还有研究报道TREM2、SIRT2等多种蛋白的表达也受到miRNA-34a的调控[15-16],因此还需要对结肠癌中的基因调控网络进行深入研究,具有重要的理论和实践价值。
综上所述,本研究对miRNA-34a在结肠癌放疗敏感性中的作用进行了初步阐明,并对其调控机制进行了检测,推动结肠癌放疗抵抗“miRNA-靶基因”作用模式的发展,为放疗技术和方案的发展提供有价值的实验证据。
[1]Clinical Outcomes of Surgical Therapy Study Group.A comparison of laparoscopically assisted and open colectomy for colon cancer[J].The New England Journal of Medicine,2004,350(20):2050.
[2]Schepeler T,Reinert JT,Ostenfeld MS,et al.Diagnostic and prognostic microRNAs in stage II colon cancer[J]. Cancer Research,2008,68(15):6416-6424.
[3]Bommer GT,Gerin I,Feng Y,et al.p53-mediated activation of miRNA34 candidate tumor-suppressor genes[J]. Current Biology,2007,17(15):1298-1307.
[4]Wiggins JF,Ruffino L,Kelnar K,et al.Development of a lung cancer therapeutic based on the tumor suppressor microRNA-34[J].Cancer research,2010,70(14):5923-5930.
[5]Cha YH,Kim NH,Park C,et al.MiRNA-34 intrinsically links p53 tumor suppressor and Wnt signaling[J].Cell Cycle,2012,11(7):1273-1281.
[6]Friedman DB,Hill S,Keller JW,et al.Proteome analysis of human colon cancer by two-dimensional difference gel electrophoresis and mass spectrometry[J].Proteomics,2004,4(3):793-811.[7]Pereira DM,Rodrigues PM,Borralho PM,et al.Delivering the promise of miRNA cancer therapeutics[J].Drug discovery today,2013,18(5):282-289.
[8]Schetter AJ,Leung SY,Sohn JJ,et al.MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J].Jama,2008,299(4):425-436.
[9]Song S J,Poliseno L,Song M S,et al.MicroRNA-antagonism regulates breast cancer stemness and metastasis via TET-family-dependent chromatin remodeling[J].Cell,2013,154(2):311-324.
[10]Wang X C,Du L Q,Tian L L,et al.Expression and function of miRNA in postoperative radiotherapy sensitive and resistant patients of non-small cell lung cancer[J]. Lung Cancer,2011,72(1):92-99.
[11]Yan D,Zhou X,Chen X,et al.MicroRNA-34a inhibits uveal melanoma cell proliferation and migration through downregulation of c-Met[J].Investigative Ophthalmology &Visual Science,2009,50(4):1559-1565.
[12]Kastl L,Brown I,Schofield AC.miRNA-34a is associated with docetaxel resistance in human breast cancer cells[J].Breast cancer research and treatment,2012,131(2):445-454.
[13]Feng B,Wang R,Song HZ,et al.MicroRNA-200b reverses chemoresistance of docetaxel-resistant human lung adenocarcinoma cells by targeting E2F3 [J].Cancer,2012,118(13):3365-3376.
[14]Chen F,Hu SJ.Effect of microRNA-34a in cell cycle,differentiation,and apoptosis:a review[J].Journal of Biochemical and Molecular Toxicology,2012,26(2):79-86.
[15]Zhao Y,Bhattacharjee S,Jones BM,et al.Regulation of TREM2 expression by an NF-κB-sensitive miRNA-34a[J]. Neuroreport,2013,24(6):318.
[16]Yamakuchi M,Ferlito M,Lowenstein CJ.miR-34a repression of SIRT1 regulates apoptosis[J].Proceedings of the National Academy of Sciences,2008,105(36):13421-13426.
miRNA-34a increases the radiotherapy sensitivity of colon cancer by targeting Rb/E2F1 pathway
JIN Fangling1CAI Zhongfang1GE Yangli1ZHANG Xiao1XIA Bing2
1.Department of Radiotherapy,the People's Hospital in Dongyang City of Zhejiang Province,Dongyang 322100,China; 2.Department of Radiotherapy,the Frist People's Hospital in Hangzhou City of Zhejiang Province,Hangzhou 310000, China
Objective To investigate effect and mechanism of miRNA-34a in the chemosensitivity of colon cancer cells.Methods Lentiviral vector for miRNA-34a overexpression was constructed and transfected into human colon cancer cell line HT29 cells.After radiation treatment,the radiosensitivity of HT29 cell was determined by MTT and colony.Rb/E2F1 pathway was measured by Western blot.Results miRNA-34a expression in lentiviral vector-transfected HT29 cells increased to (5.91±1.47)folds.The sensitivity of miRNA-34a overexpression of HT29 cells to radiotherapy was enhanced by miRNA-34a overexpression.The cell viability and clonogenic capacity were inhibited by miRNA-34a.Rb protein phosphorylation and E2F1 protein expression were also inhibited by overexpression of miRNA-34a.Conclusion miRNA-34a enhances radiation sensitivity of colon cancer by the inhibition of Rb/E2F1 pathway, confirming that miRNA-34a-Rb/E2F1 pathway is associated with colorectal cancer radiation therapy as an effective molecular target.
miRNA-34a;Rb/E2F1 pathway;Radiation therapy;Colon cancer
R735.3+3
A
1673-7210(2015)11(b)-0013-05
2015-04-19本文编辑:赵鲁枫)
浙江省自然科学基金项目(Y13H160069)。