禾谷孢囊线虫与不同小麦根系的互作表型特征
胡小斌, 梁旭东, 张 龙, 迟元凯, 王 暄, 李红梅
(南京农业大学植物保护学院,农作物生物灾害综合治理教育部重点实验室, 南京 210095)
禾谷孢囊线虫与不同小麦根系的互作表型特征
胡小斌, 梁旭东, 张 龙, 迟元凯, 王 暄, 李红梅*
(南京农业大学植物保护学院,农作物生物灾害综合治理教育部重点实验室, 南京 210095)
为了明确高抗品种‘华麦1号’的抗禾谷孢囊线虫机制,以Pluronic F-127胶体为介质,比较了禾谷孢囊线虫2龄幼虫(J2)侵入根系前对抗病品种‘华麦1号’与感病品种‘豫麦34’和‘矮抗58’的根尖趋性差异,并采用室内人工接种法观察了线虫侵入3个品种后的发育进程。结果表明,J2对3个品种的根尖均表现明显的趋性,对‘矮抗58’的趋性最强,而对‘华麦1号’的最弱,接种4 h和6 h时‘华麦1号’与‘矮抗58’根尖吸引的线虫总量差异显著(P<0.05);组织染色观察到J2对3个品种的根系均有一定数量的侵入,但高抗品种‘华麦1号’根系侵入的幼虫量和后期形成的白雌虫量均显著低于感病品种‘豫麦34’和‘矮抗58’。结果证实,‘华麦1号’的抗性机制主要表现为减少线虫的有效侵入量、抑制侵入后的线虫生长发育。
禾谷孢囊线虫; 抗性; 吸引; 侵染
禾谷孢囊线虫(HeteroderaavenaeWollenweber,1924)是一种世界范围内危害禾谷类作物的重要病原线虫,在全球40多个国家及地区均有发生和分布,在我国其危害已达16个省(市、自治区),给我国的粮食安全构成了严重威胁[1-2]。禾谷孢囊线虫病可通过施用化学杀线剂、非寄主轮作及种植抗病品种等措施进行防治,但大量施用化学药剂容易造成环境污染及线虫抗药性等问题,而农业防治(如休耕与轮作)由于受耕地面积减少、经济效益等各种因素限制,在实际应用中无法有效推广,选育和利用抗病品种是目前最经济有效的防治手段,澳大利亚通过选育和种植抗病品种已有效控制了该病的危害[3]。近年来,我国也开展了大量禾谷孢囊线虫抗性品种筛选及种质材料鉴定工作,郑经武等[4]测定了国内8个省市22个小麦品种对禾谷孢囊线虫山西太谷群体的抗性,获得了‘扬麦5号’和‘郑州831’两个抗性品种;王振跃等[5]筛选出对河南郑州群体表现高度抗性的‘CD01’和‘CD1234’2个小麦材料;赵洪海等[6]对15个山东小麦主栽品种进行室外盆栽测定,发现供试品种均为感病品种。有研究表明大豆对孢囊线虫(H.glycines)的抗性主要表现在结构、生理和化学等方面对线虫设置障碍,阻止2龄幼虫(J2)的侵入或扰乱线虫的发育进程,使线虫不能完成生活史[7]。然而,目前关于不同抗感小麦品种与禾谷孢囊线虫互作表型研究的相关报道较少。因此,明确禾谷孢囊线虫与不同抗感品种小麦根系的互作差异,对于揭示小麦品种抗性机制、有效开发利用抗性资源具有重要意义。
作者以禾谷孢囊线虫江苏沛县群体为研究对象,连续3年开展了不同小麦品种对线虫的抗感性测定,筛选出了高抗品种‘华麦1号’,同时明确了‘豫麦34’和‘矮抗58’分别为中感和高感品种[8],本研究进一步观察比较了沛县群体2龄幼虫侵入上述不同抗感品种线虫前后的表型差异,为揭示小麦品种抗性机制及有效利用抗线虫品种提供理论依据。
1 材料与方法
1.1 供试材料
品种‘华麦1号’和‘豫麦34’由江苏沛县农林局提供,‘矮抗58’由河南省农业科学院小麦研究中心培育。
禾谷孢囊线虫群体来自江苏省沛县当季小麦收获后的田间自然病土,采集的土样在室内自然风干后,用漂浮过筛法分离样品中的孢囊[9],在体式显微镜下挑选饱满孢囊,放入1 mL离心管中经0.5% NaClO 表面消毒5 min,再用无菌蒸馏水反复冲洗3~5次。将装有孢囊的离心管置于5 ℃恒温箱8周后,滴加适量无菌水,置于15 ℃培养箱孵化J2,收集J2悬浮液备用。
1.2 线虫对根尖的趋性观察
线虫对根尖的趋性观察参照Wang等的方法[10],在4 ℃条件下将Pluronic F-127(丙二醇嵌段聚醚F-127,Sigma,USA)粉末溶解于蒸馏水中并放置24 h,配制成23%(W/V)胶体溶液(pH 7.0),在溶液中加入收集的禾谷孢囊线虫J2,调节胶体浓度为40条J2/100 μL,15 ℃保存备用。麦种在25 ℃下催芽72 h,选取各品种胚根长势相近的种子,切取长约0.5 cm及1 cm的胚根尖端,分别采用细胞培养板和载玻片方法观察根尖对线虫的吸引能力。
细胞培养板观察法是在24孔细胞培养板的孔中加入1 mL Pluronic F-127线虫胶体溶液,在孔中分别放入‘华麦1号’、‘豫麦34’和‘矮抗58’的0.5 cm长根尖一段,在显微镜(Olympus DP72)下观察接种1 h和3 h后线虫对品种的趋性,各品种重复4次;此外,在培养板单孔中同时放入各品种的一段根尖,分别观察0、2、4和6 h的线虫趋性,重复4次。载玻片观察法是滴加200 μL Pluronic F-127线虫胶体溶液于载玻片上,放入1 cm长根尖一段,盖上盖玻片后,在显微镜下,分别统计0、2、4、6和8 h时间段吸引到根尖周围2 mm的J2数量, 各品种重复4次。
1.3 线虫在根组织内的侵染进程观察
将各品种催芽至胚根长约2 cm的幼苗,分别栽入装有灭菌沙壤土(沙壤比1∶3)的PVC管(直径3 cm×长度15 cm)中,在麦苗茎基部周围插3个深约2 cm的小孔,用移液器接入J2悬浮液,每3 d接种1次,共接种3次,累计接种400条,每次接种后用细土覆盖。接种后的麦苗置于人工光照培养室中,室温控制在(15±2)℃,光照14 h。在最后一次接种后的第10、20、30、40和50天各取每品种的3株苗,洗净根部后用次氯酸钠—酸性品红染色[11],在显微镜下统计侵入根内的J2及其他虫态。每个品种重复4次。
1.4 数据整理与分析
采用SPSS 11.5软件对所有数据进行方差统计分析,用Duncan氏新复极差法检验平均值的差异显著性,应用Excel软件进行图表绘制。
2 结果与分析
2.1 不同抗感小麦品种根尖对线虫的吸引能力
采用细胞培养板法观察三维空间下不同抗感小麦品种根尖对禾谷孢囊线虫的吸引能力,结果显示,根尖放入前,线虫随机分布在Pluronic F-127胶体中,放入根尖后,J2开始逐渐向根尖移动,1 h时少量线虫开始分别聚集在3个品种的根尖周围,3 h时根尖周围线虫明显增多,无论高抗品种‘华麦1号’,还是中感品种‘豫麦34’和高感品种‘矮抗58’,均有大量J2聚集在根尖的分生区和伸长区,其中‘华麦1号’周围线虫相对较少,‘矮抗58’的数量最多(图1)。

图1 细胞培养板上不同抗感小麦根尖对Pluronic F-127 胶体中禾谷孢囊线虫2龄幼虫的吸引Fig.1 Attraction of wheat root tips with different resistance levels to Heterodera avenae J2 in cell culture plate with Pluronic F-127 gel
将3个小麦品种的根尖置于同一胶体后,观察线虫向根尖聚集的情况,2 h时,‘矮抗58’的根尖周围有大量J2聚集,而‘华麦1号’和‘豫麦34’根尖周围的线虫聚集并不明显;4 h时,‘矮抗58’聚集更为明显,且线虫更接近根部,同时‘华麦1号’和‘豫麦34’根尖周围也出现了一定数量的2龄幼虫;6 h时,3个品种的根尖周围线虫数量进一步增加,并且‘矮抗58’根尖周围线虫数量明显多于其他2个品种(图2)。

图2 细胞培养板上3个小麦品种根尖对Pluronic F-127 胶体中禾谷孢囊线虫2龄幼虫的吸引Fig.2 Attraction of wheat root tips of 3 wheat cultivars to Heterodera avenae J2 in cell culture plate with Pluronic F-127 gel
为了定量分析不同抗感品种小麦根尖对线虫的吸引能力,采用载玻片法观察了低密度下的线虫移动情况,与细胞培养板三维空间条件下观察的结果相似,根尖放入前,线虫随机分布于胶体中;放入根尖时,有少量线虫开始聚集在根尖周围,2 h时各品种小麦根尖周围均聚集了一定数量的J2(图3)。统计分析显示(图4),0 h时,3个品种小麦根尖周围线虫较少,且数量基本一致,在8.3~9.0条之间;2 h时,各品种根尖周围线虫明显增多,‘矮抗58’根尖聚集了34.0条J2,‘豫麦34’和‘华麦1号’分别为25.8条和22.8条,品种间J2数量无显著差异(P<0.05);4 h和6 h各品种根尖聚集线虫持续增多,但增幅变小,‘矮抗58’根尖周围线虫增加的数量及总量均大于其他两个品种,4 h时矮抗58与‘华麦1号’、‘豫麦34’的J2数量差异显著(P<0.05);6 h以后,各品种根尖周围线虫数量不再增加,最终‘矮抗58’根尖周围聚集J2数量达到48.0条,豫麦34为39.0条,而‘华麦1号’为33.3条,‘华麦1号’与‘矮抗58’之间存在显著差异(P<0.05)。

图4 三个小麦品种对Pluronic F-127胶体中禾谷孢囊线虫2龄幼虫吸引数量的比较Fig.4 Comparison of Heterodera avenae J2 attracted by root tips of 3 wheat cultivars in Pluronic F-127 gel
2.2 线虫对不同抗感小麦品种的侵染
通过室内人工接种法观察并比较不同品种根系内禾谷孢囊线虫J2的侵入及发育情况,从图5可以看出,接种10 d后单株‘矮抗58’的根系内侵入J2数量平均达83.7条,‘豫麦34’达56.7条,而‘华麦1号’仅有24.3条;20 d后各品种根系内的线虫数量明显下降,‘矮抗58’为46.0条,‘豫麦34’为37.0条,而‘华麦1号’最少,为4.7条;30~40 d的根内幼虫及根系表面白雌虫数量略有变化,但波动较小,至 50 d时,单株‘矮抗58’的根系表面白雌虫有30.0个,‘豫麦34’有19.3个,而‘华麦1号’最少,仅有4.3个。虽然禾谷孢囊线虫能够侵入高抗品种‘华麦1号’,并且完成生活史,但侵入根内的J2量及根系上的白雌虫量要显著低于‘豫麦34’和‘矮抗58’。

图5 禾谷孢囊线虫在不同抗感小麦品种根内的群体密度变化Fig.5 Dynamics of population densities of Heterodera avenae in roots of wheat cultivars with different resistance levels
禾谷孢囊线虫J2侵入‘华麦1号’根系并在根内发育的过程,与感病品种‘豫麦34’和‘矮抗58’类似,侵入后的J2分布在根的输导组织维管束周边(图6a),之后会有少量的J2能够建立取食位点,并进一步发育为3龄幼虫(图6b)和 4龄幼虫(图6c),最后发育为白色雌成虫,撑破根表皮露在根外(图6d),老熟后变为褐色孢囊。
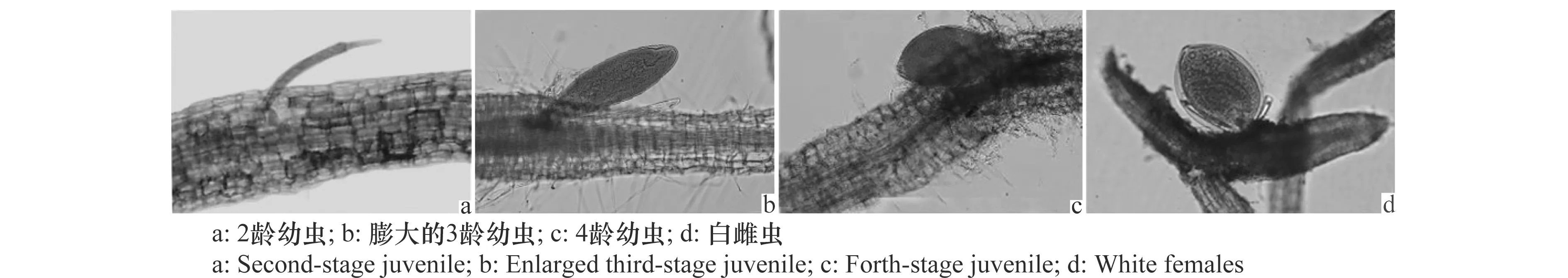
图6 禾谷孢囊线虫在‘华麦1号’根组织内的发育Fig.6 Development of Heterodera avenae in the root of wheat cultivar ‘Huamai No.1’
3 讨论
病原物一般具有向寄主方向移动或生长的能力,称为趋性,即植物表面或组织周围分泌的化学物质对病原物的侵入具有刺激或诱发作用,如洋葱和大蒜根部分泌物中的亚砜能刺激白腐小核菌(Sclerotiumcepivorum)的菌核萌发[12],大豆根部分泌的异黄酮能吸引大豆疫霉(Phytophthorasojae)[13]。植物寄生线虫同样具有类似的机制,有研究证实,线虫的这种趋性现象可能归因于CO2浓度梯度,根际周围CO2分解会引起pH的变化,而低pH环境较易吸引线虫的积聚[10,14-15]。本研究利用Pluronic F-127胶体观察线虫对抗/感不同品种的趋性试验表明,禾谷孢囊线虫J2对高抗品种‘华麦1号’、中感品种‘豫麦34’以及高感品种‘矮抗58’的根尖具有明显的趋性,但对‘华麦1号’的趋性明显弱于2个感病品种;3个品种的根尖竞争性试验表明,高感品种能够吸引大量线虫,品种间具有明显差异,推测可能与品种的根系分泌物有关,而进一步深入研究造成这种差异的生理生化机理,可为今后开发有效的线虫防治药剂或策略提供一定的思路。
室内接种试验结果表明,禾谷孢囊线虫的2龄幼虫均能侵入抗感性不同的3个小麦品种,这一现象与大豆孢囊线虫(Heteroderaglycines)侵入大豆抗性品种[16]以及根结线虫侵染含Mi基因番茄[17-18]的过程较相似,表明抗性品种很大程度上是通过抑制侵入线虫的发育来实现的。由于华麦1号对禾谷孢囊线虫J2的吸引明显弱于2个感病品种,可能导致了接种10 d时‘华麦1号’根系中的线虫数量明显少于2个感病品种,推测抗性品种通过早期抵抗线虫侵入,从而减少线虫对其自身的危害。在接种线虫10 d到20 d的期间内,3个品种小麦根系中的线虫数量均有减少,推测可能是由于大量线虫同时侵入少量的根系中,空间与养分的竞争导致部分线虫离开根系或者发育受到抑制。比较3个品种最终形成的白雌虫量与侵入J2量的比值发现,接种10 d时侵入‘华麦1号’根中的J2仅有17.8%成功建立了取食位点并完成了生活史,低于‘豫麦34’的34.1%和‘矮抗58’的35.8%,表明‘华麦1号’能抑制已侵入的J2在根系内的发育,而‘华麦1号’参与抑制禾谷孢囊线虫发育的生理生化因子需要进一步深入地研究。
此外,崔磊等[19]研究菲利普孢囊线虫(Heteroderafilipjevi)与不同抗性小麦根的互作,揭示菲利普孢囊线虫20 d时开始大量侵入,40 d左右达到最高峰,而本研究中的禾谷孢囊线虫在10 d时已成功侵入小麦根系,两种线虫的侵入高峰期存在明显差异,推测可能是由两种线虫的生物学特性以及小麦品种的抗性不同等因素造成的。近年来我国在禾谷孢囊线虫的发生分布、生物学特性、抗性品种筛选及病害综合防控等方面开展了大量的工作,进一步深入开展抗线虫小麦品种的抗性机制研究,对今后制定更加有效的防控策略具有重要的意义。
[1] Hajihasani A,Tanha Maafi Z,Nicol J M,et al.Relationships between population densities of the cereal cyst nematodeHeteroderalatiponsand yield losses of winter wheat in microplots[J].Australasian Plant Pathology,2010,39(6):530-535.
[2] Peng D L,Nicol J M,Li H M,et al.Current knowledge of cereal cyst nematode (Heteroderaavenae)on wheat in China [M]∥Riley I T,Nicol J M,Dababat A A,eds.Cereal cyst nematodes:status,research and outlook.Ankara,Turkey:CIMMYT,2009:29-34.
[3] Ogbonnaya F C,Eastwood R F, Lagudah E.Identification and utilization of genes for cereal cyst nematode resistance (Heteroderaavenae)resistance in wheat:the Australian experience[M]∥Riley I T,Nicol J M,Dababat A A,eds.Cereal cyst nematodes:status,research and outlook.Ankara,Turkey:CIMMYT,2009:166-171.
[4] 郑经武,林茂松,程瑚瑞,等.麦类作物对燕麦孢囊线虫的抗病性[J].植物保护学报,1999,26(3):250-255.
[5] 王振跃,高书峰,李洪连,等.不同小麦品种(系)对禾谷孢囊线虫病的抗性鉴定[J].河南农业科学,2006(5):49-52.
[6] 赵洪海, 杨远永, 彭德良, 等. 山东省主要小麦品种对禾谷孢囊线虫抗性的初步评价[J]. 青岛农业大学学报, 2011, 28(4): 261-266.
[7] 颜清上,陈品三,王连铮.中国小黑豆抗源对大豆孢囊线虫4号生理小种抗性机制的研究I.抗源品种对大豆孢囊线虫侵染和发育的影响[J].植物病理学报,1996,26(4):317-323.
[8] 刘炳良,孙成刚,王暄,等.小麦品种对禾谷孢囊线虫(Heteroderaavenae)江苏沛县群体的抗性鉴定[J].麦类作物学报,2012,32(3):563-568.
[9] 彭德良,张东升,齐淑华,等.禾谷孢囊线虫调查适期和方法[J].植物保护,1993,19(6):48.
[10]Wang C,Bruening G,Williamson V M.Determination of preferred pH for root-knot nematode aggregation using Pluronic F-127 gel [J].Journal of Chemical Ecology,2009,35(10):1242-1251.
[11]冯志新.植物线虫学[M].北京:中国农业出版社,2001:1.
[12]梁静,程智慧.大蒜白腐病及其防治方法研究进展[J].中国蔬菜,2010(14):13-18.
[13]Hua C,Wang Y,Zheng X,et al.APhytophthorasojaeG-protein α subunit is involved in chemotaxis to soybean isoflavones[J].Eukaryotic Cell,2008,7(12):2133-2140.
[14]Robinson A F.Movement of five nematode species through sand subjected to natural temperature gradient fluctuations [J].Journal of Nematology,1994,26(1):46-58.
[15]Pline M,Dusenbery D B. Responses of plant-parasitic nematodeMeloidogyneincognitato carbon dioxide determined by video camera-computer tracking [J].Journal of Chemical Ecology,1987,13(4):873-888.
[16]Kim Y H,Riggs R D,Kim K S.Structural changes associated with resistance of soybean toHeteroderaglycines[J].Journal of Nematology,1987,19(2):177-187.
[17]Brown C R,Mojtahedi H,Santo G S,et al.Effect of theMigene in tomato on reproductive factors ofMeloidogynechitwoodiandM.hapla[J].Journal of Nematology,1997,29(3):416-419.
[18]Regaieg H,Horrigue-Raouani N.Histological response of resistant tomato cultivars to infection of virulent Tunisian root-knot nematode (Meloidogyneincognita) populations[J].Archives of Phytopathology and Plant Protection,2012,45(17):2036-2045.
[19]崔磊,高秀,王晓鸣,等.不同抗性小麦根与菲利普孢囊线虫(Heteroderafilipjevi)互作的表型特征[J].作物学报,2012,38(6):1009-1017.
(责任编辑:田 喆)
Phenotype characterization of interaction between different wheat cultivars andHeteroderaavenae
Hu Xiaobin, Liang Xudong, Zhang Long, Chi Yuankai, Wang Xuan, Li Hongmei
(Key Laboratory of Integrated Management of Crop Diseases and Pests,Ministry of Education, College of Plant Protection, Nanjing Agricultural University, Nanjing 210095,China)
In order to understand the resistance mechanism of the wheat cultivar ‘Huamai No.1’ toHeteroderaavenae, the difference between the resistant cultivar ‘Huamai No.1’, susceptible cultivar ‘Yumai No.34’ and ‘Aikang No.58’ in root tips attracting second-stage juveniles (J2s) ofH.avenaewere compared using Pluronic F-127 gel as a medium. The infection and development of J2s in roots of the three cultivars were also observed through greenhouse inoculation test. The results showed that J2s ofH.avenaewere able to be attracted by the root tips of the three cultivars. The attraction ability of ‘Huamai No.1’ was stronger than that of ‘Aikang No.58’, with significant difference in the total number of J2s attracted at 4 h and 6 h after inoculation (P<0.05). Tissue staining revealed that J2s were capable to penetrate into the root system regardless of the cultivar resistance. However, the amounts of J2s that penetrated the root system and the white females produced in the root system of ‘Huamai No.1’ were significantly lower than those in ‘Yumai No.34’ and ‘Aikang No.58’. The study suggested that the resistance mechanism of ‘Huamai No.1’ might be decreasing the penetration of J2s and suppressing the nematode development in the root system.
Heteroderaavenae; resistance; attraction; infestation
2014-05-29
2014-08-05
公益性行业(农业)科研专项(200903040)
S 435.121
A
10.3969/j.issn.0529-1542.2015.04.014
* 通信作者 E-mail:lihm@njau.edu.cn

