皮肤恶性肢端黑素瘤中c-kit基因的表达及突变分析
周璐 黄莹雪 胡彬 吴侃 邵雪宝 李阿梅 陈浩 孙建方
皮肤恶性肢端黑素瘤中c-kit基因的表达及突变分析
周璐 黄莹雪 胡彬 吴侃 邵雪宝 李阿梅 陈浩 孙建方
目的 分析皮肤恶性肢端黑素瘤患者中c-kit基因突变的频率与类型及表达情况。方法 应用PCR、基因测序、免疫组化染色等方法检测115例皮肤恶性黑素瘤(CMM)患者、30例肢端黑素细胞痣患者及15例健康人皮肤组织标本中c-kit基因序列及c-kit蛋白表达情况。采用χ2检验、Mann-WhitneyU检验、Spearman相关检验等统计学方法分析数据。结果 93例肢端CMM中84例(90.3%)表达c-kit蛋白,22例非肢端CMM中18例(81.8%)表达。58例肢端侵袭性CMM中,29例真表皮交界处肿瘤细胞c-kit蛋白表达强阳性,而8例真皮内呈侵袭浸润性生长的肿瘤细胞则不表达或弱表达c-kit蛋白;健康人皮肤组织中c-kit蛋白表达较弱;在30例肢端黑素细胞痣中19例(63.3%)阳性表达。c-kit蛋白在93例肢端CMM组的阳性表达率(90.3%)显著高于肢端黑素细胞痣组(63.3%),两组差异有统计学意义(χ2=12.14,P<0.05);71例侵袭性CMM中,c-kit蛋白在58例肢端CMM中阳性表达55例(94.8%),在13例非肢端CMM中阳性表达11例,在肢端CMM的表达高于非肢端CMM,两组差异有统计学意义(χ2=4.18,P<0.05)。在原位、侵袭性、转移性肢端CMM组织中,c-kit蛋白表达水平与肿瘤的临床病理特征均未见明显相关(均P>0.05)。115例CMM中检测到4例患者存在c-kit基因点突变,其中3例为L576P突变,1例为K642E突变,且均为肢端CMM,免疫组化显示弥漫性c-kit蛋白强阳性表达。结论 在侵袭性CMM中,c-kit蛋白在肢端CMM中的表达高于非肢端CMM。肢端CMM中检测到c-kit基因点突变,均为肢端型较常见的突变类型,但突变率较国外文献低。
黑色素瘤;痣,色素;原癌基因蛋白质c-kit;点突变;C-kit基因
皮肤恶性黑素瘤(CMM)依据是否有紫外线暴露史及解剖部位分为无慢性光损伤型、有慢性光损伤型、黏膜型及肢端CMM[1]。肢端CMM主要是指肿瘤生长于无毛的皮肤表面,如手掌、足底、甲床等部位。c-kit基因的活化突变与多种人类恶性肿瘤相关,如胃肠间质瘤、精原细胞瘤等[2]。和其他类型的CMM相比,肢端和黏膜CMM存在不同的遗传变异和生物学行为,研究发现,36%的肢端CMM存在c-kit基因突变和(或)基因拷贝数增加,而BRAF和NRAS基因的突变较少见[1,3]。本研究分析中国人群肢端CMM患者c-kit基因突变的频率与类型及蛋白表达情况,为肢端CMM的靶向治疗提供新的依据。
一、资料与方法
(一)病例资料:选取2010年1月至2013年6月我院经组织病理学诊断的115例CMM石蜡包埋标本,15例健康人皮肤石蜡标本,30例良性黑素细胞痣石蜡标本。115例CMM中,男49例,女66例,年龄24~90岁,中位年龄60岁。所有患者均经2位有经验的皮肤病理科医生通过临床表现、组织学及免疫组化染色结果(包括 S100、HMB-45、MART-1、ki67)综合分析,确诊为CMM。115例中,肿瘤分布于肢端93例,非肢端22例;组织学上表现为原位肿瘤的32例,侵袭性肿瘤的83例(其中转移性肿瘤12例)。93例恶性肢端CMM患者中,女56例,男37例;Clark分级Ⅰ~Ⅱ级38例,Ⅲ~Ⅴ级55例。22例恶性非肢端CMM中,女10例,男12例;ClarkⅠ~Ⅱ级7例,Ⅲ~Ⅴ级15例。肢端黑素细胞痣30例中,发育不良痣4例,普通良性痣26例。
(二)c-kit基因突变检测:
1.石蜡包埋组织中基因组DNA提取:含有肿瘤的蜡块组织以5μm厚度切片,采用QIAamp DNA FFPE Tissue试剂盒(德国Qiagen公司),按说明操作,最终获得DNA样本,并通过紫外分光光度计测定DNA浓度。
2.c-kit基因第11、13、17号外显子 PCR 扩增:kit基因引物序列、扩增片段长度和退火温度见表1[4]。各对PCR引物由生工生物工程(上海)股份有限公司合成。25μl扩增体系为:1~5μmol基因组DNA(DNA质量浓度100~200 ng/25μl)加入 12.5μl PromegaGoTaq® Green Master Mix中,分别加入kit基因第11、13、17号外显子对应的上下游引物各3μl,最后加入去离子水配成25μl的总反应体系,PCR仪(美国ABI公司)上进行目的基因片段扩增,扩增条件:95℃预变性5min后,94℃变性25 s,各自退火温度退火30 s,72℃延伸25 s,完成45个循环。72℃总延伸5min,放置于4℃保存。
3.DNA测序:以上PCR产物经琼脂糖凝胶电泳扩增出特异性目的条带后,送生工生物工程(上海)股份有限公司进行DNA测序。
(三)免疫组化染色:所有石蜡组织标本按3μm厚度切片,敷贴于10%多聚赖氨酸预先处理的载玻片上,石蜡切片脱蜡脱水,置于EDTA缓冲液(0.01 mol/L,pH8.0)中高压修复10min,室温自然冷却;滴加一抗(即用型兔抗人CD117抗体),湿盒中4℃过夜;再滴加二抗(HRP-抗鼠/兔抗体)孵育,DAB显色,苏木素复染细胞核,1%盐酸乙醇分化,中性树胶封片。一抗、二抗、DAB显色液均为福州迈新生物技术开发有限公司生产。上述各步骤之间均以磷酸盐缓冲液(PBS)漂洗3次。以已证实的肥大细胞瘤组织切片作为阳性对照,PBS缓冲液代替一抗作为空白对照。所有组织染色条件相同。采用日本Nikon公司显微镜工作台及照相系统观察结果。
(四)免疫组化结果判定标准:细胞膜和(或)胞质呈棕褐色颗粒着色为阳性细胞,不着色者为阴性;皮脂腺、汗腺基底层及肥大细胞阳性染色为阳性内对照。高倍镜下(400×)随机选择5个视野,计数全部有核细胞,分别计算切片中着色强度和计算着色阳性细胞百分率。着色强度:强着色为3分,中等着色为2分,弱着色为1分,不着色或着色不清为0分;着色阳性细胞百分率 >50%为3分,10%~50%为2分,<10%为1分,不着色为0分,最后将两项分值相乘得出最终的免疫组化积分。组化积分:0~1分为(-),2~3分为(+),4~6分为(++),>6分为(+++)。结果判定由2名皮肤病理医生独立进行,每张组化切片均与HE染色切片进行对照观察,以正确判断肿瘤细胞阳性表达的范围。
(五)统计学分析:应用SPSS 17.0统计软件包分析。计数资料比较采用χ2检验,等级资料比较采用Mann-WhitneyU检验,c-kit和肿瘤进展、肿瘤分级间相关性研究通过Spearman相关检验。P<0.05为差异有统计学意义。
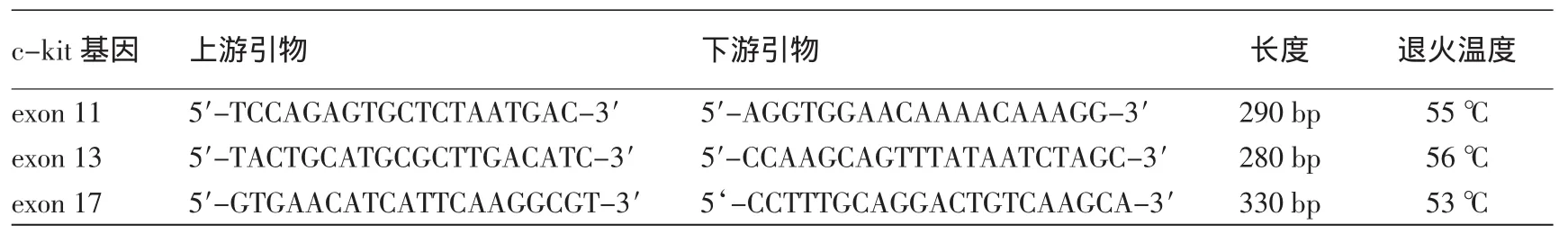
表1 c-kit基因第11、13、17号外显子扩增引物序列及退火温度[4]
二、结果
(一)c-kit蛋白在CMM中的免疫组化表达:15例健康人皮肤组织中c-kit蛋白表达较弱,2例弱阳性表达散在分布于个别表皮基底层的黑素细胞,染色程度弱(图1)。30例肢端黑素细胞痣组织中,c-kit蛋白阳性表达19例,其中阳性表达+++3例,++9例,+7例,阳性染色位于细胞膜和(或)胞质(图2)。93例肢端CMM中84例(图3)、22例非肢端CMM中18例表达c-kit蛋白(图4)。转移性CMM中,真皮内肿瘤细胞c-kit蛋白表达弱阳性或阴性。58例肢端侵袭性CMM中,29例真表皮交界处肿瘤细胞c-kit蛋白表达强阳性,而8例真皮内呈侵袭浸润性生长的肿瘤细胞则不表达或弱表达c-kit蛋白。
肢端CMM组93例中c-kit蛋白阳性表达84例(90.3%),显著高于肢端黑素细胞痣组(63.3%),两组表达差异有统计学意义(χ2=12.14,P<0.05)。肢端CMM 58例中c-kit蛋白阳性表达55例(94.8%),13例非肢端CMM中阳性表达11例,在肢端CMM的表达高于非肢端CMM,两组表达差异有统计学意义(χ2=4.18,P<0.05)。肢端CMM在男性与女性、Clark分级Ⅰ~Ⅱ级与Ⅲ~Ⅴ级、有与无溃疡、有与无炎症细胞浸润组间,经Mann-WhitneyU检验,c-kit蛋白表达差异均无统计学意义(均P>0.05,表2)。在肢端CMM中,采用Spearman相关检验,c-kit蛋白表达与肿瘤进展、Clark等级、Breslow厚度分级均无相关性(均P>0.05)(表3)。
(二)皮肤CMM中c-kit突变基因的检测结果:对115例皮肤CMM石蜡包埋组织进行基因组DNA提取,以基因组DNA为模板,分别采用针对c-kit基因第11、13、17号外显子的3对引物在各自的条件下分别扩增产物(图5)后,进行产物序列测定并与Genbank公布的序列进行比对。
通过对c-kit基因11、13、17号外显子扩增的特异性DNA序列测序发现,115例CMM组织标本中共检测到4例突变,且均为点突变,c-kit基因总突变率为3.5%。11、13号外显子分别检测到有3例和1例突变,17号外显子未检测到突变;11号外显子点突变类型均为L576P(即11号外显子第1727位胸腺嘧啶T→胞嘧啶C的突变,使得密码子CTT变为CCT,导致576位的氨基酸亮氨酸L→脯氨酸P);13号外显子点突变类型为K642E(即13号外显子第1384位腺嘌呤A→鸟嘌呤G的突变,使得密码子AAA变为GAA,导致462位的氨基酸赖氨酸K→谷氨酸E)(图6),且出现突变的组织均再重复2次进行PCR及测序。同时,再次选取上述4例含有突变的肿瘤旁正常组织,提取DNA、扩增并测序(方法同前),均未发现基因突变,提示L576P、K642E是肿瘤组织中发生的基因突变。在4例c-kit突变病例的组化切片中,均表现为弥漫性CD117蛋白的强阳性表达。
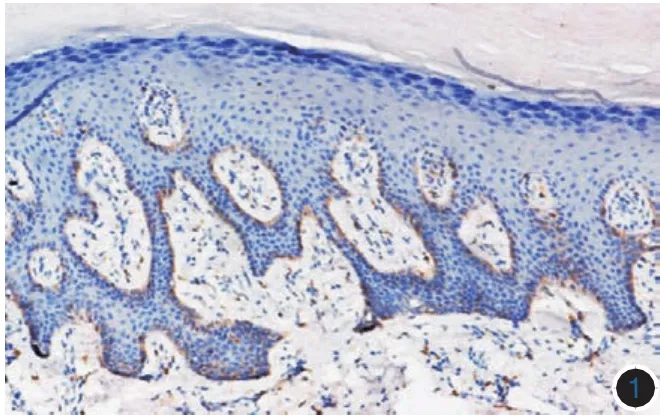
图1 健康人肢端皮肤组织c-kit蛋白弱阳性表达(DAB染色×100)

图2 肢端黑素细胞痣组织c-kit蛋白阳性表达(DAB染色×100)

图3 肢端原位皮肤恶性黑素瘤组织c-kit蛋白阳性表达(DAB染色×40)
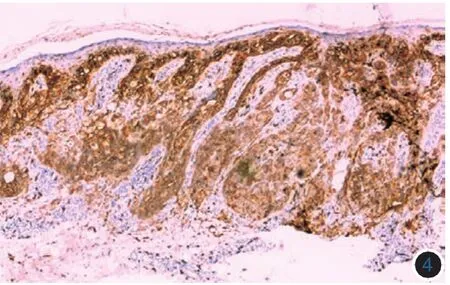
图4 非肢端皮肤恶性黑素瘤组织c-kit蛋白强阳性表达(DAB染色×100)

表2 93例肢端皮肤恶性黑素瘤组织中c-kit蛋白(CD117)表达与肿瘤的临床及病理特征的联系

表3 肢端皮肤恶性黑素瘤组织中c-kit蛋白(CD117)表达与临床病理特征的相关性分析
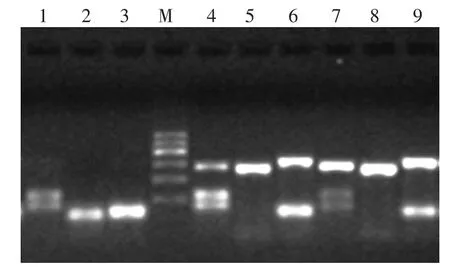
图5 c-kit 11、13、17号外显子凝胶电泳图 1~3:阴性对照;M:标准参照物(自上向下:600、500、400、300、200、100 bp);4~ 6 和7~9:分别为患者1和患者2的11、13和17号外显子(分别为290、280、330 bp)
三、讨论
c-kit蛋白(CD117)是跨膜的酪氨酸激酶受体,与配体干细胞因子结合发挥生物学作用;在多种正常细胞中均检测到c-kit蛋白表达增高,如造血细胞、精细胞、Cajal间质细胞、乳腺导管上皮细胞、肥大细胞以及黑素细胞等[5]。在 CMM 中,c-kit突变常见于黏膜型、肢端型及原发于慢性光损伤皮肤的CMM;多个研究报道,在肢端CMM中 c-kit突变率为11%~25%[1,5-6]。c-kit蛋白在良性黑素细胞痣及黑素细胞中均可表达,提示在黑素细胞生长、增殖的过程中c-kit蛋白可能发挥着重要作用[5,7]。
在一项包括了522例中国人CMM的调查中显示,肢端CMM为中国人群中最常诊断的CMM亚型,约占41.8%[8]。李丽等[9]检测 262 例中国人 CMM 中 21 例患者肿瘤组织中c-kit基因存在明显扩增,其中肢端型和非肢端型扩增比例分别为8.24%(7/85)和5.06%(4/79);上述21例患者中仅2例同时伴有c-kit基因突变,突变类型为11号外显子L576P和13号外显子K642E突变。我们检测了115例中国人CMM组织c-kit蛋白表达及基因突变情况,其中肢端型占80.9%。文献报道,c-kit在肢端CMM中的阳性表达比例范围较广(37.3%~81%)[6,10];我们通过免疫组化染色显示,90.3%肢端CMM和81.8%非肢端CMM表达c-kit蛋白,数值略高于文献报道。我们还观察到,在侵袭性CMM中,真表皮交界处肿瘤细胞c-kit蛋白表达强阳性,而真皮内呈侵袭浸润性生长的肿瘤细胞则不表达或弱表达c-kit蛋白,此现象与既往文献报道类似[7],提示在大部分CMM进展过程中可出现c-kit蛋白失表达的现象。另一方面,经统计学分析,c-kit蛋白在皮肤CMM中的表达与其临床病理特征间均未见明显差异及相关性。
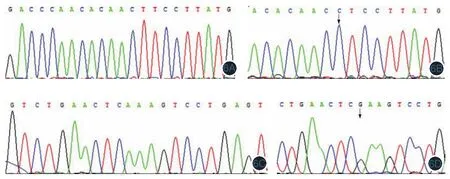
图6 原发性皮肤黑素瘤中c-kit基因突变情况 6A:c-kit 11号外显子序列;6B:c-kit 11号外显子L576P突变;6C:c-kit 13号外显子序列;6D:c-kit 13号外显子K642E突变。箭头所指即为突变位点
我们研究中发现4例CMM组织存在c-kit基因的点突变,总突变率为3.48%,较既往文献报道的比例偏低[6,9-10];我们的病例以肢端CMM为主,在肢端CMM中突变率为4.30%,提示肢端CMM的突变率可能较其他部位高,且突变位点位于11号外显子(L576P)和13号外显子(K642E)。文献报道,90%存在c-kit基因突变的CMM常表现为点突变[11]。CMM最常见的c-kit突变位点位于11号染色体的L576P点突变(约占总突变30%~40%),其次为位于13号染色体的 K642E 点突变(约占总突变 16.3%)[4,6]。本研究发现的两种点突变类型与国内文献报道相似[9],未发现新的突变位点或突变形式。文献报道,在不典型肢端黑素细胞痣中,发现c-kit蛋白表达与突变之间缺乏相关性[4];同样,本研究CMM组织中未发现c-kit表达与c-kit基因突变之间的联系。因此,在肢端CMM患者中,c-kit免疫组化染色并不能做为筛选c-kit基因突变的有效方法。值得注意的是,4例检测出突变的肢端CMM病例,其c-kit蛋白表达均为强阳性,占肢端CMM总强阳性病例的9.52%,提示c-kit免疫组化显示强阳性的病例接受酪氨酸激酶抑制剂治疗也可能获得较好疗效。
[1]Curtin JA,Busam K,Pinkel D,et al.Somatic activation of KIT in distinct subtypes of melanoma [J].J Clin Oncol,2006,24(26):4340-4346.
[2]Holden JA,Willmore-Payne C,Layfield LJ.Tyrosine kinase activating mutations in human malignancies:implications for diagnostic pathology[J].Exp Mol Pathol,2008,85(1):68-75.
[3]Roesch A,Burgdorf W,Stolz W,et al.Dermatoscopy of"dysplastic nevi":a beacon in diagnostic darkness[J].Eur J Dermatol,2006,16(5):479-493.
[4]Park E,Yang S,Emley A,et al.Lack of correlation between immunohistochemical expression of CKIT and KIT mutations in atypical acral nevi[J].Am J Dermatopathol,2012,34(1):41-46.
[5]Went PT,Dirnhofer S,Bundi M,et al.Prevalence of KIT expression in human tumors[J].J Clin Oncol,2004,22(22):4514-4522.
[6]Yun J,Lee J,Jang J,et al.KIT amplification and gene mutations in acral/mucosal melanoma in Korea [J].APMIS,2011,119(6):330-335.
[7]Chi Z,Li S,Sheng X,et al.Clinical presentation,histology,and prognoses of malignant melanoma in ethnic Chinese:a study of 522 consecutive cases[J].BMC Cancer,2011,11:85.
[8]Montone KT,van Belle P,Elenitsas R,et al.Proto-oncogene c-kit expression in malignant melanoma:protein loss with tumor progression[J].Mod Pathol,1997,10(9):939-944.
[9]李丽,孔燕,李海夫,等.262例中国人黑色素瘤C-KIT基因扩增分析[J].临床肿瘤学杂志,2010,15(5):385-389.
[10]Dai B,Cai X,Kong YY,et al.Analysis of KIT expression and gene mutation in human acral melanoma:with a comparison between primary tumors and corresponding metastases/recurrences[J].Hum Pathol,2013,44(8):1472-1478.
[11]Ni S,Huang D,Chen X,et al.c-kit gene mutation and CD117 expression in human anorectal melanomas[J].Hum Pathol,2012,43(6):801-807.
2014-05-08)
(本文编辑:颜艳)
Expression and mutation analysis of the c-kit gene in acral cutaneous malignant melanoma
Zhou Lu,Huang Yingxue,Hu Bin,Wu Kan,Shao Xuebao,Li A′mei,Chen Hao,Sun Jianfang.Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
s:Chen Hao,Email:ch76ch@163.com;Sun Jianfang,Email:sunjf57@163.com
ObjectiveTo analyze the frequency and type of mutations in the c-kit gene,and to measure the expression of c-kit protein in patients with acral malignant melanoma.MethodsSkin tissue specimens were collected from the lesions of 115 patients with cutaneous malignant melanoma(CMM)and 30 patients with acral melanocytic nevi,as well as normal skin of 15 healthy human controls.PCR and DNA sequencing were performed to analyze the sequence of the c-kit gene,and immunohistochemical staining was conducted to observe c-kit protein expression in tissue samples.Statistical analysis was done by Chi-square test,Mann-Whitney U test and Spearman′s rank correlation test.ResultsC-kit protein was expressed in 90.3% (84/93)of acral CMM specimens,81.8% (18/22)of non-acral CMM specimens,and 63.3% (19/30)of acral melanocytic nevus specimens.Among 58 acral invasive CMM specimens,29 showed strong expression of c-kit protein in tumor cells at the dermal-epidermal junction,8 showed negative or weak ckit expression in invasive and infiltrating tumor cells in the dermis.The expression rate of c-kit protein was significantly higher in acral CMM specimens than in acral melanocytic nevus specimens (χ2=12.14,P<0.05),and higher in acral than in non-acral invasive CMM specimens(94.8% (55/58)vs.11/13,χ2=4.18,P<0.05).No significant correlation was observed between the clinicopathological feature of melanoma and expression of c-kit protein inin situ,invasive or metastatic acral CMM tissues(allP>0.05).C-kit gene mutations were detected in 4 out of the 115 CMM cases,including L576P mutation in 3 cases and K642E mutation in 1 case.All the 4 patients carrying mutations were diagnosed as acral CMM,and exhibited diffuse and strong expression of c-kit protein.ConclusionsThe expression of c-kit protein is stronger in acral than in non-acral invasive CMM lesions.All the mutations detected in these cases are common types of c-kit mutations in acral CMM,but the mutation frequency is lower than that reported in foreign literature.
Melanoma;Nevus,pigmented;Proto-oncogene proteins c-kit;Point mutation;C-kit gene
10.3760/cma.j.issn.0412-4030.2015.03.012
国家自然科学基金(81102067)
210042南京,中国医学科学院北京协和医学院皮肤病研究所
陈浩,Email:ch76ch@163.com;孙建方,Email:sunjf57@163.com

