实时荧光定量PCR检测不同泌乳时期奶牛乳腺中肽转运蛋白的表达
迟超,刘芳萍,孔庆贺
(1.东北农业大学动物医学学院,哈尔滨 150030;2.哈尔滨维科生物技术开发公司,哈尔滨 150069)
实时荧光定量PCR检测不同泌乳时期奶牛乳腺中肽转运蛋白的表达
迟超1,2,刘芳萍1,孔庆贺2
(1.东北农业大学动物医学学院,哈尔滨 150030;2.哈尔滨维科生物技术开发公司,哈尔滨 150069)
肽转运蛋白是寡肽转运载体(POT)家族成员之一,它以H+梯度为动力,将绝大多数二肽和三肽等小肽从细胞外转运到细胞内。肽转运蛋白分I型(Pept1)和II型(Pept2)两种。过去对肽转运蛋白的研究主要集中于在消化道中,不同转运蛋白的分布及其对小肽等物质的转运上。但,近些年的研究发现,不同种肽转运蛋白在不同组织中有不同的分布于功能,如Pept1乳腺组织中乳蛋白的合成可能有一定作用;Pept2在肾脏中对肾脏的重吸收功能,在肺中对肺部的免疫保护等均起重要作用。
本试验用实时荧光定量PCR检测青春期、妊娠期、泌乳期(高品质乳与低品质乳)和退化期等时期那牛乳腺组织中两种肽转运蛋白的表达变化。试验既为Pept1在乳腺中的功能研究提供了思路,又为奶牛乳腺响应小肽等营养素调节泌乳信号通路的完善提供了一定的试验依据。
1 材料与方法
1.1 试验材料、试剂与仪器
健康的青春期、妊娠期、泌乳期(分产高品质奶组织样与产低品质奶组织样)与退化期中国荷斯坦奶牛组织各5份,共25份,取自黑龙江某奶牛场;实时荧光定量相关试剂购于宝生物公司;7300Real-Time PCR仪购于美国Applied Biosystems公司。
1.2 试验方法
1.2.1 组织RNA的提取本试验用Trizol法进行组织中总RNA的提取。其具体过程参见文献。提取的RNA用1%的凝胶电泳检测其质量,且用无RNA酶的ddH20稀释至各组样品中RNA浓度一致。稀释好的RNA立即反转录成cDNA。
1.2.2 qRT-PCR特异性引物设计以NCBI GeneBank中公布的牛的Pept1、Pept2和β-actin序列,用Primer Premier V5.0软件进行qRT-PCR特异性引物设计。引物由Invitrogen公司合成。引物序列如表1。
1.2.3 qRT-PCR检测各时期组样品中Pept mRNA的表达组样品中Pept mRNA的qRT-PCR检测方法主要参见文献。其过程简略如下:将上一步试验提取的RNA用实时荧光定量反转录试剂盒按照说明书反转录为cDNA,然后以此cDNA为模板,用Pept1、Pept2、β-actin的特异性qRT-PCR引物进行qRT-PCR。qRT-PCR的体系及条件参见qRT-PCR试剂盒说明书。
1.2.4 qRT-PCR检测泌乳期高品质乳与低品质乳组织中Pept mRNA的表达qRT-PCR检测的操作过程同前文所述。
试验选取青春期、妊娠期、泌乳期(分产高品质奶与产低品质奶)与退化期等几个时期的奶牛乳腺组织,提取RNA,实时荧光定量PCR检测各组织中I型和II型肽转运蛋白的表达情况。结果表明,I型肽转运蛋白的表达在青春期较低,在妊娠期与泌乳期显著上升,至泌乳期达到顶峰,在退化期下降至青春期水平;II型肽转运蛋白在各个时期表达无明显变化;在泌乳期高品质乳组织中,I型肽转运蛋白的表达显著高于低品质乳组织,且在这两组样品中,I型肽转运蛋白的表达均显著高于II型肽转运蛋白的表达。结果提示,在奶牛泌乳过程中,I型肽转运蛋白与泌乳的调节有显著的正相关性,而II型肽转运蛋白与泌乳的调节无明显关系。
二肽转运载体;实时荧光定量PCR;奶牛;乳腺

表1 qRT-PCR特异性引物
2 结果
2.1 组织RNA的提取
用Trizol提取各时期奶牛乳腺组织中总RNA,凝胶电泳检测其质量。结果如图1,各个样品的RNA均28S、18S和5S三条带,且由28S到5S条带亮度呈递减的趋势,这说明本试验中提取的组织RNA质量合格,没有降解现象且无DNA或蛋白质污染,用无RNA酶的ddH20调节各组RNA浓度达到一致后就能用于后续试验。

图1 组织RNA提取的凝胶电泳结果图
M:Marker DL2000;1-5:分别为青春期、妊娠期、泌乳期(高品质乳)、泌乳期(低品质乳)、退化期组织样的RNA。各时期均选一个样品为代表。
2.2 qRT-PCR检测各时期组织样品中Pept mRNA的表达
qRT-PCR检测各时期组织中Pept mRNA的表达情况。结果如图2所示,对Pept1来说,青春期表达量较低;妊娠期表达量上升,且较青春期显著升高;泌乳期表达量大幅度上升,且较青春期和妊娠期均显著升高,表达量达到顶峰;退化期表达量显著下降,较妊娠期和泌乳期均显著降低,且比青春期略低,表达量下降至最低水平,从整个过程来看,Pept1在妊娠期表达开始上升,且上升趋势一直维持到泌乳期达到顶峰,然后在退化期下降至略低于青春期水平。对Pept2来说,虽然在泌乳期表达量稍有上升,上升量不显著,从整个过程来看,Pept2在青春期、妊娠期、泌乳期与退化期的表达无显著变化。结果说明,在奶牛泌乳过程中,Pept1与泌乳的调节有明显的正相关性,而Pept2与泌乳的调节无明显关系。

图2 qRT-PCR检测各时期组织中Pept1和Pept2 mRNA的表达
2.3 qRT-PCR检测泌乳期高品质乳与低品质乳组织中Pept mRNA的表达
qRT-PCR检测泌乳期高品质乳与低品质乳组织中Pept mRNA的表达情况。结果如图3所示,在高品质乳组织中,Pept1的表达量显著高于低品质乳组织,并且在同一组织中,不管是高品质乳组织还是低品质乳组织,Pept1的表达均显著高于Pept2。结果说明在奶牛泌乳过程中,Pept1与泌乳的调节有明显的正相关性,而Pept2与泌乳的调节无明显关系。此结果与前面结果一致。
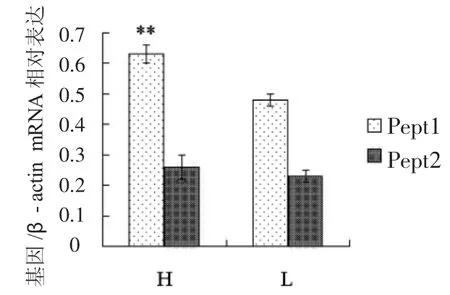
图3 qRT-PCR检测泌乳期高乳品质组织样与低乳品质组织样中Pept1和Pept2 mRNA的表达。H:高乳品质组织样;L:低乳品质组织样。
3 讨论
小肽转运载体是具有多个中心的跨膜蛋白,它在细胞外侧有一个大的亲水外环,在细胞内侧有一个较小的内环,在它的外环上有数个糖基化位点,内环上有蛋白激酶C和蛋白激酶A的磷酸化作用位点。小肽转运载体的这些作用位点是它发挥功能的结构基础。过去的研究认为小肽转运载体主要分布在机体的消化道中,主要参与肠道内的二肽和三肽的跨膜转运。然而,近些年的研究发现,不同类型的小肽转运载体在不同组织中有不同程度的表达,如Pept1在肾小管上皮细胞中、乳腺组织中高表达;Pept2在肾脏、大脑、肺及胰腺中高表达。小肽转运载体的这些分布与表达的变化提示我们,除了传统的参与肠道内的二肽和三肽的跨膜转运的功能外,小肽转运载体可能还存在别的多种未知的功能,并且这些功能可能具有组织特异性。
本试验检测了青春期、妊娠期、泌乳期与退化期等几个时期奶牛乳腺组织中,Pept1和Pept2的表达情况,结果表明,Pept1的表达在泌乳过程中的不同时期有很大的变化,且变化趋势跟泌乳一致,而Pept2的表达在泌乳过程中的不同时期变化不明显。此外,本试验还检测了泌乳期高乳品质组织样和低乳品质组织样中Pept1和Pept2的表达,结果表明,在泌乳期高品质乳组织中,Pept1的表达显著高于低品质乳组织,且在这两组样品中,Pept1的表达均显著高于Pept2的表达。这些结果提示,在奶牛乳腺组织中,Pept1可能是一个重要的泌乳调节因子,对乳腺组织的泌乳具有重要的正向调节作用,而Pept2可能跟乳腺组织的泌乳无直接关系。
[1]Doring F,et al.Functional analysis of a chimeric mammalian peptide transporter derived from the intestinal and renal isoforms [J].Journal of Physiology,1996,497:773-779.
[2]Daniel H,et al.From bacteria to man:archaic proton-dependent peptide transporters at work[J].Physiology,2006,21:93-102.
[3]Rubio-Aliaga I,et al.Peptide transporters and their roles in physiological processes and drug disposition[J].Xenobiotica,2008,38(7/8):1022-1042.
[4]Xiang J M,et al.Kyotorphin transport and metabolism in rat and mouse neonatal astrocytes[J].Brain Research,2010,1347:11-18.
[5]Biegel A,et al.Structural requirements for the substrates of the H+/peptide cotransporter PEPT2 determined by three-dimensional quantitative structure-activity relationship analysis[J].Journal of Medicine Chemistry,2006,49:4286-4296.
[6]Shen H,et al.Immunolocalization of the proton-coupled oligopeptide transporter PEPT2 in developing rat brain[J].Molecular Pharmaceutics,2004,1:248-256.
[7]朱宇旌,等.小肽转运载体1的生物学特性及其功能[J].动物营养学报,2012,24(10):1847-1853.
[8]杨建香,等.小肽转运载体2的转运机制及功能研究[J].动物营养学报,2013,25(6):1174-1179.
[9]赵东欣.寡肽转运蛋白PepT2及其药物转运[J].中国生物化学与分子生物学报,2010,26(1):1-8.
[10]Groneberg D A,et al.Peptide transport in the mammary gland: expression and distribution of PEPT2 mRNA and protein[J].The American Journal of Physiological:Endocrinol and Metabolism,2002,282(5):1172-1179.
[11]Wenzel U,et al.Regulation of the high-affinity H+/peptide cotransporter in renal LLC-PK1 cells[J].Journal of Cell Physiology,1999,178(3):341-348.
[12]Doring F,et al.Hypothyroidism induces expression of the peptide transporter PEPT2[J].Biochemistry,2005,386(8):785-790.
[13]周苗苗,等.泌乳反刍动物乳腺中小肽的摄取、利用及影响因素[J].动物营养学报,2011,23(3):378-380.
[14]Brandsch M,et al.Influence of proton and essential histidyl residues on the transport kinetics of the H+/peptide cotransport systems in intestine(PEPT1)and kidney(PEPT2)[J].Biochimica Biophysica Acta,1997,1324(2):251-262.
[15]Smith DE,et al.Distribution ofglycylsarcosine and cefadroxilamong cerebrospinal fluid,choroid plexus,and brain parenchyma after intracerebroventricular injection is markedly different between wild-type and Pept2 null mice[J].Journal of Cerebral Blood Flow &Metabolism,2011,31:250-261.
10.3969/J.ISSN.1671-6027.2015.08.024