繁殖和高温对栉孔扇贝抗氧化能力的影响*
连姗姗,李 雪,邢 强,赵柏淞,张玲玲,包振民
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
据中国渔业报2011年统计,中国扇贝年养殖产量可达到世界扇贝类年养殖业总产量的80%[1],其中,栉孔扇贝(Chlamysfarreri)是中国重要的本土经济优势种,自然分布于山东半岛和辽东半岛沿海地区。近年来,养殖区栉孔扇贝在夏季频繁出现大规模死亡,造成严重的经济损失。调查显示,栉孔扇贝大规模死亡发生在夏季高温期,持续时间久,从6月中旬至9月底时有发生,7月中旬形成高峰,平均死亡率达到35%~40%,有的地区甚至高达70%[2-4]。除栉孔扇贝以外,中国南北沿海养殖的海湾扇贝(Argopectenirradians)、合浦珠母贝(Pinctadamartensii)、牡蛎(Crassostreaspp.)、鲍(Haliotisspp.)等海洋贝类也爆发过不同程度的夏季大规模死亡[5-6],此外,在日本、美国、法国等国都有关于海洋贝类夏季频发大规模死亡的报道[7-8],由此可见,夏季大规模死亡已严重制约了全球贝类养殖业的发展。
关于栉孔扇贝养殖过程中出现的夏季大规模死亡现象,很多研究者认为环境可能是重要的诱因[3,9]。夏季养殖海区的不良环境理化因子,包括不适的温度、盐度、PH、溶解氧等,均会对养殖贝类产生胁迫刺激。研究显示,在其他环境因子良好的情况下,海水温度过高可导致栉孔扇贝死亡,且扇贝的死亡率随着高温刺激时间的延长而升高[10]。因而,高温被认为是引发扇贝大规模死亡的主要环境因素。高温对于生物的影响是多方面的,可以造成机体分解代谢增强,合成代谢下降,引发生长停滞,免疫力下降等[11-13]。
2007 年Royer等的研究发现,太平洋牡蛎死亡高峰期恰好出现在产卵之后[14],暗示着除了高温以外,繁殖也可能是引发海洋贝类夏季大规模死亡的重要原因。已有研究显示,繁殖导致太平洋牡蛎(Crassostrea gigas)、贻贝(Mytilusedulis)、海湾扇贝(A.irradians)等海洋贝类的氧氮比迅速下降,表明该阶段机体代谢消耗了大量的蛋白质[14-17]。此外,对美洲牡蛎(Crassostreavirginica)和欧洲猿头蛤(Chameleagallina)的研究显示,繁殖后机体内血细胞的免疫活性明显降低[18-19]。这些研究结果表明,繁殖过程需要消耗大量的能量,会影响机体生理功能的正常行使,导致机体免疫力下降。类似的,栉孔扇贝的养殖过程中发现,大规模死亡主要爆发于性成熟、且处于繁殖期的2龄及2龄以上养殖群体中,但是到目前为止,关于繁殖对栉孔扇贝影响的研究还鲜有报道。
早在1956年,哈曼就提出了代谢相关的自由基学说[20],认为机体正常生长、代谢过程中所产生的活性氧自由基ROS可以引发氧化损伤,影响组织正常新陈代谢及功能的维持,甚至引发疾病,显著影响生物体的体质活力状态和抗逆性[21-22]。为了使生物体内ROS保持在对机体无害的水平,生物体必须及时清除过量的ROS。超氧化物歧化酶SOD就是ROS清除系统中的重要成员,它可通过催化细胞内的超氧自由基发生歧化反应[23],降低细胞ROS的水平,因而SOD是反映机体抗氧化能力的一个重要指标。本研究将利用实时定量PCR法分析繁殖和高温胁迫后CuZnSOD和Mn-SOD两种SOD基因的表达变化,探讨繁殖和高温对栉孔扇贝抗氧化能力的影响,为揭示海洋双壳类动物夏季大规模死亡的原因提供参考。
1 材料与方法
1.1 材料
本研究所用栉孔扇贝均为2龄,于4月采自山东荣成的扇贝养殖场。新鲜的扇贝按照标准的流程[24]由荣成养殖场运回实验室,在15℃的过滤海水中暂养1周。本实验设计分对照组(Control)和实验组,对照组100只,养殖条件不变,实验组分2组,各100只,分别进行繁殖实验及高温刺激实验。繁殖实验采用阴干法进行催产,繁殖后(Post-reproduction)的扇贝一部分用于取材,剩余的在15℃过滤海水中充气暂养,12h投饵1次,恢复1个月后(After one month recovery)取材,然后对剩余的扇贝个体进行阴干催产,再次繁殖后(After second reproduction)的个体用于取材。高温刺激实验12h内由15℃升温至30℃,并维持30℃的持续高温刺激,期间对样品死亡率进行统计;在死亡率超过50%(刺激持续约12.5h)时进行取材。每次取材随机挑选6个个体,取其外套膜、鳃、性腺、肾脏、闭壳肌和肝胰腺,液氮速冻后置于-80℃超低温冰箱中保存备用。
1.2 方法
1.2.1 总RNA的提取 采用异硫氰酸胍法进行组织总RNA的提取。所有用于RNA提取的玻璃、金属制品均在180℃下烘烤6h以上以灭活RNA酶,离心管、移液器吸头等塑料耗材则用1%DEPC·H2O浸泡24h以上,高温灭菌后烘干备用。取适量(约50mg)液氮保存的组织块置入冰上预冷的含β-巯基乙醇的溶液D中,高速匀浆后进行酚氯仿抽提。利用RNase-free H2O将异丙醇沉淀得到的RNA完全溶解后,加入5μL 10×DNase I buffer,1μL DNase I(5U/μL)以及1μL RNasin(40U/μL),用 RNase-free H2O 补至50μL,混匀,37℃水浴30min消化基因组DNA。1.5%琼脂糖凝胶电泳检测RNA完整性,并利用紫外分光光度计检测RNA浓度及纯度。
1.2.2 第一链cDNA合成 取2μg总RNA,加入1μL 20μmol/L Oligo d(T)18,用 DEPC无菌水补至13μL,混匀。70℃10min后立即置于冰上。低速离心后,加入5μL 5×M-MLV buffer,5μL 2.5mmol/L dNTP,1 μL 40U/μL RNasin 和 1 μL 200U/μL M-MLV反转录酶(Promega,Madison,WI,USA),混匀离心,42℃反应90min;94℃5min灭活反转录酶。所获得的cDNA分装于PCR管中(2μL/管),-20℃保存。
1.2.3 实时定量PCR法测定基因相对表达量 实时定量PCR反应体系共20μL,包括10倍稀释的一链cDNA 2μL,SYBR Green Realtime PCR Master Mix(TOYOBO,Osaka,Japan)10μL以及正反向引物(2.5μmol/L)各4μL。PCR 反应在 ABI 7500realtime PCR System(Applied Biosystems,CA,USA)上进行,反应条件如下:Stage 1,50℃2min;Stage 2,94℃3min;Stage 3,进行94℃ 30s62.8℃ 30s,72℃30s,共40个循环;Stage 4,检测溶解曲线95℃15s,60℃1min,95℃15s,60℃15s。实验中共选取3个内参 基 因:β-actin(ACTB),elongation factor 1beta(EF1β)以及ribosomal protein L16(RPL16),目标基因及内参基因的引物序列见表1。所得到的荧光信号利用SDS软件(Applied Biosystems)及在线软件realtime PCR Miner 4.0(http://www2.miner.ewindup.info/)[25]进行分析,根据 Vandesompele的方法,即将所选择的多种看家基因的几何均数作为标准化因子从而标准化目标基因的表达[26-27],计算目标基因的相对表达量。
1.2.4 数据分析 利用单因素方差分析比较不同组织间及繁殖实验不同组间数据差异的显著性,对于差异显著(P<0.05)的数据,利用 Fisher′s least significant difference(LSD)法进行两两比较。高温胁迫前后的数据差异用双尾T检验分析。以上分析均在SPSS 16.0统计软件[28]中实现,P<0.05视为差异显著。
2 结果
2.1 组织类型对栉孔扇贝CuZnSOD和MnSOD表达的影响
首先,利用单因素方差分析检测不同组织之间CuZnSOD表达的区别。如图1所示,CuZnSOD的表达水平在不同组织之间差异显著(P<0.05),进一步分析表明,该基因在性腺中的表达水平显著低于鳃和肾脏(P<0.01)。利用同样的方法分析MnSOD的表达水平,结果显示MnSOD在不同组织中也显著差异(P<0.05),但与CuZnSOD不同,MnSOD在外套膜和肝胰腺中的表达水平较高,与鳃、性腺、闭壳肌及肾脏中的表达水平具有显著差异(P<0.001)。

表1 SOD基因及内参基因引物序列信息Table 1 Primer sequences of SOD and internal control genes used for real-time PCR
2种SOD基因总体表达水平的比较结果显示,栉孔扇贝各组织中CuZnSOD的表达水平均显著高于MnSOD(P<0.05)。综上所述,CuZnSOD和MnSOD在栉孔扇贝各组织中广泛表达,但2种SOD基因的表达水平在不同组织间均具有明显差异,在后续的繁殖及高温实验中应对不同组织进行具体分析。
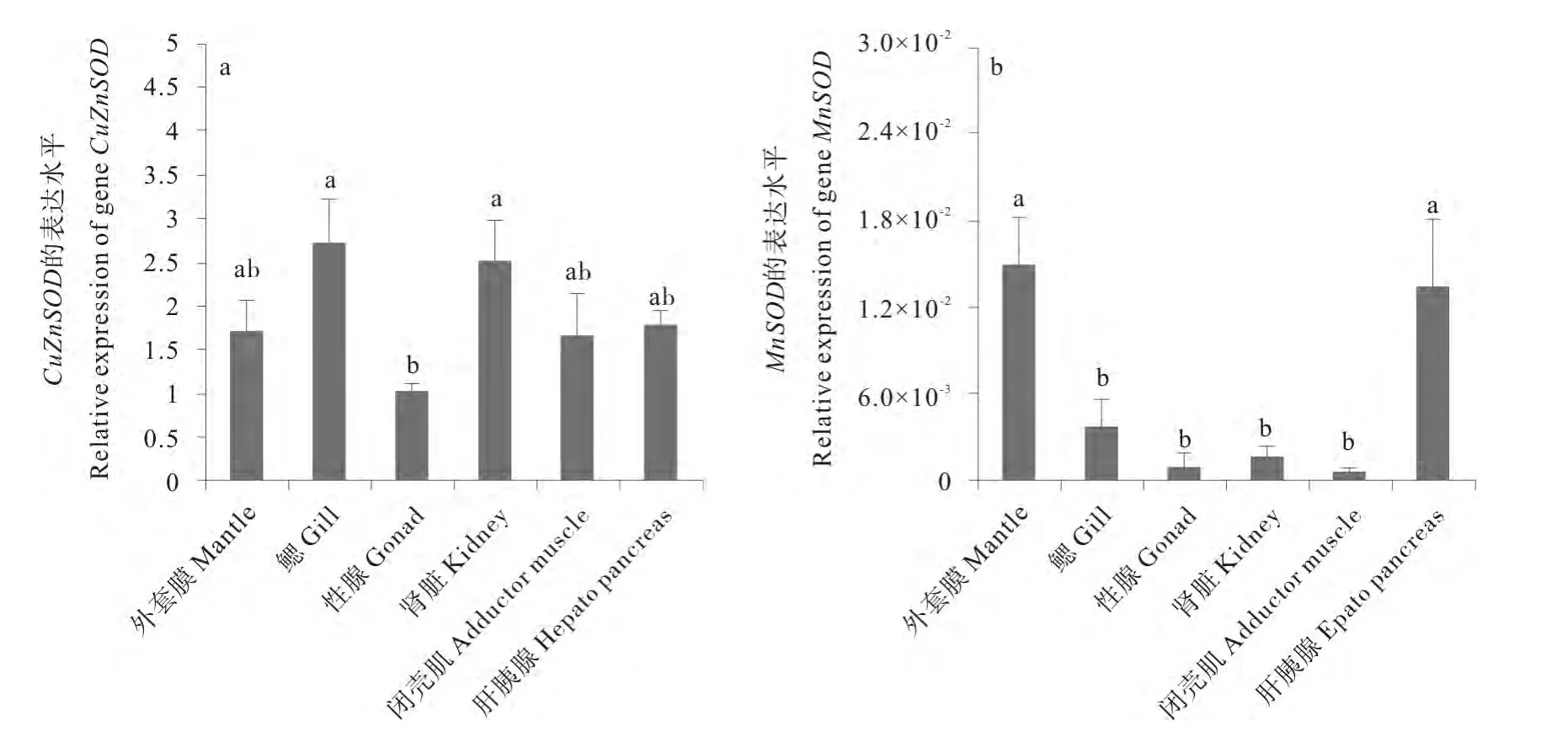
图1 栉孔扇贝CuZnSOD和MnSOD的组织表达水平Fig.1 Relative expression levels of CuZnSODand MnSODin various tissues of Chlamys farreri
2.2 繁殖对栉孔扇贝各组织CuZnSOD和MnSOD表达的影响
图2显示了繁殖前后栉孔扇贝各组织2种SOD基因表达水平的变化趋势。如图2a所示,繁殖后,CuZn-SOD的表达水平在外套膜、鳃、性腺、肾脏、闭壳肌及肝胰腺6种组织均大幅下降,且差异显著(P<0.05);其中,外套膜、鳃、肾脏和肝胰腺中CuZnSOD的表达水平经过1个月的恢复期后有上升趋势,但未能恢复至对照水平;再次繁殖后,CuZnSOD表达水平下降,但与繁殖后及恢复期相比,没有显著差异。
如图2b所示,繁殖后,MnSOD的表达水平虽然在6种组织中均呈现下降趋势,但仅在鳃和肾脏中呈显著下降(P<0.05);恢复1个月后,鳃和肾脏的MnSOD表达水平与繁殖后相比未有上升,仍显著低于对照(P<0.05);再次繁殖后,这2种组织的MnSOD表达水平进一步下降,但与繁殖后及再次繁殖前的恢复期相比,均没有显著差异。外套膜中MnSOD的表达水平在繁殖后下降;在恢复期有所回升,但均与对照没有显著差异;再次繁殖后MnSOD表达量降低,显著低于对照(P<0.05),但与繁殖后及恢复期相比,差异并不显著。
2.3 高温对栉孔扇贝各组织CuZnSOD和MnSOD表达水平的影响
30℃高温胁迫后对栉孔扇贝死亡率进行统计,结果显示,持续胁迫6h,扇贝死亡率为13.16%;6h后死亡率开始出现大幅上升,胁迫12.5h时扇贝死亡率达到62.28%;胁迫18h时扇贝死亡率高达98.68%(见图3a)。
双尾T检验结果表明,高温胁迫后CuZnSOD的表达水平在6种组织中均明显下降,在鳃、性腺、肾脏及闭壳肌中下降显著(P<0.05)(见图3b);高温胁迫后MnSOD的表达水平在除闭壳肌以外的五种组织中均出现下降,在外套膜、鳃和肾脏中下降显著(P<0.05)(见图3c)。由此可见,高温胁迫后2种SOD基因的表达水平在鳃及肾脏2种组织中均显著下降,表明高温胁迫严重影响了这2种组织的抗氧化能力。

图2 繁殖前后栉孔扇贝CuZnSOD和MnSOD在各组织中的表达水平Fig.2 Relative expression levels of CuZnSODand MnSODbefore and after reproduction in various tissues of Chlamysfarreri
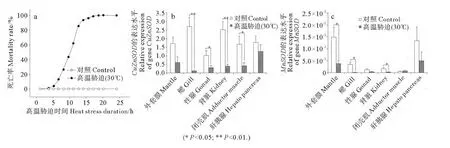
图3 高温胁迫下栉孔扇贝死亡率曲线(a)及各组织CuZnSOD(b)和MnSOD(c)的表达水平Fig.3 Motality curve of C.farreri under 30℃stimulation(a)and relative expression levels of CuZnSOD (b)and MnSOD (c)in various tissues
3 讨论
活性氧自由基ROS可以由生物体正常代谢活动产生,也可以由侵犯机体的不良外界环境因子诱发产生,具有极强的氧化性,可引发组织细胞内生物大分子的过氧化反应,造成氧化损伤,与代谢紊乱、组织癌变、细胞衰老、凋亡等密切相关[21]。为了应对ROS所引起的损伤,真核细胞发展了许多机制用于维持细胞内氧化还原状态的平衡,其中第一道防御体系就是细胞内的抗氧化酶系统[29-30]。真核生物的超氧化物歧化酶SOD即为抗氧化酶系统中的重要成员,SOD可根据金属辅基的不同分为2类:一类含Cu和Zn离子(CuZn-SOD),主要存在于细胞的胞质以及胞外[31];另一类含Mn离子(MnSOD),主要存在于线粒体中[32]。研究表明,生物体的SOD酶活性水平与机体的衰老及新陈代谢率显著相关[33]。此外,SOD还与基因组DNA稳定性有关,可参与调节ROS生成相关的基因转录调控[34]。
本研究结果表明,CuZnSOD和MnSOD在栉孔扇贝中均具有广泛的组织表达,与其他水生生物的研究结果相符[35-38]。栉孔扇贝各组织中CuZnSOD的表达水平高于MnSOD,表明组织中胞质及胞外型的SOD要多于线粒体型SOD。另外,栉孔扇贝中性腺组织的CuZnSOD表达水平相对较低,与前期研究相符[37],推测可能与该组织细胞分裂活性较低有关;肝胰腺作为扇贝的能量调控中心,其线粒体型MnSOD基因表达水平相对较高,推测可能与该组织活跃的能量代谢有关。
本研究结果显示,繁殖后SOD基因的表达水平在栉孔扇贝各组织中均显著下降,与太平洋牡蛎的研究结果相符[39]。经过1个月的恢复期,2种SOD基因的表达水平仍未能恢复至对照水平,这表明繁殖大大降低了扇贝机体的抗氧化能力,扇贝可能需要较长的时间才能恢复体质。前期研究表明,在低等的果蝇乃至高等的鸟类、哺乳动物中均存在繁殖过程中生物体机体抗氧化能力下降、组织氧化损伤加剧的现象[40-43],海洋贝类也不例外[44-45]。生物体抗氧化能力的下降会显著影响机体的正常代谢活动及生理功能,例如,研究表明,繁殖过程中机体组织抗氧化酶活性下降、细胞的氧化损伤加剧可能是诱导细胞凋亡的重要因素[46],而且机体繁殖过程中由于抗氧化能力下降所产生的ROS可降低细胞的吞噬活性,影响机体清除损伤细胞、进行组织修复的功能[47-48]。在加拿大海扇贝中(Placopectenmagellanicus)的研究中发现,产卵后机体的新陈代谢率显著低于正常个体[49],我们推测这可能是导致繁殖后组织SOD基因转录活性下降的原因之一。
除繁殖因素外,海洋贝类的研究表明,提高环境温度会显著影响海洋双壳贝类机体生理生化过程,进而影响扇贝个体的代谢率[50]。对扇贝Argopectenventricosus的研究表明,在非致死高温刺激下(19~22℃)下扇贝的代谢率上升,而在更高的温度(25~28℃)持续刺激下,扇贝机体的代谢率反而下降[51]。另外,在无脊椎动物中的研究表明,高温胁迫会引发线粒体功能障碍,导致机体供能不足[52-53]。本研究显示,30℃持续刺激18h,栉孔扇贝的死亡率达到80%以上,属于致死性高温刺激,因此,高温胁迫下扇贝线粒体功能障碍引发代谢率下降也可能是导致2种SOD基因表达水平下降的主要原因。综合分析,本研究认为高温和繁殖影响栉孔扇贝机体内多个组织CuZnSOD和MnSOD基因的转录,降低了扇贝的抗氧化能力,这可能是导致栉孔扇贝夏季大规模死亡的重要内因。
[1]李成林,宋爱环,胡炜,等.山东省扇贝养殖产业现状分析与发展对策[J].海洋科学,2011,35(3):91-98.
[2]王远隆,李美真,邱兆星,等.养殖扇贝大面积死亡的原因及对策[J].海洋湖沼通报,2001(3):63-69.
[3]张福绥,杨红生.山东沿岸夏季栉孔扇贝大规模死亡原因分析[J].海洋科学,1999(1):44-47.
[4]张景山.养殖栉孔扇贝大量死亡的原因和预防对策 [J].水产科学,1999,18(1):44-46.
[5]张国范,李霞,薛真福.我国养殖贝类大规模死亡的原因分析及防治对策 [J].中国水产,1999,9:34-39.
[6]陆彤霞,王国良,尤仲杰,等.我国海洋养殖贝类病害研究概况及防治对策 [J].浙江海洋学院学报,2002,21(2):154-159.
[7]Samain J F.Review and perspectives of physiological mechanisms underlying genetically-based resistance of the Pacific oysterCrassostreagigasto summer mortality[J].Aquatic Living Resources,2011,24(3):227-236.
[8]Samain J F,McCombie H.Summer Mortality of Pacific OysterCrassostreaGigas:The Morest Project[M].Versailles:Editions Quae,2008.
[9]于瑞海,王如才,田传远,等.栉孔扇贝大面积死亡原因分析及预防的探讨 [J].海洋湖沼通报,1998(3):69-72.
[10]柳中传,吴建芹,金福江.栉孔扇贝死亡原因及预防措施 [J].海洋科学,1992(5):9-10.
[11]Ravagnolo O,Misztal I.Effect of heat stress on nonreturn rate in Holstein cows:Genetic analyses[J].Journal of Dairy Science,2002,85(11):3092-3100.
[12]West J.Effects of heat-stress on production in dairy cattle[J].Journal of Dairy Science,2003,86(6):2131-2144.
[13]Starkie R,Hargreaves M,Rolland J,et al.Heat stress,cytokines,and the immune response to exercise[J].Brain Behavior and Immunity,2005,19(5):404-412.
[14]Royer J,Ropert M,Costil K.Spatio-temporal changes in mortality,growth and condition of the Pacific oyster,Crassostrea gigas,in Normandy(France)[J].Journal of Shellfish Research,2007,26(4):973-984.
[15]Gabbott P,Bayne B.Biochemical effects of temperature and nutritive stress onMytilusedulisL[J].Journal of the Marine Biological Association of the United Kingdom,1973,53:269-286.
[16]Barber B,Blake N.Substrate catabolism related to reproduction in the bay scallopArgopectenirradiansconcentricus,as determined by O/N and RQ physiological indexes[J].Marine Biology,1985,87(1):13-18.
[17]Ruiz C,Martinez D,Mosquera G,et al.Seasonal variations in condition,reproductive activity and biochemical composition of the flat oyster,Ostreaedulis,from San Cibran(Galicia,Spain)[J].Journal of Gerontology,1956,11(3):298-300.
[18]Dittman D E,Ford S E,Padilla D K.Effects of Perkinsus marinus on reproduction and condition of the eastern oyster,Crassostreavirginica,depend on timing[J].Journal of Shellfish Research,2001,20:1025-1034.
[19]Matozzo V,Monari M,Foschi J,et al.Exposure to anoxia of the clamChameleagallina[J].Journal of Experimental Marine Biology and Ecology,2005,325:163-174.
[20]Harman D.Aging:a theory based on free radical and radiation chemistry[J].Journal of Gerontology,1956,11(3):298-300.
[21]Valko M,Leibfritz D,Moncol J,et al.Free radicals and antioxidants in normal physiological functions and human disease [J].International Journal of Biochemistry and Cell Biology,2007,39(1):44-84.
[22]Gibson G E,Karuppagounder S S,Shi Q.Oxidant-induced changes in mitochondria and calcium dynamics in the pathophysiology of alzheimer′s disease[J].Annals of the New York Academy of Sciences,2008,1147(1):221-232.
[23]Forman H J,Maiorino M,Ursini F.Signaling functions of reactive oxygen species[J].Biochemistry,2010,49:835-842.
[24]Maeda-Martinez A N,Sicard M T.Reynoso-Granados.A shipment method for scallop seed[J].Journal of Shellfish Research,2000,19(2):765-770.
[25]Zhao S,Fernald R D.Comprehensive algorithm for quantitative real-time polymerase chain reaction[J].Journal of Computational Biology,2005,12(8):1047-1064.
[26]Vandesompele J,De Preter K,Pattyn F,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes [J].Genome Biology,2002,3(7):34.
[27]Hellemans J,Mortier G,De Paepe A,et al.qBase relative quantification framework and software for management and automated analysis of real-time quantitative PCR data[J].Genome Biology,2007,8(2):19.
[28]Norusis M.SPSS 16.0guide to data analysis[M].New Jersey:Prentice Hall Press,2008.
[29]Kavutcu M,Canbolat O,ztürk S,et al.Reduced enzymatic antioxidant defense mechanism in kidney tissues from gentamicintreated guinea pigs:effects of vitamins E and C [J].Nephron,1996,72(2):269-274.
[31]Jung O,Marklund S L,Geiger H,et al.Extracellular superoxide dismutase is a major determinant of nitric oxide bioavailability in vivo and ex vivo evidence from ecSOD-deficient mice[J].Circulation Research,2003,93(7):622-629.
[32]Brouwer M,Hoexumbrouwer T,Grater W,et al.Replacement of a cytosolic copper/zinc superoxide dismutase by a novel cytosolic manganese superoxide dismutase in crustaceans that use copper(haemocyanin)for oxygen transport[J].Biochemical Journal,2003,374(1):219-228.
[33]Abele D,Puntarulo S.Formation of reactive species and induction of antioxidant defence systems in polar and temperate marine invertebrates and fish[J].Comparative Biochemistry and Physiology Part A:Molecular and Integrative Physiology,2004,138:405-415.
[34]Ookawara T,Kizaki T,Takayama E,et al.Nuclear translocation of extracellular superoxide dismutase[J].Biochemical and Biophysical Research Communications,2002,296(1):54-61.
[35]Boutet I,Tanguy A,Moraga D.Response of the Pacific oysterCrassostreagigasto hydrocarbon contamination under experimen-tal conditions[J].Gene,2004,329:147-157.
[36]张庆利.中国明对虾免疫系统中抗氧化相关基因的克隆与表达分析 [D].青岛:中国科学院海洋研究所,2007.
[37]倪多娇.栉孔扇贝抗氧化酶基因的克隆与表达分析 [D].青岛:中国科学院海洋研究所,2007.
[38]Kim K Y,Lee S Y,Cho Y S,et al.Molecular characterization and mRNA expression during metal exposure and thermal stress of copper/zinc-and manganese-superoxide dismutases in disk abalone,Haliotisdiscusdiscus[J].Fish &Shellfish Immunology,2007,23(5):1043-1059.
[39]廉伟,温海深,毛玉泽,等.长牡蛎夏季死亡与养殖环境及自身体质关系的初步研究 [J].渔业科学进展,2010,31(4):92-100.
[40]Wang J,Green P,Simpkins J.Estradiol protects against ATP depletion,mitochondrial membrane potential decline and the generation of reactive oxygen species induced by 3-nitroproprionic acid in SK-N-SH human neuroblastoma cells[J].Journal of Neurochemistry,2001,77(3):804-811.
[41]Nussey D H,Pemberton J M,Pilkington J G,et al.Life history correlates of oxidative damage in a free-living mammal population[J].Functional Ecology,2009,23(4):809-817.
[42]Alonso-Alvarez C,Bertrand S,Devevey G,et al.An experimental manipulation of life-history trajectories and resistance to oxidative stress[J].Evolution,2006,60(9):1913-1924.
[43]Alonso-Alvarez C,Bertrand S,Faivre B,et al.Testosterone and oxidative stress:the oxidation handicap hypothesis[J].Proceedings of the Royal Society B:Biological Sciences,2007,274(1611):819-825.
[44]Vahl O.Size-specific reproductive effort inChlamysislandica:reproductive senility or stabilizing selection[C].Proceedings of the 19th European Marine Biology Symposium.Plymouth,UK:Cambridge Universtiy Press,1984.
[45]Jokela J,Mutikainen P.Phenotypic plasticity and priority rules for energy allocation in a freshwater clam:a field experiment[J].Oecologia,1995,104:122-132.
[46]Circu M L,Aw T Y.Reactive oxygen species,cellular redox systems,and apoptosis[J].Free Radical Biology and Medicine,2010,48(6):749-762.
[47]Callard G V,Drygas M,Gelinas D.Molecular and cellular physiology of aromatase in the brain and retina[J].The Journal of Steroid Biochemistry and Molecular Biology,1993,44:541-547.
[48]Wood A W,Van Der Kraak G J.Apoptosis and ovarian function:novel perspectives from the teleosts[J].Biology of Reproduction,2001,64(1):264-271.
[49]Kraffe E,Tremblay R,Belvin S,et al.Effect of reproduction on escape responses,metabolicrates and muscle mitochondrial properties in the scallopPlacopectenmagellanicus[J].Marine Biology,2008,156:25-38.
[50]Tremblay R,Myrand B,Guderley H.Thermal sensitivity of organismal and mitochondrial oxygen consumption in relation to susceptibility of blue mussels,Mytilusedulis(L.),to summer mortality[J].Journal of Shellfish Research,1998,17:141-152.
[51]Guerra C,Zenteno-Savín T,Maeda-Martínez A,et al.Changes in oxidative stress parameters in relation to age,growth and reproduction in the short-lived catarina scallopArgopectenventricosusreared in its natural environment[J].Comparative Biochemis-try and Physiology-Part A:Molecular &Integrative Physiology,2012,162(4):421-430.
[52]Heise K,Puntarulo S,Prtner H-O,et al.Production of reactive oxygen species by isolated mitochondria of the Antarctic bivalveLaternulaelliptica(King and Broderip)under heat stress[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2003,134:79-90.
[53]Abele D,Heise K,Prtner H-O,et al.Temperature-dependence of mitochondrial function and production of reactive oxygen species in the intertidal mud clamMyaarenaria[J].Journal of Experimental Biology,2002,205:1831-1841.

