长牡蛎外套膜色遗传规律初步研究
王庆志 , 李 琪 丛日浩 , 孔 宁 孔令锋 于 红
(1. 中国海洋大学 海水养殖教育部重点实验室, 山东 青岛 266003; 2. 辽宁省海洋水产科学研究院, 辽宁大连 116023; 3. 中国科学院 海洋研究所, 山东 青岛 266071)
在海产经济贝类中, 许多种类色彩缤纷的贝壳颜色, 长期受到遗传学家、育种学家的关注。美观的壳色不仅给消费者带来视觉享受, 还能显著提高商品价值。许多贝类的壳色性状属于受遗传与环境双重影响的数量性状, 它与生物所处的温度、盐度、底质、食物等栖息环境有关[1-2]。一些研究也发现贝类的壳色主要受遗传因素控制, 并与生长、存活等性状相关。在选择育种工作中, 当某一性状由少数基因和简单的显隐性机制决定时, 通过合适的交配设计可使目的性状分离, 经连续几代选择便可获得纯系[3],我国已成功培育出‘中国红’皱纹盘鲍(Haliotis discus hannai)[4]、‘中科红’海湾扇贝(Argopecten irradians)[5]、‘蓬莱红’栉孔扇贝(Chlamys farreri)[6]和“斑马蛤”菲律宾蛤仔(Ruditapes philippinesis)[7]等优良新品系。除了较易观察到的贝壳颜色存在明显的遗传规律外, 一些研究还发现贝类的闭壳肌、外套膜等组织的颜色也存在明显的遗传规律, 如虾夷扇贝(Mizuhopecten yessoensis)的橘红色闭壳肌就属于单基因控制的质量性状[8], 育种工作者据此成功选育出橘红色闭壳肌的“海大金贝”新品种。
长牡蛎(Crassostrea gigas)又称太平洋牡蛎, 具有生长速度快、肉质鲜美等优点, 是世界上产量最高的海水养殖种类[9]。笔者在长期的育种实践中发现长牡蛎的外套膜颜色由于色素沉着程度不同, 表现出介于黄、黑之间变化的连续数量性状[10-11]。在进行长牡蛎市场销售时, 日本消费者较喜欢黑色外套膜的“半壳贝”牡蛎, 而进行深加工时, 黄色外套膜因色素少而更受欢迎。因此, 选育长牡蛎外套膜的不同纯色品系, 可以满足不同的市场需求, 进而提高长牡蛎的商品价值。本研究以外套膜不同着色程度的长牡蛎为亲本构建了不同外套膜色家系, 通过分析其子代的表型性状, 查清了长牡蛎外套膜色与生长、存活的关系, 并初步分析了长牡蛎外套膜色的遗传规律, 旨在为长牡蛎的优良品种培育提供科学依据。
1 材料和方法
1.1 家系构建
本研究所用材料为长牡蛎威海本地养殖群体。参考王庆志等[10]的外套膜着色 1-4级分类标准, 从中选取外套膜色为4级纯黑、1级纯黄和2-3级的个体为亲本。参考王庆志等[12]的方法构建全同胞家系,每个雄性牡蛎与1个雌性牡蛎交配, 成功构建3个外套膜纯黑家系(BB1、BB2、BB3), 2个外套膜纯黄家系(YY1、YY2), 3个纯黑雌×纯黄雄杂交家系(BY1、BY2、BY3), 2个纯黄雌×纯黑雄杂交家系(YB1、YB2)和 2个 2-3级着色对照家系(CC1、CC2), 家系亲本信息见表1。
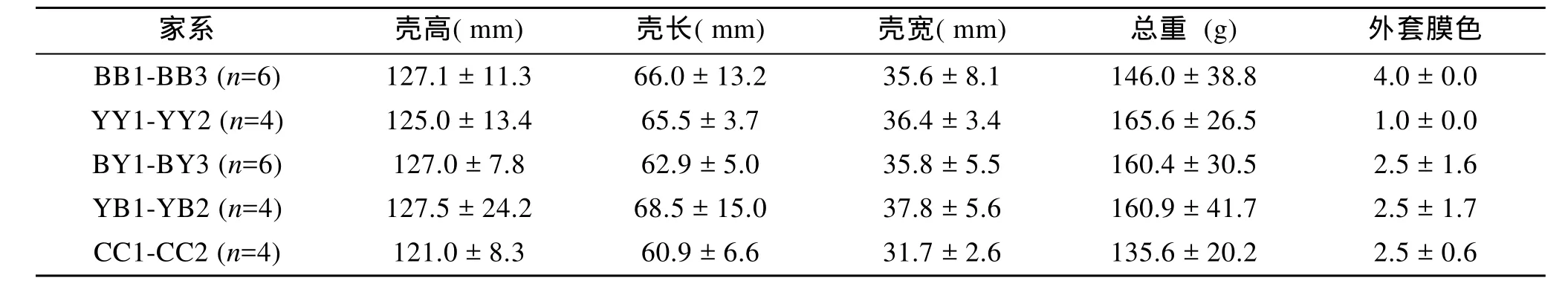
表1 长牡蛎不同外套膜色家系的亲本性状Tab.1 Parents’ traits with different mantle pigmentation families in Crassostrea gigas (±SD)
1.2 幼体培育与养成
将构建的家系在 100 L聚乙烯桶中进行孵化培育, 测量计算不同家系的卵径、受精率、孵化率等参数。浮游幼虫期密度控制在2~5个/mL, 投喂适量的单胞藻饵料, 各家系投饵、换水、充气等管理一致,避免相互混杂。当幼虫出现眼点时, 投放扇贝壳制成的固着基采苗。参考王庆志等[13]的方法进行稚贝与成体养成, 当稚贝生长至0.5~1cm时, 转入扇贝养殖笼养成。为减小环境等外因造成的误差, 转入扇贝笼时尽量使各层稚贝的密度相同。至150日龄后, 将其分离成单体牡蛎, 每层放30个。
1.3 性状测量
对测量家系的笼层进行标记, 每次均测量同层牡蛎, 记录存活个体数。分别测量了牡蛎60日龄、150日龄、350日龄和450日龄的壳高, 350日龄和450日龄的成活率, 按照外套膜着色1-4级分类标准,统计 450日龄的外套膜着色情况, 每一家系测量统计50个。
1.4 统计分析
所有统计分析用SPSS 16.0软件完成, 用单因素方差分析(ANOVA)比较不同外套膜色组间和组内家系间的差异, 显著性水平为 P<0.05。为增加数据的正态性, 进行方差分析时, 受精率、孵化率和存活率被转化为正弦函数值, 壳高被转化为常用对数。
2 结果
2.1 卵径、受精率与孵化率
各实家系的卵径为 55.8~57.4 μm, 受精率为96.9%~98.6%, 孵化率为 75.9%~82.2%, 不同家系间无显著差异(P>0.05, 表2)。
2.2 生长与存活
60日龄对照组的壳高显著大于其他交配组(P<0.05), BB1-BB3和 CC1-CC2壳高的差异不显著(P>0.05); 150日龄CC1-CC2的壳高显著大于BB1-BB3和YY1-YY2(P<0.05), BB1-BB3和YY1-YY2的壳高差异不显著(P>0.05); 350日龄和450日龄各家系间差异均不显著(P>0.05)。存活方面, 350和450日龄各家系在不同生长阶段均无显著差异(P>0.05, 表3)。
2.3 外套膜色遗传规律
亲本外套膜为纯黑的3个家系: BB1中100%为4级; BB2中3级占10.4%, 4级占89.6%; BB3中2级占4.3%, 3级占15.2%, 4级占80.4%。亲本外套膜为纯黄的2个家系: YY1 中95.2%为1级, 4.8%为2级; YY2中1级占27.3%, 2级占45.5%, 3级占24.2%,4级占 3.0%。3个外套膜纯黑雌×纯黄雄杂交家系:BY1中1级占36.7%, 2级占20.0%, 3级占16.7%, 4级占26.7%; BY2中1级占26.7%, 2级占23.3%, 3级占23.3%, 4级占26.7%; BY3中1级占13.3%, 2级占36.7%, 3级占26.7%, 4级占23.3%。2个纯黄雌×纯黑雄杂交家系: YB1中1级占10.0%, 2级占20.0%, 3级占36.7%, 4级占33.3%; YB2中2级占34.8%, 3级占30.3%, 4级占19.1%。2个对照家系: CC1中2级占20.0%, 3级占50.0%, 4级占30.0%; CC2中2级占40.0%, 3级占 26.7%, 4级占33.3%(图 1)。

表2 长牡蛎不同外套膜色家系的卵径、受精率和孵化率Tab.2 Egg-diameter, fertilized rate and hatching rate of C. gigas with different mantle pigmentation families (±SD)
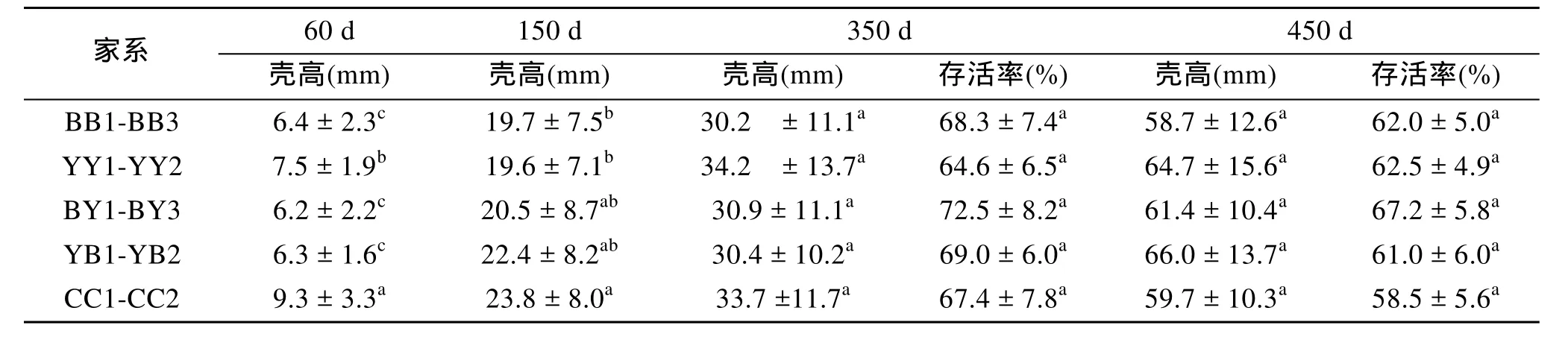
表3 长牡蛎不同外套膜色家系的生长与存活Tab.3 Growth and survival performance of C. gigas in different mantle pigmentation families (±SD)

图 1 外套膜不同着色程度个体在各家系中所占的比例Fig.1 Percentage of individuals with different degree mantle pigmentation in each family
3 讨论
在本研究中, 长牡蛎不同外套膜色家系的卵径、受精率和孵化率均无显著差异; 不同外套膜色家系的生长虽然在60日和150日龄时略有差异, 但生长至350日龄和450日龄成体阶段时, 家系间的生长差异已无显著差异; 存活方面, 各家系在不同生长阶段的存活率无显著差异。这与 Brake等[14]的研究结果相似, 即牡蛎的壳色、外套膜色与体重与存活没有显著的相关性。因此, 进行长牡蛎的外套膜色的人工选育时, 不会对牡蛎的生长和存活带来负面影响。
研究表明, 长牡蛎的壳色、外套膜色等的变异是由很多微效基因控制的数量性状, Imai和 Sakai[15]在比较日本沿海不同群体长牡蛎的性状差异时, 发现不同群体间长牡蛎的外套膜色存在显著的差异, 且深色外套膜在育种世代中具有可遗传的特性; 王庆志等[10]也发现中国、日本和韩国群体的长牡蛎在外套膜的着色程度和比例上存在明显差异; Brake等[14]在构建的大量长牡蛎全同胞家系中发现, 通过一代或两代的人工选育, 一些家系子代的壳色和外套膜色较好的遗传了亲本的特征, 具有较高的遗传力;Evans等[16]通过全同胞家系估算长牡蛎壳色的广义遗传力和狭义遗传力分别为 0.91 ± 0.38 和 0.59 ±0.19, 在2个家系中发现“黑壳”和“白壳”性状的分离符合孟德尔3∶1遗传分离定律, 并由此推断壳色如果由一对主效基因控制, 则白色对黑色具有显性效应。一些研究已证明这些性状可能由数目很少的主效基因控制, Ge等[17]利用BSA与AFLP相结合的策略, 鉴定出一个与壳色主效基因或 QTL关联的SCAR标记, 可用于鉴定含有壳色主基因的个体; Ge等[18]还研究了壳色的遗传模式, 发现长牡蛎贝壳背景色由一个位点的两个等位基因控制, 金黄色基因相对于白色为显性, 白壳背景色对于黑壳前景色存在上位显性效应。
本研究中, 在外套膜纯黑的BB1-BB3家系子代中基本全部为 4级着色的个体, 且未发现有外套膜纯黄的1级着色个体; 而在外套膜纯黄的YY1-YY2家系子代中发现YY1子代基本全部为1级着色, 但在 YY2家系的子代中, 外套膜色出现了明显的分离现象, 如果将1-2级归为黄色, 3-4级归为黑色, 黄色与黑色子代的比例为73∶27, 基本符合3∶1孟德尔遗传分离定律。因此, 可以推断长牡蛎外套膜色与长牡蛎壳色的遗传分离机制基本相同, 即外套膜色可能由一个主效基因控制, 且黄色对黑色具有显性上位效应。这一结果将为长牡蛎外套膜色的人工选育提供理论依据。同时, 外套膜色在纯色家系子代及杂交家系子代中出现的外套膜色连续分布现象也表明,温度、盐度、食物等环境因素对外套膜颜色的形成可能有一定程度的影响。
[1] 管云雁, 何毛贤. 海产经济贝类壳色多态性的研究进展[J]. 海洋通报, 2009, 28(1): 108-114.
[2] Liu X, Wu F, Zhao H, et al. A novel shell color variant of the Pacific abalone Haliotis discus hannai Ino subject togenetic control and dietary influence[J].Journal of Shellfish Resesrch, 2009, 28(2): 419-424.
[3] Falconer D S, MacKay T F C. 储明星, 译. 数量遗传学导论(第 4版)[M]. 北京: 中国农业科技出版社,2000.
[4] 刘晓, 张国范, 赵洪恩. 皱纹盘鲍“中国红”品系的选育[J]. 动物学杂志, 2003, 38(4): 27.
[5] 许飞, 郑怀平, 张海滨, 等. 海湾扇贝“中科红”品种与普通养殖群体不同温度下早期性状的比较[J].水产学报, 2008, 32(6): 876-883.
[6] 王伟, 唐玉卿. 杂交栉孔扇贝试养技术[J]. 水产科学,2003, 22(2): 37-43.
[7] 刘 振, 闫喜武, 张跃环, 等. 菲律宾蛤仔不同品系斑马蛤的选择反应及现实遗传力[J]. 海洋与湖沼,2014, 45(2): 259-264.
[8] 任晓亮, 侯睿, 王珊, 等. 控制虾夷扇贝闭壳肌积累类胡萝卜素相关基因的筛查[J]. 中国海洋大学学报,2012, 42(9): 41-47.
[9] FAO (Food and Agriculture Organization). World aquaculture production of fish, crustaceans, molluscs,etc., by principal species [M]. Rome: Food and Agriculture Organization of the United Nations, 2012.
[10] 王庆志, 李琪, 刘士凯, 等. 长牡蛎不同地理群体选育系数量性状的比较 [J]. 中国海洋大学学报, 2011,41(7/8): 36-41.
[11] 孔宁, 李琪, 丛日浩, 等. 长牡蛎 F3 代快速生长选育群体生长特性的研究[J]. 海洋科学, 2015, 39(3): 7-11.
[12] 王庆志, 李琪, 刘士凯, 等. 长牡蛎幼体生长性状的遗传力及其相关性分析 [J]. 中国水产科学, 2009,16(5): 736-743.
[13] 王庆志, 李琪, 刘士凯, 等. 长牡蛎成体生长性状的遗传参数估计[J]. 中国水产科学, 2012, 19(4):700-706.
[14] Brake J, Evans F, Langdon C. Evidence for genetic control of pigmentation of shell and mantle edge in selected families of Pacific oysters, Crassostrea gigas[J]. Aquaculture, 2004, 229: 89-98.
[15] Imai T, Sakai S. Study of breeding of Japanese oyster,Crassostrea gigas[J]. Tohoku Journal of Agricultural Research, 1961, 12(1): 125-171.
[16] Evans S, Camara M, Langdon C. Heritability of shell pigmentation in the Pacific oyster, Crassostrea gigas[J].Aquaculture, 2009, 286(3-4): 211-216.
[17] Ge J, Li Q, Yu H, et al. Identification and mapping of a SCAR marker linked to a locus involved in shell pigmentation of the Pacific oyster (Crassostrea gigas)[J]. Aquaculture, 2014, 434(2014): 249-253.
[18] Ge J, Li Q, Yu H, et al. Mendelian inheritance of golden shell color in the Pacific oyster (Crassostrea gigas) [J].Aquaculture, 2015, 441(2015): 21-24.

