磁共振成像评估胰腺导管内乳头状黏液瘤良恶性诊断价值
瓦卫民 罗 松 杨 筠 杨 永 杨映娟 赵雪沅 戴定伟
磁共振成像评估胰腺导管内乳头状黏液瘤良恶性诊断价值
瓦卫民①罗 松①杨 筠①杨 永①杨映娟①赵雪沅①戴定伟①
目的:探讨磁共振成像(MRI)评估胰腺导管内乳头状黏液瘤(IPMN)良性及恶性的诊断价值。方法:回顾性分析经手术病理证实的10例胰腺导管内乳头状黏液瘤的MRI表现,以评估其良恶性的价值。结果:入组的胰腺导管内乳头状黏液瘤病例,3例轻度不典型增生(良性)中1例位于胰头部;2例位于胰体部,表现为主胰管局部轻度扩张>5 mm<10 mm;4例中度不典型增生(交界性)中2例位于胰头,2例位于胰尾部,主胰管均扩张>10 mm<15 mm,为分叶状囊性肿块,内部有或无分隔和乳头状突起;3例重度不典型增生伴局部浸润癌(恶性),均位于胰头部,胰管明显扩张>15 mm,为不规则囊实性肿块,其中1例发生肝脏多发转移。结论:MRI评估胰腺导管内乳头状黏液瘤良性及恶性有独特优势。
胰腺肿瘤;胰腺导管内乳头状黏液瘤;磁共振成像
[First-author’s address] Department of Radiology, Dali People's Hospital of Yunnan Province, Dali 671000, China.
胰腺导管内乳头状黏液瘤(intraductal papillary mucinous neoplasm,IPMN)为胰腺癌少见的癌前病变,也是临床上较少见的一种囊性或囊实性肿瘤,1982年由Ohashi首先报道,1990年WHO对该病命名为IPMN。IPMN起源于导管上皮细胞,因过量分泌黏液,导致黏液潴留、胰管扩大,十二指肠乳头因大量黏液流过而增大,故组织学根据导管上皮增生的异型性将其分为导管内乳头状黏液瘤、交界性和导管内乳头状黏液癌。本研究重点探讨磁共振成像(magnetic resonance imaging,MRI)评估IPMN良性及恶性的诊断价值。
1 资料与方法
1.1 一般资料
收集2011-2014年在大理州人民医院经病理证实并有完整MRI影像资料的IPMN患者10例,其中男性3例,女性7例;年龄43~69岁,平均年龄52岁。临床症状主要表现为持续性上腹痛3例,其中2例伴体重减轻;黄疸4例,其中1例伴发热;无明显症状3例。
1.2 检查方法
采用西门子AVTOM1.5T超导检查仪对IPMN患者行MRI成像,16通道相控阵线圈。受检者仰卧于检查床,扫描前训练呼吸。
扫描方案:①真稳态快速进动序列态T2WI冠状扫描;②快速小角度激发梯度回波序列T1WI横断面扫描;③半傅利叶采集单次激发快速自旋回波序列T2WI横断面扫描;④快速恢复快速自旋回波序列T2WI横断面扫描;⑤动态增强扫描采用三维扰相容积内插梯度回波序列(VIBE)横断面扫描。
使用GD-DTPA造影剂(非特异性细胞外液对比剂),注射速率为20 ml/s,注射剂量为0.2 mmol/kg,
加注生理盐水25 ml。
扫描采用主动屏气,一次屏气扫描时间14 s左右,其扫描参数见表1。

表1 IPMN患者MRI成像扫描参数
2 结果
(1)主胰管型3例。1例位于胰腺头部,2例位于胰腺体部,主胰管呈节段性扩张,扩张的最大管径>5 mm<10 mm,无壁结节或乳头状结构,T1WI低信号,T2WI高信号,周围实质未见异常信号,磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)主胰管局部气囊状扩张,增强后未见异常强化信号(如图1所示)。

图1 良性IPMN局部胰管囊状扩张MRI图像
(2)分支胰管型4例。病灶位于胰头部2例,位于胰体尾部2例,呈分叶状囊性肿块,病灶最大直径为22~50 mm,由多个簇状小囊性病变组成,T1WI低信号,T2WI高信号,内部不规则厚薄不均匀等T2信号分隔或无分隔、边缘凹凸不平、多发T2WI稍高信号小乳头状突起,主胰管均扩张>10 mm<15 mm,十二指肠乳头扩大。增强后呈花边状及不规则分隔状强化伴部分指突状强化信号。1例合并分支胰管扩张,2例伴有胰腺局部萎缩,MRCP显示囊性病变与主胰管相通(如图2所示)。
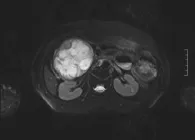
图2 交界性IPMN胰尾部囊性肿块MRI图像
(3)混合型3例。均位于胰头部,呈不规则囊实性肿块,最大径34~90 mm,T1WI等低信号,T2WI不均匀高信号,囊性部分位于肿块中央或偏心性生长,1例囊内壁无结节状突起,2例囊内壁乳头状突起、平均直径>5 mm(如图3所示)。

图3 恶性IPMN囊内壁乳头状附壁结节MRI图像
1例周围见边界不清实质肿块影,胰管明显扩张>15 mm,十二指肠乳头未见明显增大,MRCP靠近肿块处胰管明显鼠尾状缩细或呈截断状,增强后肿块不均匀强化信号,1例发现肝脏多个直径20 mm内小结节状稍长T1稍长T2异常信号,活体取材病检证实来源于胰腺上皮组织转移瘤(如图4所示)。

图4 恶性IPMN囊肿周围实性肿块MRI图像
3 讨论
3.1 IPMN的病理特征
IPMN的病理学改变较复杂,上皮分化程度差异较大,包括增生、腺瘤、不典型增生、原位癌、浸润癌及晚期癌等,也可混合存在,但其基本病理改变是胰腺导管系统内分泌黏液蛋白的上皮细胞乳头状增生,分泌大量黏液样物质并潴留于胰管内造成胰管扩
张[1-2]。根据肿瘤起源位置,通常将IPMN分为3型:①主胰管型,肿瘤存在于主胰管并且扩张;②分支胰管型,肿瘤位于分支胰管内;③混合型,肿瘤既存在于主胰管又存在于分支胰管。根据被覆上皮的形态及免疫组织化学,还可分为胃型、肠型、胰胆管细胞型、嗜酸性细胞型和混合型。由于不同类型的IPMN预后不同,临床处理也大相径庭,术前有必要进行详细评估IPMN良性及恶性[3-4]。
3.2 IPMN的MRI表现与病理对照
本研究3例轻度不典型增生IPMN均以主胰管局限性扩张为特征性改变,为累及主胰管的非浸润性肿瘤,信号均匀呈长T1长T2,扩张的囊腔内未显示乳头状影,边缘光滑,周围无肿块,病变局限于胰管壁,是胰管上皮细胞良性不典型增生的早期改变。病变进一步发展形成与主胰管相通多房分叶状囊性肿块,呈不均匀长T1长T2信号,肿块内部有分隔且粗细均匀或无分隔,囊壁见单个或多个乳头状、扁平状突起,大小基本一致,直径<5 mm,胰管扩张>10 mm<15 mm,增强后肿块呈花边状及不规则分隔状强化伴部分指突状强化信号,为本组4例中度不典型增生IPMN的MRI表现,病理上导管上皮细胞由非乳头状增生向乳头状增生过渡。随着导管上皮细胞增生活跃,出现明显的异型性和浸润性。3例恶性IPMN囊肿壁不规则增厚,囊内壁无或有结节影,周围出现边界不清软组织肿块,呈稍长T1等长T2信号,胰管明显扩张>15 mm,靠近肿块处胰管明显鼠尾状缩细或呈截断状。
3.3 MRI评估IPMN良性及恶性的诊断价值
IPMN临床症状缺乏明显特征性,良恶性IPMN的临床表现差异不明显,多数患者并无明显的临床表现,其导管扩张程度以及产生黏液量决定其临床症状和体征。10例IPMN患者回顾性分析MRI表现与病理分型显示,主胰管扩张程度是区分良恶性的重要指标,一般认为主胰管扩张程度>15 mm倾向恶性,以主胰管直径15 mm作为判定病变良恶性的临界值;囊肿内壁结节的数目及大小反映了导管上皮的增生程度,单个附壁结节>5 mm或2个以上壁结节,高度提示交界性或恶性的可能性大;本组病例良性肿块的直径小于恶性肿块,故认为肿瘤>30 mm是判定IPMN为恶性的一个依据;肿瘤内部出现分隔见于交界性或恶性IPMN,一旦囊肿周围出现实性肿块,更加支持恶性的诊断。胆道发生梗阻可能是肿瘤分泌黏液样物质阻塞胆总管所致,也可能是肿瘤浸润胆总管造成;寻找周围组织器官是否有疑似转移性占位病变可作为判断胰腺病变为恶性的佐证;IPMN的囊样病灶与扩张的胰管相通,而其他胰腺囊性肿瘤与胰管不相通,采用MRCP多方位重建能清楚显示主胰管或分支胰管的全貌,肿瘤与主胰管的沟通情况和组织关系,是判断病变性质的重要补充检查手段。诸多的诊断指标,必须综合考虑,单凭某一项指标满足上述条件尚不能草率下结论,只有多个指标满足上述条件时才能评估其为良性抑或恶性。
综上所述,IPMN发现率逐年上升,而此病的诊断主要依靠影像学检查[5-6]。目前,用于胰腺的影像学检查手段很多,诊断的灵敏度和特异度各异[7]。本研究认为,MRI能很好显示囊性病变、胰管扩张、附壁结节及交通管道,尤其在评估良性及恶性IPMN中具有独特优势并可起到重要作用[8-9]。
[1]李海良,沈健,何剑.胰腺导管内乳头状黏液瘤的MRI表现与病理对照[J].中国现代医生,2013,51(8):86-87.
[2]王天宝,高剑波.胰腺导管内乳头状黏液性肿瘤的CT表现与病理对照研究[J].中国CT和MRI杂志,2013,11(6):72-74.
[3]张栋,郎韧,樊华.胰腺导管内乳头状黏液性肿瘤免疫组织化学类型与病理学类型的Meta分析[J].中华消化外科杂志,2013,12(8):573-576.
[4]陈杰.胰腺肿瘤的病理诊断和鉴别诊断[J].临床肝胆病杂志,2013,29(1):45-49.
[5]郭子皓,张杰,郝建宇.胰腺导管内乳头状黏液瘤的研究进展[J].世界华人消化杂志,2011,19(22):2353-2357.
[6]赵庆,邵成伟,金艳,等.主胰管型胰腺导管内乳头状黏液性肿瘤的影像学表现[J].中国实用医刊,2013,40(2):45-46.
[7]徐安波,史大鹏,朱绍成,等.多层螺旋CT对胰腺导管内乳头状黏液性肿瘤的诊断价值[J].实用医学影像杂志,2013,14(4):267-269.
[8]殷小平,冯宝,李秋平,等.MSCT及MRI对胰腺导管内乳头状黏液性肿瘤的诊断[J].实用放射学杂志,2013,29(12):2059-2062.
[9]胡群辉,胡吉波,胡红杰.胰腺导管内乳头状黏液性肿瘤的CT、MRI诊断[J].浙江临床医学,2014(6):979-981.
Research on the value of diagnosis of malignant and benign by using MRI to assess intraductal papillary mucinous tumor(IPMN)/
WA Wei-min, LUO Song, YANG Jun, et al// China Medical Equipment,2015,12(4):74-76.
Objective: To investigate the MRI assessment of intraductal papillary mucinous tumors (IPMN) in the diagnosis of benign and malignant. Methods: Retrospectively to evaluate the value of benign and malignant MRI performance analysis confirmed that from 2011 to 2014 pathology in 10 cases of intraductal papillary mucinous tumors. Results: Three cases of mild atypical hyperplasia(benign), 1 cases were located in the head of pancreas, 2 cases in the pancreatic body, the performance of the main pancreatic duct dilatation of local mild greater than 5 mm and less than 10mm; 4 cases of moderate dysplasia(borderline), 2 cases were located in the pancreatic head, 2 cases in the tail of the pancreas were greater than 10mm and less than 15 mm, the expansion of the main pancreatic duct, lobulated cystic mass, internal with or without separation and papillae; 3 cases of severe atypical hyperplasia with local infiltration cancer(malignant), are located in the head of pancreas, pancreatic duct dilated obviously greater than 15mm, the irregular cystic mass, of which 1 case had liver metastasis. Conclusion: MRI assessment of intraductal papillary mucinous tumor has unique advantages and important role of.
Pancreatic neoplasms; Intraductal papillary mucinous neoplasm; Magnetic resonance imaging
10.3969/J.ISSN.1672-8270.2015.04.024
1672-8270(2015)04-0074-03
R445.2
A
瓦卫民,男,(1978- ),本科学历,主治医师。大理州人民医院放射科,从事磁共振影像诊断工作。
2014-11-19
①大理州人民医院放射科 云南 大理 671000