白细胞介素-8对缺氧脐静脉内皮细胞存活、凋亡的影响及机制
谢启应,杨天伦,孙泽琳,易军
白细胞介素-8对缺氧脐静脉内皮细胞存活、凋亡的影响及机制
谢启应,杨天伦,孙泽琳,易军
目的:通过氯化钴构建缺氧脐静脉内皮细胞模型,探讨白细胞介素-8(IL-8)对缺氧脐静脉内皮细胞存活、凋亡的影响及机制。
方法:体外培养脐静脉内皮细胞加入不同浓度氯化钴或IL-8 孵育,检测细胞存活率。正常或缺氧内皮细胞加入IL-8或同时加入IL-8抗体/蛋白激酶B(Akt)抑制剂LY294002孵育48 h,采用四唑盐比色法检测细胞存活率;用流式细胞术连接素V-异硫氰酸荧光素/碘化丙锭(Annexin V-FITC/ PI)双染标记法检测细胞凋亡;蛋白免疫印迹法检测半胱氨酸天冬氨酸蛋白酶-3(caspase-3)、磷酸化Akt(pAkt)和磷酸化糖原合成酶激酶3βser9(pGSK-3βser9)蛋白表达。
结果:低浓度氯化钴(50,100 μmol/L)孵育人脐静脉内皮细胞株(HUVECs) 12 h可促进细胞增殖(P<0.01);而高浓度氯化钴(200,400 μmol/L)孵育24 h和48 h则均明显减少内皮细胞存活。10、50和100 ng/ml的IL-8分别孵育内皮细胞48 h和72 h均可明显改善缺氧对脐静脉内皮细胞存活率的影响,细胞存活增加(P<0.01)。10 ng/ ml的IL-8可显著抑制正常和缺氧细胞的凋亡和下调caspase-3水平,上调pAkt和pGSK-3βser9水平(P<0.01);而LY294002或IL-8抗体均可拮抗IL-8的上述作用(P<0.01)。
结论:IL-8可通过下调caspase-3水平,上调pAkt和pGSK-3βser9水平,从而抑制缺氧内皮细胞的凋亡、促进细胞存活。
白细胞介素8;内皮细胞;蛋白激酶类
Objective: To investigate the effect of interleukin-8 (IL-8) on survival and apoptosis of hypoxic human umbilical vein endothelial cells (HUVECs) with its mechanisms.
Methods: Hypoxic HUVECs were induced by CoCl2. HUVECs were cultured with different concentrations of CoCl2or IL-8 and the survival rates of HUVECs were examined. Normal or hypoxic HUVECs were incubated with IL-8 or simultaneously incubated with anti-IL-8 or Akt inhibitor LY294002 for 48h. The HUVECs survival rate was detected by MTT method, apoptosis rate was measured by Annexin V-FITC/PI method, the protein expressions of Caspase-3, phosphorylated Akt (pAkt) and GSK-3βser9(pGSK-3βser9) were evaluated by Western blot analysis.
Results: By 12 h incubation with low concentration of CoCl2(50, 100 µmol/L), HUVECs proliferation were improved, P<0.01; while by 24h and 48 h incubation with high concentration of CoCl2(200, 400 µmol/L) HUVECs survival were decreased. By 48h and 72h incubation with IL-8 at (10, 50, 100 ng/ml), the hypoxia induced cell apoptosis was decreased and the survival was increased, P<0.01. IL-8 at 10 ng/ml may obviously inhibit the normal and hypoxic HUVECs apoptosis, down-regulate caspase-3 and up-regulate pAkt and pGSK-3βser9expressions in HUVECs, P<0.01, while the above effects could be reversed by LY294002 and anti-IL-8, P<0.01.
Conclusion: IL-8 could down-regulate caspase-3 and up-regulate pAkt and pGSK-3βser9expressions in HUVECs and therefore, inhibit the apoptosis and improve the survival of hypoxic HUVECs.
(Chinese Circulation Journal, 2015,30:1216.)
治疗性血管新生是冠状动脉严重狭窄时一种重要的代偿机制,有助于改善心肌供血,有多种炎症因子、细胞启动和参与该过程[1]。白细胞介素-8(IL-8)属于CXC 趋化因子亚家族,是激活和趋化炎性细胞的主要趋化因子之一,不仅是一种重要的炎症因子,而且可促进多种肿瘤组织的血管新生[2,3]。既往我们发现,冠心病患者血清IL-8水平显著增加,且与冠状动脉侧支循环分级与评分相关[4]。内皮细胞是机体最先感受缺氧的细胞之一,在血管新生中起重要作用。IL-8可直接诱导细胞增殖、迁移和血管新生[3,5]。IL-8与受体结合后以磷脂酰肌醇-3激酶(PI3K)依赖的方式激活蛋白激酶B(PKB即Akt)[6]。糖原合成酶激酶3β(GSK-3β)是Akt下游因子之一[7]。PI3K/Akt/GSK-3β/半胱氨酸天冬氨酸蛋白酶-3(caspase-3)途径在调控细胞的增殖和凋亡中起重要作用。缺氧孵育的内皮细胞更符合冠心病患者心脏血管内皮细胞功能变化,缺氧可通过激活IL-8信号途径促进血管新生[8]。但IL-8对缺氧内皮细胞增殖和凋亡的影响及机制尚不清楚。本实验通过氯化钴构建缺氧脐静脉内皮细胞模型,探讨IL-8对内皮细胞增殖和凋亡的影响,及与caspase-3、磷酸化Akt(pAkt)和磷酸化GSK-3βser9(pGSK-3βser9)表达的关系。
1 材料与方法
1.1材料和仪器
人脐静脉内皮细胞株(HUVECs)购于湖南长沙远泰生物技术有限公司(细胞来源于美国ATCC细胞库,货号CRL-2873)。连接素V-异硫氰酸荧光素/碘化丙锭(Annexin V-FITC/ PI)凋亡检测试剂盒购自美国ADL公司;LY294002购自江苏碧云天生物技术研究所;氯化钴购自湖南长沙远泰生物技术有限公司;重组人IL-8购自上海希美生物科技有限公司;四唑盐(MTT)、四甲基乙二胺(TEMED)购自美国Sigma公司;总蛋白提取试剂盒、鼠甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自美国ProMab公司;兔pAKT抗体、鼠caspase-3抗体购自美国Santa Cruz公司;兔pGSK-3β抗体购自美国Milipore公司;羊抗鼠IgG+A+M(H+L)/HRP购自美国ZYMED公司。BD FACSAria流式细胞分选仪系美国BD公司。
1.2细胞培养方法
(1)正常培养:细胞株复苏成功后,培养瓶中加入含10%小牛血清的DMEM培养基,于37℃、5%CO2条件下6孔板中培养,传代培养,至细胞生长融合率达到70%~80%时,将细胞转移至24孔培养板(1×109/L),无小牛血清的DMEM培养基中培养24 h后,随机分组进行下一步试验。(2)缺氧培养:正常培养的细胞生长融合率达到70%~80%时,培养液中加入终浓度为200 μmol/L 的氯化钴,培养48 h诱导为缺氧模型。
1.3试验设计和分组
不同浓度氯化钴诱导缺氧对脐静脉内皮细胞存活率/增殖的影响: 氯化钴可诱导缺氧诱导因子-1(HIF-1)的表达,但对IL-8的表达无影响,故按文献方法采用氯化钴诱导细胞缺氧模型[9,10]。收集对数期的脐静脉内皮细胞以1×104个/孔将细胞接种到96孔细胞培养板;培养24 h后分别加入终浓度为0、50、100、200和400 μmol/L的氯化钴,分别培养12、24和48 h。采用四唑盐比色法分析细胞存活率。共15组,每组设6个复孔。
不同浓度IL-8对缺氧脐静脉内皮细胞存活率/增殖的影响:收集对数期缺氧培养的脐静脉内皮细胞以1×104个/孔接种到96孔细胞培养板培养24 h,分别加入终浓度为0、1、10、50、100 ng/ml的重组人IL-8;对照组为普通正常培养的脐静脉内皮细胞;分别培养24、48、72 h。采用四唑盐比色法分析细胞存活率。共18组,每组设6个复孔。
IL-8对脐静脉内皮细胞凋亡及caspase-3、pAkt和pGSK-3βser9水平的影响:分为八组:(1)对照组:未添加IL-8和氯化钴正常培养的脐静脉内皮细胞;(2)缺氧组:培养液中加入终浓度为200 μmol/L的氯化钴;(3)IL-8组:培养液中加入终浓度为10 ng/ml的IL-8;(4)IL-8+缺氧组:缺氧培养的细胞培养液中加入终浓度为10 ng/ml的IL-8;(5)Anti-IL-8组:培养液中加入终浓度为10 ng/ml的IL-8和10 μg/ml的Anti-IL-8;(6)Anti-IL-8+缺氧组:缺氧培养的细胞培养液中加入终浓度为10 ng/ml的IL-8和10 μg/ml 的Anti-IL-8;(7)LY294002组:培养液中加入终浓度为10 ng/ml的IL-8和20 μmol/L的Akt抑制剂LY2904002;(8)LY294002+缺氧组:缺氧培养细胞的培养液中加入终浓度为10 ng/ml的IL-8和20 μmol/L的LY294002。各组培养48 h后收集细胞采用Annexin V-FITC/ PI双染标记法检测细胞凋亡,蛋白免疫印迹法检测pAkt、pGSK-3βser9和caspase-3的水平。
1.4四唑盐比色法
按文献方法检测细胞存活率[11]。孵育结束后每孔加入50 μl 1×四唑盐,37℃孵育4 h;弃除培养液后加入二甲基亚砜(DMSO)150 μl,低速振荡10 min。在酶标仪570 nm波长处检测光密度(OD)值。细胞存活率计算:将各测试孔的OD值减去本底OD值(培养基加四唑盐,无细胞)。细胞的存活率以T/ C%表示,T为测试细胞的OD值,C为对照细胞的OD值。细胞存活率(%)=(测试细胞OD/对照细胞OD)×100%。
1.5细胞凋亡检测
按照参考文献[11]方法采用Annexin V-FITC/ PI双染标记法检测细胞凋亡。收集细胞以预冷1×磷酸盐缓冲液(PBS)洗涤1次,500 r/min离心10 min。加入标记液(每100 μl含10×binding buffer 10 μl,annexin V-FITC 5 μl,distilled water 85 μl),按照105~106细胞/100 μl,室温避光孵育15 min,加入50 mg/ml的PI 10 μl,后加入400 μl×binding buffer稀释,15 min内用BD FACSAria流式细胞分选仪进行流式细胞检测。用CELL Quest软件对结果散点图进行分析。
1.6蛋白免疫印迹法检测蛋白
按试剂盒说明操作。收集细胞后1×PBS 洗涤1次。加入总蛋白提取液吹打至细胞完全破碎,10 000 r/min离心10 min。采用分离胶为12%的SDSPAGE恒压200 V电泳,用“三明治电转法”恒流300 mA,将凝胶上蛋白转移到NC膜上。用含5%脱脂奶粉PBS封闭膜2 h。分别加入兔pAKT多抗(1:400),兔pGSK-3βser9多抗(1:400), 小鼠caspase-3多抗(1:400),小鼠GAPDH抗体(1:1 000),室温下孵育2 h。加入辣根过氧化物酶标记的二抗(羊抗兔-HRP 1:50 000或羊抗鼠-HRP 1:50 000~1:40 000),室温下孵育1 h,滴加增强化学发光底物,暗室中采用柯达胶片记录荧光信号。
1.7统计学分析
2 结果
2.1不同浓度氯化钴诱导缺氧对脐静脉内皮细胞存活率的影响(图1)
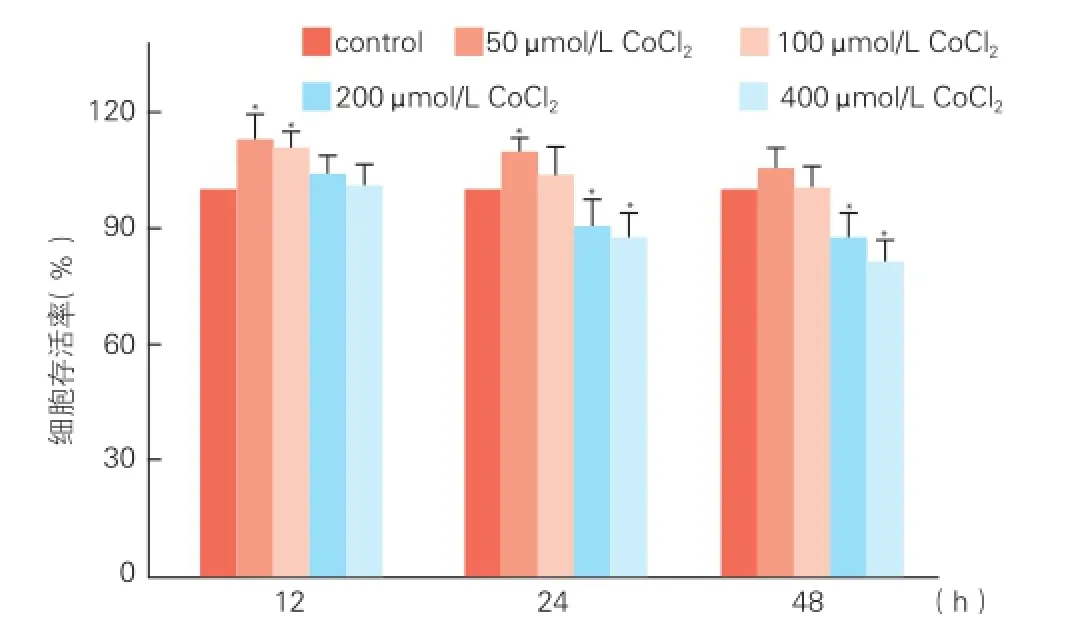
图1 四唑盐方法分析不同浓度氯化钴诱导缺氧对脐静脉内皮细胞存活率的影响(n=6)
不同浓度氯化钴孵育脐静脉内皮细胞 12 h,低浓度氯化钴(50,100 μmol/L)有促进细胞增殖的作用(P<0.01),而高浓度氯化钴(200,400 μmol/L)无明显作用;孵育脐静脉内皮细胞 24 h后仅50 μmol/L 氯化钴有促进细胞增殖的作用(P<0.01),而高浓度氯化钴(200,400 μmol/L)表现为抑制细胞增殖,细胞存活减少(P<0.01);孵育脐静脉内皮细胞 48 h后低浓度氯化钴(50,100 μmol/L)对细胞存活的作用不明显,高浓度氯化钴(200,400 μmol/L)孵育后细胞数目减少,表现为细胞存活率明显减少(P<0.01)。
2.2不同浓度IL-8对氯化钴诱导缺氧脐静脉内皮细胞存活率的影响(图2)
不同浓度IL-8(1、10、50、100 ng/ml)孵育缺氧脐静脉内皮细胞 24 h,有改善缺氧所致细胞死亡趋势,但差异无统计学意义(P>0.05)。孵育缺氧脐静脉内皮细胞 48 h和72 h后,1 ng/ml的IL-8有改善缺氧所致细胞死亡趋势,但差异无统计学意义(P>0.05);而10、50和100 ng/ml的IL-8均可明显改善缺氧所致的细胞死亡,表现出细胞存活率增多(P<0.01)。
2.3IL-8对缺氧脐静脉内皮细胞凋亡的影响
用软件分析流式细胞检测的各组凋亡分别为:对照组2.36±0.08、缺氧组13.56±0.65、IL-8组1.96±0.09、IL-8+缺氧组9.17±0.32、Anti-IL-8组2.38±0.08、Anti-IL-8+缺氧组13.53±0.57、LY294002组3.26±0.08和LY294002+缺氧组15.13±0.37。如图3所示,IL-8可抑制正常孵育细胞的凋亡(1.96±0.09 vs 2.36±0.08,P<0.05),而IL-8抗体和Akt抑制剂LY294002均可拮抗该作用。缺氧显著增加细胞的凋亡(13.56±0.65 vs 2.36±0.08,P<0.01),IL-8可明显抑制缺氧诱导的细胞凋亡(9.17±0.32 vs 13.56±0.65,P<0.01),而IL-8抗体或LY294002均明显拮抗IL-8抑制缺氧细胞凋亡的作用(13.53±0.57 vs 9.17±0.32,15.13±0.37 vs 9.17±0.32,P<0.01)。差异均有统计学意义。
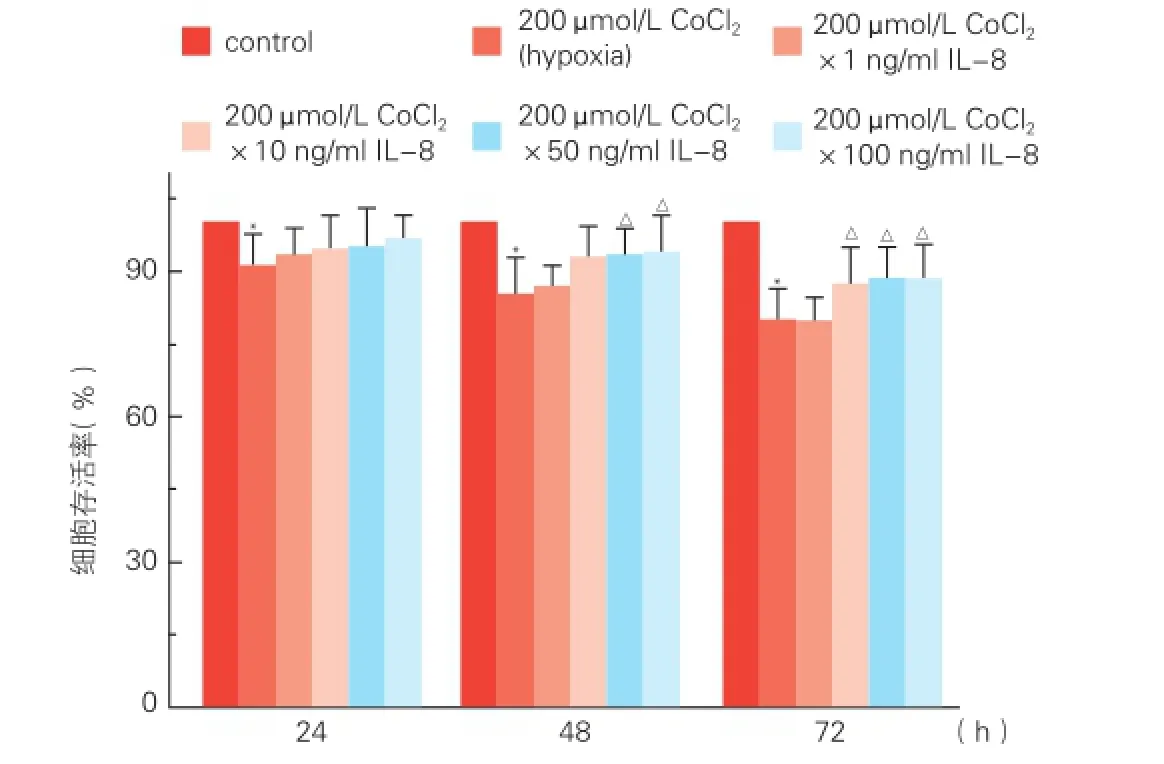
图2 四唑盐方法分析不同浓度IL-8对缺氧脐静脉内皮细胞存活率的影响(n=6)
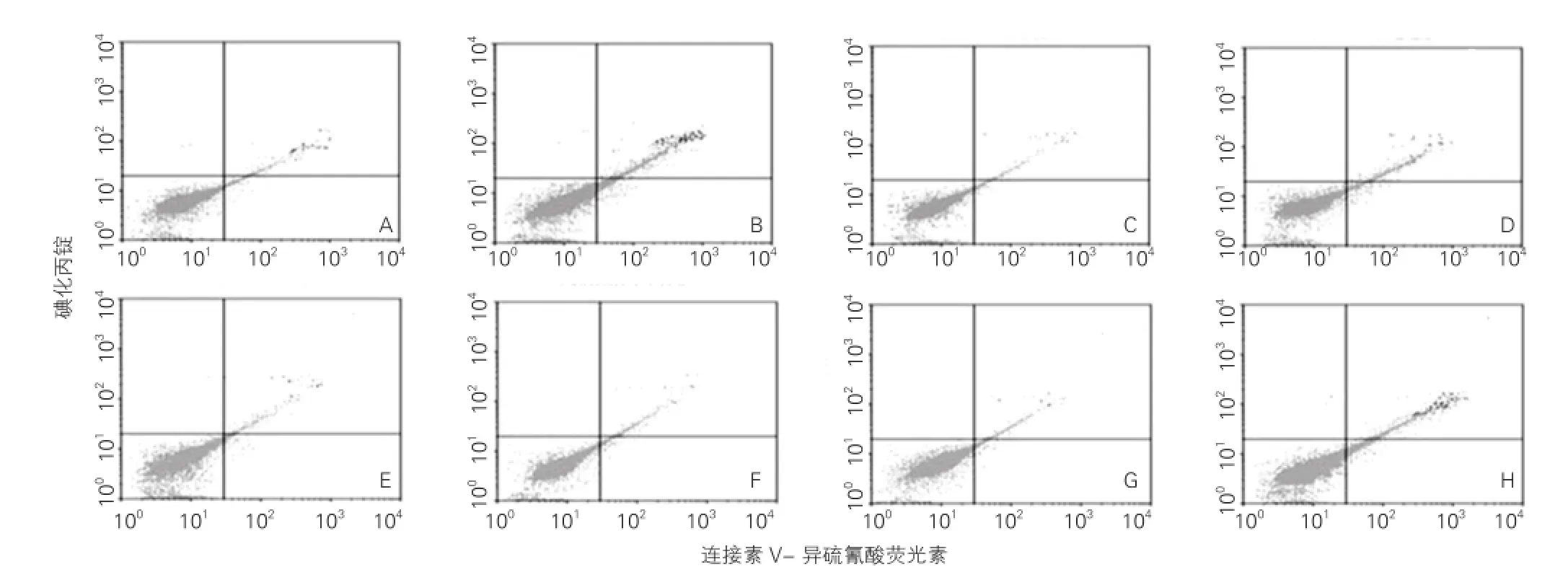
图3 IL-8对缺氧脐静脉内皮细胞凋亡的影响(n=6)
2.4IL-8对脐静脉内皮细胞caspase-3、pAkt和pGSK-3βser9水平的影响(图4)
与对照组比较,缺氧组caspase-3水平增加(308.35±5.60 vs 80.50±3.12,P<0.01);pAkt和pGSK-3βser9水平明显下降(143.40±6.22 vs 322.68±6.11,97.42±4.28 vs 223.68±7.05,P均<0.01)。分别与对照组和缺氧组比较,IL-8均可明显下调caspase-3(63.8±4.26 vs 80.50±3.12, P<0.05;63.8±4.26 vs 308.35±5.60,P<0.01)水平;上调pAkt(376.50±4.09 vs 322.68±6.11,P<0.05;376.50±4.09 vs 143.40±6.22,P<0.01)水平和pGSK-3βser9(281.13±9.79 vs 223.68±7.05,P<0.05;281.13±9.79 vs 97.42±4.28,P<0.01)水平;而LY294002或IL-8抗体均可拮抗IL-8的上述作用(P<0.01)。差异均有统计学意义。

图4 蛋白免疫印迹法分析IL-8对脐静脉内皮细胞caspase-3、pAkt和pGSK-3βser9水平的影响(n=3)
3 讨论
内皮细胞是血液与组织之间的第一道屏障,具有多种生理功能,是最先感受缺氧的细胞之一。生长因子通过促进内皮细胞增殖、迁移及黏附和抑制内皮细胞的凋亡两个方面来促进血管生成。制备内皮细胞缺氧模型有物理和化学方法,研究发现利用氯化钴诱导缺氧模型具有剂量可准确控制、无特殊设备要求等优点[10]。本研究显示:低浓度氯化钴(50、100 μmol/L) 孵育脐静脉内皮细胞12 h有促进细胞增殖作用。而高浓度氯化钴(200、400 μmol/L)孵育24 h后明显抑制细胞增殖,显示缺氧效应,是一种理想的缺氧模型诱导剂。低氧能刺激多种炎症和生长因子的表达, 促进血管新生。慢性缺氧削弱心肌对缺血/再灌注损伤的耐受性,而恢复供氧通过激活Akt和胞外信号调节激酶 1/2(ERK1/2)信号途径保护心肌[12]。白细胞介素是主要的炎症因子之一,可介导免疫炎症反应等参与动脉粥样硬化斑块的发生发展[13]。IL-8是白细胞介素家族中一种多能细胞因子,可诱导炎症因子的表达。既往我们发现,IL-8与CXCR2受体结合通过活性氧—核转录因子-kappaB/活化蛋白-1(ROS-NF-кB/AP-1)信号通路诱导单核细胞活化、黏附到内皮细胞[14]。此外,IL-8能诱导内皮细胞和肿瘤组织增殖、迁移和毛细血管形成[3,15]。研究显示,IL-8与发生心肌梗死的风险相关[16]。冠状动脉严重狭窄的冠心病患者血清IL-8水平显著增加,且与冠状动脉侧支循环分级与评分相关[4],推测IL-8表达增加与心肌缺氧诱导的血管新生有关系。本研究显示:10、50和100 ng/ml的IL-8孵育48 h后均可明显改善氯化钴诱导缺氧所致脐静脉内皮细胞增殖的抑制作用,呈剂量依赖性促进细胞的增殖。
IL-8受体包括CXCR1, CXCR2和Duffy。IL-8与其受体结合后激活下游分子通路。研究发现,IL-8可通过p38丝裂原活化蛋白激酶—核转录因子-kappaB (p38MAPK-NF-кB)途径诱导血管新生[17],也可与CXC受体结合后激活PI3K/Akt诱导细胞迁移[6]。在缺血再灌注损伤中目前已知有三条保护心肌的信号通路,在早期主要是通过PI3K/ Akt/ROS/NO/PKC/p38 MAPK和PI3K / ERK1/2 信号途径[18]。PI3K/Akt通路是介导细胞存活的经典通路之一,Akt是PI3K下游主要的效应物。活化的Akt通过磷酸化作用可引起钙动员和(或)MAPK信号级联反应,或激活GSK-3β、Bax和核因子-кB(NF-кB)等下游靶蛋白,进而调节细胞的增殖、分化、凋亡以及迁移等。LY294002是Akt拮抗剂,可通过阻断Akt的磷酸化抑制细胞增殖和肿瘤诱发的血管生成[19]。GSK-3β是Akt重要的下游因子之一,它存在两个磷酸化位点,在其N端丝氨酸9(ser9)处的磷酸化可明显降低GSK-3β的活性,而酪氨酸216(Tyr216)的磷酸化则可增强它的活性。GSK-3β活性增加激活细胞凋亡的多种蛋白激酶如Bax、caspases家族等,从而诱导细胞凋亡[6,20]。caspase的活化是凋亡发展过程中的关键环节。caspase-3是细胞凋亡过程中主要的终末剪切酶,反映了凋亡启动以及细胞的凋亡水平。在缺血性心肌损伤模型中,caspase-3激活同时伴有GSK-3β的激活,而GSK-3β激活可以进一步促进caspase-3的激活,从而促进细胞凋亡。本研究发现:同对照组相比,缺氧的脐静脉内皮细胞磷酸化Akt和GSK-3βser9明显降低,caspase-3明显升高,细胞凋亡增加。而不论有无缺氧,IL-8孵育均促进内皮细胞磷酸化Akt和GSK-3βser9的表达,降低Caspase-3表达和细胞凋亡;同时予以IL-8抗体或Akt抑制剂LY294002则可拮抗该作用。提示IL-8可通过与其受体结合后经磷酸化Akt/ GSK-3βser9途径影响内皮细胞的增殖和凋亡。
综上所述,本研究提示IL-8与受体结合后经激活PI3K/Akt/GSK-3βser9途径,降低GSK-3β活性,减少caspase-3的表达,从而减少氯化钴诱导的缺氧脐静脉内皮细胞的凋亡、促进细胞增殖。
[1] Mitsos S, Katsanos K, Koletsis E, et al. Therapeutic angiogenesis for myocardial ischemia revisited: basic biological concepts and focus on latest clinical trials. Angiogenesis, 2012, 15: 1-22.
[2] Qazi BS, Tang K, Qazi A. Recent advances in underlying pathologies provide insight into interleukin-8 expression-mediated inflammation and angiogenesis. Int J Inflam, 2011, 2011908468. PMID: 22235381.
[3] Ning Y, Manegold PC, Hong YK, et al. Interleukin-8 is associated with proliferation, migration, angiogenesis and chemosensitivity in vitro and in vivo in colon cancer cell line models. Int J Cancer, 2011, 128: 2038-2049.
[4] 牛瑞超, 谢晓云, 杨天伦. 冠状动脉侧支循环与血清白细胞介素及基质金属蛋白酶的关系. 中西医结合心脑血管病杂志, 2007, 5: 631-633.
[5] Li A, Dubey S, Varney ML, et al. IL-8 directly enhanced endothelial cell survival, proliferation, and matrix metalloproteinases production and regulated angiogenesis. J Immunol, 2003, 170: 3369-3376.
[6] Sotsios Y, Ward SG. Phosphoinositide 3-kinase: a key biochemical signal for cell migration in response to chemokines. Immunol Rev, 2000, 177: 217-235.
[7] Hardt SE, Sadoshima J. Glycogen synthase kinase-3beta: a novel regulator of cardiac hypertrophy and development. Circ Res, 2002, 90: 1055-1063.
[8] Hsiao KY, Chang N, Lin SC, et al. Inhibition of dual specificity phosphatase-2 by hypoxia promotes interleukin-8-mediated angiogenesis in endometriosis. Hum Reprod, 2014, 29: 2747-2755.
[9] Loboda A, Jazwa A, Wegiel B, et al. Heme oxygenase-1-dependent and -independent regulation of angiogenic genes expression: effect of cobalt protoporphyrin and cobalt chloride on VEGF and IL-8 synthesis in human microvascular endothelial cells. Cell Mol Biol (Noisy-legrand), 2005, 51: 347-355.
[10] Karovic O, Tonazzini I, Rebola N, et al. Toxic effects of cobalt in primary cultures of mouse astrocytes. Similarities with hypoxia and role of HIF-1alpha. Biochem Pharmacol, 2007, 73: 694-708.
[11] 杨梅, 肖智林, 吕青山, 等. PolyI: C对人脐血内皮祖细胞数量及功能的影响. 中国动脉硬化杂志, 2011, 19: 668-674.
[12] Milano G, von Segesser LK, Morel S, et al. Phosphorylation of phosphatidylinositol-3-kinase-protein kinase B and extracellular signal-regulated kinases 1/2 mediate reoxygenation-induced cardioprotection during hypoxia. Exp Biol Med (Maywood), 2010, 235: 401-410.
[13] 陈少源, 贺五一, 金健, 等. 急性冠状动脉综合征患者白细胞介素-37水平变化的研究. 中国循环杂志, 2014, 29: 871-874.
[14] 谢启应, 钟巧青, 谢秀梅, 等. 血管紧张素Ⅱ通过上调白细胞介素-8受体表达增加单核细胞黏附. 中国循环杂志, 2014, 29: 367-371.
[15] Koch AE, Polverini PJ, Kunkel SL, et al. Interleukin-8 as a macrophage-derived mediator of angiogenesis. Science, 1992, 258: 1798-1801.
[16] Velasquez IM, Frumento P, Johansson K, et al. Association of interleukin 8 with myocardial infarction: results from the Stockholm Heart Epidemiology Program. Int J Cardiol, 2014, 172: 173-178.
[17] Chen SU, Lee H, Chang DY, et al. Lysophosphatidic acid mediates interleukin-8 expression in human endometrial stromal cells through its receptor and nuclear factor-kappaB-dependent pathway: a possible role in angiogenesis of endometrium and placenta. Endocrinology, 2008, 149: 5888-5896.
[18] Akhmedov A, Montecucco F, Braunersreuther V, et al. Genetic deletion of the adaptor protein p66Shc increases susceptibility to short-term ischaemic myocardial injury via intracellular salvage pathways. Eur Heart J, 2015, 36: 516-526.
[19] Garlich JR, De P, Dey N, et al. A vascular targeted pan phosphoinositide 3-kinase inhibitor prodrug, SF1126, with antitumor and antiangiogenic activity. Cancer Res, 2008, 68: 206-215.
[20] Song JQ, Teng X, Cai Y, et al. Activation of Akt/GSK-3beta signaling pathway is involved in intermedin(1-53) protection against myocardial apoptosis induced by ischemia/reperfusion. Apoptosis, 2009, 14: 1061-1069.
(编辑:漆利萍)
Effect and Mechanism of Interleukin-8 on Survival and Apoptosis of Hypoxic Human Umbilical Vein Endothelial Cells
XIE Qi-ying, YANG Tian-lun, SUN Ze-lin, YI Jun.
Department of Cardiology, Xiangya Hospital, Central South University, Changsha (410008), Hunan, China
Corresponding Author: YI Jun, Email: yjwx0312@163.com
Interleukin-8; Endothelial cell; Akt; Protein kinase
湖南省科技厅科研基金资助(2008FJ4183)
410008 湖南省长沙市,中南大学湘雅医院 心内科
谢启应 副教授 博士 主要从事冠心病防治及心脏起搏电生理 Email: eagledoctor@163.com 通讯作者:易军 Email: yjwx0312@163.com
R54
A
1000-3614(2015)12-1216-06
10.3969/j.issn.1000-3614.2015.12.020
2015-03-31)

