响应面法优化重组大肠杆菌生物合成别藻蓝蛋白(holo-apcA)的发酵条件
周孙林, 陈华新, 姜 鹏, 李富超, 唐东山,
(1.南华大学 污染控制与资源化湖南省高校重点实验室, 湖南 衡阳 421000; 2.中国科学院 海洋研究所,山东 青岛 266071; 3.南华大学 环境保护与安全工程学院, 湖南 衡阳 421001)
藻胆蛋白是蓝藻、红藻、隐藻和某些甲藻中特有的重要捕光色素蛋白, 由藻胆色素与脱辅基蛋白共价结合而成, 具有增强人体免疫力、抗氧化和抗肿瘤作用, 并可用作食品天然色素。藻胆蛋白具有荧光特性, 在免疫组化、荧光免疫分析等领域有着广阔的应用前景。别藻蓝蛋白是藻胆蛋白中的一种, 目前大多提取自各种藻类, 但天然别藻蓝蛋白的制备需要经过藻种选育、培养、回收与纯化等过程, 时间及经济成本大, 且得到的蛋白稳定性不高, 因此市面价格极高, 很大程度上限制了它的广泛应用。
利用代谢工程的方法实现别藻蓝蛋白在大肠杆菌体内的生物合成[1], 为藻胆蛋白的制备提供了一种新的途径[1-4]。本实验室将嗜热蓝藻(Synechococcus elongatusBP-1)的别藻蓝蛋白 α亚基基因插入载体pCDFDuet-1第一表达框内, 同时将催化合成藻蓝胆素的亚铁血红素氧化酶基因Ho1和胆绿素还原酶基因PcyA插入载体pCDFDuet-1第二表达框内, 得到质粒 pCDF-apcA-Ho1-PcyA; 并将催化色基与 apcA共价结合的裂合酶基因CpcS和CpcU插入载体pRSFDuet-1第二表达框内, 得到质粒 pRSF-cpcS-cpcU。将上述质粒共转化大肠杆菌, 利用大肠杆菌本身具有亚铁血红素这一特性, 实现了重组别藻蓝蛋白α亚基的体内重组[2]。与天然别藻蓝蛋白相比, 它具有结构单一, 理化性质稳定等优点。大肠杆菌中生物合成别藻蓝蛋白受多种因素影响, 张伟杰等[5]对重组别藻蓝蛋白诱导条件进行了优化, 但上述试验中利用的优化方法均为单因素试验, 即单次单因子法(One-factor-at-a-time design), 这种方法是在假设因素间不存在交互作用的前提下, 一次改变一个因素的水平而其他因素保持不变, 对每个因素逐一考察。这种方法的优点是简单、结果明了, 不需要专门的统计学知识, 因此一直都是条件优化的常用方法。但是由于作者通常考察的实验因素间存在一定的交互作用, 该方法得出的结果无法全面的说明各因素与响应值之间的复杂关系, 且当考察的因素较多时,需要试验次数多和试验周期长, 因此单因素法在条件优化过程中常常用于初步的筛选试验[6-9]。
本试验利用响应面中心组合设计试验方法对诱导条件进行了进一步优化, 响应面设计法(Responsesurface methodology, RSM)是一种寻找多因素系统中最佳条件的数学统计方法, 是数学方法和统计方法结合的产物, 它可以用来对受多个变量影响的响应问题进行建模与分析, 并可以将该响应进行优化。该法不但具备试验次数少, 周期短、精度高等优点, 而且可以建立连续变量曲面模型, 同时对影响试验指标的各因子水平及其交互作用进行优化和评价, 可快速有效的确定多因子系统的最佳条件[6,9-10]。
试验利用中心组合设计对重组别藻蓝蛋白 α亚基表达体在大肠杆菌中诱导表达的影响因素进行了影响显著性及各因素间交互性考察, 通过验证试验比较, 证实了优化条件下诱导得到的同体积表达量是未优化条件的2.3倍, 验证试验结果与优化试验预测值相符。该诱导结果与以往文献[12]报道结果相比提高了70 %~580 %, 且IPTG使用浓度经优化后减少至原使用浓度的十分之一, 为文献[12]报道使用浓度(IPTG 0.5 mM)的五分之一, 降低了发酵成本。试验证明响应面法-中心组合设计对重组别藻蓝蛋白α亚基的诱导条件优化确实可行。
1 材料与方法
1.1 菌株、培养基和试剂
菌株: 基因工程菌E.coliBL21(DE3)/pCDF-apcA-Ho1-pcyA/pRSF-cpcU-cpcS 由中国科学院海洋研究所构建, 含有别藻蓝蛋白 α亚基生物合成相关的5个基因。
活化菌种所用培养基: LB培养基(蛋白胨10 g/L,酵母粉5 g/L, NaCl 10 g/L; pH值7.4)
诱导所用培养基: TB培养基(蛋白胨12 g/L, 酵母粉12 g/L, 磷酸盐缓冲液(72 mmol/L K2HPO4; 17 mmol/L KH2PO4), 甘油 4 ‰)
试剂: 酵母粉和蛋白胨购自Oxoid公司, 卡那霉素, 壮观霉素和IPTG购自Solarbio公司, 其他试剂购自国药化学试剂有限公司。
1.2 试验方法
1.2.1 响应面(RSM)因素水平
根据以往文献报道试验结果[5]确定 4因素(诱导温度、诱导时机、培养基初始pH、诱导剂IPTG终浓度)用于中心组合试验设计作4因素5水平实验设计, 共30组实验, 其中中心点6组(用于评估随机误差对实验结果造成的影响), 每组重复 3次平行试验(共计90组实验)。实验设计因素水平见表1。
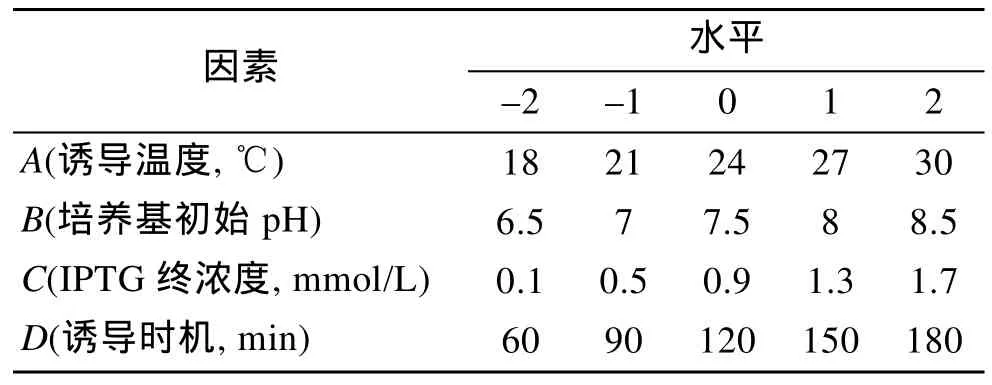
表1 中心组合设计试验因素与水平Tab.1 Factors and levels of central composition design
1.2.2 菌种的诱导表达
取保存的同等活力菌种按 0.5 %的接种量接种于加壮观霉素 (100 μg/mL)和卡那霉素 (50 μg/mL)抗性的50 mL LB培养基中, 37 ℃ , 200 r /min回旋式摇床中培养 15 h。按 4%的接种量, 接种至不同 pH值的25 mL TB培养基中, 37 ℃剧烈振摇(200 r/min)不同时长, 再于超净台加入IPTG至不同终浓度, 在试验设计的各自温度下诱导相同时长(8 h)。
1.2.3 荧光强度的测定
使用荧光分光光度计 F-4500 (Hitachi, Japan)直接对诱导得到的菌液进行荧光值测定, 后对其进行数据处理。所设参数为扫描范围600~700 nm, 在590 nm激发光波长下扫描其荧光发射光谱, 扫描速度240 nm/s,荧光最大值设为1000, 荧光值超过1000的样品对菌体稀释相应倍数后测定, 记录其荧光发射峰值及其峰值处的波长。
1.2.4 响应面(CCD)分析法
预试验中, 菌液荧光值 0~500 a.u.范围内, 菌液荧光值与蛋白表达量呈线性关系, 即菌液经离心破碎后得到重组荧光蛋白的表达量(mg/L)=(1.8×菌液荧光值-1.9513)/22.781。试验中以菌液荧光值为响应值, 反应了不同因素对重组别藻蓝蛋白表达量的影响。利用Design-Expert 8.0软件建立多元二次回归方程, 对方程进行模型回归和方差分析, 确定别藻蓝蛋白(holo-apcA)诱导表达的最佳条件, 分别以优化条件和以往诱导条件进行验证试验。
2 结果与分析
2.1 中心组合设计试验优化重组别藻蓝蛋白(holo-apcA)的发酵条件
2.1.1 响应面法中心组合设计及试验结果
根据响应面法中心组合设计试验设计原理作四因素 5水平试验设计。中心组合设计及试验结果见下表3。
利用Design-Expert 8.0软件对表2中数据进行多元回归拟合, 得到4因素A(诱导温度)、B(发酵培养基初始 pH)、C(IPTG 终浓度)、D(诱导时机)与响应值R之间的回归方程为:

表2 中心组合试验设计及结果Tab.2 Coded and real values of variables in central composition design

表3 响应面二次模型回归方程的方差分析结果Tab.3 Analysis of variances for full quadratic model
R=95.16+16.1A+15.08B-6.08C+31.40D+5.79AB-
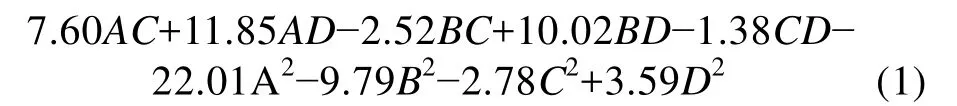
2.1.2 回归模型方差分析
利用Design expert 8.0软件对响应面二次模型回归方程进行方差分析, 结果见表3和表4。
从表3可以看出, 该模型的F值为9.37,Prob>F值为<0.0001, 说明该模型极显著, 仅有不到 0.01%的概率不能用该模型来解释; 失拟项Prob>F=0.1637>0.05, 失拟不显著, 说明回归方程的拟合度较好; CV%= 29.84, 较低, 说明试验操作可信; 预测R2值为0.8974, 校正后RAdj2= 0.8016, 说明该模型可以解释89.74%的试验所得的响应值的变化。从表4可以看出, 影响因子A(诱导温度)、B(pH)、D(诱导时机)的P值均小于0.05, 说明这3个因素对模型影响显著, 其中D的P值<0.0001, 影响极显著; 而C(IPTG终浓度)的P值=0.1766>0.05, 对模型的影响不显著, 各因素对响应值的影响顺序为:D>A>B>C;且各因素间存在交互作用, 交互项AD的P值小于0.05, 影响显著; 另外二次项A2、D2的P值也小于0.05, 影响显著, 其中A2的P值<0.0001影响极显著,其余项不显著。交互项及二次项的显著性进一步说明各影响因子对响应值的影响不是简单的线性关系,不能单靠单因素试验来进行优化。
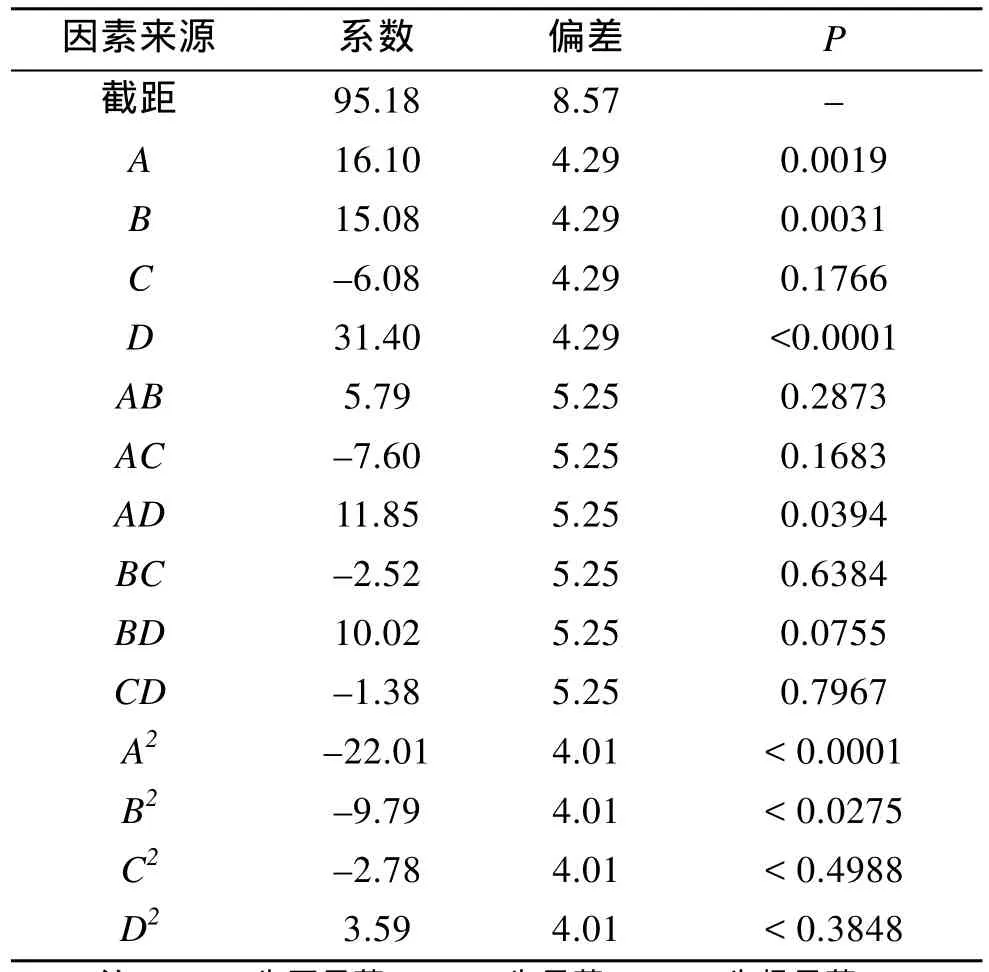
表4 各编码因素水平方差分析Tab.4 Analysis of variances for holo-apcA production in coded level variables
2.1.3 响应曲面分析
响应曲面是在所考察的四因素中的任意两因素水平固定的前提下, 以中心组合设计中的响应值为纵坐标, 其他两个因素分别为水平面上的两垂直横坐标所构成的三维模型。模型中每个响应面分别代表2个独立变量之间的相互作用, 两因素相互之间交互作用对响应值的影响显著的模型曲面呈马鞍型,等高线呈椭圆形; 反之, 则模型曲面呈圆滑型, 等高线呈圆形。二次回归方程的响应面及等高线图见图1, 图中由各响应曲面及相应的等高线可以看出, (a)图诱导温度与培养基初始pH之间以及(d)图IPTG终浓度与培养基初始pH之间的交互作用均不显著, 表现为响应曲面圆滑, 变化平缓, 等高线呈圆形; 而其余图(b, c, e, f)的两因素间交互作用都比较明显, 表现为曲面呈马鞍型, 在靠近极值处响应值骤变, 等高线呈椭圆形。
2.2 验证试验
根据得到的拟合方程, 可采用绘制出响应面图的方法获得最优值, 也可采用方程求解的方法获得最优值。本试验中直接通过Design-Expert软件在响应曲面图中得出重组别藻蓝蛋白发酵的最佳条件为:诱导温度28 ℃, 发酵培养基初始pH 8.5, 加入IPTG的终浓度0.1 mmol/L, 诱导时机为菌体转接后3 h。在此条件下软件得出的回归模型预测值为菌液荧光值269.5, 即蛋白表达量为21.2 mg/L。
为验证模型预测的准确性及优化方案的可行性,根据软件得出的优化方案进行了验证试验, 试验重复3次, 取平均值。实测诱导得到的菌液荧光值258.7 au,即重组别藻蓝蛋白表达量为20.4 mg/L, 与软件预测值相对误差为 4 %, 说明响应面优化得到的模型与试验数据拟合度较好, 达到了优化重组别藻蓝蛋白发酵条件的目的。
3 讨论
藻胆蛋白作为藻类特有的重要捕光色素蛋白,在临床医学诊断和免疫组化等研究领域有着广阔的应用前景, 因此, 近年来对于藻胆蛋白制备与应用等相关研究较多。其中关于重组别藻胆蛋白在大肠杆菌体内诱导表达的试验研究中, 包括了一部分对其诱导表达条件的探索及优化试验[5,11], 文献报道的对重组别藻蓝蛋白诱导表达条件的优化方法一般采用单因素试验, 该试验方法忽略了试验中因素间的交互作用, 得到的优化条件不一定为最优。因此,本试验利用响应面-中心组合设计试验对重组别藻蓝蛋白诱导表达条件进行了进一步的优化。
通过 Design-expert 8.0软件得出了各因素优化值和优化条件下的响应值。优化后的发酵条件为: 诱导温度28℃、发酵培养基初始pH 8.5、诱导时机3 h、IPTG终浓度0.1 mmol/L, 在此条件下发酵得到的重组别藻蓝蛋白(holo-apcA)表达量为20.4 mg/L, 与软件预测值相对误差为 4 %, 说明响应面优化得到的模型与试验数据拟合度较好, 达到了优化重组别藻蓝蛋白发酵条件的目的, 与优化前本试验原始诱导条件诱导的结果(即表达量 9 mg/L)相比较, 蛋白表达量增加为原来的2.3倍, 与文献报道的重组别藻蓝蛋白α亚基蛋白表达量3~12 mg/L[12]相比较, 表达量提高了70 %~580 %。该发酵条件与原发酵条件相比主要不同在于发酵培养基初始pH由原来的7.4增大到现在的8.5, IPTG使用终浓度由原来的1 mmol/L减少到现在的0.1 mmol/L。
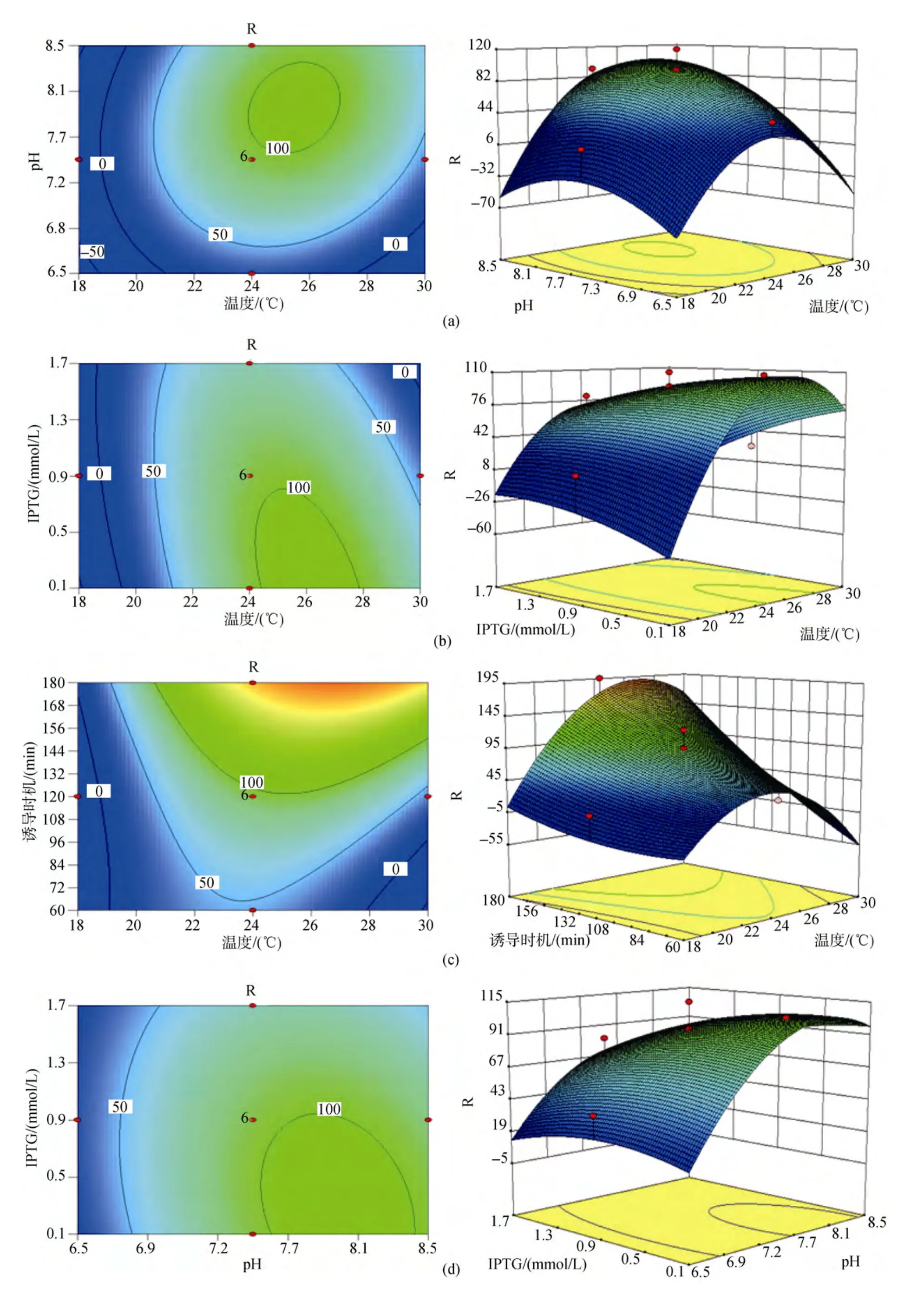
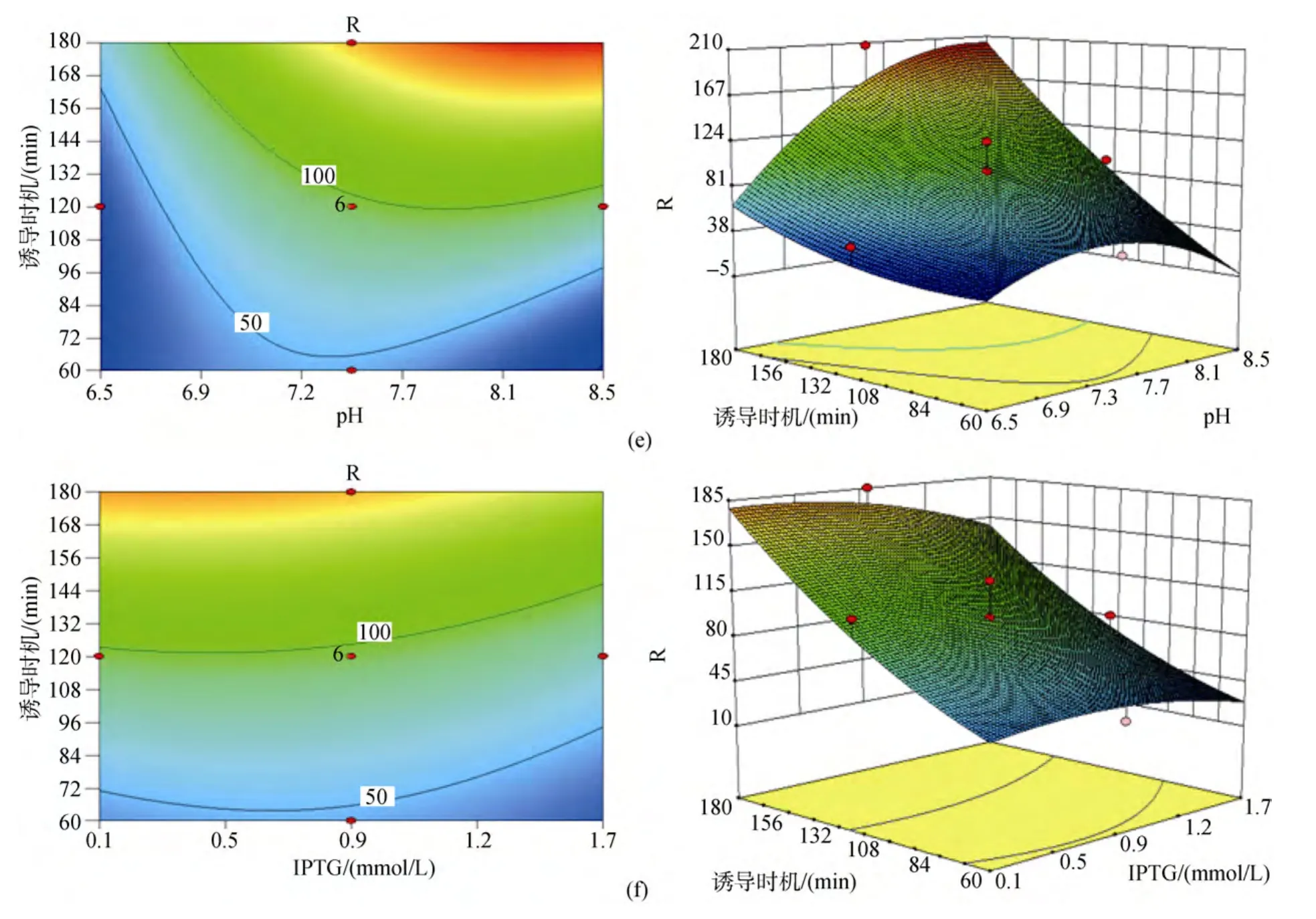
图1 各因素交互作用及其对别藻蓝蛋白表达量影响的响应面图和等高线图Fig.1 Response surface curves and contour plot of factor interaction effecting on holo-apcA production

表5 最优化发酵条件验证试验结果Table.5 Validation of the model
发酵培养基初始 pH对菌体的生长和产物的表达均存在一定的影响, 因为乙酸是大肠杆菌的主要副产物, 它对细菌生长和产物的表达都有抑制作用[13-15], 刘永军等[16]通过试验得到大肠杆菌的最适生长酸度为7.82, 较高的初始pH对菌体生长过程中产生的乙酸存在一定的调节作用, 促进菌体的生长与产物的表达。培养基的pH还将影响酶分子和底物分子的带电状况, 从而影响酶的合成, 使代谢和细胞透性发生变化[17]。分析pH的增加可能导致细胞膜通透性的增大, 从而有利于诱导剂IPTG进入到细胞内部与阻遏蛋白结合, 起到诱导效果。由于IPTG是一种作用极强的诱导剂, 不被细菌代谢而十分稳定,因此少量的 IPTG在较高通透性的细胞间可自由出入, 对多个细胞起到诱导作用。而由响应面图1可以看出, IPTG终浓度过高反而会导致表达量的减少,由于 IPTG对工程菌的生长有着明显的抑制作用[18-19],菌体量不足固然导致蛋白表达量的降低。
通过响应面模型分析得出影响因素A(诱导温度)与D(诱导时机)间存在明显的交互作用。交互作用是两种或两种以上因子的综合效果[20], 在统计学上的定义为: 如果因素A的数值和水平发生变化, 试验指标随因素B变化的规律发生变化; 或反之, 若因素B的数值或水平发生变化时, 试验指标随因素A变化的规律也发生变化。AD(即诱导温度和时机)的交互作用表现为:AD(即诱导温度和时机)的交互作用表现为: 诱导时机随着诱导温度的上升而缩短,反之, 随着诱导温度的降低, 诱导时机则相应延长。大肠杆菌生长最适温度为37 ℃, 试验得到蛋白表达的最适诱导温度为 28 ℃, 最适诱导时机为 3 h, 由于诱导的最佳时机为菌体生长的对数期, 该阶段菌体生长活性高, 菌体内蛋白表达效率也高。若一定时长范围(本试验 1 ~3 h)内菌体诱导时机(即诱导前培养时长)较长, 诱导前菌体生长则较接近对数期, 进入诱导阶段后诱导温度越高则菌体生长越快, 较高的诱导温度使得菌体在原对数期的基础上继续快速繁殖, 菌液中由于菌体量的迅速增多使得营养物质缺乏和代谢物堆积, 从而使菌体生长很快进入稳定期, 菌体活性降低, 蛋白表达量从而受到影响; 且由于大肠杆菌体内自身会合成一些蛋白酶, 酶在一定范围内温度越高其活性越高, 发酵得到的蛋白在较高温度下可能被蛋白酶部分降解, 从而降低了最终获取蛋白量。若一定时长范围(本试验1 ~3 h)内菌体诱导时机(即诱导前培养时长)较短, 诱导前菌体生长尚未达到对数期, 进入诱导阶段后诱导温度越高则菌体生长越快, 菌体在较适宜温度下生长达到对数期, 在对数期维持一定时长后再进入稳定期, 菌体在蛋白诱导表达过程中大部分时间停留在整个对数期内, 菌体活性高, 蛋白表达量高。
综上所述, 利用响应面优化法优化重组别藻蓝蛋白发酵条件不但提高了蛋白的表达量, 还减少了IPTG的用量, 降低了发酵成本。该试验结果为重组大肠杆菌大规模发酵制备别藻蓝蛋白提供了依据。
[1]Zhang W J, Guan X Y, Yang Y, et al.Biosynthesis of fluorescent allophycocyanin α-subunits by autocatalysis inEscherichia coli[J].Biotechnology and Applied Biochemistry, 2009, 52: 135-140.
[2]刘少芳.蓝藻别藻蓝蛋白的生物合成及组装的研究[D].青岛: 中国科学院海洋研究所, 2010.
[3]Ge B S H, Sun H X, Feng Y, et al.Functional biosynthesis of an allophycocyan beta subunit inEscherichia coli[J].Journal of Bioscience and Bioengineering, 2009, 107 (3): 246-249.
[4]Liu S H F, Chen Y J, Lu Y D, et al.Biosynthesis of fluorescent cyanobacterial allophycocyanin trimer inEscherichia coli[J].Photosynth Res, 2010, 105:135-142.
[5]张伟杰, 杨雨, 关翔宇, 等.产重组别藻蓝蛋白类荧光蛋白的重组大肠杆菌发酵条件的优化[J].海洋科学, 2009, 33(9): 57-61.
[6]代志凯, 张翠, 阮征.试验设计和优化及其在发酵培养基优化中的应用[J].微生物学通报, 2010, 37(6):894-903.
[7]范洪臣, 李艳华, 梁金钟, 等.响应面法优化枯草芽孢杆菌产γ-PGA的条件[J].生物加工过程, 2008, 6(3):17-23.
[8]田泱源, 李瑞芳.响应面法在生物过程优化中的应用[J].食品工程, 2010, 2 (6): 8-11.
[9]刘建忠, 熊亚红, 翁丽萍, 等.生物过程的优化[J].中山大学学报(自然科学版), 2002, 41(Suppl): 132-137.
[10]He J, Zhen Q W, Qiu N, et al.Medium optimization for the production of a novel bioflocculant from Halomonas sp V3a′ using response surface methodology[J].Bioresource Technology, 2009, 100(23): 5922-5927.
[11]林凡, 秦松.乳糖诱导重组别藻蓝蛋白基因在大肠杆菌中的表达[J].海洋科学, 2005, 29(11): 22-27.
[12]Biswas A, Vasquez Y M, Dragomani T M, et al.Biosynthesis of cyanobacterial phycobiliproteins inEscherichia coli: chromophorylation efficiency and specificity of all bilin lyases fromSynechococcussp.Strain PCC 7002[J].Applied and Environmental Microbiology, 2010, 76(9): 2729-2739.
[13]Konstantinor K, Kishimoto M, Seki T, et al.A balanced DO-stat and its application to the control of acetic acid excretion by recombinantEscherichia coli[J].Biotech Bioeng, 1990, 36(7): 750-758.
[14]李民, 陈常庆.重组大肠杆菌高密度发酵研究进展[J].生物工程进展, 2000, 20(2), 26-31.
[15]杨如燕, 李民, 陈常庆.重组大肠杆菌YK537/pSB-TK高密度培养过程中有机酸的 RP-HPLC快速分析[J].工业微生物, 1998, 28(3): 30-32.
[16]刘永军, 刘英, 孙海涛, 等.微生物最适生长酸度的微量热法研究[J].物理化学学报, 1997, 13(7):637-639.
[17]童群义, 陈坚.分批培养时 pH和温度对重组大肠杆菌生产谷胱甘肽合成酶系的影响[J].工业微生物,2001, 31(4): 17-21.
[18]杨梅, 程安春, 汪铭书, 等.重组鸭 α-干扰素基因工程菌表达条件的研究[J].四川农业大学学报, 2007,25(3): 337-342.
[19]常国栋, 李壮林, 秦加阳, 等.重组人血管内皮抑制素(rh.Endostatin)大肠杆菌表达体系发酵条件的优化[J].生物工程学报, 2005, 21(4): 662-665.
[20]叶红卫.SPSS实现有交互作用的正交实验设计[J].西安文理学院学报(自然科学版), 2009, 12(4):118-121.

