海洋微藻固碳及其培养技术的研究进展
李 林, 王 帅, 郑 立
(1.青岛科技大学, 化学与分子工程学院, 山东青岛 266042; 2.国家海洋局第一海洋研究所, 海洋生态研究中心, 山东青岛 266061)
海洋微藻生物固定CO2是一种可持续性的处理温室气体的方法, 海洋微藻不仅能吸收 CO2, 还能通过固碳产出高附加值产品, 比如蛋白、多糖、生物质能[1]等。与传统的物理和化学法固定 CO2技术相比, 海洋微藻固碳具有光合速率高、生长速度快、环境适应性强, 且不需要CO2的分离而直接利用等特点[2]。海洋微藻可以直接利用光合作用经过 CCM 机制捕捉和固定CO2, 形成自身生物质能[3]。目前普遍认为海洋微藻生物制品的生产应该与微藻固碳结合进行综合发展, 特别是利用电厂排放的 CO2作为微藻碳源, 以降低培养成本, 在获得高附加值产品的同时, 获得环境效益。
本文就海洋微藻的固碳及其培养研究技术, 从海洋微藻中耐高 CO2的种类及能力、影响海洋微藻固碳的环境因素、海洋微藻固碳培养方式进行综述性的总结, 为高固碳藻种的筛选、培养和设计廉价的光生物反应器提供技术参考。
1 海洋微藻耐高CO2的种类和能力
海洋微藻物种丰富, 世界各地报道的种类超过4000种。海洋微藻有着高CO2的适应能力。但不同的海洋微藻对 CO2浓度耐受性不尽相同, 表1为部分海洋微藻的CO2耐受浓度。
虽然微藻在培养过程中可以通过通入空气或气液接触吸收并固定CO2, 但由于空气中的CO2浓度只有 0.03%, 因此培养液中易发生碳源不足而导致微藻生长缓慢, 产率低的问题。增加空气中的CO2浓度有利于进一步发挥微藻的生长和固碳效率, 因此富碳气源如电厂烟道气中更高浓度的 CO2, 是比较合适的碳源, 且从减排的角度, 相对集中的高CO2废气更适合于工业固碳过程。但是, 烟道气中一般含有的CO2浓度过高, 可达10%以上。而过高CO2浓度对细胞有麻痹作用, 其最直接的表现为抑制藻细胞生长和光合作用水平, 并出现生长的滞后[4-5]。能在较高浓度的 CO2条件下生长的海洋微藻多属于绿藻门。比如海水小球藻(Chlorellasp.), 其最大 CO2耐受浓度是40%[6]。其次还有空球藻(Eudorinasp.)[7], 杜氏盐藻(Dunaliella tertiolecta)[8], 微拟球藻(Nannochlorissp.)[9], 杆状裂丝藻(Stichococcus bacillaris)[10]等, 这些海洋绿藻的最高CO2耐受性为15%~40%。也有一些从极限条件下分离的海洋藻种的 CO2耐受性大于40%, 甚至能在 60%条件下生长, 比如甲栅藻(Scenedesmus armatus)[11]和海滩绿球藻(Chlorococcum littorale)[5]。 而其他门类海洋微藻中, Seckbach[12]等发现的类蓝藻(Cyanidium caldarium)能在纯浓度(100%)的CO2条件下生存。此外, Sachio[13]等还研究了多种海洋微藻在空气到60%CO2浓度条件变化下的生长情况, 也发现蓝藻细菌对 CO2耐受性超过 60%。硅藻中的海链藻(Thalassiosira weissflogiiH1)[14]和三角褐指藻(Phaeodactylum tricornutum)[15]也能在20%CO2浓度条件下生长。

表1 不同海洋微藻的CO2耐受性
研究表明, 低浓度 CO2条件下主要是卡尔文循环控制着藻类对 CO2的吸收, 卡尔文循环中 1, 5-二磷酸核酮糖羧化酶(RubisCO)和碳酸酐酶(CA)是影响海洋微藻固定 CO2的主要途径, 它们参与各个生态系统的 CO2固定和初级产物的合成。其中的两个基因RubisCO和CA是在低CO2浓度条件下影响微藻耐受性及固碳效率的基因。随着CO2浓度的增加,细胞内外的 CO2分压也相应升高, 同时可溶性蛋白减少[16],CA表达减少, 降低细胞对 CO2的亲和力,同时减少送达 1, 5-二磷酸核酮糖羧化酶的底物量,以维持细胞正常生理代谢[17]。
目前高浓度 CO2条件下成体系的碳循环机制尚不明确, 只是对一些藻种的耐高浓度 CO2基因有少许研究。在3%CO2浓度条件下H43蛋白(high-CO2-inducible 43 kDa protein)会明显影响绿球藻(Chlorococcum littorale)的呼吸作用和光合作用, 随着CO2浓度的增加,H43基因表达也明显增加[18]。此外,FEA(Fe-assimilation)基因组也是绿球藻(Chlorococcum littorale)高浓度 CO2耐受性基因, CO2浓度增加,FEA1基因表达相应增加[19]。虽然不少研究表明高CO2耐受性基因影响微藻的 CO2耐受性, 但是单个基因对微藻的影响很小, 他们往往是相互协作, 并影响着微藻的CO2耐受性。
2 影响海洋微藻固碳的环境因素
2.1 光照强度对海洋微藻固碳的影响
微藻对光照强度有一个饱和度范围, 高于光饱和度, 藻类的光合速率不再增加, 且超过一定光照强度, 微藻对 CO2的吸收反而受到抑制[20], 会降低微藻的固碳效率[21]。光照周期也决定着微藻的光合作用效率, 在一定的光照时间内, 生长率与光照时间成正比, 超过一定比率时, 微藻生长不再增加, 碳固定能力显著降低。孙岁寒等[22]对微藻四列藻研究表明, 当光周期小于4 h和大于20 h时都不利于海洋微藻固碳。然而也有部分学者认为光周期对固碳效率的影响不大, 例如Jacob-Lopes等[23]研究了盐性隐杆藻(Aphanothece microscopicNageli)的生物量和固定CO2能力在不同光周期条件(0: 24, 2: 22, 4: 20, 6:18, 8: 16, 10: 14, 12: 12, 14: 10, 16: 8, 18: 6, 20: 4, 22: 2 and 24: 0 (N: D))下的变化, 发现固碳作用基本不变。
有证据表明, 光照强度和光照周期确实影响微藻的CCM机制, 高光强会促进1, 5-二磷酸核酮糖羧化酶由叶绿体基质向蛋白核中聚集, Rubisco酶在有光照的条件下主要分布在蛋白核中, 而无光照条件下则主要分布于叶绿体基质中, 从而影响微藻对CO2的固定[24]。因此, 笔者认为, 从微藻生长的角度来看, 是需要适当的光照强度和光暗周期, 以利于微藻体内代谢的正常运行[25]。
2.2 温度对海洋微藻固碳的影响
温度对微藻光合作用的影响是多方面的, 高温不仅直接引发光合系统的损伤, 同时也影响光合电子传递和光合磷酸化等过程[26-27]。欧阳峥嵘等[20]的研究表明, 温度过高会影响海洋微藻的放氧速率,造成微藻固碳率降低。徐宁等[28]通过对锥状斯氏藻(Scrippsiella trochoidea)的研究也表明, 温度过高,微藻固碳能力变弱。PSⅡ是热敏感的色素蛋白复合体之一[29-30], 其活性在高温时受到抑制, 进而影响光合作用和呼吸作用, 使得微藻的固碳作用发生变化, 这也是微藻对温度有一定适应范围的原因。
2.3 pH值对海洋微藻固碳的影响
CO2是海洋浮游植物无机碳主要利用形式[31-32]。海洋浮游植物在长期的进化中形成了主动运输 CO2能力, 或借助碳酸酐酶转化为 CO2, 或直接吸收的生理机制[33]。培养环境中的pH大小决定了CO2,, H+转化为游离 CO2或3的方向,此时 CO2才能够进入微藻细胞进行固定[34-35]。研究表明, pH值过低和过高都会抑制海洋微藻的生长。例如: 海水小球藻(Chlorella strainKR-1)的最佳pH值生长范围是4.2到9.0, 超过这个范围, 其固定CO2能力降低, 同时生长也会受到抑制[36]。而 Zhao[35]等研究的海洋小球藻(Chlorellasp.)在低pH值条件下有良好的CO2耐受性, 以及较高的CO2固定能力。
3 海洋微藻的固碳培养方式
微藻的培养包括开放式培养与封闭式培养, 两种培养方式都具有其优势与劣势(表2)。封闭式光生物反应器因其具有环境可操控性, 不容易污染, 且具有高生物量生产力, 在实验室范围内广泛使用,然而由于其造价都比较昂贵, 空间受限, 使得封闭式光生物反应器在商业化生物碳减排上的应用比较困难。近几年, 美国国家航空航天局(NASA)的Jonathan Trent提出OMEGA计划(Offshore Membrane Enclosures for Growing Algae)[37], 该计划将微藻放入 NASA特制的塑料管道中, 再充入沿海城市排放的废水和电厂(工厂)排放的CO2, 然后把它们一起放到近岸海湾中养殖, 营建一个面积巨大的微藻海上养殖牧场, 微藻在封闭系统中利用废水和 CO2生长,以实现城市污水的净化和碳减排; 同时微藻还可用于食品、饲料、生物质能的开发。此外, 整个系统的运行所需的能源还可以结合其他海洋能获得, 例如微藻养殖海域同时安放海流能、波浪能装置, 利用海上风能和太阳能驱动系统运行。尽管该计划理论可行, 但实际应用过程中还需要考虑养殖海湾的选址、藻种的环境适应性以及封闭系统在海上的抗污等诸多技术细节问题。

表2 跑道池与光生物反应器的优劣势[38]
相对于封闭式光生物反应器, 开放式培养方式相对廉价, 特别是培养海洋微藻时, 搭建开放式跑道池可不占用耕地资源, 在一些偏远或海边盐碱地等地区即可建造培养池[39], 而且开放式培养需要的能耗比较少, 污垢容易清洗, 因此更容易实现商业化大规模培养[40]。 早在1950年代, 开放式跑道池就已经应用于微藻的培养[41]。随后人们开始研究以海洋微藻生产生物燃料结合减排工程的新型可再生能源培养系统[42-43]。工厂烟气的CO2浓度约为10%, 适合海洋微藻培养[44](表3)。例如: 通过3%过氧化氢处理的烟气持续性通入跑道池, 盐生微拟球藻(Nannochiloropsis salinaNANNP-2)和三角褐指藻(Phaeodactylum tricounutum)在含有 70×10–6~90×10–6SOX, NOX的烟气(12% CO2)中生长与通入直接供应的实际浓度 CO2气体的生物量产率基本一样, 可达 8~10 g/(m2·d)[42]。微小单针藻(Monoraphidium minutum)间接性通入无处理的13.6% CO2的烟气, 其在开放式跑道池的生物量生长率也可达1 g/(m2·d)[45]。以色列的Ashkelon公司利用400 m2的开放式培养池培养微拟球藻(Nannochiloropsissp.)使用的是脱硫烟气[46]。Pushparaj等[47]利用 100%浓度的 CO2通过调节跑道池内的 pH值来培养的海水钝顶螺旋藻(Arthrospira platensis), 其生物量产率为 14.47 g/(m2·d)±0.16 g/(m2·d)。由于微藻碳减排技术的提出, 越来越多的公司进行了规模化的海洋微藻养殖, 但是真正利用海洋微藻, 且结合电厂烟气的商业化碳减排实例仍然很少。澳大利亚的 Hazelwood 电厂曾经开展了利用微藻进行烟道气 CO2减排的尝试, 收集的微藻用来制备生物质油, 尽管年吸收的 CO2达到了全部排放的 4%,但由于成本高昂, 仍然实现不了商业化的碳减排[48]。
无论是开放跑道池还是光生物反应器培养, 微藻都是在水体中进行悬浮培养。悬浮培养微藻易造成光衰减现象, 导致培养效率降低、能耗大等缺点。因此, 近年来, 学者们开始关注微藻的生物膜贴壁培养技术的研究。Liu[49-50]研究团队提出的微藻贴壁培养技术, 将藻细胞直接接种于滤膜上形成生物膜,通过培养基浸湿的滤膜为微藻提供所需水分和营养盐成分, 通入含 1%CO2的空气作为碳源, 通过自动化刮膜技术进行采收。研究发现, 栅藻、葡萄藻、微拟球藻、筒柱藻和螺旋藻等均可实现良好的贴壁生长, 生长速度与光照强度和培养基组成有关。研究结果表明, 每生产1 kg藻比开放池节水45%, 节约脱水能耗 99.7%, 因此微藻的贴壁培养在节约水耗和采收能耗方面具有明显优势。
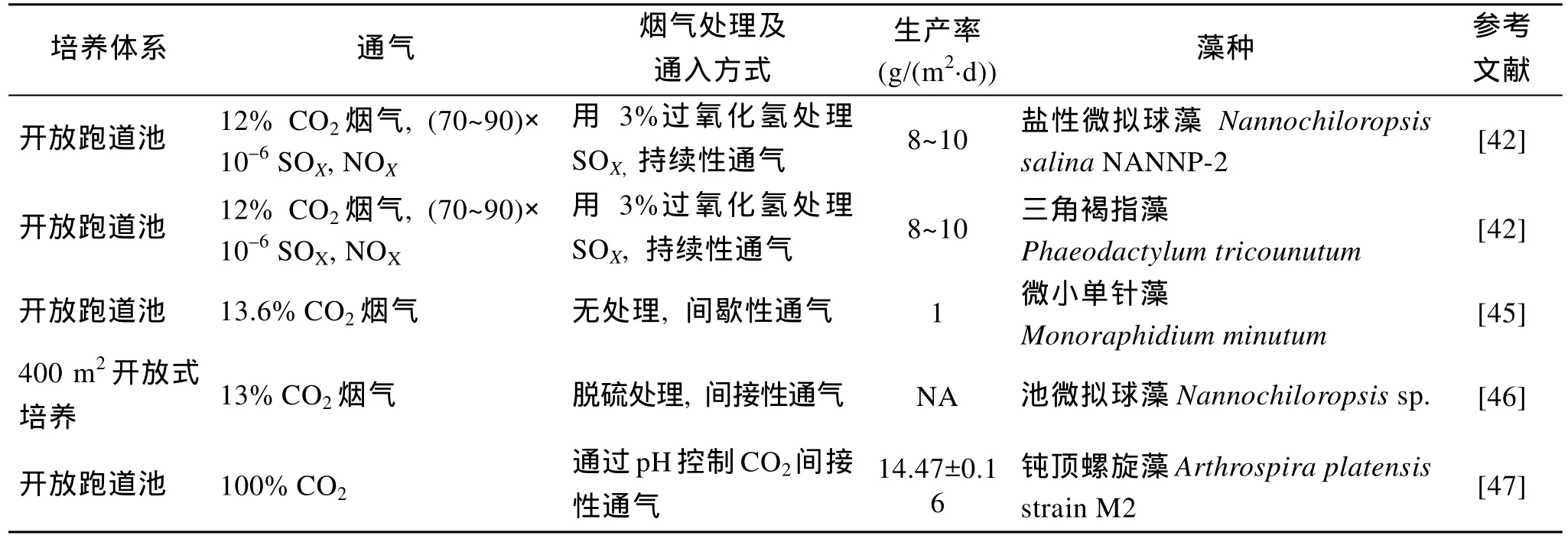
表3 部分海洋微藻烟气减排的开放式培养
4 展望
利用海洋微藻进行固碳减排在理论上日趋成熟,许多公司都开始尝试利用海洋微藻固碳减排并生产生物质能, 但是由于技术的限制, 包括获得高固碳高油脂产率的优良藻株, 微藻培养过程中如何避免污染和浮游动物的捕食, 适合的规模化培养系统等问题, 使得海洋微藻无论用于 CO2减排生产生物柴油,还是获取高附加产品在商业化上还面临巨大挑战。
筛选出高生物量产率的物种及高固碳率的海洋微藻仍是海洋微藻固碳减排技术应用的首要问题。目前, 还没有任何快速筛选藻种的科技手段, 发展一种新型的物种快速筛选技术用于提高筛选效率显得非常必要。通过基因工程的方法将藻种的固碳基因进行改造也是获得高固碳海洋微藻的有效途径之一。
对于微藻固碳的规模化培养方式, 无论是封闭式光生物反应器, 还是开放式跑道池, 现阶段仍无法达到商业化要求。由于开放式与封闭式光生物反应器缺陷都很明显, 因此生物膜贴壁培养是否可以发展成一种新型的培养模式已成为一个技术热点。
目前, 海洋微藻固碳减排技术还是处于初级阶段, 需要解决的问题仍然很多。随着温室效应凸显,能源短缺和生态环境的破坏, 发展海洋微藻固碳减排技术将为减排产能带来一定的经济和环境价值,符合现今科技的可持续发展道路。
[1]Mata T M, Martins A A, Caetano N S.Microalgae for biodiesel production and other applications: A review[J].Renewable and Sustainable Energy Reviews,2010, 14(1): 217-232.
[2]杨忠华, 陈明明, 曾嵘, 等.利用微藻技术减排二氧化碳的研究进展[J].现代化工, 2008, 28(8): 15-20.
[3]Wang Y, Duanmu D, Spalding M.Carbon dioxide concentrating mechanism inChlamydomonas reinhardtii:inorganic carbon transport and CO2recapture[J].Photosynthesis Research, 2011, 109(1): 115-122.
[4]Seckbach J, Baker F A, Shugarman P M.Algae thrive under Pure CO2[J].Nature, 1970, 227(5259): 744-745.
[5]Kodama M, Ikemoto H, Miyachi S.A new species of highly CO2tolerant fast growing marine microalga suitable for high density culture[J].Journal of Marine Biotechnology, 1993, (1): 21-25.
[6]Nagase H, Eguchi K, Yoshihara K I, et al.Improvement of microalgal NOx removal in bubble column and airlift reactors[J].Journal of Fermentation and Bioengineering, 1998, 86(4): 421-423.
[7]Yoshihara K I, Nagase H, Eguchi K, et al.Biological elimination of nitric oxide and carbon dioxide from flue gas by marine microalga NOA-113 cultivated in a long tubular photobioreactor[J].Journal of Fermentation and Bioengineering, 1996, 82(4): 351-354.
[8]Miura Y, Yamada W, Hirata K, et al.Stimulation ofhydrogen production in algal cells grown under high CO2concentration and low temperature[J].Applied Biochemistry and Biotechnology, 1993, 39-40(1):753-761.
[9]Matsumoto H, Shioji N, Hamasaki A, et al.Carbon dioxide fixation by microalgae photosynthesis using actual flue gas discharged from a boiler[J].Applied Biochemistry and Biotechnology, 1995, 51-52(1): 681-692.
[10]Iwasaki I, Hu Q, Kurano N, et al.Effect of extremely high CO2stress on energy distribution between photosystem I and photosystem II in a ‘high-CO2’tolerant green alga,Chlorococcum littoraleand the intolerant green algaStichococcus bacillaris[J].Journal of Photochemistry and Photobiology B: Biology, 1998,44(3): 184-190.
[11]徐敏, 陈珊, 刘国祥, 等.极高 CO2胁迫对被甲栅藻(Scenedesmus armatus)生理活性和细胞结构影响[J].武汉植物学研究, 2004, 22(5): 439-444.
[12]Seckbach J, Kaplan I R.Growth pattern and13C/12C isotope fractionation ofCyanidium caldariumand hot spring algal mats[J].Chemical Geology, 1973, 12(3): 161-169.
[13]Sachio M.CO2assimilation in a thermophilic cyanobacterium[J].Energy Conversion and Management,1995, 36(6-9): 763-766.
[14]Ishida Y, Hiragushi N, Kitaguchi H, et al.A highly CO2tolerant diatom,Thalassiosira weissflogiiH1, enriched from coastal sea, and its fatty acid composition[J].Fisheries Science, 2000, 66(4): 655-659.
[15]Wu Y, Gao K.CO2induced seawater acidification affects physiological performance of the marine diatomPhaeodactylum tricornutum[J].Biogeosciences, 2010,7(9): 2915-2923.
[16]于娟, 唐学玺, 张培玉, 等.CO2加富对两种海洋微绿藻的生长、光合作用和抗氧化酶活性的影响[J].生态学报, 2005, 25(2): 197-203.
[17]Long S P, Baker N R, Raines C A.Analysing the responses of photosynthetic CO2assimilation to long term elevation of atmospheric CO2concentration[J].Plant Ecology, 1993, 104-105(1): 33-45.
[18]Hanawa Y, Watanabe M, Karatsu Y, et al.Induction of a high CO2inducible, periplasmic protein, H43, and its application as a high CO2responsive marker for study of the high CO2sensing mechanism inChlamydomonas reinhardtii[J].Plant Cell Physiol, 2007, 48(2): 299-309.
[19]Allen M D, del Campo J A, Kropat J, et al.FEA1,FEA2, andFRE1, encoding two homologous secreted proteins and a candidate ferrireductase, are expressed coordinately withFOX1andFTR1in iron deficientChlamydomonas reinhardtii[J].Eukaryot Cell, 2007,6(10): 1841-1852.
[20]欧阳峥嵘, 温小斌, 耿亚红, 等.光照强度、温度、pH、盐度对小球藻(Chlorellasp.)光合作用的影响[J].武汉植物学研究, 2010, 28(1): 49-55.
[21]Pope D H.Effects of light intensity, oxygen concentration, and carbon dioxide concentration on photosynthesis in algae[J].Microbial Ecology, 1975,2(1): 1-16.
[22]孙岁寒, 段舜山.海洋微藻四列藻对光周期改变的响应[J].生态科学, 2007, 26(4): 293-297.
[23]Jacob-Lopes E, Scoparo C H G, Lacerda L M C F, et al.Effect of light cycles (night/day) on CO2fixation and biomass production by microalgae in photobioreactors[J].Chemical Engineering and Processing: Process Intensification, 2009, 48(1): 306-310.
[24]蔡春尔, 尹顺吉, 汪卿, 等.光照因素对Rubisco酶在蛋白核内外分布的影响[EB/OL].北京: 中国科技论文在线[2008-10-16].http: //www.paper.edu.cn/releasepaper/content/200810-373.
[25]Morton S L, Norris D R, Bomber J W.Effect of temperature, salinity and light intensity on the growth and seasonality of toxic dinoflagellates associated with ciguatera[J].Journal of Experimental Marine Biology and Ecology, 1992, 157(1): 79-90.
[26]Ottander C, Hundal T, Andersson B, et al.Photosystem II reaction centres stay intact during low temperature photoinhibition[J].Photosynthesis Research, 1993,35(2): 191-200.
[27]Öquist G, Chow W S, Anderson J M.Photoinhibition of photosynthesis represents a mechanism for the long-term regulation of photosystem II[J].Planta, 1992,186(3): 450-460.
[28]徐宁, 吕颂辉, 陈菊芳, 等.温度和盐度对锥状斯氏藻生长的影响[J].海洋环境科学, 2004, 23(3): 36-39.
[29]Wen X, Gong H, Lu C.Heat stress induces an inhibition of excitation energy transfer from phycobilisomes to photosystem II but not to photosystem I in a cyanobacteriumSpirulina platensis[J].Plant physiology and biochemistry : PPB / Societe francaise de physiologie vegetale, 2005, 43(4): 389-395.
[30]Morgan-Kiss R, Ivanov A G, Williams J, et al.Differential thermal effects on the energy distribution between photosystem II and photosystem I in thylakoid membranes of a psychrophilic and a mesophilic alga[J].Biochimica et Biophysica Acta (BBA) - Biomembranes,2002, 1561(2): 251-265.
[31]Riebesell U, Wolf-Gladrow D A, Smetacek V.Carbon dioxide limitation of marine phytoplankton growth rates[J].Nature, 1993, 361(6409): 249-251.
[32]Hein M K Sand-Jensen.CO2increases oceanic primary production[J].Nature, 1997, 388(6642): 526-527.
[33]陈雄文, 高坤山.赤潮藻中肋骨条藻的光合作用对海水 pH 和 N 变化的响应[J].水生生物学报, 2004,28(6): 635-640.
[34]de Morais M G J, Costa A V.Isolation and selection of microalgae from coal fired thermoelectric power plant for biofixation of carbon dioxide[J].Energy Conversion and Management, 2007, 48(7): 2169-2173.
[35]Zhao B, Zhang Y, Xiong K, et al.Effect of cultivation mode on microalgal growth and CO2fixation[J].Chemical Engineering Research and Design, 2011,89(9): 1758-1762.
[36]Sung K D, Lee J S, Shin C S, et al.CO2fixation byChlorellasp.KR-1 and its cultural characteristics[J].Bioresource Technology, 1999, 68(3): 269-273.
[37]Wiley P, Harris L, Reinsch S, et al.Microalgae cultivation using offshore menbrane enclosures for growing algae (OMEGA)[J].Journal of Sustainable Bioenergy Systems, 2013, 3: 18-32.
[38]Brennan L P, Owende.Biofuels from microalgae—A review of technologies for production, processing, and extractions of biofuels and coproducts[J].Renewable and Sustainable Energy Reviews, 2010, 14(2): 557-577.
[39]Chisti Y.Biodiesel from microalgae beats bioethanol[J].Trends Biotechnology, 2008, 26(3): 126-131.
[40]Rodolfi L, Chini Zittelli G, Bassi N, et al.Microalgae for oil: Strain selection, induction of lipid synthesis and outdoor mass cultivation in a low cost photobioreactor[J].Biotechnology Bioengineering, 2009, 102(1): 100-112.
[41]Borowitzka M A.Commercial production of microalgae: ponds, tanks, and fermenters[J].Progress in Industrial Microbiology, 1999, 35: 313-321.
[42]Negoro M, Hamasaki A, Ikuta Y, et al.Carbon dioxide fixation by microalgae photosynthesis using actual flue gas discharged from a boiler[J].Applied Biochemistry and Biotechnology, 1993, 39-40(1): 643-653.
[43]李健, 王广策.微藻生物技术在二氧化碳减排和生物柴油生产中的应用研究进展[J].海洋科学, 2011,35(7): 122-130.
[44]Kumar A, Ergas S, Yuan X, et al.Enhanced CO2fixation and biofuel production via microalgae: recent developments and future directions[J].Trends Biotechnology, 2010, 28(7): 371-378.
[45]Zeiler K G, Heacox D A, Toon S T, et al.The use of microalgae for assimilation and utilization of carbon dioxide from fossil fuel-fired power plant flue gas[J].Energy Conversion and Management, 1995, 36(6–9):707-712.
[46]徐少琨, 张峰, 向文洲, 等.微藻应用于煤炭烟气减排的研究进展[J].地球科学进展, 2011, 26(9): 944-953.
[47]Pushparaj B, Pelosi E, Tredici M, et al.An integrated culture system for outdoor production of microalgae and cyanobacteria[J].Journal of Applied Phycology,1997, 9(2): 113-119.
[48]Taylor R.(20 December 2010).“Efficient algae–the next biofuel?”[M].ECOS (CSIRO Publishing).Retrieved 26 February 2014.
[49]Liu T, Wang J, Hu Q, et al.Attached cultivation technology of microalgae for efficient biomass feedstock production[J].Bioresoure Technology, 2013,127: 216-222.
[50]Cheng P F, Ji B, Gao L L, et al.The growth, lipid and hydrocarbon production ofBotryococcus brauniiwith attached cultivation[J].Bioresoure Technology, 2013,138: 95-100.

