长牡蛎两种engrailed同源基因的鉴定及其与贝壳发育相关性的研究
黄晓红 , 郇 聘 刘保忠
(1.中国科学院 海洋研究所, 山东 青岛 266071; 2.中国科学院大学, 北京 100049)
贝壳是大多数软体动物最显著的特征, 为动物生存提供基本保护。鉴于其重要性, 贝壳发生机制的研究一直是人们关注的热点。显微观察表明, 贝壳发生起始于胚胎发育的早期。早在原肠作用刚刚开始时, 胚胎的背部细胞就开始变形、内陷, 进而分泌贝壳物质, 并在担轮幼虫时期形成最早的贝壳。随后贝壳逐渐扩大并钙化, 至 D形幼虫时期, 贝壳首次覆盖完整幼虫身体, 完成第一阶段的发育[1], 此时期的贝壳称作Ⅰ期胚壳(prodissoconch I)。
贝壳的发生过程依赖多个基因的协同作用。目前该方面是一个研究热点, 受到重点研究的基因包括dpp,engrailed,hox-1等[2-4]。其中engrailed基因属于同源异形基因家族成员[5], 具备该家族蛋白典型的同源异形结构域(homeodomain)。与同家族的HOX蛋白一样, Engrailed通过其同源异形结构域结合特定DNA序列, 作为转录因子发挥调节基因表达的功能。此外, Engrailed还与多种其他蛋白相互作用(如Pbx蛋白), 并可发生翻译后修饰调节, 从而增加基因表达调控的多样性水平[6-7]。作为典型的发育相关基因,engrailed被报道广泛参与节肢动物[8-11]、棘皮动物[12]、脊索动物[10,13]等的分节、附肢发育和神经系统发育过程。目前, 多个软体动物的engrailed基因已被报道参与贝壳发生[3,14-16]。软体动物engrailed表达于正在发生的贝壳外缘, 可能调控了贝壳发生的边界[3, 14-16]。
长牡蛎(Crassostrea gigas)是一种在世界范围内广泛分布的经济贝类, 具备广泛的研究基础。同时,其全基因组数据在2012年发布, 使其成为软体动物的一种潜在模式生物。目前长牡蛎贝壳发生相关基因尚未展开系统研究。本研究基于长牡蛎基因组数据库, 鉴定了两个engrailed同源基因序列, 分析了其系统演化关系, 并对其在贝壳形成关键时期的表达情况进行了研究和比较, 研究结果将有助于加深作者对贝壳形成过程分子调控机制的认识。
1 材料与方法
1.1 幼虫培养及样品固定
性成熟的长牡蛎购自山东省青岛市南山水产市场。选取性腺饱满的个体, 解剖获取配子, 进行人工授精。受精卵在 25~26 ℃条件下进行培养, 持续充气, 在受精后14h收集长牡蛎早期D形幼虫, 经4%多聚甲醛固定后梯度甲醇脱水, 保存于–20℃中备用。
1.2 engrailed同源基因的克隆
利用已报道的刺牡蛎Saccostrea kegaki的engrailed基因(GenBank No.BAG68617.1)序列比对长牡蛎基因组数据库(Blastp), 搜索得到两条engrailed同源基因序列(OYG_10012208及OYG_10012209)。这两个参考序列已包括基因的全长 ORF部分, 作者设计了全长ORF引物cgeng1_F (ATGGATGTTAAACAAAAT AACGCGGAGG)、cgeng1_R (TTATGACTCGCCTTCATC CGAAACTGT)和cgeng2_F (ATGTCGGACGTGAA AGT)、cgeng2_R(TCATTGCT CCATCCCATC)。以上述引物进行 PCR扩增并测序验证, 成功获得两条长牡蛎engrailed同源基因的全长cDNA序列, 并分别命名为cgi-eng1和cgi-eng2。为了保证扩增反应的特异性, 本研究中所用到的所有 PCR扩增反应均使用了Touchdown PCR, 具体程序为: 95 ℃预变性4 min;之后为 18个逐步降低退火温度的循环: 95 ℃变性15 s, 68 ℃退火15 s(之后每个循环降低1 ℃), 72 ℃延伸1 min; 然后是25个常规PCR循环: 95 ℃变性15 s, 50 ℃退火15 s, 72 ℃延伸1 min; 最后72 ℃延伸10 min。
1.3 engrailed同源基因序列特征和聚类分析
利用生物信息学工具, 对cgi-eng1和cgi-eng2序列和对应的氨基酸序列进行特征分析, 包括通过ExPASy网站的在线工具(http://web.expasy.org/computepi/)分析分子量及等电点; SignalP网站(http://www.cbs.dtu.dk/services/SignalP/)的工具预测信号肽序列; 利用 SMART在线工具(http://smart.emblheidelberg.de/)并结合相关文献报道对 Cgi-Eng1和Cgi-Eng2中的结构域进行预测。利用Clustal W(http://www.ebi.ac.uk/Tools/msa/muscle/)对不同物种结构域之间的保守性进行比较, 并利用 Neighbor-Joining方法进行聚类分析。
1.4 整装原位杂交
分别利用基因特异性引物 cgeng1_wF (CGGA GGCTGCACACGAAC)、cgeng1_wR(GGCGA AGTG GCTACTGGACTAC)和 cgeng2_F、cgeng2_R, 通过touchdown PCR扩增其cDNA序列。将PCR产物连接入 pGEM-T载体(Promega), 转化入大肠杆菌中增殖, 提取质粒。将质粒酶切线性化之后作为模板, 使用DIG RNA Labeling Mixture试剂盒(Roche)合成地高辛标记的 RNA探针。整装原位杂交流程按照Maures & Duan报道的方法进行[17], 用Nikon 80i显微镜观察, 拍照。以正义RNA探针作为阴性对照组。
2 结果
2.1 长牡蛎engrailed同源基因及序列特征
长牡蛎cgi-eng1基因(GenBank No.EKC23208.1)的ORF全长690bp, 编码一个长229个氨基酸多肽(图1), 其理论分子质量为 25.7ku, 等电点为 9.62。长牡蛎cgi-eng2基因(GenBank No.EKC23209.1)的ORF全长 642bp, 编码一个长 213个氨基酸的多肽(图1), 其理论分子质量为 24.3ku, 等电点为 9.43。经过SignalP预测, Cgi-Eng1和Cgi-Eng2均没有信号肽序列。结构域预测表明二者均具备典型的同源异形结构域, 在Cgi-Eng1中位于第141和203个氨基酸之间, 在Cgi-Eng2中位于第126和188个氨基酸之间。根据相关的报道[18-20], 在 Cgi-Eng1和Cgi-Eng2中鉴定到Engrailed蛋白全部的5个典型结构域(EH1-5)(图2), 其中EH4即同源异形结构域。多序列比较分析发现, EH2在物种间的保守性最高,EH4次之, 而其他结构域较低(图2)。
2.2 聚类分析
作者对来自包括脊椎动物、节肢动物和软体动物的engrailed同源基因进行了演化分析。结果如图3所示, 3个类群的基因各自聚为一支, 与其演化关系有很好的对应。在软体动物分支内部, 双壳类和腹足类也各自聚为一支。在双壳贝类的3种engrailed同源基因间,cgi-eng1先与刺牡蛎S.kegaki的engrailed基因聚成一支, 之后和cgi-eng2聚在一起。这提示cgi-eng1和刺牡蛎已报到的engrailed基因可能是直系同源基因。
2.3 原位杂交
作者在贝壳发生的关键时期——早期 D形幼虫中, 利用整装原位杂交技术研究了这两个engrailed同源基因的表达情况。结果显示,cgi-eng1和cgi-eng2基因mRNA均在长牡蛎幼虫贝壳外缘高表达(图4)。同时作者发现,cgi-eng1和cgi-eng2的表达模式存在一定差异:cgi-eng1特异性表达于贝壳外缘, 在其他部位检测不到表达; 而cgi-eng2虽然在贝壳外缘高表达, 但在其他部位亦有广泛的表达。作者在阴性对照组(使用正义链探针)没有检测到信号, 证实了杂交结果的特异性。

图1 长牡蛎cgi-eng1和cgi-eng2 cDNA序列和对应的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequence of cgi-eng1 and cgi-eng2

图2 长牡蛎engrailed同源基因EH1-5结构域的多物种比较分析Fig.2 Multiple alignment of the five conserved domains of cgi-eng1 and cgi-eng2
3 讨论
作者从长牡蛎幼虫 cDNA中克隆到两个engrailed同源基因cgi-eng1和cgi-eng2。其氨基酸序列预测结果显示, Cgi-Eng1和Cgi-Eng2的结构高度保守, 包含5个结构域。其中EH4是同源异形结构域, 参与蛋白的相互作用。研究结果表明 Engrailed能与12种可溶性的核蛋白相互作用[21]。EH2和EH3能与Exd/Pbx蛋白相结合, 增加engrailed与DNA的结合能力; 而EH1和EH5参与转录抑制的激活[22]。多序列比对表明EH2保守性最高, 这与笠螺Patella vulgata的分析结果一致[3]。
由于其功能的重要性,engrailed基因一直发育生物学研究的热点。已有研究结果表明,engrailed基因是一个古老的后生动物发育相关基因, 在演化过程中发生了多次独立的复制、基因座的丢失及基因功能的分化等事件, 导致出现了大量的旁系同源基因[22]。目前, 在许多物种中都发现了多个engrailed基因。而现有软体动物中的研究均只报道了一个engrailed同源基因[2,3]。作者推测, 软体动物可能并非只存在一个engrailed同源基因, 而是由于基因组信息缺乏的原因导致部分成员尚未鉴定。在本研究中, 作者系统搜索了长牡蛎基因组数据库, 得到两条engrailed同源基因序列, 这验证了作者的猜测。此外, 在聚类分析中, 双壳贝类的engrailed同源基因并不与已报道的腹足类基因单独聚在一起, 提示engrailed基因在腹足类和双壳类可能经历了单独的演化过程, 这将是今后研究的一个重要问题。
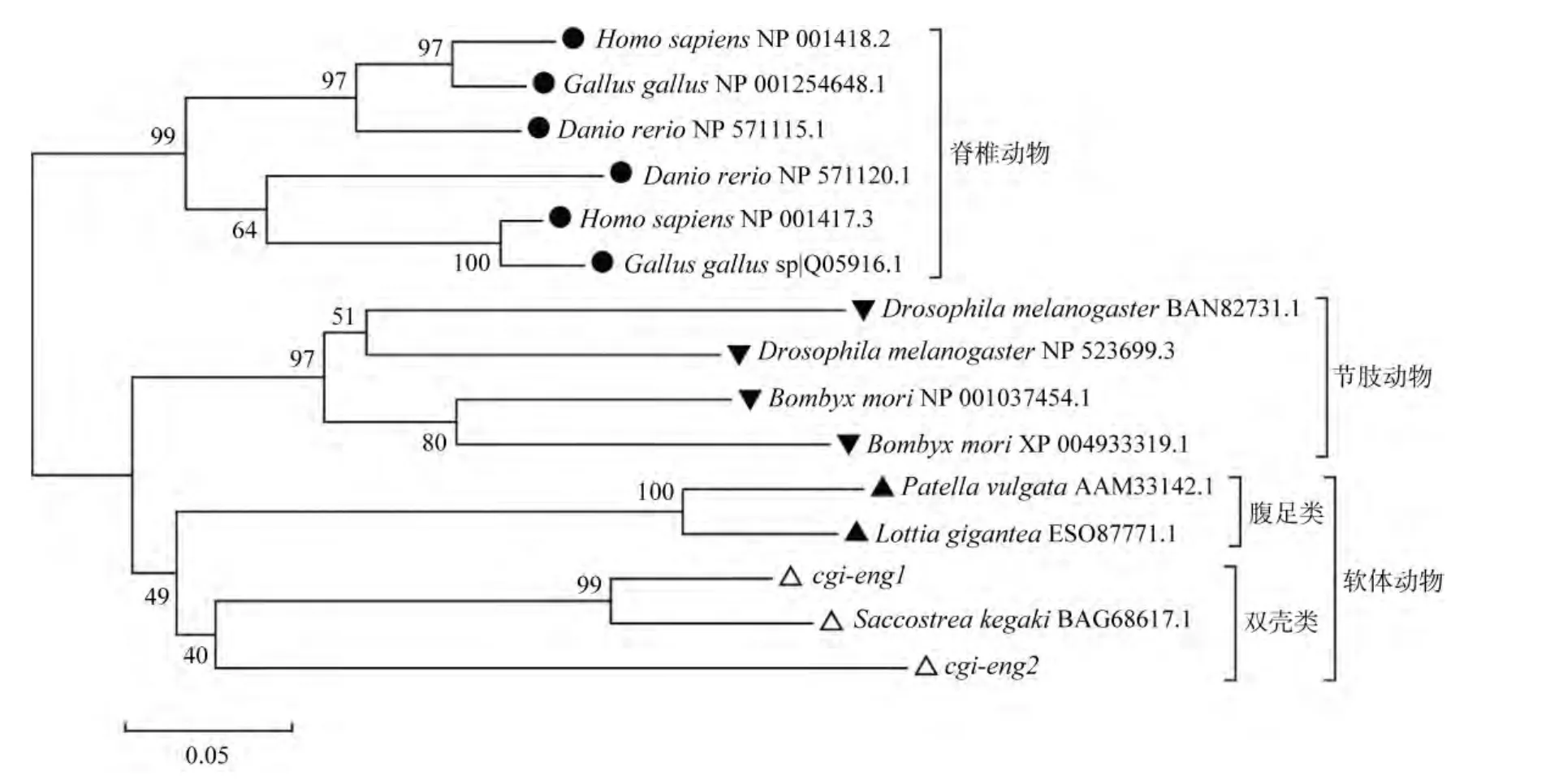
图3 长牡蛎engrailed同源基因氨基序列的聚类分析Fig.3 A phylogenetic tree of cgi-eng1 and cgi-eng2 constructed through the Neighbor-Joining method
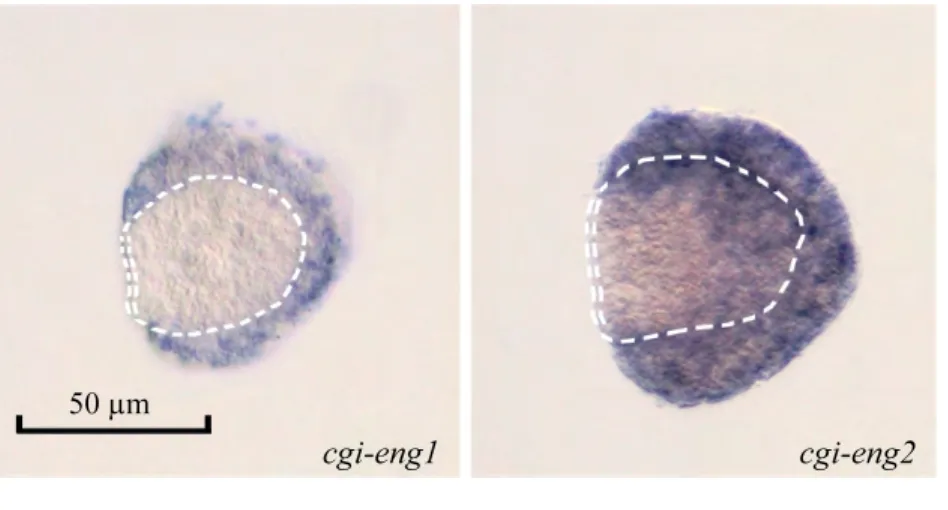
图4 长牡蛎cgi-eng1和cgi-eng2基因mRNA在长牡蛎早期D形幼虫的分布情况Fig.4 Expression patterns of cgi-eng1 and cgi-eng2 in early D-veligers (14 hpf)
基于软体动物engrailed基因参与贝壳发生过程的报道[3,14-16], 作者着重观察了长牡蛎两种engrailed同源基因与贝壳发生的相关性。作者选择的早期D形幼虫处于贝壳形成的关键时期, 此时贝壳由背部的一个小区域逐渐长大并最终覆盖整个幼虫。Nederbragt等[3]首次报道了engrailed在P.vulgata中表达于贝壳外缘, 并提出假说认为engrailed限定了贝壳发生的边界; Kin等[2]在S.kegaki的早期D形幼虫的研究结果也表明engrailed分布于贝壳外缘, 与腹足类的结果一致。作者在长牡蛎中的研究表明, 两种engrailed同源基因均在贝壳外缘高表达, 与前人结果一致, 支持了engrailed可能参与贝壳发生的观点。
除发现两种engrailed同源基因均高表达于贝壳外缘外, 作者还发现两种基因的表达模式存在差别。与cgi-eng1的特异性表达相比,cgi-eng2虽然也分布与贝壳外缘, 但在幼虫其他部位亦有广泛的表达,提示其不仅仅参与贝壳边界的形成过程, 还可能发挥其他功能。这些功能是否局限于贝壳发生过程, 抑或还参于其他早期发育事件, 需要进一步的研究以加以佐证。
本研究基于长牡蛎基因组数据库, 首次鉴定了长牡蛎的两种engrailed同源基因, 展示了其与贝壳发生的相关性, 并提出二者可能存在功能差异。在下一步的工作中, 深入解析engrailed同源基因在贝壳发生中的具体功能, 及不同engrailed同源基因的功能差异将是研究的重点内容。此外, 本文中作者仅考察了一个关键发育时期的engrailed基因表达情况,而并未对engrailed在发育过程中的表达变化情况展开研究。在后续的工作中将有必要系统研究整个早期贝壳发育阶段engrailed基因的表达情况, 比如从担轮幼虫(25~26 ℃时约11 hpf)到完全发育的D形幼虫(约24 hpf)。这些研究一方面可以验证作者的结论,另一方面还可能发现新的功能提示信息。
[1]Mouëza M, Gros O, Frenkiel L.Embryonic development and shell differentiation inchione cancellata(bivalvia,veneridae): An ultrastructural analysis [J].Invertebrate Biology, 2006, 125(1): 21-33.
[2]Kin K, Kakoi S, and Wada H.A novel role fordppin the shaping of bivalve shells revealed in a conserved molluscan developmental program [J].Dev Biol, 2009,329(1): 152-166.
[3]Nederbragt A J, van Loon A E, Dictus W J.Expression ofPatella vulgataorthologs ofengrailedanddpp-bmp2/4in adjacent domains during molluscan shell development suggests a conserved compartment boundary mechanism [J].Dev Biol, 2002, 246(2): 341-355.
[4]Samadi L, Steiner G.Involvement of hox genes in shell morphogenesis in the encapsulated development of a top shell gastropod (Gibbula varia l.) [J].Development genes and evolution, 2009, 219(9-10): 523-530.
[5]Pérez-Parallé M L, Carpintero P, Pazos A J, et al.The hox gene cluster in the bivalve molluscMytilus galloprovincialis[J].Biochemical genetics, 2005,43(7-8): 417-424.
[6]Peltenburg L, Murre C.Engrailed and Hox homeodomain proteins contain a related Pbx interaction motif that recognizes a common structure present in Pbx [J].The EMBO journal, 1996, 15(13): 3385.
[7]Bourbon H-M, Martin-Blanco E, Rosen D, et al.Phosphorylation of theDrosophilaengrailed protein at a site outside its homeodomain enhances DNA binding[J].Journal of Biological Chemistry, 1995, 270(19):11130-11139.
[8]Manzanares M, Marco R, Garesse R.Genomic organization and developmental pattern of expression of theengrailedgene from the brine shrimpArtemia[J].Development, 1993, 118(4): 1209-1219.
[9]Condron B G, Patel N H, Zinn K.Engrailedcontrols glial/neuronal cell fate decisions at the midline of the central nervous system [J].Neuron, 1994, 13(3):541-554.
[10]Joyner A L.Engrailed,wntandpaxgenes regulate midbrain-hindbrain development [J].Trends in Genetics , 1996, 12(1): 15-20.
[11]Ahzhanov A, Kaufman T C.Evolution of distinct expression patterns forengrailedparalogues in higher crustaceans (malacostraca) [J].Development genes and evolution, 2000, 210(10): 493-506.
[12]Lowe C J, Wray G A.Radical alterations in the roles of homeobox genes during echinoderm evolution [J].Nature, 1997, 389(6652): 718-721.
[13]Logan C, Hornbruch A, Campbell I, et al.The role ofengrailedin establishing the dorsoventral axis of the chick limb [J].Development, 1997, 124(12): 2317-2324.
[14]Moshel S M, Levine M, Collier J.Shell differentiation andengrailedexpression in theilyanassaembryo [J].Development genes and evolution, 1998, 208(3): 135-141.
[15]Wanninger A, Haszprunar G.The expression of an engrailed protein during embryonic shell formation of the tusk-shell, antalis entalis (mollusca, scaphopoda)[J].Evolution & development, 2001, 3(5): 312-321.
[16]Jacobs D K, Wray C G, Wedeen C J, et al.Molluscanengrailedexpression, serial organization, and shell evolution [J].Evolution & development, 2000, 2(6):340-347.
[17]Maures T J , Duan C.Structure, developmental expression, and physiological regulation of zebrafish igf binding protein-1 [J].Endocrinology, 2002, 143(7):2722-2731.
[18]Hui C C, Matsuno K, Ueno K, et al.Molecular characterization and silk gland expression of bombyxengrailedand invected genes [J].Proceedings of the National Academy of Sciences, 1992, 89(1): 167-171.
[19]Logan C, Hanks M, Noble-Topham S, et al.Cloning and sequence comparison of the mouse, human, and chickenengrailedgenes reveal potential functional domains and regulatory regions [J].Developmental genetics, 1992, 13(5): 345-358.
[20]Ekker M, Wegner J, Akimenko M A, et al.Coordinate embryonic expression of three zebrafishengrailedgenes [J].Development, 1992, 116(4): 1001-1010.
[21]Gay N J, Poole S, Kornberg T.Association of the drosophila melanogasterengrailedprotein with specific soluble nuclear protein complexes [J].The EMBO journal, 1988, 7(13): 4291.
[22]Gibert J M.The evolution ofengrailedgenes after duplication and speciation events [J].Development genes and evolution, 2002, 212(7): 307-318.

