miR-101靶向甲基化转移酶3A抑制人卵巢癌细胞生长与侵袭
胡可可,邓赫男,谭 琛,彭丽秀,肖斌梅
郴州市第一人民医院妇产科,湖南 郴州 423000
miR-101靶向甲基化转移酶3A抑制人卵巢癌细胞生长与侵袭
胡可可,邓赫男,谭 琛,彭丽秀,肖斌梅
郴州市第一人民医院妇产科,湖南 郴州 423000
背景与目的:miR-101在胃癌、结肠癌、乳腺癌以及前列腺癌中表达下调,有类似抑癌基因样作用,然而,其在卵巢癌中的作用尚未明确。该研究旨在探讨miR-101是否通过靶向调控甲基化转移酶3A(DNMT3A)抑制人卵巢癌细胞生长与侵袭,从而进一步揭示miR-101的抑瘤机制。方法:采用实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测22例卵巢癌组织及癌旁正常卵巢组织中miR-101的表达改变;将miR-101 mimics转染于卵巢癌SKOV3细胞,以DNMT3A siRNA为阳性对照,采用蛋白[质]印迹法(Western blot)检测外源过表达miR-101对DNMT3A蛋白表达水平的影响;采用噻唑蓝(thiazolyl blue,MTT)和Transwell侵袭实验检测外源高表达miR-101对人卵巢癌细胞生长与侵袭能力的影响。结果:qRT-PCR检测结果显示,miR-101在22例卵巢癌组织中的表达水平较癌旁正常组织明显下调;Western blot检测结果显示,外源过表达miR-101或沉默DNMT3A能下调SKOV3细胞DNMT3A蛋白的表达水平;MTT检测结果显示,转染miR-101 mimics或沉默DNMT3A 48、72和96 h后D值与对照组比较明显减少,差异均有统计学意义(P<0.05);Transwell侵袭实验显示,转染miR-101 mimics或沉默DNMT3A 36 h后穿过基底膜的细胞数分别为(105±7)个和(107±13)个,与对照组(213±11)个比较能明显减缓SKOV3细胞的穿膜能力,差异有统计学意义(P<0.05)。结论:miR-101通过靶向调控DNMT3A抑制人卵巢癌细胞生长与侵袭。
miR-101;卵巢癌;甲基化转移酶3A;生长和侵袭
microRNAs (miRNAs)是一类长度约为22 nt的单链、非编码的小RNA分子,通过与靶基因的3’非编码区相互结合从而调控靶基因的表达[1]。miRNAs是基本的调控因子,在肿瘤的发展中调控细胞的增殖、分化以及调亡等过程。miRNAs的表达具有一定时间性和空间性,其生理表达模式的破坏与多种肿瘤的发生密切相关,表明miRNAs在人类肿瘤的发生、发展中可能起癌基因或抑癌基因样作用。研究显示,miR-101在多肿恶性肿瘤中表达下调,起到类似于抑癌基因样作用,抑制肿瘤细胞的增殖与侵袭,表明miR-101在这些肿瘤的发生、发展过程中可能发挥重要作用[2-3]。甲基化转移酶3A(DNMT3A)在多种肿瘤中表达上调,其在肾细胞癌中的表达水平与肿瘤的大小、临床分期、淋巴结转移以及患者的预后生存相关[4]。Xu等[5]的研究显示,miR-29s通过靶向DNMT3A抑制胶质瘤细胞的增殖、侵袭与转移。然而,目前对于miR-101与DNMT3A在卵巢癌中的研究鲜见报道。本研究拟通过采用实时定量聚合酶链式反应(quantitative real-time polymerase chain reation,qRT-PCR)技术、蛋白[质]印迹法(Western blot)、MTT及Transwell检测miR-101在卵巢癌中的生物学作用以及相关作用机制。
1 材料和方法
1.1 病例资料
收集2010年2月—2012年3月期间我院收治并确诊为卵巢癌的患者22例,中位年龄56(41~73)岁。所有卵巢癌患者术前均未行放化疗等抗肿瘤治疗。所有癌组织标本经HE染色并经2名以上病理学专家确诊。所取正常组织距癌缘超过5 cm,并经HE染色证实为非癌组织。
1.2 主要材料
人卵巢癌株SKOV3细胞,由中山大学肿瘤研究所惠赠。LipofectamineTM2000购自美国Invitrogen公司,MTT购自美国Sigma公司,Transwell小室购自美国BD公司。miR-101 mimics与scramble序列分别为5’-UACAGUACUGUGAUAACUGAA-3’与5’-UUCUCCGAACGUGUCACGUTT -3’ ,均由丹麦Exiqon公司设计合成。RNA抽提试剂盒购自美国Applied Biosystems公司,DNMT3A和β-actin抗体购自美国Santa Cruz公司。
1.3 瞬时转染
将预先培养好的SKOV3细胞接种于6孔板中,按2 mL/孔铺好,培养过夜。用灭菌的无酶水稀释micrRNA-101mimics干粉,按说明配制成20 μmol/L的溶液备用。用不含血清的Opti-MEM培养液分别稀释100 pmol miRNA-101mimics与5 μL的LipofectamineTM2000,混匀,室温温育5 min。然后,将上述2种混合液加入培养孔继续培养48 h。
1.4 qRT-PCR
称取每个卵巢癌标本和癌旁正常组织各适量,用RNA抽提试剂盒抽提组织中总RNA,并逆转录合成cDNA置于-80 ℃保存备用。PCR扩增反应体系为20 μL,包括Taq DNA polymerase 5 U/μL)0.2 μL,MiR-PCR primers(5 mmol/L) 0.4 μL,2×SYBR Mix 10 μL,miRNA RT product 2.0 μL,灭菌蒸馏水7.4 μL。循环体系为: 95 ℃预变性3 min;95 ℃变性12 s,62 ℃退火35 s,72 ℃延伸30 s,共35个循环。以β-actin为内参,所测定的miR-101的相对表达量采用2-ΔΔCt法分析。
1.5 Western blot
将miR-101 mimics、scramble、DNMT3A siRNA转染于卵巢癌SKOV3细胞,分别作为实验组、阴性对照组和阳性对照组,48 h后抽提细胞总蛋白,每组取等量标本进行SDS-PAGE凝胶电泳,电泳后转膜,封闭1 h,加入DNMT3A抗体或β-actin抗体,4 ℃过夜,TBST洗膜,加二抗温育1 h,洗膜,ECL发光,X片曝光、显
影、定影。
1.6 Transwell侵袭实验
在Transwell小室中铺加适量基质胶稀释液过夜以成膜。次日取100 μL即含1×105个/mL细胞稀释液接种至Transwell小室的上腔,下腔加500 μL含10%胎牛血清的RPMI-1640培养液,置于37 ℃、CO2体积分数为5%的细胞培养箱中培养36 h后取出,用棉签擦弃小室上层细胞,PBS液轻洗,4%多聚甲醛固定,0.1%结晶祡染色,PBS液清洗,倒置,晾干。光学显微镜下观察并摄相,随机选取4个高倍视野进行细胞计数,取平均值。实验重复3次。
1.7 MTT法
将转染细胞接种于96孔板中,每组设5个复孔,培养至临近饱和。每孔加入灭菌MTT液5 mg/mL 20 μL,温育4 h后取出。每孔中加入亚甲基亚砜(dimethyl sulfoxide,DMSO)150 μL,低速振荡10 min,选择波长为570 nm,在酶标仪上测定各孔吸光度(D)值,记录结果。实验重复3次。
1.8 统计学处理
2 结 果
2.1 卵巢癌组织中miR-101表达水平的检测
提取卵巢癌组织和癌旁正常卵巢组织中的总RNA,以U6 snRNA为内参采用qRT-PCR法检测卵巢癌组织和癌旁正常卵巢组织中miR-101的表达水平。确定1例癌旁正常卵巢组织的miR-101的值为1,然后与其他正常组织和癌组织进行分析比较,以2-ΔΔCt表示miR-101的表达水平,然后分析得到22例卵巢癌组织中miR-101的平均表达值为0.691±0.036,癌旁正常卵巢组织中miR-101的平均表达值为1.604±0.065。两者相比,差异有统计学意义(P<0.001,图1)。
2.2 miR-101对DNMT3A蛋白表达的影响
有研究表明,DNMT3A是miR-101直接调控的靶基因[6]。为明确在卵巢癌细胞中miR-101对DNMT3A蛋白表达调控的影响,将miR-101mimics转染于SKOV3细胞中,以转染miR-101-scramble为阴性对照,转染DNMT3A siRNA为阳性对照,转染48 h后收集蛋白。Western blot结果显示,转染miR-101组和DNMT3A siRNA组DNMT3A蛋白表达水平较阴性对照组明显降低(图2)。结果提示,在卵巢癌SKOV3细胞中miR-101能下调DNMT3A蛋白的表达。
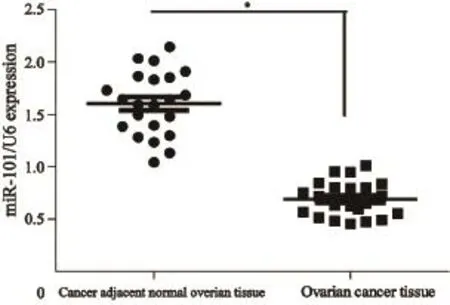
图 1 miR-101在卵巢癌组织和癌旁正常卵巢组织中表达水平Fig. 1 The expression of miR-101 in ovarian cancer and cancer adjacent normal ovarian tissues tested by qRT-PCR
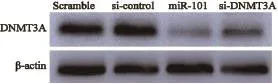
图 2 Western blot检测miR-101对DNMT3A蛋白的影响Fig. 2 The expression of DNMT3A protein regulated by miR-101 and si-DNMT3A was tested by Western blot
2.3 miR-101对人卵巢癌SKOV3细胞增殖的影响
MTT结果显示,转染miR-101组和DNMT3A siRNA组48、72和96 h后,人卵巢癌SKOV3细胞的增殖速度和能力明显受到抑制,与对照组相比,差异均具有统计学意义(P<0.05,图3)。提示外源高表达miR-101可能通过下调DNMT3A的表达抑制卵巢癌SKOV3细胞的增殖。
2.4 miR-101对卵巢癌SKOV3细胞侵袭能力的影响
Transwell结果显示,转染miR-101 mimics和
DNMT3A siRNA组36 h后,SKOV3细胞穿过基质胶的细胞数分别为(105±7)和(107±13)个,与对照组(213±11)个和空白组(176±6)个相比,差异有统计学意义(P<0.01,图4)。提示外源高表达miR-101可能通过下调DNMT3A的表达抑制卵巢癌SKOV3细胞的侵袭。
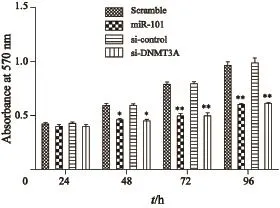
图 3 MTT法检测过表达miR-101对卵巢癌SKOV3细胞增殖能力的作用Fig. 3 The proliferation ability of SKOV3 cells regulated by miR-101 and si-DNMT3A was detected by MTT
3 讨 论
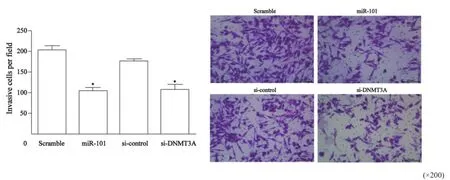
图 4 Transwell侵袭实验检测过表达miR-101对卵巢癌SKOV3细胞侵袭能力的作用Fig. 4 The invasion ability of SKOV3 cells regulated by miR-101 and si-DNMT3A was detected by Transwell invasion assay
卵巢癌是全球妇科肿瘤中常见的恶性肿瘤之一,也是女性癌症死亡相关的第二大病因[7]。尽管目前的诊断和治疗技术在不断发展,但是卵巢癌患者的临床结局仍然不太理想,因为大多数患者在疾病诊断时已为晚期,且多数患者对化疗药物存在抵抗。据统计,卵巢癌患者的5年总生存率仅在40%~45%[8]。因此,早期特异性肿瘤标志物的识别以及靶向治疗策略的开发对提高卵巢癌患者的生存率具有重要的临床意义。目前越来越多的研究者在不同的卵巢癌细胞系、组织以及血清标本中进行miRNA表达谱的研究,以确定卵巢癌新的生物标志物[9-10]。例如,miR-30[11]、miR-124[8]和miR-199[12]在卵巢癌中表达下调,并能抑制肿瘤细胞的生长、侵袭与转移。研究显示,miR-101在胃癌[3]、结肠癌[4]和乳腺癌[13]中表达下降。Chen等[13]研究证实,miR-101在乳腺癌中表达下调,且其低表达与乳腺癌发生的高危险性密切相关。此外,miR-101还可通过靶向Stathmin抑制乳腺癌的生长和转移[14]。miR-101在前列腺癌中通过靶向调控EZH2抑制前列腺癌干细胞的增殖[15]。miR-101在结肠癌中通过靶向调控EP4的表达抑制结肠癌细胞的迁移与侵袭[4]。综上可见,miR-101在多种肿瘤中具有抑制肿瘤生长和转移的作用。本研究通过采用qRT-PCR技术检测发现,miR-101在卵巢癌组织中表达明显下调。进一步通过MTT、Transwell实验研究发现,过表达miR-101能明显
抑制卵巢癌SKOV3细胞的增殖和侵袭能力,表明miR-101在卵巢癌中发挥抑瘤基因样作用。相关研究显示,DNMT3A是miR-101直接调控的靶基因,miR-101通过靶向DNMT3A抑制肺癌细胞的增殖与转移[6]。本研究也证实在卵巢癌细胞中过表达miR-101能下调DNMT3A蛋白表达,而在卵巢癌细胞中沉默DNMT3A后,卵巢癌细胞的增殖与侵袭能力也明显受到抑制。
综上所述,miR-101在卵巢癌中表达下调,并且可能通过靶向DNMT3A抑制卵巢癌细胞的增殖、迁移和侵袭,表明miR-101可作为一个潜在的治疗靶点用于卵巢癌的治疗。研究将继续深入miR-101在卵巢癌中的功能和分子研究,系统阐明miR-101参与卵巢癌发生、发展的可能分子机制,为卵巢癌的防治提供实验依据。
[1] TANG H, KONG Y, GUO J, et al. Diallyl disulfide suppresses proliferation and induces apoptosis in human gastric cancer through Wnt-1 signaling pathway by up-regulation of miR-200b and miR-22 [J]. Cancer Lett, 2013, 340(1): 72-81.
[2] WANG H J, RUAN H J, HE X J, et al. MicroRNA-101 is down-regulated in gastric cancer and involved in cell migration and invasion[J]. Eur J Cancer, 2010, 46(12):2295-2303.
[3] CHANDRAMOULI A, ONYEAGUCHA B C, MERCADOPIMENTEL M E, et al. MicroRNA-101 (miR-101) posttranscriptionally regulates the expression of EP4 receptor in colon cancers[J]. Cancer Biol Ther, 2012, 13(3): 175-183.
[4] LI M, WANG Y, SONG Y, et al. Expression profiling and clinicopathological significance of DNA methyltransferase 1, 3A and 3B in sporadic human renal cell carcinoma[J]. Int J Clin Exp Pathol, 2014, 7(11): 7597-7609.
[5] XU H, SUN J, SHI C, et al. miR-29s inhibit the malignant behavior of U87MG glioblastoma cell line by targeting DNMT3A and 3B[J]. Neurosci Lett, 2015, 590: 40-46.
[6] YAN F, SHEN N, PANG J, et al. Restoration of miR-101 suppresses lung tumorigenesis through inhibition of DNMT3adependent DNA methylation[J]. Cell Death Dis, 2014, 5:e1413.
[7] NASU K, KAI K, HIRAKAWA T, et al. Retrospective analysis of outcomes of secondary debulking surgery for recurrent epithelial ovarian cancer with favorable prognostic factors[J]. J Obstet Gynaecol Res, 2014, 40(3): 791-796.
[8] ZHANG H, WANG Q, ZHAO Q, et al. MiR-124 inhibits the migration and invasion of ovarian cancer cells by targeting SphK1[J]. J Ovarian Res, 2013, 6(1): 84.
[9] ZHENG H, ZHANG L, ZHAO Y, et al. Plasma miRNAs as diagnostic and prognostic biomarkers for ovarian cancer[J]. PLoS One, 2013, 8(11): e77853.
[10] MILES G D, SEILER M, RODRIGUEZ L, et al. Identifying microRNA/mRNA dysregulations in ovarian cancer[J]. BMC Res Notes, 2012, 5: 164.
[11] WANG T, LI F, TANG S. MiR-30a upregulates BCL2A1, IER3 and cyclin D2 expression by targeting FOXL2[J]. Oncol Lett, 2015, 9(2): 967-971.
[12] KINOSE Y, SAWADA K, NAKAMURA K, et al. The role of microRNAs in ovarian cancer[J]. Biomed Res Int, 2014, 2014: 249393.
[13] CHEN J, QIN Z, JIANG Y, et al. Genetic variations in the flanking regions of mir-101-2 are associated with increased risk of breast cancer[J]. PLoS One, 2014, 9(1): e86319.
[14] WANG R, WANG H B, HAO C J, et al. MiR-101 is involved in human breast carcinogenesis by targeting Stathmin1[J]. PLoS One, 2012, 7(10): e46173.
[15] LI K, LIU C, ZHOU B, et al. Role of EZH2 in the growth of prostate cancer stem cells isolated from LNCaP cells[J]. Int J MolSci, 2013, 14(6): 11981-11993.
miR-101 inhibits growth and invasion of ovarian cancer cells by targeting DNMT3A
HU Keke, DENG
Henan, TAN Chen, PENG Lixiu, XIAO Binmei (Department of Gynaecology and Obstetrics, First Hospital of Chenzhou, Chenzhou 423000, Hunan, China)
HU Keke E-mail: zrzl67@aliyun.com
Background and purpose: miR-101 has been reported to be down-regulated in gastric cancer, colorectal cancer, breast cancer as well as prostate cancer acting as a tumor suppressor gene. However, its function in ovarian cancer is still unknown. The aim of this study was to investigate whether miR-101 can suppress cell growth and invasion of ovarian cancer cells by targeting DNMT3A, so as to reveal molecular mechanism to inhibit ovarian cancer. Methods: Quantitative real-time palymerase chain reaction (qRT-PCR) method was employed to detect the expression of miR-101 in ovarian cancer and cancer adjacent normal ovarian tissues. SKOV3 cells were transfected with miR-101 mimics, and DNMT3A siRNA was transfected as a positive control. Then Western blot was used to detect the expression of DNMT3A protein regulated by miR-101 in SKOV3 cells. The growth and invasion ability of SKOV3 cells were evaluated by MTT and Transwell invasion assays. Results: qRT-PCR showed that miR-101 was down-regulated in ovarian cancer tissues. Western blot showed that the level of DNMT3A protein was inhibited by restored miR-101 or knock-down of DNMT3A in SKOV3 cells. Following transfection of miR-101 mimics or knock-down of DNMT3A for 48, 72 and 96 h respectively, MTT assay showed that the D values were significantly lower than the control group, (P<0.05). After transfection of miR-101 mimics or knock-down of DNMT3A for 36 h, Transwell invasion assay showed that the numbers of cells through the basement membrane was (105±7) and (107±13), respectively, which are significantly different from the control group (213±11), indicating invasion of SKOV3 cells significantly slowed down
MiR-101; Ovarian cancer; DNMT3A; Growth and invasion
10.3969/j.issn.1007-3969.2015.10.006
R73-37
A
1007-3639(2015)10-0791-05
2015-01-02
2015-04-28)
湖南省教育厅课题资助项目(13C929)。
胡可可 E-mail:176024235@qq.com
(P<0.05). Conclusion: miR-101 suppresses cell growth and invasion by targeting DNMT3A in ovarian cancer.

