食用油中3-氯-1,2-丙二醇酯的研究进展
焦 博 胡 晖 刘红芝 刘 丽 石爱民 王 强
(农业部农产品加工综合性重点实验室/中国农业科学院农产品加工研究所,北京 100193)
食用油中3-氯-1,2-丙二醇酯的研究进展
焦 博 胡 晖 刘红芝 刘 丽 石爱民 王 强
(农业部农产品加工综合性重点实验室/中国农业科学院农产品加工研究所,北京 100193)
3-氯-1,2-丙二醇酯是形成于食用油加工过程中的污染物质。在对食用油中3-氯-1,2-丙二醇酯文献分析的基础上,综述了食用油中3-氯-1,2-丙二醇酯的研究进展,主要包括氯丙醇类物质的结构类型;不同国家和地区的污染水平现状及限量标准;近期建立的检测方法;氯化物和脂类前体物质以及形成原理;精炼前、精炼中和精炼油到成品油3个阶段的控制措施。同时指出了现阶段主要存在的问题,并对今后研究的方向和重点进行了展望。旨在为完善有效控制油脂加工过程中3-氯-1,2-丙二醇酯的产生、保障油脂安全提供依据。
3-氯-1,2-丙二醇酯 污染水平及限量 检测方法 形成原理 控制措施
2013年6月1日,食品安全国家标准GB 2762—2012《食品中污染物限量》正式实施,其中调味品3-氯-1,2-丙二醇(3-monochloropropanol-1,2-diol,3-MCPD)限量指标[1]的增加体现出污染物 3-氯-1,2-丙二醇的控制对于我国当代食品安全的重要性。研究发现,除了调味品之外,3-氯-1,2-丙二醇还以脂肪酸酯的形式广泛存在于油炸、焙烤等食品中,且其主要来源于加工过程中添加的精炼食用油[2-3]。3-MCPD酯在人体中会被降解为游离态的3-MCPD[4-5],具有肾脏毒性、强致癌性及致突变性等危害[6]。
近年来有关氯丙醇酯的食品安全问题日益凸显,2007年德国联邦风险评估机构(BfR)评估认为婴儿配方乳中3-MCPD酯水平已达到了每日容许摄入量(TDI)的3.6~12.5倍;2009年日本花王公司停止销售缩水甘油酯含量较高的Econa食用油以及与Econa有关的产品,而缩水甘油酯是3-MCPD酯的一类前体物质。
3-MCPD酯的控制不但直接影响企业利益,更事关人民身体健康和生命安全,应尽快展开全面、系统的研究。结合国内外近期研究,对食用油中3-MCPD酯的污染水平及限量、检测方法、形成原理及控制措施进行综述,以期为有效控制3-MCPD酯的产生、保障油脂食用安全提供理论依据。
1 氯丙醇类物质的结构类型
氯丙醇(chloropropanol)类物质主要包括3-氯-1,2-丙二醇、2-氯 -1,3-丙二醇(2-monochloropropane-1,3-diol,2-MCPD)、1,3-二氯丙醇(1,3-dichloropropanol-2-ol,1,3-DCP)和 2,3-二氯丙醇(2,3-dichoropropanol-ol,2,3-DCP),对应氯丙醇酯的结构共有7种(见图1)。食品加工过程中,3-MCPD以及3-MCPD酯的生成量远高于其他氯丙醇类物质,因此通常以3-MCPD以及3-MCPD酯来反映氯丙醇类物质的指标。
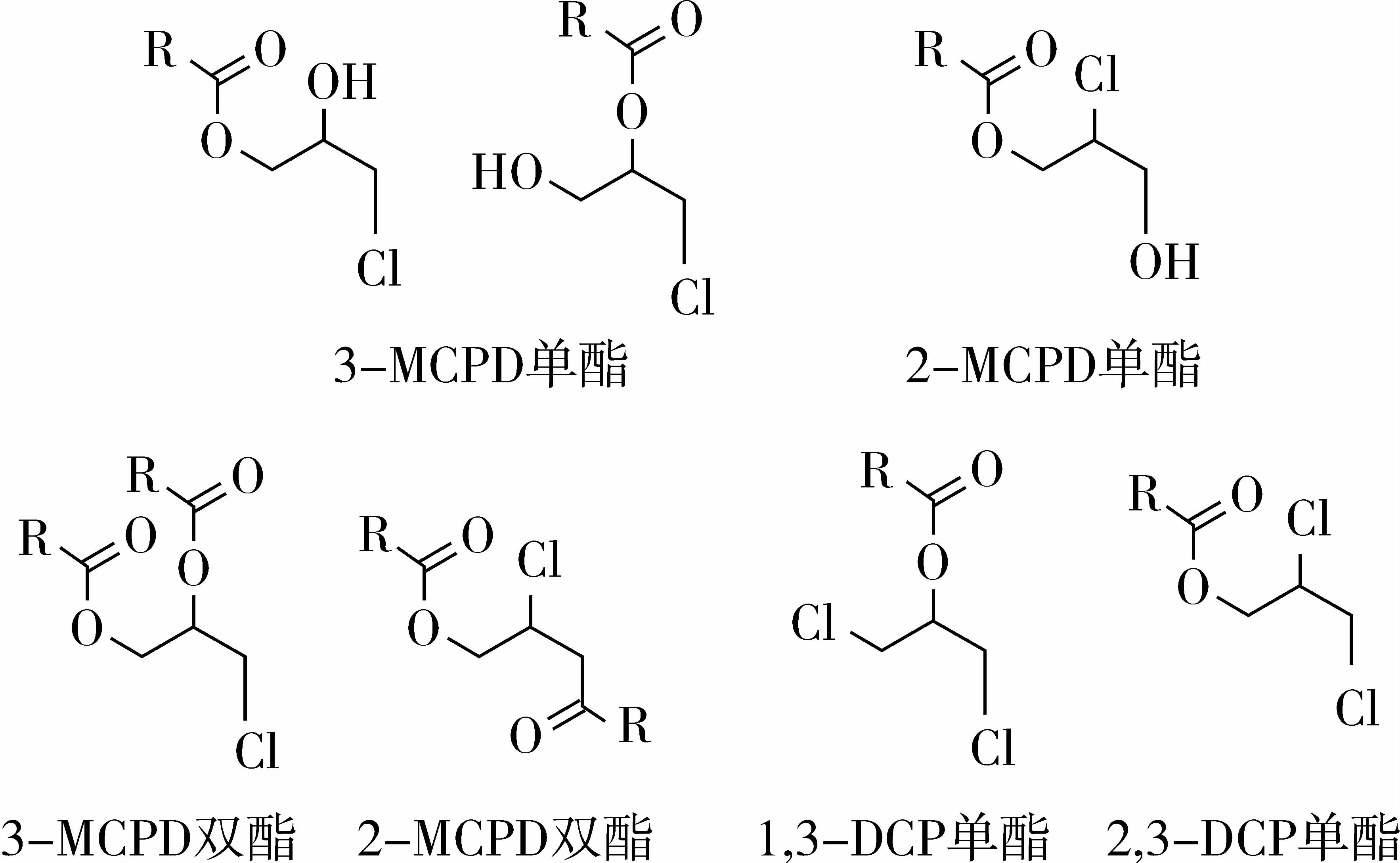
图1 氯丙醇酯的结构
2 3-MCPD酯的污染水平及限量
3-MCPD酯的毒理学研究正在不断开展中,迄今鲜见关于3-MCPD酯的官方评估结论。目前的评估是基于BfR的假设,即3-MCPD酯在人体中会完全水解为游离态的3-MCPD,再根据3-MCPD的限量进行评估。
近年来,部分科研人员对本国的3-MCPD酯污染水平进行了调查,以期为3-MCPD酯的危害评估提供依据。2010年,Kuhlmann[7]对德国市售食用油中3-MCPD酯的含量进行了测定,结果显示精炼核桃油、榛子油、棕榈油中的污染水平较高。2013年,MacMahon等[8]对美国食用油中3-MCPD酯的污染情况进行了调查,最终在精炼棕榈油和棕榈油精中发现了最高浓度的3-MCPD酯。同在2013年,里南等[9]对我国市售食用油中氯丙醇酯的情况进行了调查,结果显示在11类食用油中3-MCPD酯的检出率为74.8%,其中茶籽油和芝麻油污染水平较高。从国内外调查数据可以看出,3-MCPD酯广泛存在于食用油中,不同种类的油之间3-MCPD酯的含量存在一定差异,同种油不同生产商生产出产品的3-MCPD酯含量也不同,其原因与前体物质含量和油脂加工工艺密切相关。对于酸水解植物蛋白(HVP)、酱油等基质中游离态的3-MCPD,某些地区已制定了限量指标(见表1),但仍未制定出3-MCPD酯的限量指标。
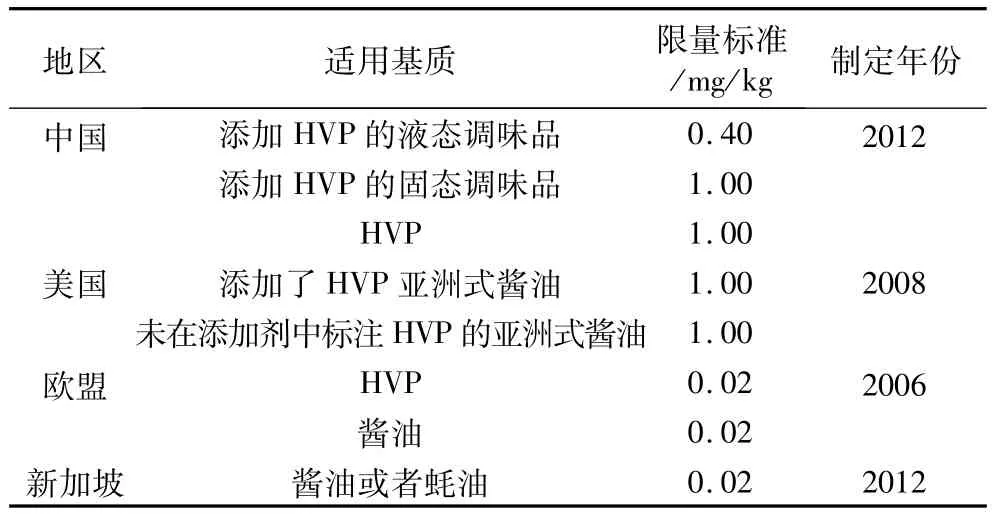
表1 3-MCPD限量标准统计
3 3-MCPD酯检测方法
3.1 直接检测法
直接检测法是对3-MCPD酯单体直接进行检测,样品前处理过程中不改变3-MCPD酯的结构。
Haines等[10]建立了利用液相-飞行时间质谱联用仪(LC-TOFMS)直接检测3-MCPD酯的方法,食用油样品不需要任何前处理,直接溶解在流动相中进行分析,保证了检测结果的真实性,但方法存在着仪器污染严重、成本高等缺陷。Moravcova等[11]建立了超高压液相色谱(U-HPLC)结合离子阱轨道质谱检测3-MCPD酯的方法,该方法采用硅胶对样品进行了纯化,减少了三酰甘油的干扰,方法同时建立了一种实时分析技术(DART)能够快速半定量检测3-MCPD双酯,4min内可快速分析12个样品;然而这2种方法都没有应用到单酯的检测中,这是因为单酯在电喷雾电离源(ESI)和DART中的的低离子化程度导致了检出限增高。MacMahon等[12]建立了液相色谱联用串联质谱(LC-MS/MS)检测3-MCPD酯的方法,样品经过两步的固相萃取后进行分析检测,且该方法通过了椰子油、橄榄油和棕榈油中的28种3-MCPD双酯的验证。Zhou等[13]直接使用高效液相色谱(HPLC)检测3-MCPD酯,油样经乙腈萃取后先使用配有C18色谱柱的HPLC进行分离,再将收集到的含3-MCPD酯的组分混合浓缩后利用装有硅胶色谱柱的HPLC进行定量分析,该方法分析成本低且前处理简单,但测得的食用油中3-MCPD酯含量远远高出了国内外已有的含量数据,其真实性还需进一步验证。
3.2 间接检测法
间接检测法是通过前处理手段将结合态的3-MCPD酯裂解为游离态的3-MCPD,再对3-MCPD进行定量分析,测定结果以游离态的3-MCPD总量计。
酯裂解的原理是根据3-MCPD酯在酸性或者碱性条件下能够与甲醇发生酯交换反应生成3-MCPD。酸法常用的酯交换剂为硫酸-甲醇溶液,反应条件缓和但反应时间较长。Ermacora等[14]对酸法的酯交换反应时间进行了评估,结果显示反应4~16 h得到的结果无显著性差异,因此将反应时间优化为4 h。但Abd Razak等[15]认为棕榈油的熔点高,酯交换时间需要更长,在考察了16、18、20 h的反应时间后发现18 h和20 h没有显著性差异,最终采用18 h。碱法的酯交换试剂通常为甲醇钠-甲醇或氢氧化钠-甲醇溶液,反应条件剧烈且时间短,但3-MCPD在碱性环境中会降解成甘油,此时内标物的选择至关重要。Hrncirik等[16]证明采用游离态的 3-MCPD-d5作为内标会使测定的结果比使用棕榈酸双酯3-MCPD-d5偏高7%~15%,与分析物性质相近的棕榈酸双酯3-MCPD-d5作为内标得到的结果相对准确。自从高纯度的棕榈酸双酯3-MCPD-d5标准品商业化后,各协会制定的标准方法大都采用了棕榈酸双酯3-MCPD-d5作为内标[17-18],但Liu等[19]认为油脂中脂肪酸种类差异显著,3-MCPD酯的酯结构也存在差异,不能仅以棕榈酸双酯对应的3-MCPD-d5作为内标;Liu等[19]发现随着碱法酯交换反应时间的增长(2~12min),3-MCPD的水平逐渐降低,但3-MCPD与3-MCPD-d5的峰面积比值基本不变,因此碱法酯交换只降低了方法的灵敏度而不是准确度。此外碱法中酯交换后盐析试剂的选择也至关重要,Hrncirik等[16]的研究表明碱法中用氯化钠作为盐析试剂会高估3-MCPD酯的含量,因为氯化钠中的氯离子与缩水甘油发生了反应,生成了额外的3-MCPD,而酸法酯交换测定的则不会受盐析试剂种类的影响,原因是中和后pH不同(酸法pH约为7,碱法在1.5~2之间),而酸性环境有利于缩水甘油向3-MCPD的转换,导致了结果的偏差。
由于3-MCPD相对分子量低、沸点高、极性大,在进入GC-MS前需要进行衍生化以提高它的挥发性并获得特征离子碎片。常见的衍生剂是苯基硼酸(PBA)和七氟丁酰基咪唑(HFBI)。PBA能与二醇化合物反应成环,衍生3-MCPD所需的前处理步骤较少且价格低廉,但PBA的性质不稳定,在空气中暴露或加热的条件下能够生成三分子的低聚物,这种低聚物会污染色谱系统,国外常采用程序升温蒸发进样器或反冲洗技术以减少对仪器的污染,否则将会使仪器背景值升高,维护频繁,严重降低了分析效率[19]。HFBI是分析游离3-MCPD时常用的衍生剂,目前鲜见关于HFBI作为衍生剂分析3-MCPD酯检测标准,相关的文献也很少[19-20]。这可能是因为HFBI对水十分敏感,在衍生化前需要经过严格的脱水,因此使前处理变得复杂,且脱水所用的硅藻土、HFBI衍生剂价格较高,淋洗和洗脱消耗的有机溶剂量较大。但经过硅藻土净化后的样品相对于PBA衍生法更加纯净,减少了仪器的维护频率,提高了分析效率。此外,HFBI能对双氯单羟基丙醇进行衍生,从而能够实现对所有氯丙醇酯的同步分析[19]。
4 3-MCPD酯形成原理
4.1 前体物质
形成3-MCPD酯的前体有氯化物和脂类2部分。氯化物前体物质包括有机氯化物和无机氯化物,脂类前体物质包括甘油单酯(Monoacylglycerol,MAG)、甘油双酯(Diacylglycerol,DAG)、三酰甘油(Triacylglycerol,TAG)、磷脂等。
氯的来源隐蔽而又广泛,结构类型也复杂多样。Nagy等[21]在油棕果果肉中检测到不同类型的氯化物,包括类似植物鞘氨醇的有机氯化物以及FeCl2、FeCl3等无机氯化物,部分氯化物在油棕果未成熟之前就已经存在;同时Nagy等[22]通过质量亏损过滤及同位素图谱匹配得到了高分辨率的质谱信号,推测出油棕果自身存在的氯化物是3-MCPD酯的前体,且试管试验表明脂溶性有机氯化物更有可能是3-MCPD酯的前体物质,其原理是在温度高于120℃的条件下有机氯化物发生消去反应产生了HCl,HCl中的氯离子亲核攻击甘油酯骨架,产生了3-MCPD酯,这种观点在之后的文献中也得到了证实。基于氯离子亲水疏油的特性,Matthäus等[23]用水洗处理棕榈毛油意在将氯离子脱除,模拟脱臭后,3-MCPD酯的生成量减少了20%~30%,说明毛油中的水溶性氯离子确实参与了3-MCPD酯的形成。脱臭水蒸气中可能含有一定量的氯离子,Pudel等[24〛分别用无氯离子蒸馏水和含有37.2 mg/L氯离子的自来水用作脱臭蒸汽,240℃下对菜籽和棕榈毛油脱臭2 h,发现自来水蒸汽并没有显著提高3-MCPD酯的形成,排除了蒸汽用水中的氯离子是前体物质的可能性。
形成3-MCPD酯的主要脂类前体物质在国际上引起了热议。因油脂中几乎不含MAG,磷脂在脱胶过程中也被大量除去,因此主要的脂类前体物质的研究主要集中在DAG和TAG上。部分科研工作者认为DAG是3-MCPD酯的最主要的前体物质,且油脂中DAG的含量与3-MCPD酯的形成量存在良好的线性关系,而TAG在脱臭高温下非常稳定,只能参与形成微量的 3-MCPD酯[23,25-26]。但一些学者也表达出不同的观点,以棕榈毛油为例,TAG的含量高达88%~96%,而DAG含量仅为4%~12%,由此认为TAG与氯化物前体接触反应的几率更大[22〛,且Hrncirik等[27〛和 Zulkurnain等[28]的试验结果显示DAG的含量与3-MCPD酯的形成并无线性关系。
4.2 形成机理

图2 由DAG形成3-MCPD酯的4种可能途径(R=脂肪酸链)
3-MCPD酯的形成机理备受争论,Rahn等[29〛归纳3-MCPD酯可能的形成途径共有4条(见图2):1)氯离子直接亲核取代甘油碳骨架上的酰基;2)氯离子直接亲核取代甘油碳骨架上的质子化羟基;3)脂类前体先脱去羟基基团或者水生成环酰氧鎓离子(cyclic acyloxonium ion)中间体,再因氯离子进攻开环形成3-MCPD酯;4)精炼油中存在的缩水甘油脂肪酸酯受到氯离子进攻开环,形成3-MCPD酯。途径1和途径2起初得到了部分研究团队的认可[2],但其原理主要是由游离态3-MCPD在酸性环境下的形成机理中推测出来;途径3中的环酰氧鎓离子中间体已被Rahn等[30]通过红外光谱和同位素标记技术检测到,并指出具有相邻酰基的甘油酯更容易形成环酰氧鎓离子;途径4是形成3-MCPD酯的次要途径,Shimizu等[31]将初始浓度为120 mg/kg的缩水甘油酯与有机氯共热,3-MCPD酯含量相对于对照组仅提高了23 mg/kg,由此证明确有此途径存在但并非是主要途径。
最近,Zhang等[32]提出了一种新的环酰氧鎓自由基机制。Zhang等通过电子自旋共振技术推测出3-MCPD酯的主要反应过程是DAG的C-3位上脱去一分子羟基自由基,而余下的中心碳自由基立即攻击C-1位上的羰基形成环酰氧自由基,未成对电子在C-2、C-3以及2个氧原子之间重排,最终与氯自由基反应开环形成3-MCPD双酯。
5 3-MCPD酯控制措施
5.1 精炼前阶段的控制
精炼前阶段的主要控制手段是降低前体物质的水平。氯前体在油脂加工前就已经存在于油料之中,在此阶段的控制能够在源头上减少前体物质在整个加工链上的扩散。
氯是植物必需营养素之一,氯的来源十分广泛,土壤、空气、肥料、水、农药等都会给植物提供氯。在保证作物良好生长的前提下应尽可能地减少氯的迁入以便在加工源头上减少前体物质的生成,通过控制生长条件如改善空气环境、灌溉用水、使用非有机氯农药等可达到此阶段的控制目的。Matthäus等[23]发现不同种类的毛油最终形成3-MCPD酯的能力不同,而且同是棕榈毛油,世界不同地区得到的样品形成3-MCPD酯的能力是不同的。Zulkurnain等[28]比较了不同质量毛油生成3-MCPD酯的能力,在品质最差的棕榈毛油(Standard quality II)中就已经检测到了少量3-MCPD酯((0.061±0.01)mg/kg),而其他3类品质较好的样品中均未检出,精炼后Standard quality II中的3-MCPD酯含量高出了其他样品油3~4倍。不同地区、不同品质的毛油形成3-MCPD酯的能力是不同的,这与毛油中所含前体物质的含量有关,因此可以优选加工原料减少3-MCPD酯的形成。
Zelinkova等[33]发现由烘烤过的杏仁、花生制得的初榨油中3-MCPD酯的含量是未烘烤的5倍以上。在热榨工艺中,为提高油料的出油率并增加食用油的风味,入榨前需对一部分油料(如花生)进行烘烤加热,但过高的烘烤温度(如花生烘烤温度在180~200℃)可能导致3-MCPD酯在油脂制取阶段就已经生成。Craft等[34]用水代替棕榈油常用浸出溶剂中的2-丙醇对棕榈果进行浸出并脱除极性氯化物,模拟脱臭后3-MCPD酯的生成量减少了95%。Matthäus等[10]在精炼前用极性溶剂(水或75%酒精)清洗毛油,模拟脱臭后3-MCPD酯的生成量减少20%~30%。因此可以通过改变油料的制取条件、预处理毛油等方式减少3-MCPD酯的生成。
5.2 精炼阶段的控制
油脂精炼阶段控制的主要手段是降低氯化物前体物质的水平与控制反应条件相结合,在此阶段的控制需要对各个工序尤其是脱臭前上游工艺的优化。
Ramli等[35]改进了脱胶和脱色工艺,采用水化法脱胶并结合中性白土脱色后,能使精炼棕榈油中3-MCPD酯的含量达到最低(0.25 mg/kg)。增大水化脱胶的比例虽然移除了部分前体物质,但精炼油的色泽相对于标准脱胶工艺增加了1.4。同时Ramli[33]证明了酸性环境下有利于3-MCPD酯的形成,Hrncirik等[27]和 Freudenstein等[26]的研究也证实这种观点,这是因为酸性白土引入的酸提供了质子,使得氯离子可以直接进攻甘油酯的质子化基团最终形成3-MCPD酯。Matthäus等[36]指出采用两步脱臭法能大幅度减少3-MCPD酯和缩水甘油酯的生成,在200℃下脱臭120min后升温至250℃脱臭5min,相对于270℃下脱臭90min,3-MCPD酯的生成量减少了80%并且保障了精炼油品质。Zulkurnain等[37]使用响应面法优化整个棕榈油精炼的工艺参数,当脱胶阶段加水用量为总油量的3.5%、酸用量为0.08%、脱胶温度60℃、脱色白土用量为0.3%且脱臭温度260℃时,3-MCPD酯的生成量降低87.2%且油脂品质得到了保障。
5.3 精炼油到成品油阶段的控制
在精炼油到成品油阶段进行控制的主要手段是移除已经生成的3-MCPD酯。此阶段控制的优点是不受精炼阶段剧烈条件的影响,但面临着引入新杂质的可能。
Strijowski等[38]通过煅烧沸石和合成硅酸镁的吸附作用,能够至多减少40%的3-MCPD酯,其中沸石能够在较宽的温度范围(60~120℃)内快速降低3-MCPD酯含量,且对棕榈油的感官品质和氧化稳定性无副作用。Bornscheuer等[39]运用脂肪酶、卤代醇脱卤素酶和环氧化物水解酶将3-MCPD酯酶解为对人体无害的甘油,这种方法不需要高温条件和有机溶剂的存在,并且能够发生在水-油两相系统中,是一种除去3-MCPD酯的有效方法。
综上,对3-MCPD酯的控制应结合具体的加工工艺灵活选择控制阶段和手段,但无论在哪一个阶段,采取哪一种手段,不影响油脂品质、不产生其他有害物质都是实施控制的前提。
6 问题与展望
近年来,食用油中3-MCPD酯的研究已取得一定进展,但国内外学者的工作依然任重而道远。目前主要存在的问题如下:1)现阶段鲜见3-MCPD酯的限量指标;2)国际上鲜见统一的检测标准;3)氯、脂类前体尚未确定,很多结论存在矛盾之处;4)3-MCPD酯的形成原理没有最终定论;5)针对从原料种植到成品油整条加工线的综合控制报道较少,鲜见种植阶段对氯前体的控制方法;6)对不同油脂加工工艺研究的覆盖面小,针对一种加工方式的控制不能被其他加工工艺所借鉴。综合来看,对于3-MCPD酯的研究不够全面,但针对3-MCPD酯的控制刻不容缓。
今后研究的重点将是:1)整合最新的毒理学数据,对3-MCPD酯的危害进行系统的评估;2)建立准确、简便、高效、低成本的检测方法,推进实验室检验间方法协同性的验证;3)研究氯化物前体物质的来源、积累方式并确定最主要脂类前体物质的类型;4)继续展开3-MCPD酯形成机理的探索,寻找更有说服力的证据;5)控制方法的研究应从源头开始,在种植过程中最大程度的减少氯前体的迁入;6)控制方法要针对具体生产工艺,如:浓香花生油需重点探究压榨工艺中的高温烘炒对3-MCPD酯含量的影响;棕榈油物理精炼法需重点研究在脱臭前如何摆脱酸性环境、减少氯和脂类前体物质水平等。
对于当代食品安全,科研工作者们需主动出击,任何食品中潜在的危害物质都要提前研究、尽早控制,杜绝“亡羊补牢”的控制模式,早日制定限量标准、完善法制规范、明确形成机理并找到切实有效的控制措施以保障油脂食品安全。
[1]GB 2762—2012,食品中污染物限量[S]
[2]Baer I,de la Calle B,Taylor P.3-MCPD in food other than soy sauce or hydrolysed vegetable protein(HVP)[J].Analytical and Bioanalytical Chemistry,2010,396(1):443-456
[3]Ilko V,Zelinkova Z,Dolezal M,et al.3-Chloropropane-1,2-diol fatty acid esters in potato products[J].Czech Journal of Food Sciences,2011,29(4):411-419
[4]Buhrke T,Weisshaar R,Lampen A.Absorption and metabolism of the food contaminant 3-chloro-1,2-propanediol(3-MCPD)and its fatty acid esters by human intestinal Caco-2 cells[J].Archives of Toxicology,2011,85(10):1201-1208
[5]Abraham K,Appel K E,Berger-Preiss E,etal.Relative oral bioavailability of3-MCPD from 3-MCPD fatty acid esters in rats[J].Archives of toxicology,2013,87(4):649-659
[6]Bakhiya N,Abraham K,Gurtler R,etal.Toxicologicalassessment of3-chloropropane-1,2-diol and glycidol fatty acid esters in food[J].Molecular Nutrition& Food Research,2011,55(4):509-521
[7]Kuhlmann J.Determination of bound 2,3-epoxy-1-propanol(glycidol)and bound monochloropropanediol(MCPD)in refined oils[J].European Journal of Lipid Science and Technology,2011,113(3):335-344
[8]MacMahon S,Begley T H,Diachenko G W.Occurrence of 3-MCPD and glycidyl esters in edible oils in the United States[J].Food Additives&Contaminants:Part A,2013,30(12):2081-2092
[9]里南,方勤美,严小波,等.我国市售食用植物油中脂肪酸氯丙醇酯的污染调查[J].中国粮油学报,2013,28(8):28-32
[10]Haines TD,Adlaf KJ,Pierceall RM,et al.direct Determination of MCPD fatty acid esters and glycidyl fatty acid esters in vegetable oils by LC-TOFMS[J].Journal of the American Oil Chemists'Society,2011,88(1):1-14
[11]Moravcova E,Vaclavik L,Lacina O,et al.Novel approaches to analysis of 3-chloropropane-1,2-diol esters in vegetable oils[J].Analytical and Bioanalytical Chemistry,2012,402(9):2871-2883
[12]MacMahon S,Begley TH,Diachenko GW.Analysis of processing contaminants in edible oils.Part2.Liquid chromatography-tandem mass spectrometry method for the direct detection of3-monochloropropanediol and 2-monochloropropanediol diesters[J].Journal of Agricultural and Food Chemistry,2013,61(20):4748-4757
[13]Zhou H,Jin Q,Wang X,et al.Directmeasurement of 3-chloropropane-1,2-diol fatty acid esters in oils and fats by HPLC method[J].Food Control,2014,36(1):111-118
[14]Ermacora A,Hrncirik K.Evaluation of an improved indirect method for the analysis of 3-MCPD esters based on acid transesterification[J].Journal of the American Oil Chemists'Society,2012,89(2):211-217
[15]Abd Razak R A,Kuntom A,Slew W L,et al.Detection and monitoring of 3-monochloropropane-1,2-diol(3-MCPD)esters in cooking oils[J].Food Control,2012,25(1):355-360
[16]Hrncirik K,Zelinkova Z,Ermacora A.Critical factors of indirect determination of3-chloropropane-1,2-diol esters[J].European Journal of Lipid Science and Technology,2011,113(3):361-367
[17]DGFStandard Methods C-VI18(10).Fatty-acid-bound 3-chloropropane-1,2-diol(3-MCPD)and 2,3-epoxi-propane-1-ol(glycidol)
[18]AOCSOfficialMethod Cd 29a-13.2-and3-MCPD Fatty acid esters and glycidol fatty acid esters in edible oils and fats by acid transesterification
[19]Liu Q,Han F,Xie K,et al.Simultaneous determination of total fatty acid esters of chloropropanols in edible oils by gas chromatography-mass spectrometry with solid-supported liquid-liquid extraction[J].Journal of Chromatography A,2013,1314:208-215
[20]Hamlet CG,Asuncion L.Single-laboratory validation of a method to quantify bound 2-chloropropane-1,3-diol and 3-chloropropane-1,2-diol in foodstuffs using acid catalysed transesterification,HFBIderivatisation and GC/MS detection[J].European Journal of Lipid Science and Technology,2011,113(3):345-355
[21]Nagy K,Sandoz L,Craft BD,etal.Mass-defect filtering of isotope signatures to reveal the source of chlorinated palm oil contaminants[J].Food Additives&Contaminants Part A,Chemistry,Analysis,Control,Exposure& Risk Assessment,2011,28(11):1492-1500
[22]Destaillats F,Craft B D,Sandoz L,et al.Formation mechanisms ofmonochloropropanediol(MCPD)fatty acid diesters in refined palm(Elaeis guineensis)oil and related fractions[J].Food Additives&Contaminants Part A,Chemistry,Analysis,Control,Exposure&Risk Assessment,2012,29(1):29-37
[23]Matthäus B,Pudel F,Fehling P,et al.Strategies for the reduction of3-MCPD esters and related compounds in vegetable oils[J].European Journal of Lipid Science and Technology,2011,113(3):380-386
[24]Pudel F,Benecke P,Fehling P,et al.On the necessity of edible oil refining and possible sources of 3-MCPD and glycidyl esters[J].European Journal of Lipid Science and Technology,2011,113(3):368-373
[25]Shimizu M,Vosmann K,Matthaus B.Generation of 3-monochloro-1,2-propanediol and related materials from tri-,di-,and monoolein at deodorization temperature[J].European Journal of Lipid Science and Technology,2012,114(11):1268-1273
[26]Freudenstein A,Weking J,Matthaus B.Influence of precursors on the formation of 3-MCPD and glycidyl esters in a model oil under simulated deodorization conditions[J].European Journal of Lipid Science and Technology,2013,115(3):286-294
[27]Hrncirik K,van Duijn G.An initial study on the formation of3-MCPD esters during oil refining[J].European Journal of Lipid Science and Technology,2011,113(3):374-379
[28]Zulkurnain M,Lai O M,Latip R A,et al.The effects of physical refining on the formation of 3-monochloropropane-1,2-diol esters in relation to palm oilminor components[J].Food Chemistry,2012,135(2):799-805
[29]Rahn A K K,Yaylayan V A.What do we know about the molecularmechanism of 3-MCPD ester formation?[J].European Journal of Lipid Science and Technology,2011,113(3):323-329
[30]Rahn A K K,Yaylayan V A.Monitoring cyclic acyloxonium ion formation in palmitin systems using infrared spectroscopy and isotope labelling technique[J].European Journal of Lipid Science and Technology,2011,113(3):330-334
[31]Shimizu M,Weitkamp P,Vosmann K,et al.Influence of chloride and glycidyl-ester on the generation of 3-MCPD-and glycidyl-esters[J].European Journal of Lipid Science and Technology,2013,115(7):735-739
[32]Zhang X,Gao B,Qin F,et al.Free radicalmediated formation of 3-monochloropropanediol(3-MCPD)fatty acid diesters[J].Journal of Agricultural and Food Chemistry,2013,61(10):2548-2555
[33]Zelinkova Z,Svejkovska B,Velisek J,etal.Fatty acid esters of3-chloropropane-1,2-diol in edible oils[J].Food Additives and Contaminants,2006,23(12):1290-1298
[34]Craft BD,Nagy K,Sandoz L,et al.Factors impacting the formation ofmonochloropropanediol(MCPD)fatty acid diesters during palm(Elaeis guineensis)oil production[J].Food Additives&Contaminants Part A,Chemistry,Analysis,Control,Exposure&Risk Assessment,2012,29(3):354-361
[35]Ramli MR,Siew WL,Ibrahim NA,et al.Effects of degumming and bleaching on 3-MCPD esters formation during physical Refining[J].Journal of the American Oil Chemists'Society,2011,88(11):1839-1844
[36]Matthäus B,Pudel F.Mitigation of 3-MCPD and glycidyl esterswithin the production chain of vegetable oils especially palm oil[J].Lipid Technology,2013,25(7):151-155
[37]Zulkurnain M,LaiOM,Tan SC,etal.Optimization of palm oil physical refining process for reduction of3-monochloropropane-1,2-diol(3-MCPD)ester formation[J].Journal of Agricultural and Food Chemistry,2013,61(13):3341-3349
[38]Strijowski U,Heinz V,Franke K.Removal of3-MCPD esters and related substances after refining by adsorbentmaterial[J].European Journal of Lipid Science and Technology,2011,113(3):387-392
[39]Bornscheuer UT,Hesseler M.Enzymatic removal of 3-monochloro-1,2-propanediol(3-MCPD)and its esters from oils[J].European Journal of Lipid Science and Technology,2010,112(5):552-556.
Advances in 3-Monochloropropanol-1,2-diol Esters in Edible Oil
Jiao Bo Hu Hui Liu Hongzhi Liu Li Shi Aimin Wang Qiang
(Key Laboratory of Agro-Products Processing,Ministry of Agriculture/Institute of Agro-Food Science and Technology,Chinese Academy of Agricultural Sciences,Beijing 100193)
3-Monochloropropanol-1,2-diol esters belong to a kind of contaminants which can be formed during edible oil processing.Based on the analysis of the references of 3-monochloropropanol-1,2-diol esters,the paper summarized the study results of recent research conducted on the structures of chloropropanol esters,their levels and limitations in different countries and districts,the recent developed detection methods,chloride and lipid precursor,the formationmechanism,mitigation strategies in three phases including before,during and after refining.Meanwhile the existing problemswere analyzed and the direction and priority of research were also prospected to provide a foundation to improve the effective control on 3-monochloropropanol-1,2-diol esters during oil process and guarantee of oil safety.
3-monochloropropanol-1,2-diol esters,levels and limitation,detection methods,mechanism,mitigation strategies
TS221
A
1003-0174(2015)06-0140-07
时间:2015-06-17 07∶14
网络出版地址:http://www.cnki.net/kcms/detail/11.2864.TS.20150617.0714.001.html
国家科技支撑计划(2012BAD29B03),公益性(农业)行业科研专项(201303072),中国农业科学院科技创新工程(CAAS-ASTIP-201X-IAPPST)
2014-08-26
焦博,男,1989年出生,硕士,粮油加工与功能食品
王强,男,1965年出生,研究员,粮油加工与功能食品

