兔肉宰后成熟过程中肌原纤维蛋白功能性质的变化
张斌斌,李兴艳,夏杨毅,2,3,彭增起,尚永彪,2,3,*
(1.西南大学食品科学学院,重庆400716;2.农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆400716;3.重庆市特色食品工程技术研究中心,重庆400716;4.南京农业大学,农业部农畜产品加工与质量控制重点开放实验室,江苏南京210095)
兔肉宰后成熟过程中肌原纤维蛋白功能性质的变化
张斌斌1,李兴艳1,夏杨毅1,2,3,彭增起4,尚永彪1,2,3,*
(1.西南大学食品科学学院,重庆400716;2.农业部农产品贮藏保鲜质量安全评估实验室(重庆),重庆400716;3.重庆市特色食品工程技术研究中心,重庆400716;4.南京农业大学,农业部农畜产品加工与质量控制重点开放实验室,江苏南京210095)
以兔腿肉和兔背最长肌为原料,研究兔肉宰后成熟过程中pH变化趋势以及肌原纤维蛋白(MP)功能性质的变化规律。结果表明:宰后成熟过程中兔后腿和兔背最长肌的pH显著下降并分别在宰后24h和48h时达到极限pH,肌肉进入完全僵直状态,此时的兔肉加工品质较差;兔后腿和兔背最长肌MP的溶解度、乳化性及凝胶保水性等功能性质的变化规律与pH变化趋势一致,分别在宰后24h和48h达到最小值;而表面疏水性及凝胶的硬度均呈先上升后下降的趋势,且分别在宰后24h和48h达到最大值。通过对兔肉MP功能性质变化规律的分析并结合宰后成熟过程中理化性质的变化趋势,确定宰后合理的成熟时间为72h。
兔肉,宰后成熟,理化性质,肌原纤维蛋白,功能性质
随着生活水平的提高,人们对于肉类的需求更趋多样化。兔肉由于味道鲜美、营养价值高,需求量逐年上升。宰后成熟是指动物宰后肌肉的肉用品质及理化性质改变的过程,胴体逐渐由肌肉转变成可食用肉,宰后成熟是一种有效改善肉品质量的途径[1]。经过合理的成熟处理不仅可以改善肉的嫩度而且不会影响肉的品质和风味。不同种类肉的成熟时间不同,肉质的变化情况也有差异。肌原纤维蛋白是动物肌肉中非常重要的一种蛋白质,包括原肌球蛋白、肌动蛋白、肌球蛋白等,肌原纤维蛋白质性质的变化会影响其功能性质及肉制品的质构特性[2]。
目前,国内外对兔肉的研究集中在兔肉宰后理化性质、肉用品质及有害物质的检测方面,对肌原纤维蛋白功能性质的研究较少。Lambertini等[3]研究了运输时间对兔肉胴体肉用品质的影响,发现活体的重量下降,胴体pH降低;Macanga等[4]研究了不同捕捉方式下野生兔宰后肌肉中理化指标的变化,发现通过直接射击得到兔子肉质较好,野生兔子在运输期间产生的应激刺激对理化指标产生不利影响。本文以兔腿肉和兔背最长肌为原料,得出宰后成熟过程中不同部位肌原纤维蛋白功能性质的变化规律,这对我们了解兔肉的性质、改善兔肉的品质以及指导兔肉制品的加工具有一定的理论和实际意义。
1 材料与方法
1.1材料与仪器
原料兔为雌性伊拉兔,购买于西南大学种兔厂;EGTA、磷酸二氢钾、磷酸氢二钾、叠氮化钠、牛血清白蛋白、三氯乙酸、葡萄糖、硫酸钠、氢氧化钾、氯化钾、硼酸、硫酸铜、硫酸钾成都市科龙化工试剂厂;氢氧化钠、乙醇重庆北碚化学试剂厂;次甲基蓝、甲基红北京鼎国生物技术有限责任公司,以上均为分析纯;1,1,3,3—四乙氧基丙烷高级纯,上海研域生物科技有限公司。
PHS-4C+酸度计成都世纪方舟科技有限公司;Avanti J-30I冷冻离心机美国贝克曼库尔特公司;5810台式高速离心机德国Eppendorf公司;XHF-D内切式匀浆机宁波新芝生物科技股份有限公司;TA.XT2i质构仪英国stable micro system公司;HR-1流变仪美国TA公司;DSC 4000差式扫描量热仪美国PerkinElmer公司;DF8517超低温冰箱韩国ilshin公司;HH-6数显恒温水浴锅金坛市富华仪器有限公司。
1.2实验方法
1.2.1原料兔处理雌性伊拉兔饲养环境和饲料配方均相同,平均体重在2.5kg左右,65日龄。将不同部位的现宰兔肉切成一定规格的小块(30g左右),立刻进行真空包装。真空包装条件:约30g/袋,抽气时间30s,热合时间4s,真空度0.095MPa;包装袋规格:150mm×100mm,包装袋材料:聚乙烯包装袋。包装后立即将其放置在0~4℃的环境中贮藏使之成熟。
1.2.2pH的测定称取去除脂肪、结缔组织的肉样3g于50mL离心管中,加入10倍体积5mmol/L碘乙酸、150mmol/L氯化钾溶液(pH7.0),10000r/min高速匀浆30s,用酸度计测定其pH[5]。
1.2.3肌原纤维蛋白质的提取提取方法是在Xiong[6]的基础上作了改进。将肉样解冻,称取一定质量剔除结缔组织、脂肪的肉样,加入10倍体积冰、pH7.0的分离缓冲液A(10mmol/L K2HPO4,0.1mol/L KCl,2mmol/L MgCl2,0.5mmol/L DTT,1mmol/L EGTA),在0~4℃的条件下高速匀浆1min后过滤。然后在4℃、5500r/min下离心10min,倒掉上清液,取沉淀,重复3次,得到粗肌原纤维蛋白质。再加入4倍体积冰、pH6.25的分离缓冲液B(0.1mol/L NaCl,1mmol/L NaN3),充分溶解,制得悬浮液后离心10min,取沉淀,重复2次,再加入8倍体积冰的缓冲液B,充分溶解,制得悬浮液,最后离心10min,弃去上清液,剩余沉淀即为肌原纤维蛋白。
1.2.4肌原纤维蛋白质溶解性的测定参考Kingsley[7]的方法,取一定量的肌原纤维蛋白质沉淀,溶于一定体积的磷酸盐缓冲液(0.6mol/L NaCl,50mmol/L Na2HPO4),0~4℃的条件下,2000r/min分散均匀,使其充分溶解,分散过程中尽量避免产生气泡,制成蛋白质质量浓度为2.5mg/mL的溶液,然后在4℃条件下放置1h,取出后在4℃,5500r/min下离心15min,取上清液,用双缩脲法测定肌原纤维蛋白质的浓度。计算公式为:

1.2.5肌原纤维蛋白质乳化性的测定依据Agyare[8]的方法并做出修改。将一定量的肌原纤维蛋白质溶解在0.1mol/L磷酸盐缓冲溶液中,在0~4℃的条件下,2000r/min分散均匀,充分溶解,分散过程中尽量避免产生气泡,制取浓度为1mg/mL的肌原纤维蛋白溶液,取20.0mL与5.0mL大豆油混合,高速匀浆60s后立即从距离心管底0.5cm的地方取乳浊液50μL,加入到5mL、0.1%SDS溶液中,振荡混匀后静置10min,用紫外分光光度计在500nm波长处测定吸光值记作A500,空白为0.1%SDS溶液。乳化活性指数(EAI)计算式为:

式中:A500—为500nm波长处的吸光值;φ—油相体积分数(油的体积/乳浊液的体积);ρ—蛋白质质量浓度,g/mL;稀释倍数—101。
1.2.6肌原纤维蛋白质表面疏水性的测定参照Chelh[9]的方法并作改进,制取浓度为5mg/mL的肌原纤维蛋白样液,取1mL样液和200μL 1mg/mL溴酚蓝于离心管中,在室温下摇动10min,然后在8000r/min下离心10min,取上清液稀释10倍后在595nm下测定吸光值A,以磷酸盐缓冲液做空白,表面疏水性计算公式为:

1.2.7肌原纤维蛋白质热力学性质的测定根据Tahergorabi[10]的方法并作调整。制取质量浓度为40mg/mL肌原纤维蛋白,取一定质量的样品于铝制金属小罐内,密封,然后放在DSC测定仪的试样室内。先在20℃下平衡1min,然后以10℃/min的速度升温至95℃,测定热流量变化曲线,通过软件计算出焓值。
1.2.8肌原纤维蛋白质流变学性质的测定依据Westphalen[11]的方法并做修改,制取质量浓度为15mg/mL的肌原纤维蛋白溶液。样品以1℃/min的速度从20℃加热至85℃,在85℃保持3min,然后以5℃/min的速度从85℃冷却至5℃,狭缝gap:0.5mm。擦干暴露在外面的样品并用凡士林密封,以免样品在加热过程中蒸干。
1.2.9肌原纤维蛋白质热诱导凝胶的制备参照Doerscher[12]的方法并作改进,取一定量的肌原纤维蛋白沉淀,加入一定体积的磷酸盐缓冲液(0.02mol/L、pH7.0磷酸盐缓冲液),制取质量浓度为40mg/mL的肌原纤维蛋白溶液,然后取6mL样液于离心管中,置于水浴锅中,温度以1℃/min的速度从0℃升温至70℃,保持20min,取出快速冷却至4℃。
1.2.9.1肌原纤维蛋白质热诱导凝胶强度的测定利用质构仪的Texture Profile Analysis(TPA)测定肌原纤维蛋白凝胶的硬度。质构仪的设置参数如下[13]:探头类型:P5,以P5探头穿刺形式测试样品得到的最大峰值力;测前速度:1mm/s;测定速度:0.5mm/s;测后速度:1mm/s;压缩比:50%;触发类型:auto;数据攫取速率:200pps;停留时间:5s。
1.2.9.2肌原纤维蛋白质热诱导凝胶保水性的测定参照Kocher[14]的方法并作调整,测定前先将凝胶试样从4℃条件下取出,在室温下放置2h,称重m,放置于离心管中,4℃、5000r/min离心15min,去除离心出的水,将离心管倒置于滤纸上方,将凝胶取出后,称重m1。计算公式为:

式中:m1—离心后凝胶的重量,g;m—离心前凝胶的重量,g。
1.3数据处理
每个实验重复3次。数据用Microsoft Office 2007的Excel软件进行处理,得出平均数和标准偏差,采用Originpro 8.5软件作图,再用SPSS Statistics 17.0软件对数据进行差异显著性分析,显著性差异值为p<0.05。
2 结果与分析
2.1宰后成熟过程中不同部位兔肉pH的变化
从图1中可以看出,兔后腿和兔背最长肌的pH随宰后成熟时间的延长呈先下降后上升的趋势。在成熟过程中,兔后腿的pH大于兔背最长肌的且2部位间pH的差异表现为极显著(p<0.01)。
宰后成熟过程中,兔肉的pH呈显著(p<0.05)下降的趋势,原因是由于动物宰杀后肌肉组织内的需氧性生化反应终止,ATP分解产生磷酸根离子和肌糖原无氧酵解产生乳酸。此后pH不再下降,这是因为肌糖原无氧酵解过程中的酶失活,肌糖原不再分解同时不再产生乳酸。成熟后期,肉中微生物开始缓慢生长,在微生物和酶的双重作用下,肉中部分蛋白质和含氮化合物开始缓慢分解,并产生碱性的含氮物质并积累导致了pH缓慢增加。此实验结果与刘佳东[15]在研究宰后牦牛肉成熟机理及肉用品质变化、熊国远[16]在研究贮藏温度对兔肉品质变化的影响时得出的pH变化趋势一致。
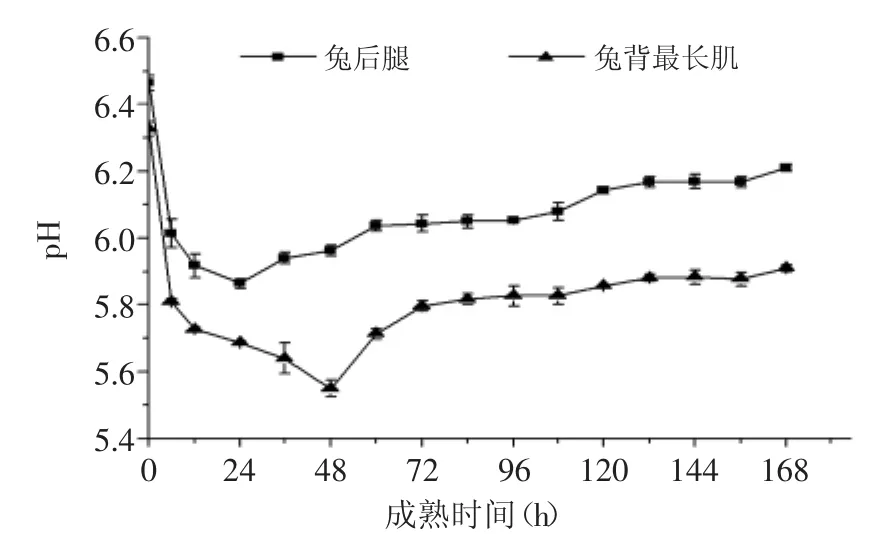
图1 宰后成熟过程中不同部位兔肉pH的变化Fig.1 Changes in pH of rabbit meat from different anatomical positions during postmortem aging
2.2宰后成熟过程中不同部位兔肉肌原纤维蛋白溶解度的变化
从图2中可以看出,兔后腿和兔背最长肌中肌原纤维蛋白(MP)的溶解度随着宰后成熟时间的延长整体呈先下降后上升的趋势,兔背最长肌中MP的溶解度大于兔后腿。兔后腿中MP的溶解度在宰后0~24h之间显著下降(p<0.05)至最小值35.5%,此后随着成熟时间的增加,MP的溶解度逐渐增加;兔背最长肌中MP的溶解度在宰后0~48h之内显著下降(p<0.05)至最小值68.86%,此后随着成熟时间的延长,MP的溶解度逐渐增加。

图2 宰后成熟过程中不同部位兔肉肌原纤维蛋白溶解度的变化Fig.2 The changes of myofibrillar protein solubility in rabbit meat from different anatomical positions during postmortem aging
宋玉[17]研究雪山草鸡在成熟过程中肌原纤维蛋白溶解度变化时,发现肌原纤维蛋白溶解度呈现先降后升的趋势。因所用材料等不同,使得有的研究与本实验结果在数值上有一定的差别,但总体变化趋势一致。肉蛋白质溶解度反映了蛋白质的变性程度,且与肉的嫩度呈正相关。肌原纤维蛋白在宰后成熟初期发生了变性聚集,蛋白空间结构发生改变,疏水基团暴露并发生聚集,使得蛋白质之间的作用增强,蛋白质和水分子间的作用力减弱,溶解度下降,肉的加工性能变差[18-19]。随着成熟时间的延长,肌原纤维蛋白中的肌动蛋白、肌球蛋白作用所形成的肌动球蛋白容易被解离,生成小分子蛋白,与水分子相互作用增强,溶解度也随之增大。

图3 宰后成熟过程中不同部位兔肉肌原纤维蛋白乳化活性的变化Fig.3 The changes of myofibrillar protein emulsifying activity in rabbit meat from different anatomical positions during postmortem aging
2.3宰后成熟过程中不同部位兔肉肌原纤维蛋白乳化性的变化
从图3可以看出,兔后腿和兔背最长肌中MP的乳化活性指数随着宰后成熟时间的延长先减小后增大,其中兔后腿和兔背最长肌中MP的乳化活性指数在成熟144h及168h时大小差异不显著(p>0.05),而在其他成熟时间点处差异显著(p<0.05)。兔后腿中MP的乳化活性指数在宰后0~24h之间显著降低(p<0.05),此后随着成熟时间的增加,MP的乳化活性指数呈逐渐上升的趋势(p>0.05);兔背最长肌中MP的乳化活性指数在宰后0~48h之内显著降低(p<0.05),此后MP的乳化活性指数随着成熟时间的延长而逐渐升高。
蛋白质的乳化性和溶解度呈正相关[20]。兔后腿和兔背最长肌中MP的乳化活性指数分别在宰后0~24h和0~48h显著下降,这与前期研究溶解度的变化趋势一致。肌原纤维蛋白的溶解性下降,蛋白凝聚,肌原纤维蛋白的乳化性随之降低;当溶解度最小时,蛋白质在油-水界面上的吸附也最少,以至于乳化活性最差[21];随后成熟过程中,蛋白质的溶解度增加,蛋白迅速扩散并吸附在表面上,以至于此阶段乳化活性指数升高。
2.4宰后成熟过程中不同部位兔肉肌原纤维蛋白表面疏水性的变化
从图4中可以看出,兔后腿和兔背最长肌中MP的表面疏水性随着宰后成熟时间的延长呈先升高后下降的趋势。其中在成熟0、48、168h时,2部位间兔肉MP的表面疏水性大小差异显著(p<0.05),而在其他成熟时间点处差异不显著(p>0.05)。兔后腿和兔背最长肌中MP的表面疏水性分别在宰后0~24h和0~48h内显著升高(p<0.05),此后随着成熟时间的延长两部位中MP的疏水性都呈下降的趋势,且MP疏水性的大小都分别在48~72h及120~144h两个成熟时间段内差异显著(p<0.05),在其他成熟时间点时差异不显著(p>0.05)。

图4 宰后成熟过程中不同部位兔肉肌原纤维蛋白表面疏水性的变化Fig.4 The changes of myofibrillar protein hydrophobicity in rabbit meat from different anatomical positions during postmortem aging
表面疏水性也是衡量蛋白质功能性质的一个重要指标,能够显著影响蛋白质其他功能性质[22]。兔后腿和兔背最长肌中MP的表面疏水性分别在宰后24h和48h内显著升高,可能是由于宰后兔肉的蛋白质的溶解性较差,因为蛋白质的溶解性与其表面疏水性呈负相关,所以其疏水性较大;还可能是因为蛋白质的分子结构发生改变,内部的疏水基团暴露,进而增加了疏水性。MP的表面疏水性在成熟72~168h期间逐渐升高又降低是由于肌原纤维蛋白随着成熟的进行而被降解,蛋白质内部的疏水性基团逐渐暴露,使得表面疏水性增大;疏水性末端随着降解程度的增大而不断暴露,致使体系中的肽键可能通过疏水相互作用发生聚集,导致表面疏水性下降。
2.5宰后成熟过程中不同部位兔肉肌原纤维蛋白热转变温度的变化
蛋白质的热力学性质可以通过对蛋白质DSC(差式热量扫描)的测定来呈现[23],通过测量蛋白变性时的热量,直观反映蛋白的变性过程。从表1中可知,温度从20℃升至90℃,兔后腿和兔背最长肌中肌原纤维蛋白DSC扫描分别发现了2个焓变点,其中两部位间肌原纤维蛋白的第一个焓变点分别在成熟48h和96h时差异显著(p<0.05),第二个焓变点分别在成熟24h时差异显著(p<0.05)。结果表明:兔后腿和兔背最长肌中肌原纤维蛋白的第一个变性温度分别在宰后0~24h及0~48h有所降低,说明肌球蛋白的性质发生了变化,再结合MP溶解性的分析结果,可以得出肌球蛋白的热稳定性下降。此后肌球蛋白的变性温度有所升高,可能是由于蛋白质间的静电斥力增大,蛋白质间作用力及二级结构稳定,需要更多的热量使其变性。兔背最长肌中第二个变性温度变化不显著(p>0.05),说明宰后肌肉中的肌动蛋白稳定。因此,可以得出本实验中的2个焓变点是肌球蛋白变性引起的,肌球蛋白在该温度附近的变性是导致理化特性迅速下降的原因[24]。
2.6宰后成熟过程中不同部位兔肉肌原纤维蛋白流变学性质的变化
储能模量(G′)是衡量蛋白凝胶能力的一个重要指标,G′值高意味着凝胶能力强。从图5、图6可以看出:在不同成熟时间点处,兔后腿肉和兔背长肌肌原纤维蛋白G′的变化趋势基本一致。在升温过程中肌原纤维蛋白的G′达到第一个峰值(最大值)时,表明黏性溶胶开始向弹性凝胶结构变化,肌球蛋白开始交联[25];G′随着温度的升高降低至最小值,因为在这个温度范围内兔肉中活性较高的内源性蛋白酶分解肌球蛋白,凝胶的结构受到破坏[26];肌动蛋白和肌球蛋白发生了解离;促进凝胶形成的疏水作用下降[27];随着温度升高,MP在温度超过55℃时开始发生变性,形成了复杂的凝胶结构,使得G′再一次开始上升。G′的增加反映了肌原纤维蛋白凝胶的逐渐形成,在85℃时,兔腿肉中MP的G′在24h时最大,兔背最长肌中MP的G′在48h时最大。这与MP最大凝胶强度的成熟时间点一致。

表1 宰后成熟过程中不同部位兔肉肌原纤维蛋白热转变温度的变化Table.1 The changes of myofibrillar protein heat transition temperature in rabbit meat from different anatomical positions during postmortem aging

图5 宰后成熟过程中兔后腿肉肌原纤维蛋白储能模量(G′)的变化Fig.5 The changes of myofibrillar protein elastic modulus(G′)in rabbit rear legs during postmortem aging

图6 宰后成熟过程中兔背最长肌肌原纤维蛋白储能模量(G’)的变化Fig.6 The changes of myofibrillar protein elastic modulus(G’)in rabbit longissmus during postmortem aging
兔腿肉和兔背最长肌MP的G′分别在24h和48h时达到最大,表明在该时间点形成凝胶的能力最强;兔背最长肌中MP的G′要大于兔后腿中MP的G′,说明兔背最长肌中MP的凝胶性能较好,主要与其化学键的形成和蛋白质的空间结构有关。本实验结果与熊雄等[28]在研究鳙鱼宰后冰藏期间其盐溶蛋白流变学特性的变化趋势一致。
2.7宰后成熟过程中不同部位兔肉肌原纤维蛋白凝胶特性的变化
从图7中可以看出,兔后腿和兔背最长肌中MP热诱导凝胶硬度随着宰后成熟时间的延长呈先上升后下降的趋势,分别在宰后24、48h时达到最大值。

图7 宰后成熟过程中不同部位兔肉肌原纤维蛋白热诱导凝胶硬度的变化Fig.7 The changes of myofibrillar protein heat-induced gel hardness in rabbit meat from different anatomical positions during postmortem aging
从图8中可以看出,兔后腿和兔背最长肌中MP热诱导凝胶的保水性随着宰后成熟时间的延长呈先下降后上升的趋势。分别在宰后24、48h内显著降低至最小值。
肌原纤维蛋白的凝胶特性主要由凝胶的保水性和凝胶强度组成。分子间排斥力减弱、热诱导下网络收缩增强、凝胶强度增强、水分由于过分收缩而被压出使得持水力下降,因而使凝胶的空间结构更加牢固,肌原纤维蛋白的凝胶强度就会增强[13]。在随后解僵成熟过程中,蛋白质分子间的相互作用减弱,而蛋白质与水分子之间的吸引力被加强,蛋白质的溶解度增大,凝胶保水性增大[29]。

图8 宰后成熟过程中不同部位兔肉肌原纤维蛋白热诱导凝胶保水性的变化Fig.8 The changes of myofibrillar protein heat-induced gel water-holding capacity in rabbit meat from different anatomical positions during postmortem aging
3 结论
兔肉宰后成熟过程中,pH发生了显著的变化(p<0.05),兔后腿和兔背最长肌的pH分别在宰后24h和48h时达到最低,肌肉进入完全僵直状态,此时的兔肉加工品质较差。通过分析兔肉宰后成熟过程中肌原纤维蛋白功能性质的变化规律,得出兔后腿和兔背最长肌MP的溶解度、乳化性及凝胶保水性等功能性质的变化规律与pH变化趋势一致,分别在宰后24h和48h达到最小值;而表面疏水性及凝胶的硬度均呈先上升后下降的趋势,且分别在宰后24h和48h达到最大值;兔后腿和兔背最长肌中肌原纤维蛋白DSC扫描分别发现了2个焓变点,第一个焓变点分别在成熟48h和96h时差异显著,第二个焓变点分别在成熟24h时差异显著;兔后腿肉和兔背长肌肌原纤维蛋白储能模量(G′)的变化趋势在不同成熟时间点处基本一致,并分别在24h和48h时达到最大。
蛋白质的功能性质与其空间结构密切相关,宰后成熟过程中肌原纤维蛋白的结构发生了变化,进而影响到其功能性质。肌原纤维蛋白质的功能性质(溶解性、乳化性、持水性及凝胶性等)是决定肉制品品质的关键因素之一[30]。兔肉成熟过程中肌原纤维蛋白的功能性质及成胶能力等随着僵直和解僵的变化而改变,这些变化与风味等变化规律是一致的。兔肉进入解僵成熟阶段(72h前),其肉质变软,保水性、挥发性风味物质(如醛类、酮类、酯类)等都增加,适于深加工[31],结合兔肉宰后成熟过程中肌原纤维蛋白功能性质的变化规律,确定宰后合理的成熟时间为72h。
[1]Kristensen L,Purslow P P.The effect of ageing on the waterholding capacity of pork:role of cytoskeletal proteins[J].Meat Science,2001,58(1):17-23.
[2]游远,彭晓蓓,杨玉玲,等.鸡肉肌原纤维蛋白静态流变特性的研究[J].食品工业科技,2013,34(1):102-104.
[3]Lambertini L,Vignola G,Badiani A,et al.The effect of journey time and stocking density during transport on carcass and meat quality in rabbits[J].Meat Science,2006,72(4):641-646.
[4]Martinez-Cerezo S,Sanudo C,Panea B,et al.Breed,slaughter weight and ageing time effects on physico-chemical characteristics of lamb meat[J].Meat Science,2005,69(2):325-333.
[5]朱学伸.动物宰后肌肉成熟期间乳酸含量与pH的变化[D].南京:南京农业大学,2007.
[6]Xiong Y L,Lou X Wang C,et al.Protein extraction from chicken myofibrils irrigated with various polyphosphate and nacl solutions[J].Journal of Food Science,2000,65(1):96-100.
[7]Kingsley K A,Xiong Y L,Kwaku A.Influence of salt and pH on the solubility and structural characteristics of transglutaminasetreated wheat gluten hydrolysate[J].Food Chemistry,2008,107(3):1131-1137.
[8]Agyare K K,Addo K,Xiong Y L.Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH,temperature and salt[J].Food Hydrocolloids,2009,23(1):72-81.
[9]Chelh L,Gatellier P,Sante-lhoutellier V.Technical note:A simplified procedurefor myofibril hydrophobicity determination[J]. Meat Science,2006,74(4):681-683.
[10]Tahergorabi R,Sivanandan L,Jaczynski J.Dynamic rheology and endothermic transitions of proteins recovered from chickenmeat processing by-products using isoelectric solubilization/ precipitation and addition of TiO2[J].LWT-Food Science and Technology,2012,46(1):148-155.
[11]Westphalen A D,Briggs J L,Lonergan S M.Influence of muscle type on rheological properties of porcine myofibrillar protein during heat-induced gelation[J].Meat Science,2006,72(4):697-703.
[12]Doerscher D R,Briggs J L,Lonergan S M.Effects of pork collagen on thermal and viscoelastic properties of purified porcine myofibrillar protein gels[J].Meat Science,2003,66(1):181-188.
[13]陈文博.肌原纤维蛋白热诱导凝胶形成机制研究[D].南京:南京农业大学,2010.
[14]Kocher P,Foegeding E.Microcentrifuge-based method for measuring water-holding of protein gels[J].Journal of Food Science,1993,58(5):1040-1040.
[15]刘佳东.宰后牦牛肉成熟机理及肉用品质变化研究[D].兰州:甘肃农业大学,2011.
[16]熊国远,朱秀柏,徐幸莲.贮藏温度对兔肉品质变化的影响[J].食品与发酵工业,2007,33(6):158-164.
[17]宋玉.不同品种鸡肉成熟过程中品质特性比较研究[D].南京:南京农业大学,2011.
[18]Benjakul S,Bauer F.Physicochemical and enzymatic changesof cod muscle proteins subjected to different freeze-thaw cycles [J].Journal of the Science of Food and Agriculture,2000,80(8):1143-1150.
[19]王耀耀,朱蓓薇,董秀萍,等.鲍鱼腹足肌原纤维蛋白的组成及其性质[J].大连工业大学学报,2011,30(3):183-186.
[20]郭浩楠,杨荣华,袁晓晴,等.鲢鱼蛋白的酶解及其酶解物功能性质的研究[J].中国食品学报,2010,10(4):106-112.
[21]阚建全.食品化学[M].北京:中国农业大学出版社,2003:7.
[22]王辰,江连洲,魏冬旭,等.不同品种大豆分离蛋白结构与表面疏水性的关系[J].食品科学,2012,33(9):54-57.
[23]师伟伟,华欲飞.豌豆粉丝厂废水中蛋白质的提取和性质研究[J].食品工业科技,2014,35(1):120-124.
[24]潘锦锋,沈慧星,尤娟,等.草鱼肌原纤维蛋白加热过程中理化特性的变化[J].中国农业大学学报,2009(6):17-22.
[25]Takahashi A.Calcium-induced Weakening of skeletal muscle Z-disks in Postmortem skeletal muscle[J].Biolchemistry,1982,101:76.
[26]Ryoichi T,Ryuichi T K,Koui T.Purification and characterization of the l200kDasubfragmentofconnection filaments Produced by 0.1mM calcium ions[J].Biolchemistry,1994,115:351-355.
[27]Chen L,Feng X C,Lu F,et al.Effects of camptothecin,etoposide and Ca2+on caspase-3 activity and myofibrillar disruption of chicken during postmortem ageing[J].Meat Science,2011,87(3):165-174.
[28]熊雄,彭增起,靳红果,等.鳙鱼宰后pH和僵直指数的变化及其对盐溶蛋白凝胶特性的影响[J].食品科学,2012,33(9):87-90.
[29]Xiong Y L,Brekke C J.Changes in protein solution solubility and gelations of chicken myofibrils during storages[J].Journal of Food Science,1989,54(4):1141-1146.
[30]孙金辉.冻藏、反复冻融及解冻方式对兔肉品质的影响[D].重庆:西南大学,2013.
[31]李兴艳.兔肉宰后成熟过程中理化性质、肉用品质及肌原纤维蛋白功能性质的研究[D].重庆:西南大学,2014.
Changes of myofibril protein functional properties during rabbit postmortem aging
ZHANG Bin-bin1,LI Xing-yan1,XIA Yang-yi1,2,3,PENG Zeng-qi4,SHANG Yong-biao1,2,3,*
(1.College of Food Science,Southwest University,Chongqing 400716,China;2.Quality and Safety Risk Assessment Laboratory of Products Preservation(Chongqing),Ministry of Agriculture,Chongqing 400716,China;3.Chongqing Special Food Programme and Technology Research Center,Chongqing 400716,China;4.Key Laboratory of Agricultural and Animal Products Processing and Quality Control,Ministry of Agriculture,Nanjing Agricultural University,Nanjing 210095,China)
Rabbit longissimus dorsi muscle and leg meat were used as the raw material to investigate the changing trends of pH and variation regulation of myofibril protein(MP)functional properties during rabbit postmortem aging.The results showed that:during rabbit postmortem aging,the pH of rabbit longissimus dorsi muscle and leg meat significantly decreased and respectively reached the limits pH at 24h and 48h during rabbit postmortem aging,muscles into full stiff state,at this time the rabbit meat processing quality was poor. The variation regulation on solubility,emulsification,gel water-holding capacity of rabbit longissimus dorsi muscle and leg meat MP was consistent with pH trends,respectively reached a minimum value in post-mortem 24h and 48h.But surface hydrophobicity and gel hardness were increased first and then decreased,and in post-mortem 24h and 48h reached a maximum value respectively.By analyzing the variation regulation of the functional properties of rabbit MP,and combining the changes of physical and chemical properties during rabbit postmortem aging,determined a reasonable mature time after postmortem was 72h.
rabbit;postmortem aging;physical and chemical properties;myofibrillar protein;functional properties
TS251.54
A
1002-0306(2015)04-0105-07
10.13386/j.issn1002-0306.2015.04.014
2014-06-03
张斌斌(1989-),男,硕士研究生,研究方向:食品安全与质量控制。
尚永彪(1964-),男,博士,教授,研究方向:农产品加工。
(国家)公益性行业(农业)科研专项(201303144)。

