一株产纤溶酶放线菌YY21的生理生化特征和抑菌活性研究
邓永平,刘晓兰,*,韩 杨,郑喜群,艾瑞波(.齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔6006;2.黑龙江省普通高校齐齐哈尔农产品加工重点实验室,黑龙江齐齐哈尔6006)
一株产纤溶酶放线菌YY21的生理生化特征和抑菌活性研究
邓永平1,2,刘晓兰1,2,*,韩杨1,郑喜群1,2,艾瑞波1
(1.齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔161006;2.黑龙江省普通高校齐齐哈尔农产品加工重点实验室,黑龙江齐齐哈尔161006)
研究一株产胞外纤溶酶的中度嗜酸放线菌YY21,该菌株在GYM和PDA培养基上可以产生基内菌丝和气生菌丝,气生菌丝分化成波曲状孢子丝,孢子呈球形;菌株适宜的生长pH范围为3~7,可以向细胞外分泌蛋白酶、淀粉酶,可以分解含硫氨基酸产生硫化氢,不能产生胞外纤维素酶;能够利用葡萄糖和棉子糖作为碳源;液体培养3d后培养液对大肠杆菌有较显著的抑菌效果,抑菌圈直径达到了36.2mm,培养液中含纤溶酶,在血纤维蛋白平板上溶圈面积可达99.37mm2。
放线菌,纤溶酶,抑菌,生理生化特征
血栓栓塞性疾病严重威胁人类生命和健康,溶栓疗法效果显著。人们在针对原有溶栓药物的弊端进行改造的同时,还在不断探寻新型、高效、特异、廉价的溶栓剂[1]。微生物易于培养、代谢产物种类多,而且生长条件可人为控制,因而成为开发新型溶栓剂的主要来源。
目前已见报道的有源自细菌的链激酶(SK)[2]、葡激酶(SaK)[3]、纳豆激酶(NK)[4]、枯草激酶(CK)[5]等,源自好食脉孢霉[6]、根霉[7]、镰刀霉[8]、枯青霉[9]等霉菌的纤溶酶,源自蛹虫草[10]、金针菇[11]等大型真菌的纤溶酶,以及源自链霉菌[12]的纤溶酶。
嗜酸放线菌(Acidophilic actinomycetes)广泛分布于酸性环境中,可以产生耐酸的胞外酶,如几丁质酶、蛋白酶、淀粉酶等,在酸性土壤有机物的降解循环中起着重要作用。此外,由于大多数真菌适宜于酸性环境中生存,所以嗜酸放线菌也是极具潜力的抗真菌活性物质的产生者[13]。从嗜酸放线菌的代谢产物中开发新的天然生物活性物质,对新型药物的开发具有重要意义。本文报道了一株产胞外纤溶酶的中度嗜酸放线菌的生理生化特征及抑菌活性,以期获得能够联产纤溶活性物质及抑菌活性物质的菌株。
1 材料与方法
1.1材料与仪器
纤溶酶产生菌为中度嗜酸放线菌菌株YY21(Actinomycete sp.),保藏号CGMCC No.5816;枯草芽胞杆菌(Bacillus subtilis)D-03、金黄色葡萄球菌(Staphylococcus aureus)W18、大肠杆菌(Escherichia coli)W06-1、产气肠杆菌(Enterobacter aerogenes)W21、酿酒酵母(Saccharomyces cerevisiae)、黑曲霉(Aspergillus niger)YY-12由齐齐哈尔大学食品科学与工程学院菌种保藏实验室提供;牛血纤维蛋白原、牛凝血酶为中国医学科学院天津血研所产品;其余试剂均为国产分析纯;GYM固体培养基葡萄糖0.4%,酵母膏0.4%,麦芽浸膏1%,碳酸钙0.1%~0.2%,琼脂1.8%,pH6.7;GYM液体培养基葡萄糖0.4%,酵母膏0.4%,麦芽浸膏1%,碳酸钙0.1%~0.2%,pH6.7;碳源利用实验基础培养基KH2PO40.238%,K2HPO40.565%,MgSO4·7H2O 0.1%,CuSO4·5H2O 0.00064%,FeSO4·7H2O0.00011%,MnCl2·H2O 0.00079%,ZnSO4·7H2O 0.00015%,琼脂1.5%,pH6.8~7.0,121℃高压灭菌20min。
PYX-DHS型隔水式电热恒温培养箱上海跃进医疗器械厂;pHS-25型酸度计上海精密科学仪器有限公司;himac CF15RX型冷冻离心机天美科学仪器有限公司;Nikon 50i型生物显微镜尼康公司。
1.2实验方法
1.2.1菌株YY21形态特征
1.2.1.1细胞形态观察采用插片法培养菌株YY21,压印法观察菌株YY21形态。
1.2.1.2菌种的培养特征将菌株YY21分别接种于高氏一号培养基、察氏培养基、GYM培养基、PDA培养基中,28℃培养6~15d,观察菌落特征变化。高氏一号培养基、察氏培养基、PDA培养基培制方法参照沈萍[14]。
1.2.2菌株YY21生理生化特征
1.2.2.1最适生长pH测定将菌株YY21接入不同pH(分别为3.0、4.0、5.0、6.0、7.0、8.0)的GYM琼脂平板中,于28℃培养箱中培养6~10d,观察菌株生长情况。
1.2.2.2菌株生化特性测定将菌株YY21分别接入明胶培养基、脱脂牛奶培养基、淀粉培养基、纤维素培养基、硫化氢实验培养基,在28℃下培养一定时间后观察实验结果。培养基配制方法参照沈萍[14]。
1.2.2.3碳源利用实验基础培养基灭菌后分别加入过滤灭菌的10%碳素化合物溶液,使其最终浓度为1%(供试碳源包括:葡萄糖、蔗糖、木糖、甘露糖、果糖、肌醇、阿拉伯糖、棉子糖),充分混匀后分装到灭菌试管中,每管含5mL培养液,将菌株YY21孢子悬液分别等量接种于各个试管中,以未接菌的作为对照,置28℃静止培养一定时间,观察并记录结果[15]。
1.2.3抑菌实验将YY21菌株接种至GYM培养液中,培养一定时间后取样,测定样品的抑菌活性。参照沈萍[14],采用滤纸片法测定抑菌活性。
1.2.4纤溶酶活力的测定参照Liu的方法[16],采用血纤维蛋白平板法测定纤溶酶活力。
2 结果与讨论
2.1菌株YY21形态特征
2.1.1放线菌菌株YY21的细胞形态放线菌菌株YY21的菌丝形态及孢子形态分别见图1和图2。由图1和图2可以看出,菌丝有大量分支,不断裂,气生菌丝分化形成波曲状孢子丝,孢子呈圆形,表面光滑。
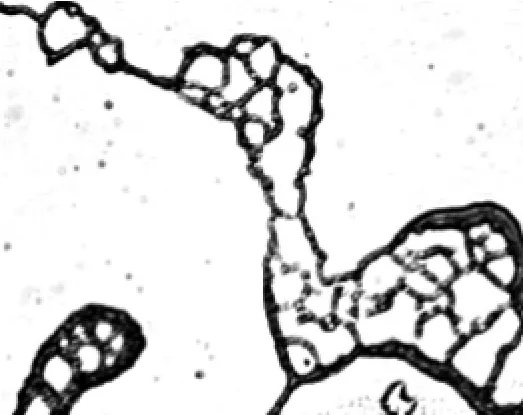
图1 放线菌菌株YY21的菌丝形态(200×)Fig.1 The hypha of the strain YY21(200×)
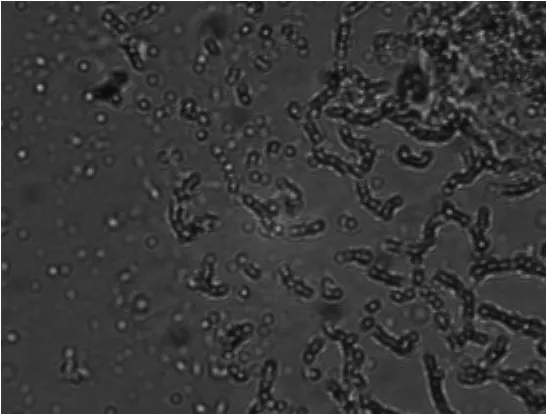
图2 放线菌菌株YY21孢子形态(400×)Fig.2 The spores of the strain YY21(400×)
2.1.2放线菌菌株YY21的培养特征菌株YY21在不同培养基上生长情况分别见图3~图5,其培养特征如表1所示。实验结果表明该菌在GYM培养基和PDA培养基上长势良好,其中GYM培养基上生长较快,培养3d菌落即铺满平板表面,菌落边缘呈明显的放射状,表面粗糙,产生大量孢子。PDA平板培养3d时菌落表面光滑,孢子产量较少。该菌在高氏一号及察氏培养基上生长速度较慢,分别在5d和7d后菌落长满平板表面。

图3 放线菌菌株YY21在GYM培养基上生长情况Fig.3 Cultural characteristics of the strain YY21 in GYM medium
2.2菌株YY21生理生化特征
2.2.1菌株的最适生长pH在28℃条件下于GYM培养基中培养菌株YY21 6~10d,根据菌落大小,基内菌丝、气生菌丝及孢子丝的茂盛程度判断其生长状况,结果如表2所示。表2结果表明,放线菌YY21菌株在环境pH范围为3~7时都可以生长,pH为4~6时生长良好,pH为5时长势最好,菌丝繁茂,确定最适生长pH为5,初步判断菌株YY21为中度嗜酸的放线菌。
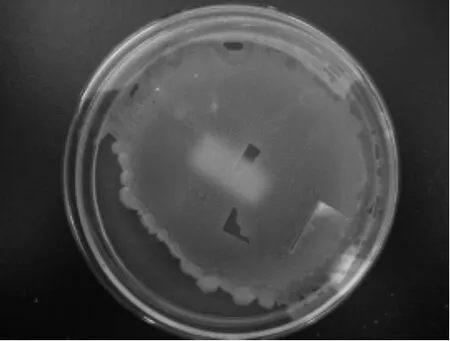
图4 菌株YY21在PDA培养基上生长情况Fig.4 Cultural characteristics of the strain YY21 in PDA medium
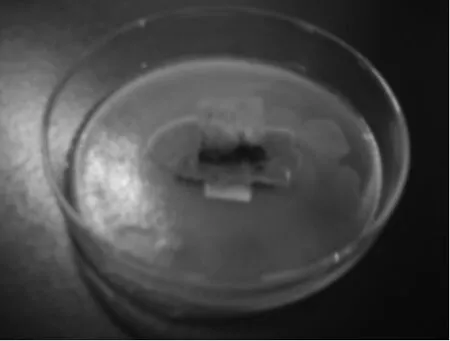
图5 菌株YY21在察氏培养基上生长情况Fig.5 Cultural characteristics of the strain YY21 in czapek’s medium

表1 放线菌菌株YY21培养特征Table.1 Cultural characteristics of the strain YY21
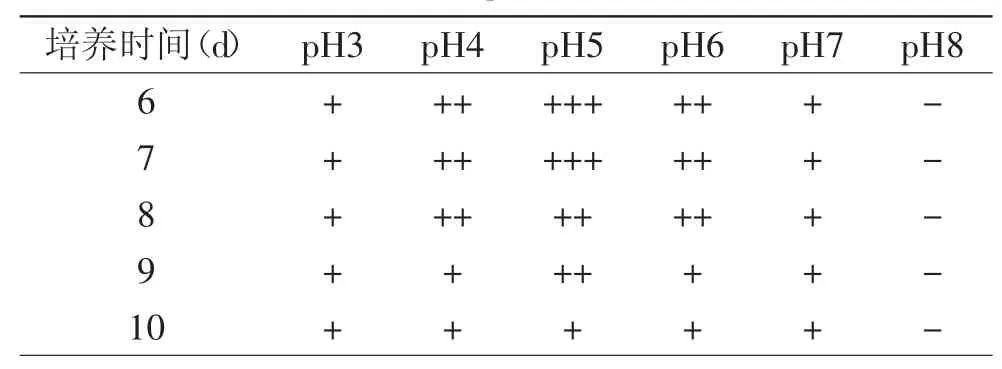
表2 pH对菌株YY21生长的影响Table.2 The effect of pH values on strain YY21
2.2.2菌株的生理生化特性放线菌YY21菌株的生化实验结果见表3。表3结果表明,菌株可以使明胶液化,也可以使牛奶先凝固后胨化,说明该菌能够向细胞外分泌蛋白酶;菌株能够水解淀粉,说明其可以向细胞外分泌淀粉酶;该菌株可以分解含硫氨基酸产生硫化氢;该菌株不能分解纤维素培养基中的滤纸,说明不能产生胞外纤维素酶。

表3 放线菌YY21菌株的生化实验结果Table.3 Physiological features and carbon-source utilization of the strain YY21
2.2.3菌株对碳源的利用情况菌株对碳源利用的实验结果见表4。表4结果表明,放线菌YY21能够利用葡萄糖和棉子糖作为碳源,不能利用实验范围内的其他碳源。

表4 放线菌YY21菌株对碳源的利用情况Table.4 Physiological features and carbon-source utilization of the strain YY21
2.3菌株YY21抑菌实验
采用滤纸片法检测放线菌YY21菌株培养液是否具有抑菌作用,实验结果如表5所示,表5结果表明,该放线菌YY21菌株对革兰氏阳性菌枯草芽胞杆菌及金黄色葡萄球菌没有抑菌作用,但是抑制革兰氏阴性菌大肠杆菌效果明显,第5d培养液的抑菌圈直径达到36.2mm。推测菌株YY21代谢产物的抑菌作用位点可能是细菌细胞壁[17]。
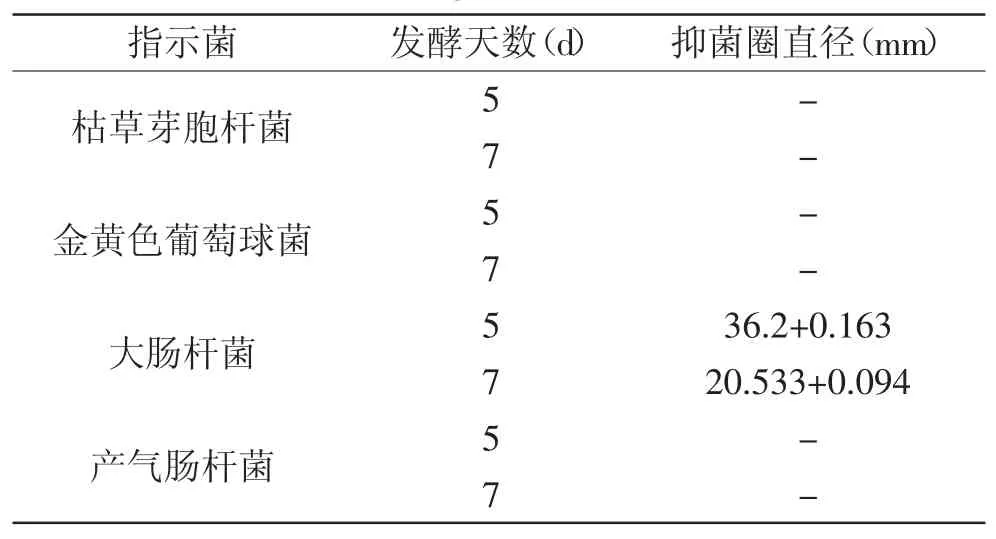
表5 菌株YY21发酵液抑菌效果Table.5 Inhibition activity of fermentation broth of the strain YY21 against bacteria
该菌株生长曲线如图6所示,在GYM培养液中YY21菌株生长至36h后即进入平稳期,即开始产生次级代谢产物,继续培养,由于次级代谢产物积累引起自身反馈调节或是由于前体物质耗尽,导致抑菌活性物质产量降低,从而导致第7d的培养液形成的抑菌圈直径小于第5d[18]。
资料表明,抑菌圈直径达到10mm以上,即具有了较强的抑菌性[19]。李艳利等[20]对链霉菌Streptomyces sp.NJ0510的抑菌活性进行了研究,发现其次级代谢产物能抑制G+细菌,抑菌圈直径达到14mm,该菌代谢产物能够抗耐药的金色葡萄球菌。本研究中菌株YY21具有明显抗大肠杆菌活性,具有潜在的应用前景。
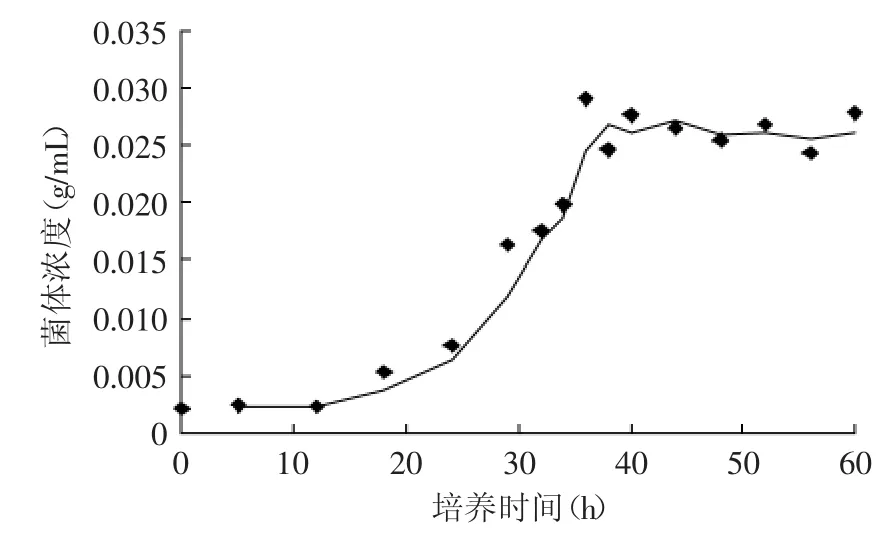
图6 放线菌YY21生长曲线Fig.6 The growth curve of the strain YY21
2.4放线菌菌株YY21产纤溶酶实验
利用GYM液体培养基培养放线菌菌株YY21,培养一定时间后离心发酵液,取上清液,测定纤溶酶的活力,结果如图7所示。

图7 放线菌YY21发酵液纤溶酶活性Fig.7 The enzyme activity of fermentation liquor of the strain YY21
实验结果表明,放线菌菌株YY21发酵液具有纤溶酶活力,第3d发酵液纤溶酶活性相对最高,在纤维蛋白平板上形成溶圈面积达到99.37mm2,随发酵时间的延长,纤溶酶活力变化呈逐渐下降趋势。
3 结论
放线菌菌株YY21菌落呈放射状生长,基内菌丝及气生菌丝呈分枝状,气生菌丝体覆盖在菌落边缘,形成褶皱的边缘,成熟的菌落呈土黄色;孢子丝形状为波曲状,单个孢子呈球形。
放线菌YY21是一株中度嗜酸放线菌,生长pH范围为3~7;可向细胞外分泌蛋白酶、淀粉酶,不能产生纤维素酶,可以分解含硫氨基酸产生硫化氢;能够利用葡萄糖和棉子糖作为碳源。放线菌菌株YY21发酵液含有抑制大肠杆菌的活性物质,同时,其发酵液中还含有能够降解牛血纤维蛋白的纤溶酶。
目前对放线菌所产抗生素的研究甚多,而对其产纤溶酶的报道较少,国内研究人员武临专、张立平、汤祝华等[21-23]都报道了链霉菌产纤溶酶发酵条件的优化,国外Ratnakar R等[12,24]对一种嗜温链霉菌所产纤溶酶进行了研究,但是,以上报道只是以生产纤溶酶一种产物为目的。该放线菌菌株YY21为一株嗜酸放线菌,产纤溶酶和抑菌活性物质能力较强,培养容易,有望开发为新型纤溶酶和抑菌素的联产菌。
[1]杨新春,温绍君,李志忠,等.溶栓药物在动脉血栓栓塞性疾病中的应用及其评价[J].中华内科杂志,2006(6):522-523.
[2]丁文惠,李建平,张宝娓,等.基因重组链激酶静脉溶栓治疗急性心肌梗塞临床研究[J].中国临床药理学杂志,2000,16(4):259-261.
[3]Nack-Shick Choi,Jae Jun Song,Dong-Min Chung,et al. Purication and characterization of a novel thermoacid-stable fibrinolytic enzyme from Staphylococcus sp.strain AJ isolated from Korean salt-fermented Anchovy-joet[J].J Ind Microbiol Biotechnol,2009,36(3):417-426.
[4]Sumi H,Hamada H,Tsushima H,et al.A novel fibrinolytic enzyme(Nattokinase)in the vegetable cheese Natto,a typical and popular soybean food in the Japanese diet[J].Experientia,1987,43:1110-1111.
[5]Kim W,Choi K,Kim Y,et al.Purification and characterization of a fibrinolytic enzyme produced flom Bacillus sp.strain CK11-4 scrcened from Chungkook-Jang[J].Appl Environ Microbiol,1996,62(5):2482-2488.
[6]邓永平,刘晓兰,郑宏臣.应用Octyl Sepharose FF疏水层析分离好食脉孢霉发酵产生的纤溶酶[J].中国酿造,2009,19(10):21-24.
[7]Liu Xiaolan,Du Lianxiang,Lu Fuping,et al.Purification and characterization of a novel fibrinolytic enzyme from Rhizopus chinensis 12#[J].Appl Microbiol Biotechnol,2005,67(2):209-214.
[8]Mitsuhiro Ueda,Toshihiro Kubo,Kazutaka Miyatake.Takumi nakamura purification and characterization of fibrinolytic alkaline protease from Fusarium sp.BLB[J].Appl Microbiol Biotechnol,2007,74(2):331-338.
[9]闵伟红,李佳,王影,等.高产纤溶酶霉菌固体发酵工艺条件的优化[J].食品科学,2008,29(1):207-211.
[10]刘晓兰,张雯舒,郑喜群,等.蛹虫草发酵产物新纤溶酶的分离纯化[J].华南理工大学学报:自然科学版,2012,40(5):107-114.
[11]Se-Eun Park.Purification and characterization of a fibrinolytic protease from a culture supernatant of Flammulina velutipes mycelia[J].Biosci Biotechnol Biochem,2007,71(9):2214-2222.
[12]Ratnakar Ravindra Chitte,Siddharath V Deshmukh,Pradnya Pralhad Kanekar,et al.Production,purification,and biochemical characterization of a fibrinolytic enzymefromthermophilic Streptomyces sp.MCMB-379[J].Appl Biochem Biotechnol,2011,165(5-6):1406-1413.
[13]崔庆锋,王黎明,刘志恒.酸性土壤中嗜酸稀有放线菌的多样性研究[J].微生物学报,2004,44(5):571-575.
[14]沈萍,陈向东.微生物学实验[M].第四版.北京:高等教育出版社,2007.
[15]张玲玲,崔德杰,洪永聪,等.氯氰菊酯降解放线菌的分离与筛选[J].青岛农业大学学报:自然科学版,2008,25(4):280-284.
[16]Liu XL,hen HX,Zheng XQ.Scale-up of submerged culture conditions for the production of fibrinolytic enzyme with cordyceps militaris[J].International Conference on Cellular,Molecular Biology,Biophysics and Bioengineering,2010,VolumeⅣ:507-510.
[17]路福平.微生物学[M].北京:中国轻工业出版社,2005:19.
[18]王卫卫.微生物生理学[M].北京:科学出版社,2008:197-198.
[19]邵彦坡,方丽萍,魏少鹏,等.海洋放线菌B5菌株发酵液抗菌谱及稳定性研究[J].西北农业学报,2007,16(3):248-251,256. [20]李艳利,黎晶晶,马中良.链霉菌Streptomyces sp.NJ0510的分离、鉴定及其抑菌活性的研究[J].生物技术,2007,17(4):69-71.
[21]武临专,陈昉,王以光,等.一种产生纤溶酶的链霉菌C-3662的鉴定与发酵研究[J].微生物学报,2002,42(5):600-606.
[22]张立平,李术娜,袁洪水,等.纤溶酶产生菌的筛选及酶活力的测定[J].药物生物技术,2007,14(1):48-50.
[23]汤祝华,朱春节,张宇,等.白色链霉菌(Streptomyces albus)HS1产豆豉纤溶酶发酵条件优化[J].海南师范大学学报:自然科学版,2010,23(3):308-314.
[24]Ratnakar R.Chitte,Sabita Dey.Production of a fibrinolytic enzyme by thermophilic Streptomyces species[J].World Journal of Microbiology&Biotechnology,2002,18(4):289-294.
Study on the physiological and biochemical characteristics and antimicrobial activity of actinomycetes YY21 producing fibrinolytic enzyme
DENG Yong-ping1,2,LIU Xiao-lan1,2,*,HAN Yang1,ZHENG Xi-qun1,2,AI Rui-bo1
(1.College of Food and Biotechnology,Qiqihar University,Qiqihar 161006,China;2.Key Laboratory of Processing Agricultural Products of Heilongjiang Province,Qiqihar University,Qiqihar 161006,China)
A extracellular plasmin producing moderately Acidophilic actinomycetes named YY21 was reported in this paper.On the GYM and PDA medium this strain could growth substrate mycelium and aerial hyphae,and aerial hyphae differentiate into wave-like spore-bearing mycelium which could produce spherical spores.The suitable pH range for the growth of the strain YY21 was 3~7.This strain could secrete protease and amylase,but no extracellular cellulase,and could break down the sulfur amino acid to roduce hydrogen sulfide.It could utilize glucose and raffinose as a carbon source.After this strain was cultured in liquid medium for 3 days,the medium had significant inhibitory effect on the E.coli,and the inhibition zone diameter reached 36.2mm.The medium contain plasminogen and the dissolved circle area was 99.37mm2on the fibrin tablet.
actinomycetes;fibrinolytic enzymes;antibacterial;physiological and biochemical characteristics
TS201.3
A
1002-0306(2015)04-0163-05
10.13386/j.issn1002-0306.2015.04.027
2014-05-09
邓永平(1978-),女,硕士,副教授,研究方向:微生物学与应用酶学。
刘晓兰(1962-),女,博士,教授,研究方向:发酵工程、微生物学与应用酶学。
黑龙江省教育厅科学技术研究项目(12521598)。

