从富油新绿藻提取叶绿素的研究
李灿良,钟 敏,胡雪琼,李雁群
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东湛江524088)
从富油新绿藻提取叶绿素的研究
李灿良,钟敏,胡雪琼,李雁群*
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东湛江524088)
为了探讨利用微藻生产天然食用色素叶绿素可能性及其工艺条件,以富油新绿藻为研究对象,首先研究通过提高培养基氮源含量来提高藻细胞叶绿素含量,然后针对提取溶剂配方、提取剂的用量、提取时间、提取温度等工艺条件进行实验,分析提取工艺参数对叶绿素提取效果的影响,对超声波辅助提取做了探讨,最后通过正交实验对提取条件进行了优化。结果表明,丙酮∶乙醇=1∶3的混合溶剂、溶剂用量为鲜藻泥质量的8倍、提取温度45℃、提取时间8h的工艺条件可以获得满意的提取效果。实验表明,在本文的微藻培养条件和优化的叶绿素提取条件下,富油新绿藻的叶绿素提取率可以达到53.69mg/g(藻干物质),实验结果还表明超声波处理对于富油新绿藻的叶绿素提取没有促进作用。
绿藻,富油新绿藻,叶绿素
叶绿素是脂溶性卟啉类化合物,色泽鲜艳,是所有绿色植物的基本化学物质,是优质、食用安全的天然色素,广泛应用于食品、医药和日用化学工业[1-2]。目前,叶绿素主要从竹叶、苎麻叶、蚕砂等原料中提取。由于绿色素的需求量大,叶绿素的生产量不能满足对绿色素的市场需求,许多食品和药品仍然还在使用化学合成的绿色素。因此,开发叶绿素的生产原料、增加叶绿素的供应具有重要的现实意义。
近年来,微藻在能源、食品等多方面应用的研究广泛开展起来[3-4]。绿藻门微藻大多叶绿素含量高,因此,利用微藻生产叶绿素将具有良好的前景。不仅如此,在利用微藻作为油脂和蛋白质资源方面,如果能在生产中先提取叶绿素,可以增加微藻的价值,降低微藻在食品、化工、能源等领域应用的成本,增加收益[5]。
在传统的以高等植物叶子或蚕沙为原料的叶绿素提取工艺中,一般用丙酮、甲醇、乙醇等溶剂,或者用这些溶剂的混合溶剂为提取剂[6-8],这种工艺提取设备较为简单、操作容易、设备投入相对较低、生产能力也较大,所以得到广泛的采用。此外,一些新工艺也逐步得到关注,如超临界CO2提取工艺[9-10]、超声波辅助提取技术也被应用到叶绿素的提取工艺中[11]。但是,超临界CO2工艺要求材料必须先经过干燥,而叶绿素是热敏性色素,因此只能采用诸如冷冻干燥等低温干燥工艺,这必然大幅度增加生产成本。超声波辅助有助于提取过程中的质量传递,特别是有利于叶绿素从大尺寸的颗粒材料中提取出来,但是,大规模工业化超声波辅助设备除了设备复杂以外,存在超声波在物料中的传递障碍和梯度分布容易造成局部过热等问题,所以其在叶绿素等热敏性成分提取中的应用也受到一定的影响。从微藻中提取叶绿素作为食品添加剂的研究少有报道,以绿藻为原料生产的叶绿素也尚未见上市。富油新绿藻是绿藻门微藻,在国外用来作为鲍鱼饲料,具有食用安全性的潜力,叶绿素含量高,近几年本实验室利用其高产油脂能力开展研究,然而,在油脂提取之前提取叶绿素,充分利用资源,提高微藻原料的附加值具有重要意义。微藻作为单细胞生物,与高等植物有所不同。微藻和高等植物的细胞壁结构有较大的差异,在其材料的颗粒大小和混合流动状态以及溶剂的渗透性等方面都有自身的特点。因此,从微藻中提取叶绿素与传统工艺中有何差异,值得研究。本文拟研究从富油新绿藻中提取叶绿素的工艺条件,比较溶剂、温度、提取时间、超声波等工艺条件对提取效率的影响,以期为开发利用微藻生产叶绿素的工艺提供参考数据。
1 材料与方法
1.1材料与仪器
藻种富油新绿藻Neochloris oleoabundans,从美国德克萨斯大学(奥斯丁)藻种保存中心引入,本实验室保存;丙酮、无水乙醇、95%乙醇、NaNO3、NaCl、K2HPO4、KH2PO4、MgSO4、CaCl2、FeCl3均为分析纯,购自湛江市林达化学试剂公司。
TDL-5-A型低速台式离心机上海安亭科学仪器厂;WFJ 7200型可见分光光度计尤尼柯上海仪器有限公司;HWS-24型电热恒温水浴锅上海-恒科学仪器有限公司;QHZ-98B型全温度光照振荡培养箱太仓市华美生化仪器厂;98-2型磁力搅拌器上海司乐仪器有限公司;FA1004型精密电子天平等。
1.2实验方法
1.2.1藻细胞收获富油新绿藻接种于装有1000mL改良SE培养基的大锥形瓶中培养,通入含5%CO2的空气、连续光照、用磁力搅拌器搅拌,在室内通过空调、通风和取暖器调节室温使培养液温度稳定在28~30℃,培养7d,将微藻培养液在3300×g离心10min,倾去上清液,得到湿藻细胞(简称藻泥)作为原材料用于叶绿素提取实验。
1.2.2藻生物量测定藻培养液或藻泥悬浮液中藻生物量的测定采用参考文献[12]的方法,即先将样品适当稀释,再测600nm波长下的光密度OD600,以OD600× 0.4之积为细胞生物量(g/L,细胞干物质质量)。
1.2.3叶绿素提取直接测定微藻培养液中的叶绿素含量的方法,取微藻培养液2mL于离心管中,3300×g离心10min,弃上清得微藻细胞,加2mL丙酮,振荡混匀,在4~10℃放置24h,3300×g离心10min,上清液即为叶绿素提取液,用于叶绿素含量测定;
叶绿素提取条件实验中叶绿素含量测定方法,称取一定质量的藻泥于提取容器中(离心管或三角瓶),添加提取剂(提取剂的配方和用量按照设计的实验条件定)制成悬浮液,在设定温度下振荡浸提一定时间,取悬浮液于离心机中3300×g离心10min,取上清液即为叶绿素提取液,用于叶绿素含量测定。
1.2.4叶绿素含量测定叶绿素提取液分别在663、645nm测定光密度值,提取液中叶绿素含量按Becker的方法计算[13]。
叶绿素含量(mg/L)=20.21×OD645+8.02×OD663
式中:OD645—提取液在波长645nm时的光密度;OD663—提取液在波长663nm时的光密度。
1.2.5培养基氮源量对绿藻细胞中叶绿素含量的影响用改良的SE培养基,其中氮源(NaNO3)含量分别为10、20、25、30mmol/L,在1000mL三角瓶中装液量为800mL,控制室温以维持培养液温度在28~30℃,以1vvm的流量通入含5%(v/v)CO2的空气,5000lux强度的人工灯光连续光照,磁力搅拌,每天按照1.2.2测培养液中藻的生物量并按照1.2.3和1.2.4的方法测叶绿素含量。
1.2.6不同提取剂配方对叶绿素提取效果的影响先按照表1配制提取剂,然后各称取1.00g藻泥,加30mL表1中相应提取剂,置于50mL离心管中,在30℃恒温箱中振荡浸提,在2、4、6、12、24h分别取样2mL,离心,取上清液测OD663和OD645,计算提取液中的叶绿素含量。
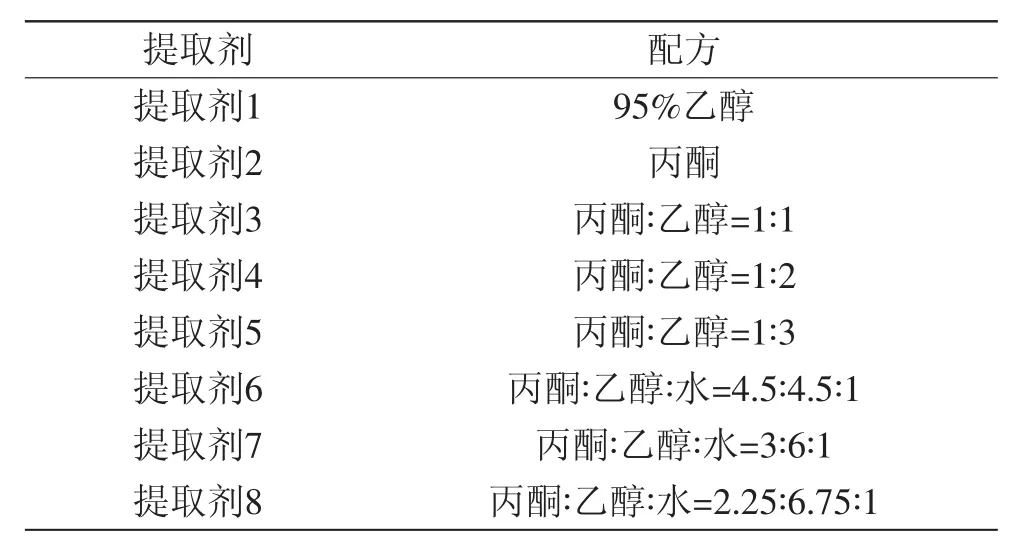
表1 提取剂配方Table.1 The formulas of extraction solvents
1.2.7提取剂用量对提取叶绿素效果影响各称取1.00g藻泥,分别按藻泥质量(g)∶提取液体积(mL)为1∶5、1∶10、1∶15、1∶20、1∶30的提取剂用量添加前步实验得出的最好配方的提取剂,置于40mL离心管中,在30℃恒温箱中振荡浸提12h,取悬液2mL,离心,取上清液测叶绿素含量。
1.2.8提取温度对叶绿素提取效果影响按照上两步实验优化的提取剂配方、提取剂用量,取1.00g藻泥加提取剂,分别在20、30、40、50、60℃条件下提取12h,测量提取液叶绿素。
1.2.9超声波处理对叶绿素提取效果影响分别取200mg藻泥置于4个5mL容积的薄壁离心管中,加1mL提取剂,在冰浴中,进行超声波处理,处理时间分别为10、30、45、60min,然后按照优化的提取剂、提取剂用量和提取温度提取12h,测量提取液的叶绿素含量。
1.2.10正交设计实验采用4因素3水平(L34)正交设计表,对提取温度、提取剂用量和提取时间的参数做进一步优化,实验的因素和水平安排如表2所示,按照正交表安排实验,每组实验做3个重复,用重复实验数据的平均值进行统计分析。
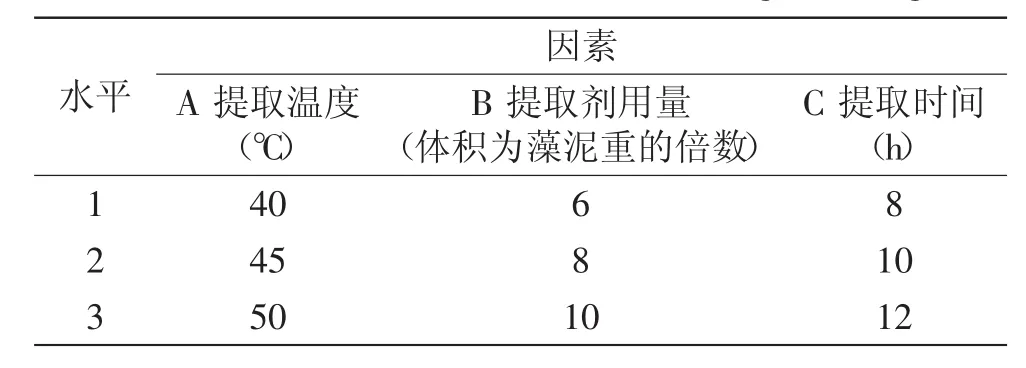
表2 正交设计因素水平表Table.2 The factors and levels in the orthogonal design
2 结果与讨论
2.1培养基氮源量对绿藻细胞中叶绿素含量的影响
培养基氮源含量对细胞生物量的影响结果如图1所示,在微藻的培养过程中藻细胞的生物量变化符合单细胞微生物生长规律,氮源含量的高低影响了微藻生长的进程,但是在第7d藻生物量基本相同,总生物量没有随氮源量的不同而变化,这表明在实验的浓度范围内氮源是足够的,而其他营养素的不足限制了生物量的增长。

图1 在不同含氮培养基中细胞生物量随培养时间的增长Fig.1 The biomass increased with cultivation time in the medium congtaining different nitrogen concentration
氮源含量对细胞叶绿素含量的影响实验结果见图2,从图中可见10~25mmol/L之间氮源浓度增加提高了叶绿素含量,在25mmol/L的氮源浓度条件下叶绿素含量达到最大,而30mmol/L的氮源浓度条件下细胞的叶绿素含量反低于25mmol/L。参考文献[12]的结果表明,在3~20mmol/L的氮源浓度范围内,随着氮源浓度的增加藻细胞的叶绿素含量也增加。结合图2所示的结果和文献结果,说明可以将氮源浓度进一步提高到25mmol/L以提高藻细胞的叶绿素含量。绿藻作为靠叶绿素进行光合作用的单细胞植物,可期望用于生产叶绿素。在作为能源、饲料等用途的培养中可以兼顾叶绿素的生产来选用培养基配方或培养条件。
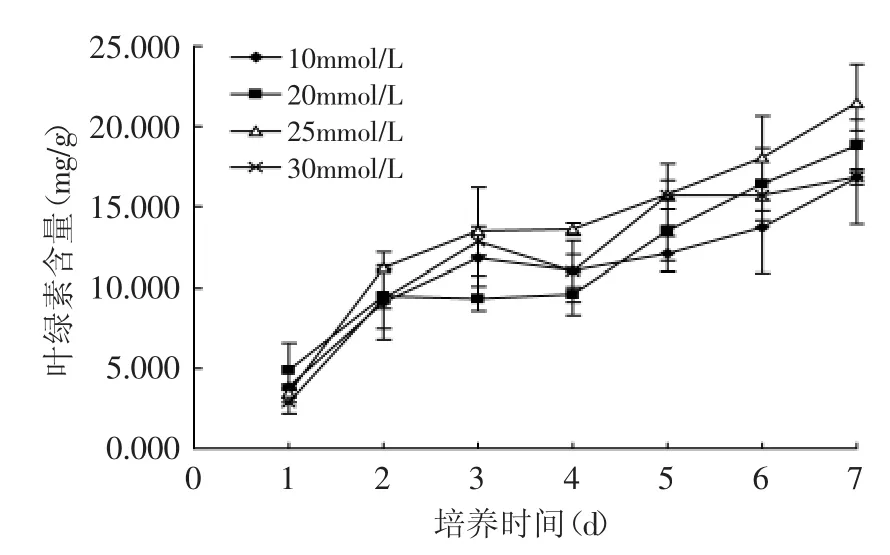
图2 在不同含氮培养基中细胞中叶绿素的含量随培养时间的变化Fig.2 The cell chlorophyll content varied with cultivation time in the medium congtaining different nitrogen concentration
2.2提取剂配方对叶绿素提取效果的影响
提取剂配方对叶绿素提取效果的影响实验结果如表3所示。叶绿素为脂溶性色素,提取剂的极性对提取效率有很大影响。实验所用的提取剂配方不同,提取剂的极性、渗透能力都不一样,结果表明丙酮∶乙醇=1∶3的混合溶剂得到最好的提取效果,因此可以选用此溶剂作为提取剂。从提取率随提取时间的变化可见,提取时间在2~12h时,随着提取时间的延长,绿藻中的叶绿素提取率快速增加,而从12~24h则未见明显增加。叶绿素提取是由细胞内向细胞外扩散的过程,因此可以认为经过12h的浸提叶绿素基本能够从细胞内部扩散到细胞外,即12h可以基本完成叶绿素的提取,所以提取时间可以确定为12h。
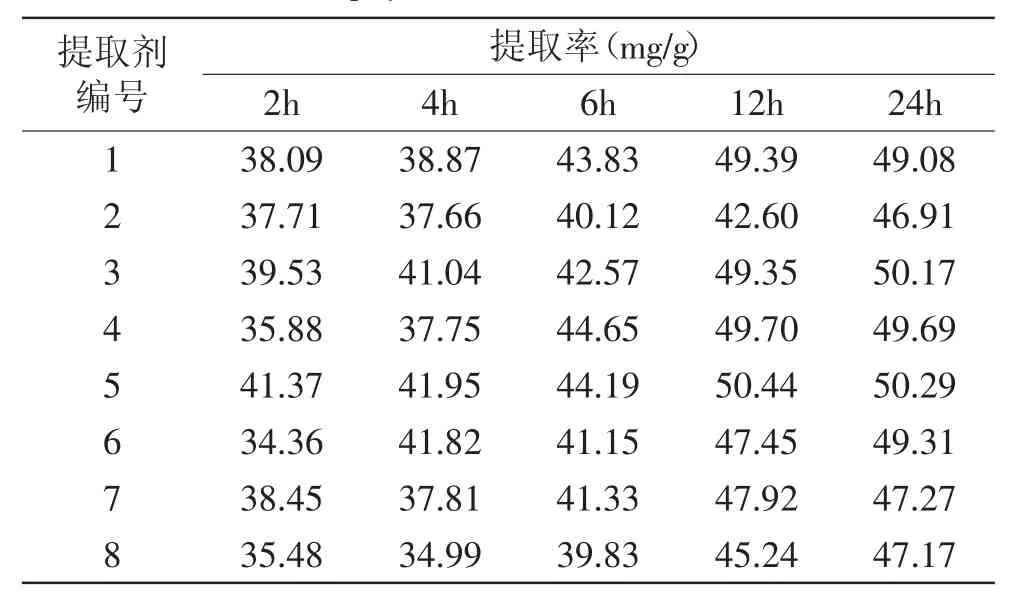
表3 不同配方提取剂提取叶绿素的效果Table.3 The chlorophyll extraction effect of different solvents
2.3提取剂用量对叶绿素提取效果的影响
以丙酮∶乙醇=1∶3的混合溶剂为提取剂,用不同的提取剂用量在30℃下提取12h,测量叶绿素提取效果,结果见图3。从结果可见,提取剂用量(体积,mL)为藻泥质量(g)的5倍增加到10倍时叶绿素提取率提高明显,但是提取剂用量增加到10倍以上后叶绿素提取率不再提高,说明10倍的提取剂用量已经足够。提取剂的用量越高,溶剂回收的负担越大,生产成本必然提高,因此提取剂用量应适当。
2.4提取温度对叶绿素提取效果的影响
用丙酮∶乙醇=1∶3的混合溶剂,提取剂用量(mL)为藻泥重量的10倍,在20~60℃范围内的不同温度下提取12h,叶绿素提取效果见图4。由实验结果可见,在20℃的温度下绿藻叶绿素提取率较低,在20~40℃之间,叶绿素提取率逐步提高,40~50℃时提取率达到了最高,为51.54mg/g;50℃之后,叶绿素提取率有下降的趋势。较高的提取温度可以加速叶绿素扩散速度,能提高提取效率。但是叶绿素对热不稳定,在高温下容易发生分解,提取温度过高叶绿素得率反而下降。所以,提取温度的确定既要考虑提取速率又要考虑叶绿素的稳定性,采用40~50℃比较合适。
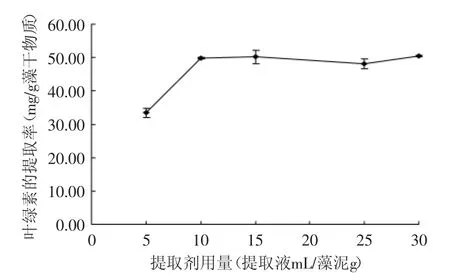
图3 提取剂用量对叶绿素提取效果的影响Fig.3 The effects of solvent quantities on the chlorophyll extraction
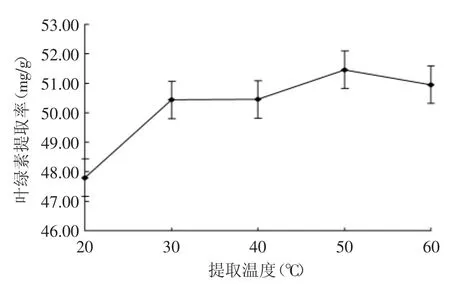
图4 提取温度对叶绿素提取效果的影响Fig.4 The effects of temperatures on the chlorophyll extraction
2.5超声波处理对叶绿素提取效果的影响
超声波处理对叶绿素提取效果的影响实验结果见表4。由结果可见,超声波处理10、30、45、60min后绿藻叶绿素提取率都比不进行超声波处理的要低。可见,超声波辅助提取在本实验中没有促进作用的效果。因此,从节约生产成本考虑,以不采用超声波辅助提取为好。

表4 超声波处理对叶绿素提取的作用Table.4 The effect of ultrasonication on the chlorophyll extraction
有文献报道超声波有利于叶绿素的提取,可以提高提取效率,缩短提取时间[14],但绿藻中叶绿素提取研究还未见报道。超声波处理过程中,样品温度升高,虽然有利于物质的扩散传递,但是叶绿素具有热不稳定性,容易造成分解。超声波频率高,穿透能力强,对于从颗粒大、结构紧密的材料中提取目标物质是有利的,但是富油新绿藻作为单细胞微藻,材料颗粒小,超声波不能发挥促进提取的作用,相反如使用不当造成提取温度升高还反会促进叶绿素分解。这可能是本实验在用超声波处理时,没有取得更好提取效果的原因。
2.6正交设计实验结果
正交设计的实验结果如表5所示。由极差分析可见,温度是影响更加明显的因素,提取剂用量的影响次之,提取时间的影响最小。从各因素对结果的影响趋势看,提取温度为45℃时可以获得最大的提取率,而40℃和50℃的提取温度下提取率都更低,说明温度太低提取不尽,温度太高叶绿素分解也可能增加。提取剂用量从6~8倍提取率增加较大,但是提取剂用量从8~10倍的提取率增加不明显,提取剂用量的增加会增加溶剂蒸馏的负担,因此,提取剂用量可以采用藻泥重量的8倍作为提取剂用量。从提取时间的影响看,实验范围内对提取效果没有明显的影响,提取时间达到8h已经足够,增加提取时间并不能增加提取效率,这时实验的其他因素的作用显得更加重要,所以,看上去10h和12h提取时间获得的提取率反更少。从提取效果和生产成本综合来考虑,从富油新绿藻提取叶绿素的工艺条件可以采用A2B2C1即45℃的提取温度,8倍于藻泥质量的提取剂用量和8h的提取时间。用A2B2C1条件做验证实验得到的叶绿素提取率为53.69mg/g。
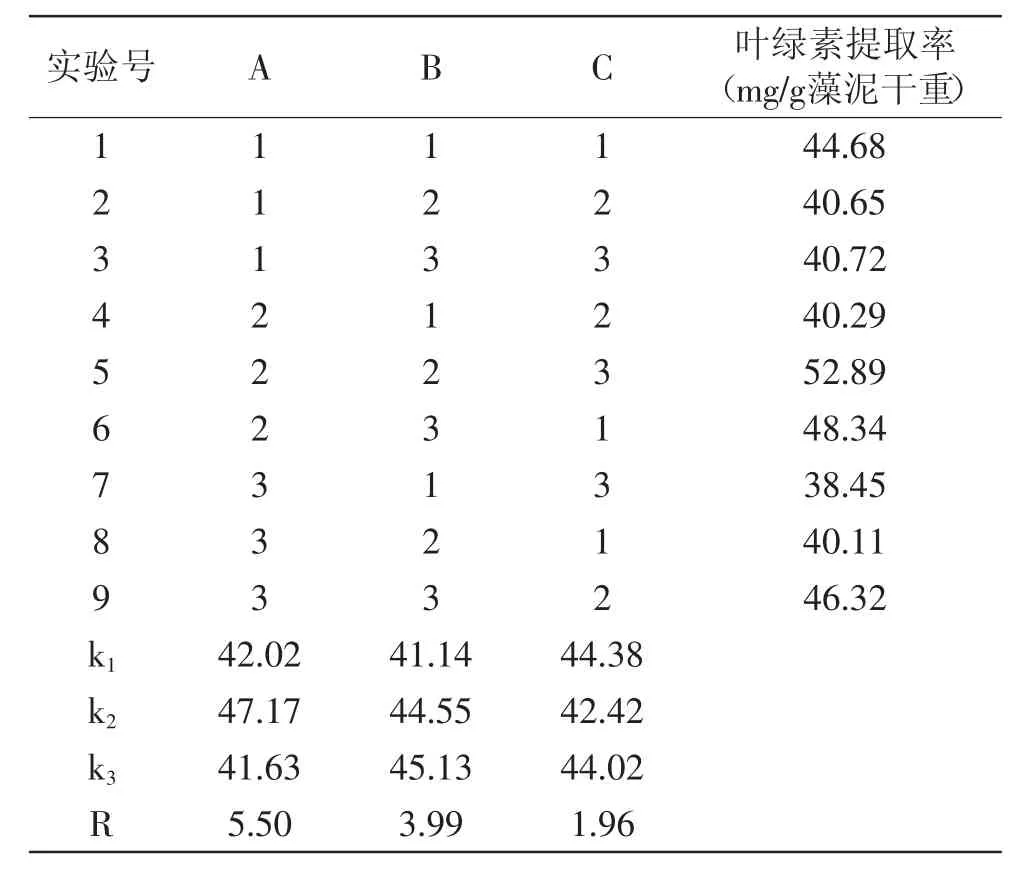
表5 正交设计实验结果和统计分析Table.5 The experiment results and analysis of orthogonal design
3 结论
适当增加培养基的氮源含量可以提高富油新绿藻细胞叶绿素含量,在以硝酸钠为氮源的情况下,氮源浓度为25mmol/L为宜;在叶绿素提取过程中,提取剂用丙酮∶乙醇为1∶3的混合提取剂效果较好,提取剂的体积用量以微藻生物量质量数的8倍为宜,提取温度45℃可以获得较高的提取效率又可以避免发生叶绿素的严重的热分解,提取时间8h可以充分完成提取;超声波辅助不能增加富油新绿藻的叶绿素提取效率,使用不当还可能降低叶绿素得率,因此不必采用超声波辅助的提取工艺;采用优化的提取工艺条件从富油新绿藻中可以提取叶绿素达到53.69mg/g(对藻干物质)。
[1]Steinmetz K A,Potter J D.Vegetables,fruit and cancer prevention:a review[J].JournaloftheAmericanDietetic Association,1996(10):1027-1039.
[2]TimberlakeC F,Henry B S.Plant pigments as natural food colours[J].Endeavour,1986,10(1):31-36.
[3]Li Yanqun,Horsman Mark,Wu Nan,et al.Biofuels from Microalgae[J].Biotechnology Progress,2008,24:815-820.
[4]王冬琴,谭瑜,卢虹玉,等.微藻生物活性物质在食品工业中的应用进展[J].现代食品科技,2013,29(5):1185-1191.
[5]Rangel-Yagui Carlota de Oliveira,Danesi Eliane Dalva Godoy,João Carlos Monteiro de Carvalho,et al.Chlorophyll production from Spirulina platensis:cultivation with urea addition by fedbatch process[J].Bioresource Technology,2004,92(2):133-141.
[6]Schoefs B.Chlorophyll and carotenoid analysis in food products.Properties of the pigments and methods of analysis[J]. Trends in Food Science&Technology,2002,13(11):361-371.
[7]Schoefs B.Determination of pigments in vegetables[J].Journal of Chromatography A,2004,1054(1-2):217-226.
[8]SimonD,HelliwellS.Extractionandquantification of chlorophyll a from freshwater green algae[J].Water Research,1998,32(7):2220-2223.
[9]Fujii K.Process integration of supercritical carbon dioxide extraction and acid treatment for astaxanthin extraction from a vegetative microalga[J].Food and Bioproducts Processing,2012,90(4):762-766.
[10]Guedes A Catarina,Gião S Maria,Matias A Ana,et al. Supercritical fluid extraction of carotenoids and chlorophylls a,b and c,from a wild strain of Scenedesmus obliquus for use in food processing[J].Journal of Food Engineering,2013,116(2):478-482.
[11]王丰俊,王运强,顾欣,等.响应面法优化超声波提取构树叶中叶绿素的工艺研究[J].北京林业大学学报,2010,32(6):135-140.
[12]Li Yanqun,Wang Bei,Wu Nan,et al.Effects of nitrogen sources on cell growth and lipid production of Neochloris oleoabundans[J].Applied Microbiology and Biotechnology,2008,81:629-636.
[13]Becker E.Microalgae:biotechnology and microbiology[M]. New York:Cambridge University Press,1994.
[14]王爽,姚秉华.超声法提取松针叶绿素及稳定性研究[J].纺织高校基础科学学报,2010,23(1):87-90.
Study on the extraction of chlorophyll from a green microalga
LI Can-liang,ZHONG Min,HU Xue-qiong,LI Yan-qun*
(College of Food Science and Technology,Guangdong Ocean University,Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety,Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Zhanjiang 524088,China)
In order to study the possibility of the production of natural edible pigment chlorophyll from green microalgae,and to investigate the procession conditions of that production,the effects of nitrogen source contents in the medium on the chlorophyll content of the microalgal cell were investigated,and the effects of the solvent formulas,solvent quantities,extraction time,extraction temperature and ultrasonication on the chlorophyll extraction were studied.The results indicated that a satisfied extract rate could be obtained when 8 times of a complex solvent composed of acetone and ethanol at a ratio of 1∶3 based on the microalgal biomass was utilized and the extraction was performed at 45℃for 8h.At that procession conditions,53.69mg/g(by dry cell weight)of chlorophyll had been extracted from the green microalga Neochloris oleoabundans.
green microalga;Neochloris oleoabundans;chlorophyll
TS201.1
B
1002-0306(2015)04-0199-05
10.13386/j.issn1002-0306.2015.04.035
2014-02-11
李灿良(1990-),男,本科,研究方向:食品科学与工程。
李雁群(1963-),男,博士,教授,研究方向:食品生物技术。
国家十二五农业领域项目子课题(2011BAD14B03-06);广东省国际合作项目(2011B050400027);广东海洋大学引进人才启动项目。

