Box-behnken设计优化玉米须黄酮纯化工艺研究
郭志红,周鸿立,郭向明
(1.吉林大学化学学院,吉林长春130012;2.吉林化工学院化学与制药工程学院,吉林吉林132022)
Box-behnken设计优化玉米须黄酮纯化工艺研究
郭志红1,2,周鸿立2,*,郭向明2
(1.吉林大学化学学院,吉林长春130012;2.吉林化工学院化学与制药工程学院,吉林吉林132022)
以玉米须总黄酮回收率作为考察指标,用AB-8大孔树脂进行纯化,在单因素实验基础上,采用Box-behnken设计优化洗脱条件,确定最佳纯化条件为:上样浓度为2mg/mL,上样速度为1mL/min,上样量为55mL,吸附时间2h,用乙醇浓度70%,乙醇体积4BV,洗脱速率为1.8mL/min,在最佳工艺条件下玉米须总黄酮回收率可达80.68%,玉米须粗提物中总黄酮含量由纯化前的4.15%提高到25.68%。实验说明,该法操作简单、方便、便于工业化生产。
玉米须黄酮,AB-8大孔树脂,Box-behnken设计,回收率
玉米须(Zea mays L.)为禾本科玉蜀黍属植物玉米的花柱和柱头,含有黄酮类、多糖类、皂甙、生物碱、单宁酸、绿原酸、蛋白质、挥发性油和类固醇[1-2]等多种生物活性成分。黄酮类成分有降压、降血脂、增加冠脉流量、强心、抗心律不齐等药理作用[3]。因此对玉米须黄酮纯化研究很有必要。
大孔吸附树脂是近年来发展起来的一类有机高分子聚合物吸附剂,其具有物理化学稳定性好、工艺简单、吸附容量大、速度快、再生简便、使用周期长、机械强度高等诸多优点[4],广泛用于天然产物的纯化。Box-behnken设计——响应曲面法(response surface methodology,RSM)是一种应用较广的实验优化方法,由于采用了更为合理的实验设计,通过多项式模型有效快速地确定多因子系统的最佳条件[5]。目前响应面法已广泛用于天然产物的提取过程,有关应用于黄酮类纯化的报道较少,目前笔者只见响应面法纯化刺山柑叶黄酮[6]、枳实总黄酮[7]、苦荞黄酮[8]的相关报道,未见应用于大孔树脂纯化玉米须黄酮的工艺。本文中用AB-8大孔树脂纯化玉米须粗黄酮,采用Box-Behnken设计方法,探索研究最佳的洗脱工艺,为玉米须黄酮的精制提供理论基础。
1 材料与方法
1.1材料与仪器
玉米须玉米须药材2012采自吉林省吉林市郊区,由吉林大学王广树教授鉴定为甜粘1号;芦丁对照品0080-9705,纯度>98%,中国药品生物制品检定所;AB-8大孔树脂天津南开大学化工厂;实验用水为蒸馏水;无水乙醇、浓盐酸、氢氧化钠、浓硫酸、苯酚、无水三氯化铝均为分析纯。
752紫外可见分光光度计上海菁华科技仪器有限公司;FA1004电子天平上海菁海仪器有限公司;层析柱(18mm×200mm) 上海天玻仪器;GZXGW·2-BS高温干燥箱上海博泰实验设备有限公司;PHS-3C数字式酸度计上海理达仪器厂;SHB-ⅢA循环水式多用真空泵郑州长城科工贸有限公司;RE-52A旋转蒸发器上海亚荣生化仪器厂;KQ2500B超声波清洗器昆山市超声仪器有限公司;HH-6数显恒温水浴锅国华电器有限公司。
1.2实验方法
1.2.1样品的处理与制备玉米须清洗去尘,晾干,粉碎,过筛(60目)后,称取300g玉米须粉末,放入大烧瓶中,按料液比1∶25的比例加入60%的乙醇,80℃下提取2h,重复两次,过滤,合并滤液,浓缩,用60%的乙醇定容到1000mL容量瓶,备用。
1.2.2黄酮的含量测定以芦丁为对照品,采用三氯化铝显色法测定玉米须黄酮[9]。得回归方程为:y=24.834x+0.0071,r2=0.9995,黄酮质量浓度在10~30μg/mL呈良好的线性关系。
1.2.3单因素实验
1.2.3.1上样液pH对吸附性能的影响将玉米须总黄酮浓度为1.2mg/mL的玉米须黄酮上样液用5%盐酸和2%的NaOH溶液调成pH=3、4、5(原液5.4)、6、7、8、9,分别取20mL于250mL的装有2g预处理后树脂的三角烧瓶中,封口,置于恒温水浴摇床中振摇24h,充分吸附后,静止2h,过滤,测定滤液的浓度,计算吸附率。吸附率Q=(C0-Ct)Vy/C0Vy
式中,C0为样液的初始质量浓度,Ct为吸附后样液质量浓度,Vy为样液体积。
1.2.3.2上样浓度对总黄酮回收率的影响以筛选出的AB-8型大孔树脂为玉米须总黄酮的纯化载体,采用湿法装柱。装柱高度为10cm,即1BV(柱床体积)约为20mL。取总黄酮浓度为0.52、1.03、1.58、2.04、2.81mg/mL的样液各40mL,以1.5mL/min的流速,分别加入5根同样的树脂柱中。吸附完全后,用去离子水冲至流出液无色,再用浓度70%乙醇洗脱,乙醇用量为4BV,测定回收率,选择最适上样浓度。
回收率(%)=乙醇洗脱所得总黄酮的质量/上样前总黄酮的质量×100
1.2.3.3上样量的确定将提取液总黄酮稀释为浓度2.07mg/mL的样液若干,量取10mL已处理好的树脂装于层析柱(1.8mm×200mm)中,以1mL/min的速度上样,每5mL为一个收集段,检测每段收集液中总黄酮浓度。当流出液的浓度达到初始浓度的1/10时,即可认为树脂已吸附饱和。
1.2.3.4上样速率对总黄酮回收率的影响取总黄酮浓度为2mg/mL的样液5份,每份40mL。分别以0.5、1.0、1.5、2.0、2.5mL/min的流速加入到5根同样的树脂柱中。吸附完全后(大约2h),用去离子水冲洗至流出液无色,再用浓度70%乙醇洗脱,乙醇用量为4BV,测定回收率,选择最适合上样速率。
1.2.3.5吸附时间对总黄酮回收率的影响取5根相同的玻璃层析柱(18mm×200mm),5份相同体积的已处理好的树脂20mL,湿法装柱,总黄酮浓度为2.0mg/mL的溶液5份,每份40mL,上样,上样速度1mL/min,上样后分别吸附1、2、3、4、5h后,水洗至流出液无明显颜色,分别加入70%的乙醇80mL,洗脱速度为1.5mL/min,测洗脱液浓度,计算回收率。
1.2.3.6乙醇洗脱浓度对总黄酮回收率的影响取20mL饱和吸附的AB-8树脂五份,装入相同型号的五根层析柱,先用去离子水冲洗至流出液无色,再分别用浓度40%、50%、60%、70%、80%、90%的乙醇溶液进行洗脱,洗脱速率为2mL/min,乙醇用量为4BV,测定其回收率,选择最适洗脱浓度。
1.2.3.7洗脱速率对总黄酮回收率的影响取20mL饱和吸附的AB-8树脂五份,装入相同型号的五根层析柱,先用去离子水冲洗至流出液无色,然后用浓度70%的乙醇溶液分别以1、2、3、4mL/min的速率进行洗脱,乙醇用量为4BV,测定其回收率,选择最适洗脱速率。
1.2.3.8洗脱剂体积的考察取按上述条件吸附后的AB-8大孔树脂20mL,用纯化水洗脱至无明显颜色,再用70%乙醇洗脱,流速为2mL/min,每5mL收集一次洗脱液,检测洗脱液中玉米须总黄酮浓度。
1.2.3.9响应面实验设计根据Box-Behnken实验设计原理,在单因素实验基础上,共设计17个实验点,12个分析点,5个零点以估计误差,每次精密量取20mL吸附饱和的大孔树脂进行实验,选用对解析率影响较大洗脱剂浓度X1、洗脱速率X2和洗脱剂用量X3为变量,以玉米须总黄酮回收率为响应值(R),进行响应面分析实验。实验设计表1。

表1 响应面实验因素水平表Table.1 Factors and levels of RSM
1.3数据处理
按照表1的设计方案,利用Design-Expertv8.0.5软件,采用Box-Behnken设计、二项式模型进行回归分析。
2 结果与分析
2.1单因素实验
2.1.1上样液pH对吸附性能的影响当pH=3、4时,溶液中出现砖红色沉淀,可能是黄酮类物质生成烊盐,导致吸附效果变差。当pH=9时,溶液部分变绿色,导致黄酮类物质变质,影响吸附效果,在pH5.0时,黄酮类化合物最适宜被该树脂吸附。这可能是由于在此条件下,黄酮类物质呈分子状态,不生成烊盐,以氢键方式被吸附[7],因而树脂吸附量大,吸附率也高。因此,原液(pH=5.3)不需要调节pH,可直接使用。

图1 pH对总黄酮吸附率影响Fig.1 Effect of pH values on the adsorption efficiency
2.1.2上样浓度对总黄酮回收率的影响从图2可以看出,当上样液浓度为0.5mg/mL时,树脂对黄酮液的吸附率达到最大,此时上样量较少,绝大部分黄酮都被吸附,树脂未饱和,当用蒸馏水洗树脂时,只有少数黄酮洗出,损失量少,回收率大,随浓度的增加上样量增加吸附量逐渐增大,当树脂完全饱和时,吸附量不再变化,相应的黄酮就有损失,上样量越大水洗时损失越大,在2mg/mL左右时回收率达到最大,为了充分利用树脂,将浓度为2mg/mL的溶液作为上样液的最佳浓度。

图2 上样浓度对回收率的影响Fig.2 Effect of sample concentration on recovery efficiency
2.1.3上样量的确定实验以流出黄酮浓度为上样液的10%时为泄露点,根据图3可知当上样55mL时达到泄露点,吸附量为105mg,当上样为160mL时接近上样液浓度,上样量为此时可确定为上样体积为55mL,约为3BV。

图3 上样量对吸附效果的影响Fig.3 Effect of sample loading amount on the recovery efficiency
2.1.4上样速率对总黄酮回收率的影响从图4可知,当上样速度为0.5mL/min时黄酮的回收率最大,随着上样速度的增大,回收率逐渐减小,原因可能是树脂的内扩散速率与上样液流速的反比关系[10]。上样液流速过快,总黄酮未进行彻底吸附就已经发生泄漏。但当速度为1mL/min时,回收率与最大值相差不大,为了节省时间,选择1mL/min作为最佳的上样速度。
2.1.5吸附时间的对总黄酮回收率的影响从图5中可以看出,在2h内由于吸附时间短,黄酮分子未与树脂完全吸附,水洗时会带走一部分未被吸附的黄酮,回收率较低,随着时间的增加,黄酮分子逐渐被吸附完全,2h时达到最大值,吸附时间超过2h后,由于吸附时间过长会有一部分杂质也被吸附,黄酮分子与树脂间形成死吸附,回收率逐渐下降,因此最佳吸附时间为2h。
2.1.6乙醇洗脱浓度对总黄酮回收率的影响从图6中可知看出,总黄酮的回收率随着乙醇浓度的增大而呈上升趋势,体积分数在70.0%时达到最大,之后略显下降。不同浓度的乙醇的极性不同,随着乙醇浓度的增大极性逐渐减小,在40%的乙醇洗脱时包括多糖类的大分子物质组分先流出,杂质较多,在70%时黄酮类物质基本被洗脱,90%时极性小,洗脱物质大多为苷元类物质,因此选择70%的乙醇为洗脱溶剂。

图4 上样速度对回收率的影响Fig.4 Effect of loading flow rate on the recovery efficiency

图5 吸附时间对回收率的影响Fig.5 Effect of adsorption time on the recovery efficiency

图6 乙醇浓度对回收率的影响Fig.6 Effect of different ethanol concentration on recovery efficiency
2.1.7洗脱速率对总黄酮回收率的影响从图7中可以看出,随着乙醇流速增大回收率降低,这是因为在乙醇体积相同的情况下,乙醇流速太大,洗脱剂还未充分洗脱树脂上吸附的黄酮就已经流出柱外,因此洗脱流速应比较小,但流速过低将导致整个洗脱过程时间变长,生产周期延长。从图7中可以看出,当洗脱速率1.0mL/min时洗脱效果最好,而在洗脱流速1.0~2.0mL/min之间下降趋势不明显,综合考虑解吸率及时间后洗脱流速应选择在1.0~2.0mL/min之间。

图7 洗脱速率对回收率的影响Fig.7 Effect of different velocity of ethanol on recovery efficiency
2.1.8洗脱剂体积的考察从图8中可以看出,洗脱液中总黄酮浓度随洗脱液用量增大而升高,之后又随之降低,大约在第15个组分时,黄酮的含量相对较少,因此3.5BV体积的洗脱液就可以基本将总黄酮洗脱干净。

图8 乙醇用量的考察Fig.8 Investigation on the amount of ethanol
2.2Box-Behnken实验设计与结果
采用Design-expertv 8.0.5软件进行实验设计和结果分析,结果见表2。

表2 总黄酮解吸条件的优化实验设计及结果Table.2 Optimization of desorption conditions and results of experimental design
通过对实验结果进行响应面分析,经过二次回归拟合后,得出拟合方程式:
R1(%)=76.65-1.88X1-2.07X2+5.05X3+0.86X1X2-0.49X1X3-0.46X2X3-0.96X12-8.24X22-2.29X32
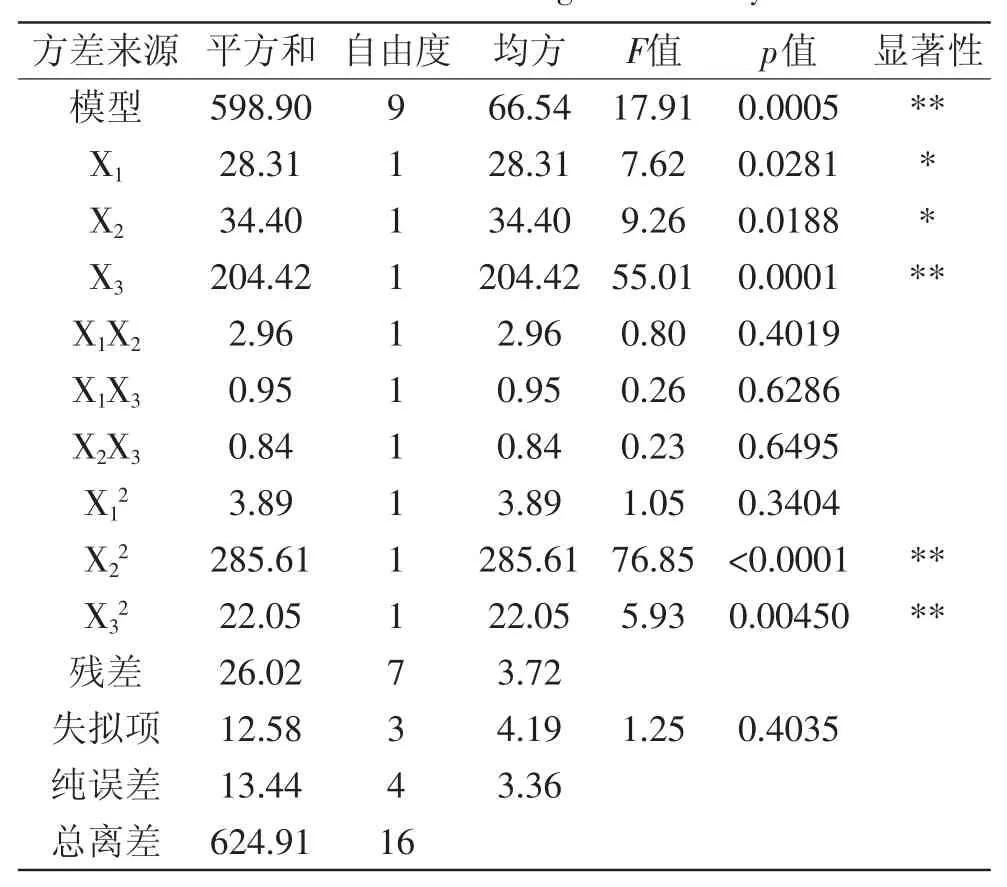
表3 方差分析表Table.3 ANOVA of regression analysis
表3中对回归方程进行方差分析,可以看出模型的p<0.001,证明实验所选用的二次多项模型具有极显著性,且失拟项的p>0.05,表明失拟项不显著;其校正系数R2=0.9584,表明模型充分拟合实验数据,因此可以用此模型来分析和预测纯化黄酮的工艺[11]。在总的作用因素中,X3、X22、X32项的对响应值Y影响是极显著的(p<0.01),X1、X2项的影响是显著的(p<0.05),而方程的交互项X1X2、X1X3、X2X3对Y影响不显著(p>0.05)。
2.3响应面图分析
结合Box-Behnken实验设计方案,利用RSM研究各个因素之间对总黄酮回收率的影响,做出响应面图,以洗脱剂浓度、洗脱速率与洗脱剂用量的交互作用对总黄酮的回收率的影响,根据回归方程得出不同因子的响应面分析图及相应等值线图结果见图9。

图9 两因素交互作用对总黄酮得率的响应面图和等高线图Fig.9 Response surface and contour plots for the effect of operating parameters on the recovery efficiency of total flavonoids
从响应面分析图上可较直观地看出各因素交互作用对响应值的影响。响应面中,若响应曲面很平滑,则交互作用对响应值的影响不显著,若曲面陡峭则交互作用影响显著。等高线图中,等高线的密度越大,表示条件的变化对响应值的影响越显著。等高线为椭圆形表示交互作用影响显著,为圆形时影响则不显著[12],从图9可知,三种因素的交互作用不显著,表现为曲线平滑。
图9(a)中,洗脱剂体积对响应值影响显著,表现为曲线较陡。由交互作用的等高线可知,沿洗脱体积轴向等高线密集,而速度轴向等高线相对稀疏,说明洗脱体积对响应值峰值的影响比速度大。曲面中心值并不是曲面最大值,随着洗脱体积的增大而增大,在4BV时达到最大值,说明此时为最优的工艺。图9(b)中,洗脱剂浓度对响应值影响不显著,表现为曲面平缓,浓度轴线等高线稀疏,浓度轴向曲线变化不大,曲面最大值对应的洗脱剂浓度在零水平处,可判断此时为最佳洗脱剂浓度。图9(c)中响应值随洗脱速度呈现由低到高再降低的趋势,即响应值在零水平处具有极大值。
可推断对响应值的影响顺序为:洗脱剂体积>洗脱速度>洗脱剂浓度,这基本和方差分析结果一致。可通过软件对模型极值求解和分析等高线得到最佳洗脱条件:洗脱剂浓度70%,洗脱速率1.79mL/min,洗脱剂体积4BV。
2.4验证实验
为检验RSM分析法的可靠性,采用上述最优提取条件进行黄酮的分离纯化实验,同时考虑到实际操作的便利,将洗脱的最佳条件修正为:洗脱速率1.80mL/min,洗脱剂浓度为70%,洗脱剂用量为4BV,理论上总黄酮回收率值可达81.19%,实际得到大孔树脂解析玉米须黄酮类化合物的平均回收率为80.68%,与理论值较为稳合,粗黄酮的纯度由原来的4.15%提高到25.68%,提高了6.12倍,表明优选工艺提取效果较为理想性。
3 结论
3.1AB-8大孔吸附树脂用于玉米须黄酮的分离纯化,除去了大量色素、多糖、蛋白质等物质,省去了传统溶剂萃取法的繁琐工艺,仅吸附-洗脱一步工艺即得到高含量的玉米须总黄酮,且收效高、成本低、操作简便,适于工业化规模生产。
3.2在单因素的基础上用响应面法优化玉米须粗黄酮的纯化工艺,采用多元二次回归方程来拟合因素与响应值之间的函数关系,通过回归方程得到最优工艺:上样浓度2mg/mL,上样速度为1mL/min,上样量为55mL,吸附时间2h,洗脱剂乙醇浓度70%,乙醇体积4BV,洗脱速率为1.80mL/min,在最佳工艺条件下玉米须总黄酮回收率可达80.68%,本研究为工业纯化玉米须黄酮提供了依据。但本实验仅对解析过程进行了优化,吸附过程的优化还需进一步探索。
[1]HU QL,DENG ZH.Protective effects of flavonoids from corn silk on oxidative stress induced by exhaustive exercise in mice [J].African Journal of Biotechnology,2011,10(16):3163-3167.
[2]HU QL,ZHANG LJ,Li YN,et al.Purification and anti-fatigue activity of flavonoids from corn silk[J].International Journal of Physical Sciences,2010,5(4):321-326.
[3]方敏,占才贵,宫智勇.玉米须总黄酮的提取与抗氧化活性研究[J].食品科学,2009,30(18):206-208.
[4]FU B,LIU J,LI H,et al.The application of macroporous resins in the seperation of licorice flavonoids and glycyrrhizic acid[J]. Journal of Chromatography A,2005,1089(1-2):18-24.
[5]Qian Xu,Yanyan Shen,Haifeng Wang,et al.Application of response surface methodology to optimise extraction of flavonoids from fructus sophorae[J].Food Chemistry,2013(138):2122-2129.
[6]李国庆,李佳,顾晶晶,等.相应面法纯化柑叶黄酮的研究[J].中成药,2009,31(9):1363-1367.
[7]马丽,陈家仪,陈稚.星点设计-响应面法优选枳实总黄酮的大孔吸附树脂纯化工艺[J].中国实验方剂学杂志,2014,20(8):34-37.
[8]于智峰.苦荞黄酮大孔树脂精制工艺及抗氧化特性研究[D].西安:西北农林科技大学,2007.
[9]Jun Liu,Songyi Lin,Zuozhao Wang.Supercritical fluid extraction of flavonoids from Maydisstigma and its nitritescavenging ability[J].Food and Bioproducts Processing,2011,89:333-339.
[10]景怡,景荣琴,任远.AB-8大孔吸附树脂分离纯化玉米须中总黄酮的研究[J].中医药学报,2010,38(1):75-78.
[11]邹建国,刘飞,刘燕燕,等.响应面法优化微波辅助提取枳壳中总黄酮工艺[J].食品科学,2012,33(2):24-28.
[12]Li Yang,Ya-Lan Cao,Jian-Guo Jiang.Response surface optimization of ultrasound-assisted flavonoids extraction from the flower of Citrus aurantium L.Var.amara Engl[J].J Sep Sci,2010,33:1349-1355.
Study on purification of total flavonoids of corn silk with the Box-behnken design
GUO Zhi-hong1,2,ZHOU Hong-li2,*,GUO Xiang-ming2
(1.College of Chemistry,Jilin University,Changchun 130012,China;2.College of Chemical and Pharmaceutical Engineering,Jilin Institute of Chemical Technology,Jilin 132022,China)
To optimize the purification of total flavonoids of corn silk,AB-8 macroporous resin was carried out by response surface methodology in this study.Total flavonoids elution rate of corn silk as the indexes,on the basis of single-factor experiments,Box-behnken design was used to explore the optimal conditions.The optimal refined conditions were as follows:55mL sample volume,the velocity of sample solution 1mL/min,2mg/mL sample concentration,adsorption time 2h,4BV of 70%ethanol,elution velocity 1.8mL/min.The recovery efficiency of total flavonoids was up to 80.68%.The purity of total flavonoids increased from 4.15%to 25.68%.Results indicated that the method was simple,convenient,easy to industrial production.
flavonoids of corn silk;AB-8 macroporous resin;Box-behnken design;recovery efficiency
TS201.1
B
1002-0306(2015)04-0260-06
10.13386/j.issn1002-0306.2015.04.048
2014-07-03
郭志红(1987-),女,在读硕士研究生,研究方向:有机分析化学。
周鸿立(1967-),女,博士,教授,研究方向:天然产物的研究与开发。
吉林省科技厅科研项目(20130303050NY);吉林省教育厅2013第319号。

