南酸枣果胶性质研究
梁瑞红,郭文丽,陈 军,*,刘 伟,刘成梅,刘继延
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.江西齐云山食品有限公司,江西崇义341000)
LIANG Rui-hong1,GUO Wen-li1,CHEN Jun1,*,LIU Wei1,LIU Cheng-mei1,LIU Ji-yan2
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China;2.Jiangxi Qiyunshan Food Co.,Ltd.,Chongyi 341000,China)
南酸枣果胶性质研究
梁瑞红1,郭文丽1,陈军1,*,刘伟1,刘成梅1,刘继延2
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.江西齐云山食品有限公司,江西崇义341000)
以南酸枣枣肉为原料,采用酸提和水提两种方法提取果胶,对其理化性质进行分析,并研究其凝胶的影响因素(浓度、pH、糖含量)。结果表明,酸提和水提得到的南酸枣果胶的提取率分别为1.62%、1.27%,半乳糖醛酸含量分别为74.24%、77.81%,酯化度分别为60.04%、61.96%。所得果胶的半乳糖醛酸含量、干燥失重、灰分、蛋白质、pH均满足国标的要求。相同浓度下水提果胶的粘度大于酸提果胶;两者的凝胶强度和咀嚼性均随着果胶浓度和体系含糖量的增大而增大,且水提果胶大于酸提果胶;酸提果胶的凝胶强度和咀嚼性在pH2.8时最大,水提果胶则在pH2.6时最大。该文为南酸枣糕产品的生产提供理论参考。
南酸枣,果胶,酸提,水提,凝胶性能
LIANG Rui-hong1,GUO Wen-li1,CHEN Jun1,*,LIU Wei1,LIU Cheng-mei1,LIU Ji-yan2
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China;2.Jiangxi Qiyunshan Food Co.,Ltd.,Chongyi 341000,China)
果胶是一种天然的高分子聚合物,主要存在于植物细胞壁中,其主链是以α-l,4糖苷键连接的多聚半乳糖醛酸(homogalacturonans,HG),侧链是由短的呈毛发状的鼠李糖半乳糖醛酸聚糖(rhamnogalacturonans,RG)构成[1]。果胶作为胶凝剂、增稠剂、乳化剂、质构改良剂等,已广泛用于食品、生化、化妆品和制药工业[2]。但目前工业上果胶主要从柑橘皮和苹果渣中提取,开发新的果胶资源是适应市场需求的必然选择。
南酸枣(Choerospondias axillaries)又名山枣、五眼果、酸枣等,属漆树科落叶大乔木,是生长在我国南方几省的一种可食用的野生果实[3]。南酸枣果实含有多种营养成分,具有很高的营养和药用价值[4]。但南酸枣味酸涩,且采摘后易腐烂发酵,损失大量营养物质,不利于鲜枣的贮藏保鲜和流通,因此常被加工成酸枣蜜饯、南酸枣糕、酸枣汁、酸枣酒等产品[5],尤其是南酸枣糕一直是市场上的畅销食品。南酸枣糕制作工艺的关键技术在于调整南酸枣糕坯的糖酸比,使南酸枣果胶凝胶达到最佳程度,以使在烘干步骤脱去多余的水分,得到甜酸韧滑的产品[6]。因此,南酸枣糕的成胶与果胶含量、糖含量及pH有着密切的关系,然而,对于南酸枣果胶的研究目前尚未见相关报道。
因此本研究对南酸枣中的果胶进行研究,采用酸法和水提法从新鲜南酸枣肉中提取果胶,并对其理化性质进行分析,特别是对影响凝胶性质的关键因素进行了研究。本研究对于南酸枣相关产品的开发及产品品质的控制具有至关重要的作用,为开发南酸枣新产品、优化加工工艺以及改善南酸枣糕口感提供理论依据。
1 材料与方法
1.1材料与仪器
南酸枣肉江西齐云山食品有限公司;柑橘果胶、间羟基联苯、半乳糖醛酸Sigma公司,分析纯;无水乙醇天津市大茂化学试剂厂,分析纯。
AR224CN分析天平美国Ohaus公司;SevenMulti型pH计瑞士Mettler Toledo公司;HR83型快速水分测定仪瑞士Mettler Toledo公司;NDJ-5S数字旋转粘度计上海恒平科学仪器有限公司;UV-1600PC紫外可见分光光度计上海美谱达仪器有限公司;CT3质构分析仪美国Brookfield公司;高速离心机上海安亭科学仪器厂;恒温水浴锅江苏省金坛市荣华仪器制造有限公司。
1.2实验方法
1.2.1南酸枣果胶的提取方法新鲜的南酸枣经剥皮去核之后,将枣肉在100℃水中漂烫8min,以达到灭酶的目的。分别取100g经预处理的南酸枣果肉,置于1000mL烧杯中,按料液比1∶5加入蒸馏水,其中一个用HCl调节pH为1.8,另一个不调节。然后均放入90℃水浴中,不断搅拌1h。取出冷却至室温,4800r/min条件下离心20min,去上清液即为果胶提取液。分别按提取液与乙醇体积比为1∶2加入无水乙醇,静置2h,果胶析出,采用200目的滤布过滤,得到粗果胶。用无水乙醇洗涤粗果胶2~3次,过滤,在50℃恒温干燥箱中干燥12h,称重,并按公式(1)计算果胶提取率。
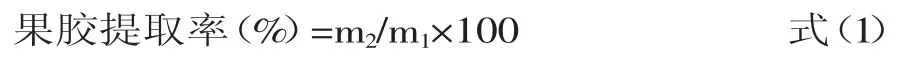
式中:m1—南酸枣果肉质量(g);m2—南酸枣果胶质量(g)。
1.2.2果胶基本理化指标的测定
1.2.2.1果胶酯化度(DE)参考Fabiola Munarin[7]的方法测定南酸枣果胶的酯化度。
1.2.2.2半乳糖醛酸含量(GA)的测定使用UV-1600PC型紫外可见分光光度计,采用间羟基联苯法[8],制作标准曲线并测定酸提和水提南酸枣果胶的半乳糖醛酸含量。
1.2.2.3干燥失重采用快速水分测定仪测定果胶中的干燥失重含量。
测定条件:将果胶样品平铺于测量盘上,在110℃下干燥至稳定。
1.2.2.4灰分参考QB 2484-2000测定果胶样品的总灰分含量。
1.2.2.5蛋白质参考Marion M.Bradford[9]的方法测定蛋白质含量。
1.2.2.6pH参考QB 2484-2000测定浓度为2.5%的样品在25℃下的pH。
1.2.3果胶的红外光谱分析取酸提和水提的南酸枣果胶干燥样品分别在红外灯干燥的条件下与KBr一起碾磨均匀,压片制样,用傅立叶红外光谱仪对样品在400~4000cm-1区内进行红外光谱扫描分析[10]。
1.2.4黏均分子量(Mν)的测定采用Ubbelohde粘度计(毛细管内径为0.52mm),通过在(25±0.1)℃水浴条件下测定果胶的粘度计算果胶的黏均分子量。将果胶溶解于0.1mol/L NaCl溶液中,使最初浓度为2mg/mL,调pH为7,室温下磁力搅拌18h。果胶溶液和溶剂在进行粘度测量之前经0.45μm滤膜过滤,其他浓度的溶液均由最初溶液稀释得到。通过Kraemer曲线外推至“零”浓度计算得到固有粘度([η])。通过Mark-Houwink方程,Mν=([η]/k)1/α计算果胶的黏均分子量,其中k和α值分别为4.36×10-4和0.78[11]。
1.2.5果胶及含糖体系粘度的测定
1.2.5.1果胶粘度的测定分别称取酸提和水提的南酸枣果胶样品,配制成质量浓度为1.0%、1.5%、2.0%、2.5%的果胶溶液。采用NDJ-5S数字旋转粘度计在25℃测量不同浓度果胶样品的粘度。
1.2.5.2果胶含糖体系粘度的测定分别称取不同质量的酸提和水提的南酸枣果胶样品,配制成果胶溶液。然后将果胶溶液置于95℃水浴锅中,加入一定量的蔗糖,使最终体系中果胶的质量浓度分别为1.0%、1.5%、2.0%、2.5%,蔗糖的质量浓度为60%。95℃快速搅拌使糖充分溶解,室温静置,4℃冰箱冷藏过夜,采用NDJ-5S数字旋转粘度计在25℃分别测其粘度。
1.2.6果胶凝胶性质的测定试样(15mL)放置在质构仪上测定凝胶强度。探头为P/0.5R;模式为TPA;测前速度为5.0mm/s,测中速度为1.0mm/s,测后速度为5.0mm/s;压缩率为50%;起动力为3g,时间10s;温度25℃。测定果胶凝胶的硬度和咀嚼性,并从凝胶的成型情况、透明度、弹性程度方面进行感官评价。
1.2.6.1浓度对南酸枣果胶凝胶的影响分别配制4组不同浓度的酸提和水提的果胶溶液,磁力搅拌溶解后,在95℃水浴条件下分别加入一定量的蔗糖,搅拌均匀,使酸提和水提果胶的最终浓度分别为1.0%、1.5%、2.0%、2.5%,最终糖含量为65%。取出室温放置,将温度计插入其中,记录各胶体在烧杯中不再流动时的温度及所用的时间,得到它们的凝胶温度及凝胶速度。然后于4~8℃冰箱放置12h,测其凝胶性质。
1.2.6.2pH对南酸枣果胶凝胶的影响据南酸枣制备工艺的相关报道,果胶凝胶的最佳pH条件为2.8~3.3[6],结合高酯果胶的凝胶pH范围通常在2.0~3.5[12],设计5个pH进行研究。分别配制5组相同浓度的酸提和水提的果胶溶液,磁力搅拌溶解后,常温下用HCl调节pH分别为2.4、2.6、2.8、3.0、3.2,在95℃水浴条件下分别加入一定量的蔗糖,使酸提和水提果胶的最终浓度均为2.0%,最终糖含量为65%。搅拌均匀后在4~8℃冰箱放置12h,测凝胶特性。
1.2.6.3糖含量对南酸枣果胶凝胶的影响分别配制3组不同浓度的酸提和水提的果胶溶液,磁力搅拌溶解后,在95℃水浴条件下分别加入不等量的蔗糖,使酸提和水提果胶的最终浓度均为2.0%,最终糖含量分别为60%、65%、70%,搅拌均匀后在4~8℃冰箱放置12h,测凝胶特性。
2 结果与分析
2.1果胶基本理化指标的测定
酸法提取和直接水提的南酸枣果胶的基本理化指标的测定数据见表1。

表1 果胶的基本理化指标Table.1 The basic physicochemical index of pectin
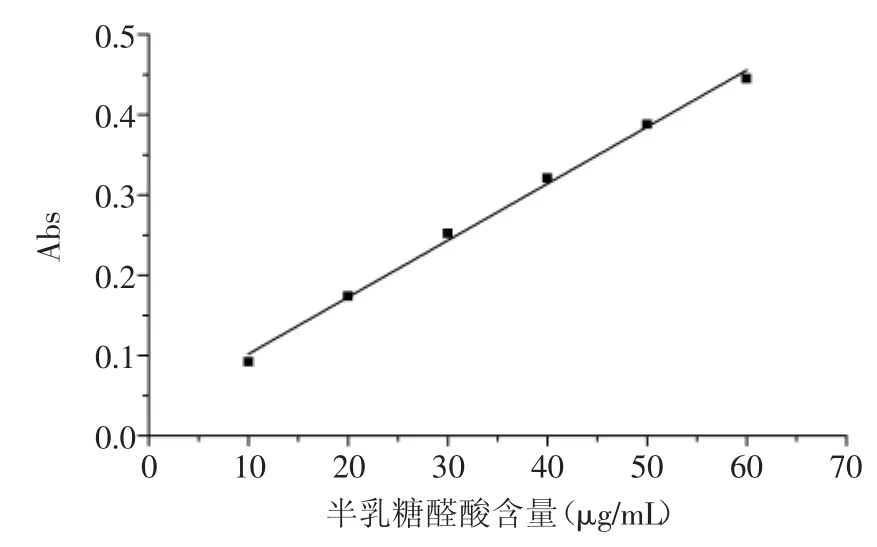
图1 间羟基联苯法制得的标准曲线图Fig.1 Standard curve made of the method with meta-hydroxydiphenyl
采用间羟基联苯法,以D-半乳糖醛酸浓度为横坐标,吸光度为纵坐标绘制标准曲线如图1所示,计算其回归方程为:y=0.0071x+0.0311,相关系数R2=0.9961。
由表1可知,酸提和水提果胶的提取率分别为1.62%、1.27%,两者的干燥失重、灰分和蛋白质含量分别为7.74%和7.68%、3.57%和3.22%、0.37%和0.23%,由此可见,酸提果胶的提取率略大于水提果胶,且前者较高的干燥失重、灰分和蛋白质含量可能是其提取率较高的原因。酸提和水提果胶的酯化度和半乳糖醛酸含量分别为60.04%和61.96%、74.24%和77.81%,水提的果胶大于酸提的果胶,且两者的酯化度均>50%,为高酯果胶。酸取和水提得到的南酸枣果胶的各个质量指标满足QB/GB标准对果胶的要求。
2.2果胶的红外光谱分析
对商业柑橘果胶、酸提和水提南酸枣果胶进行红外扫描,得出红外图谱如图2所示。
从图2可以看出,采用酸法提取和用水直接提取的南酸枣果胶的特征吸收峰大致相同。经比较,酸法提取和直接水提的南酸枣果胶与柑橘果胶标品的红外图谱相似,证明其为果胶。图谱中3450cm-1附近出现的宽峰主要来源于果胶半乳糖醛酸聚合物分子内和分子间氢键O-H的伸缩振动;2927cm-1附近的吸收峰由果胶的半乳糖醛酸甲酯CH的伸缩振动产生;1610cm-1和1720cm-1处分别为自由羧基官能团(COO-)和酯化羧基官能团(-COOR)C=O的吸收峰。南酸枣果胶在1720cm-1处吸收峰很强,1610cm-1处很弱,为高酯果胶,这与酯化度测定结果相一致[13]。

图2 酸提和水提果胶及商业柑橘果胶标品的红外光谱图Fig.2 Fourier transform infrared spectra of acid and water extraction pectin and commercial citrus pectin
2.3黏均分子量(Mν)测定
经乌氏粘度计测量得出,酸法提取和直接水提得到的果胶的固有粘度值分别为2.756、3.525dL/g,代入Mν=([η]/k)1/α,得出两者的黏均分子量分别为74.6、102.3ku。
由结果可知,酸提的南酸枣果胶的黏均分子量小于水提的南酸枣果胶。这可能是由于强酸溶剂造成了果胶分子的部分降解,从而降低了果胶的分子量。Rui-hong Liang[11]采用不同方法提取薜荔子果胶的研究中,直接水提的薜荔子果胶的黏均分子量远大于酸法提取的果胶。
2.4果胶及含糖体系粘度的测定
由表2可知,南酸枣果胶溶液的粘度随浓度的增大而显著增加,且直接水提的果胶样品的粘度明显大于相同浓度下酸法提取的果胶样品的粘度。南酸枣果胶含糖体系的粘度也随果胶浓度的增大而增大,直接水提的果胶样品的含糖体系粘度略大于相同浓度下用酸法提取的果胶样品的粘度。由于水提果胶比酸提果胶的分子量大,水溶液在流动时,其分子间产生的内摩擦较大,导致其粘度较大。果胶含糖体系的粘度远大于不含糖的果胶的粘度,这可能是由于果胶和糖之间产生多羟基联合,同时,糖的脱水作用有助于果胶分子间形成交联键,使果胶分子形成聚集体,因此,蔗糖能够显著提高果胶溶液的粘度[14]。
2.5果胶凝胶性质的测定
2.5.1浓度对南酸枣果胶凝胶的影响硬度的感官定义为牙齿间用来压迫样品所需要的力;咀嚼性为用来咀嚼一个固体食物达到吞咽状态所需的能量。硬度和咀嚼性均可表达凝胶的质构特性。由表3可知,酸提和水提的果胶在浓度为1.0%时未形成凝胶,浓度≥1.5%时则可形成凝胶。并可得出,在体系含糖量均为65%和自然pH条件下,随着浓度的增大,酸提和水提南酸枣果胶的凝胶速度均加快,凝胶温度增高,其原因是果胶溶液浓度越高时,形成的凝胶网络结点数就越多,结构越致密,因而凝胶强度就越大,凝胶速度加快,并且在较高温度下就可以形成凝胶。且水提果胶的凝胶速度比酸提果胶的凝胶速度快,凝胶温度略高,这可能是因为水提果胶的分子量比酸提果胶的略大,其形成的网络结构较致密。

表2 果胶及含糖体系粘度的测定Table.2 Viscosity determination of pectin and sugary system
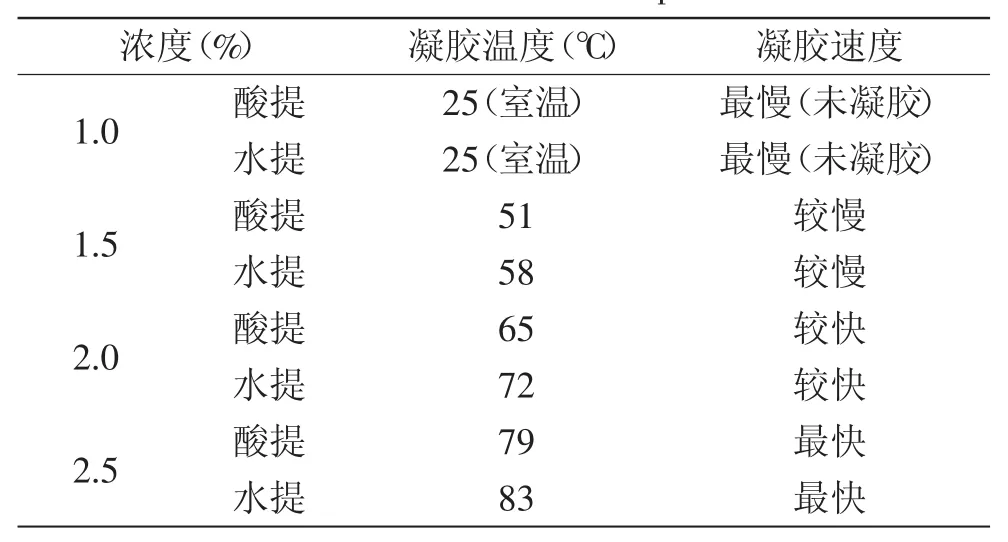
表3 不同浓度的果胶凝胶温度与凝胶速度Table.3 Gel temperature and gel rate of different concentrations of pectin
由表4可知,在体系含糖量均为65%和自然pH的条件下,随着浓度的增大,酸提和水提南酸枣果胶形成的凝胶的硬度和咀嚼性均增大,且水提果胶的凝胶强度均大于酸提果胶。

表4 不同浓度的果胶凝胶特性Table.4 Gel properties of different concentrations of pectin
2.5.2pH对南酸枣果胶凝胶的影响如表5所示,在体系果胶浓度均为2.0%,含糖量均为65%的条件下,酸提的南酸枣果胶在pH2.6~3.0的范围内能够形成凝胶,且在pH2.8处其凝胶的硬度和咀嚼性达到最大;而水提的南酸枣果胶在pH2.4~3.0范围内能够形成凝胶,且在pH2.6处其凝胶的硬度和咀嚼性达到最大。其原因是高酯果胶主要依靠氢键和疏水相互作用结合形成凝胶,pH太小会形成局部凝胶,降低凝胶强度;pH太大则游离的带负电荷的羧基较多,使分子间的排斥力增大,氢键减弱,凝胶强度减小[15]。
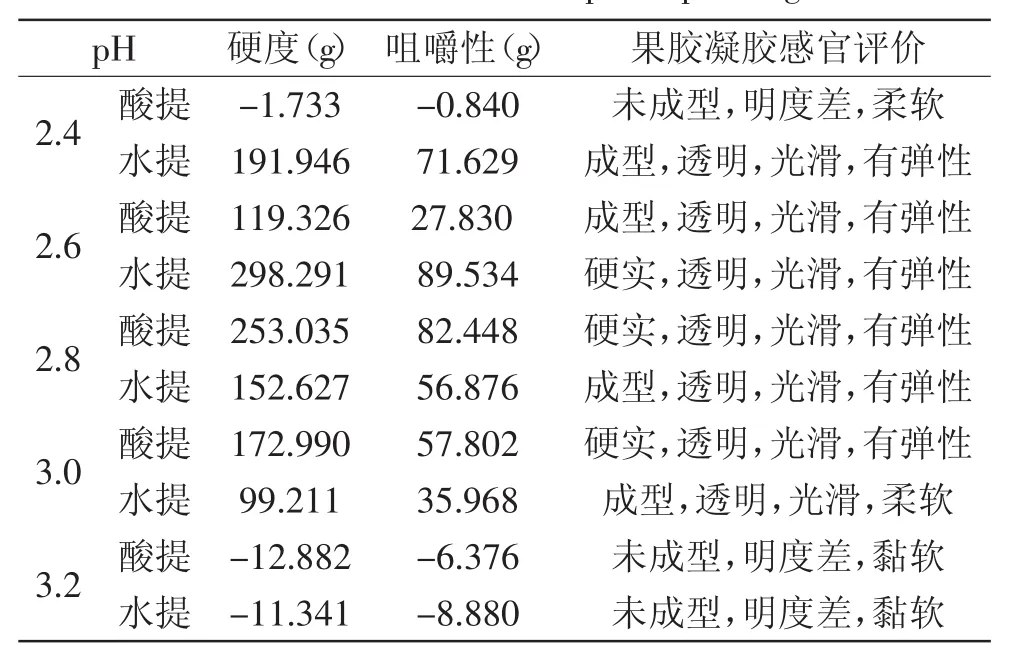
表5pH对果胶凝胶的影响Table.5 The influence of pH to pectin gel
2.5.3糖含量对南酸枣果胶凝胶的影响由表6可知,在体系果胶浓度为2.0%和自然pH条件下,含糖量在60%时,酸提和水提果胶均未形成凝胶,原因可能是糖含量为60%时,体系中的水分活度较高,疏水相互作用较弱,尚未形成三维网络结构;而含糖量为65%和70%时,随着含糖量的增加,酸提和水提的果胶形成的凝胶的硬度和咀嚼性均增大。通常蔗糖的浓度保持在60%~70%较理想,因为糖的浓度低于55%时对果胶和酸的需要量很大,而糖的浓度过高则易出现“返砂”现象[12]。
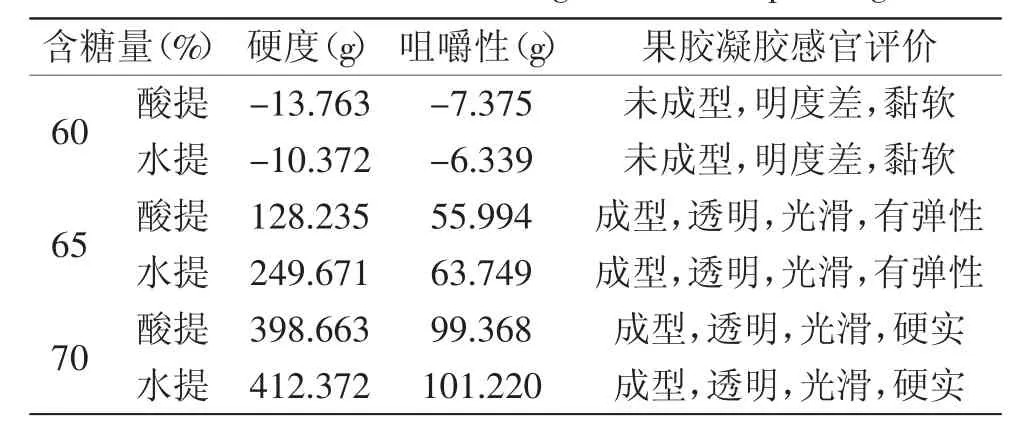
表6 糖含量对南酸枣果胶凝胶的影响Table.6 The influence of sugar content to pectin gel
3 结论
通过研究表明,酸提得到的南酸枣果胶的提取率大于水提果胶,而酯化度、半乳糖醛酸含量、pH均小于水提果胶。相同浓度下水提果胶的粘度大于酸提果胶;两者的凝胶强度和咀嚼性均随着果胶浓度和体系含糖量的增大而增大,且水提果胶均大于酸提果胶;酸提果胶的凝胶强度和咀嚼性在pH2.8时最大,水提果胶则在pH2.6时最大。所得南酸枣果胶的性质均满足国标要求,该研究为南酸枣产品的加工工艺及技术改进提供了参考。
[1]Mohnen D.Pectin structure and biosynthesis[J].Current opinion in plant biology,2008,11(3):266-277.
[2]Thakur B R,Singh R K,Handa A K,et al.Chemistry and uses of pectin—a review[J].Critical Reviews in Food Science& Nutrition,1997,37(1):47-73.
[3]李长伟,崔承彬,蔡兵,等.南酸枣的研究进展[J].解放军药学学报,2008,24(3):231-234.
[4]种小桃,程战立,姚庆强.南酸枣属植物化学成分及药理活性研究进展[J].齐鲁药事,2008,27(5):289-291.
[5]刘晓庚,陈梅梅,丁悦琴.南酸枣果的几种加工方法[J].林业科技开发,1995(1):44-46.
[6]胡泽敏,黄赣辉,周来发,等.南酸枣糕制作关键技术及设备[J].江西食品工业,2005(4):29-30.
[7]Munarin F,Petrini P,Tanzi M C,et al.Biofunctional chemically modified pectin for cell delivery[J].Soft Matter,2012,8(17):4731-4739.
[8]Blumenkrantz N,Asboe-Hansen G.New method for quantitative determination of uronic acids[J].Analytical biochemistry,1973,54(2):484-489.
[9]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical biochemistry,1976,72(1):248-254.
[10]夏天添,梁瑞红,刘成梅,等.橙皮果胶的提取及性质研究[J].食品工业科技,2011(11):234-236,240.
[11]Liang R H,Chen J,Liu W,et al.Extraction,characterization and spontaneous gel-forming property of pectin from creeping fig(Ficus pumila Linn.)seeds[J].Carbohydrate Polymers,2012,87(1):76-83.
[12]方小东.果胶凝胶机理及影响凝胶的因素[J].食品科学,1983,6(11):32-34.
[13]冯静,梁瑞红,刘成梅,等.菠萝皮果胶的提取及结构组成研究[J].食品工业科技,2011(11):241-243.
[14]田玉霞,乔书涛,仇农学,等.不同分子量级苹果果胶的流变性评价[J].陕西师范大学学报:自然科学版,2010(1):104-108.
[15]汪英.柑橘果胶的凝胶特性研究和荸荠皮果胶超声提取工艺初探[D].南昌:南昌大学,2013.
Studying properties of pectin from Choerospondias axillaris
Pectin was extracted from fresh pulp of Choerospondias axillaris by using acid and water respectively. Its physicochemical properties and factors(concentration,pH,sugar content)that influence gelling properties were studied.The results showed that the yield,galacturonic acid content,and degree of methoxylation of acid-extraction and water-extraction were 1.62%and 1.27%,74.24%and 77.81%,60.04%and 61.96%,respectively.The galacturonic acid content,weight loss on drying,ash content,protein content,pH of pectins all satisfied the requirement of national standard.The viscosity of water-extracted pectin was bigger than that of acid-extracted pectin at the same concentration.Gel strength and chewiness for both pectin increased with the increase of pectin concentration and sugar content,and those of water-extracted pectin was bigger than those of acid-extracted one.The largest gel strength and chewiness achieved at pH 2.8 for acid-extracted pectin,and pH 2.6 for water-extracted pectin.This paper provided theoretical reference for Choerospondias axillaris products.
Choerospondias axillaries;pectin;acid extraction;water extraction;gelling property
TS255.1
A
1002-0306(2015)04-0301-05
10.13386/j.issn1002-0306.2015.04.057
2014-07-30
梁瑞红(1966-),女,博士,研究员,研究方向:天然产物研究与开发。
陈军(1986-),男,博士,助理研究员,研究方向:食品(含生物质)资源的开发利用。
国家自然科学基金(31260386);江西省支撑计划(20121BBF60039)。

