虾青素酯对饲喂高脂高果糖饲料诱导的小鼠慢性炎症的影响
王学娟,赵延蕾,王倩瑞,周庆新,王静凤
(中国海洋大学食品科学与工程学院,山东青岛266003)
虾青素酯对饲喂高脂高果糖饲料诱导的小鼠慢性炎症的影响
王学娟,赵延蕾,王倩瑞,周庆新,王静凤*
(中国海洋大学食品科学与工程学院,山东青岛266003)
研究了虾青素酯对高脂高果糖饲料(high-fat high-fructose diet,HFFD)饲喂的小鼠慢性炎症的影响。采用高脂高果糖饲养的方法建立慢性炎症小鼠模型,雄性C57BL/6小鼠随机分为正常对照组(低脂低糖饲料)、模型对照组(HFFD)、阳性对照组(HFFD+虾青素,6.32mg/kg bw·d)、虾青素酯高剂量组(HFFD+虾青素酯,60.45mg/kg bw·d)、虾青素酯低剂量组(HFFD+虾青素酯,20.15mg/kg bw·d)。连续灌胃60d后,称重小鼠白色脂肪重,检测空腹血糖、葡萄糖耐受量、血清胰岛素水平、血清促炎症因子[游离脂肪酸(FFA)、一氧化氮(NO)、活性氧簇(ROS)、肿瘤坏死因子-α(TNF-α)、白介素6(IL-6)、白介素1β(IL-1β)、C-反应蛋白(CRP)]及血清炎症抑制因子[脂联素(ADPN)、白介素10(IL-10)]的含量。实验结果表明:虾青素酯能有效的降低慢性炎症小鼠的脂肪积累、空腹血糖及血清胰岛素含量(p<0.05,p<0.01),改善糖耐量及胰岛素抵抗(p<0.01);显著降低血清中促炎症因子FFA、NO、ROS、TNF-α、IL-6、IL-1β、CRP的含量(p<0.01),显著提高炎症抑制因子ADPN、IL-10水平(p<0.01)。虾青素酯可显著改善小鼠的慢性炎症反应,作用机制可能与其调节炎症相关因子水平有关。
虾青素酯,慢性炎症,促炎症因子,炎症抑制因子
炎症是一种机体的自我保护机制,传统的炎症反应是短期的适应性反应。而慢性炎症是一种长期的低度炎症状态,营养和能量过剩是这种低度炎症发生的主要诱因[1]。高脂高糖诱导的小鼠慢性炎症模型的机理是高脂高糖喂养导致小鼠肥胖,而过量的脂质积累会使脂肪细胞变得肥大,改变脂肪细胞内的信号,触发胞内的应激反应。炎症信号通路被激活,诱导大量的炎症介质表达,最后引起慢性炎症的发生[2]。慢性炎症参与多种疾病的产生和发展,为许多疾病(如胰岛素抵抗和Ⅱ型糖尿病)[3]共同的病理基础。在慢性炎症过程中,人体的免疫系统被激活,分泌大量的炎性因子,如TNF-α、IL-6、IL-10及ADPN等[4]。炎症因子在介导炎症反应的病理变化过程中起重要调控作用。
虾青素天然存在于各种海洋和水生生物中,学名为3,3′-二羟基-4,4′-二酮基-β,β′胡萝卜素,又可称为超级维生素E[5]。雨生红球藻作为自然界中能够合成和积累虾青素达到最大水平的生物,成为国内外的研究热点[6-7]。虾青素有多种结构形式,可淬灭单线态氧、清除自由基、防止或终止因单线态氧和自由基引起的链式反应。虾青素的结构[8]如图1所示。
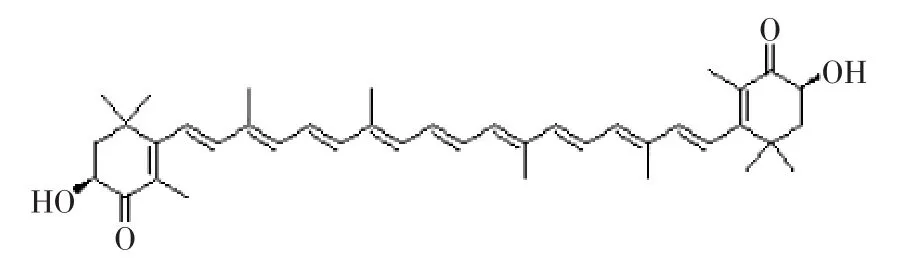
图1 虾青素的结构Fig.1 Structures of astaxanthin
虾青素的末端环装结构各有一羟基,这种羟基与脂肪酸结合形成虾青素酯,根据脂肪酸结合的羟基数可分为单双酯。酯化后,其疏水性增强,双酯比单酯的亲酯性强[9]。虾青素酯与油脂性质相近,组分复杂,纯化和检测困难。雨生红球藻孢子态细胞中提取到的虾青素主要为虾青素酯,游离的虾青素较少。虾青素酯具有较好的抗氧化性,抑制酪氨酸酶活性及预防皮肤癌的发生[10]。目前虾青素酯的研究多为其皂化为虾青素的工艺研究,鲜有关于虾青素酯的生理功能研究的报道。本文以虾青素酯为研究对象,研究其对小鼠慢性炎症的影响,为其抗炎生物活性提供理论依据。
1 材料与方法
1.1材料与仪器
实验用虾青素酯从雨生红球藻中提取的,为单酯和双酯混合物,虾青素含量为29.776%。所含的脂肪酸有C18∶4、C18∶3、C18∶2、C18∶1、C16∶0、C18∶0和C20∶0,虾青素酯为深红色膏状物,易溶于有机试剂,难溶于水,其化学结构[11]如图2所示;健康C57BL/6J小鼠雄性(体重18~20g,4~5周龄),北京维通利华实验动物技术有限公司提供,合格证号为SCXK(京)2012-0001,实验期间动物房环境温度为22~24℃,湿度为52%~58%;葡萄糖测定试剂盒中生北控生物科技股份有限公司;血清胰岛素(insulin released test,INS)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素6(interleukin-6,IL-6)、白介素1β(interleukin-1β,IL-1β)、C-反应蛋白(C-Reactive protein,CRP)、游离脂肪酸(free fatty acids,FFA)、一氧化氮(nitrogen monoxide,NO)、活性氧簇(reactive oxygen species,ROS)、脂联素(adiponectin,ADPN)、白介素10(interleukin-10,IL-10)试剂盒均为ELISA试剂盒,为美国Sigma公司产品。
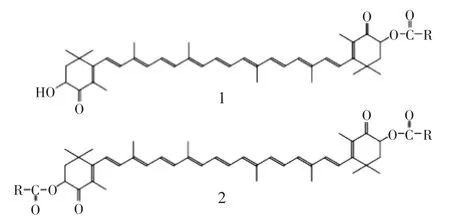
图2 虾青素酯的结构Fig.2 Structures of astaxanthin esters
Model680型酶标仪美国Bio-Rad公司;GL-20M型高速冷冻离心机上海卢湘仪离心机仪器有限公司;GXZ型光照培养箱宁波东南仪器有限公司;HH-8型丹瑞数显恒温水浴锅金坛市双捷实验仪器厂;CAV114C型电子天平OHAUS公司。
1.2实验方法
1.2.1小鼠慢性炎症模型建立及动物实验模型建立的方法:雄性C57BL/6J小鼠适应性喂养4d,按体重随机分为5组:正常组、模型组、阳性对照组、虾青素酯低、高剂量组。正常对照组喂食低脂低果糖饲料,其他组喂食高脂高果糖饲料。正常组和模型组灌胃生理盐水,阳性对照组灌胃虾青素(灌胃剂量为6.32mg/kg bw·d),虾青素酯低剂量组和高剂量组灌胃虾青素酯(灌胃剂量分别为20.15mg/kg bw·d和60.45mg/kg bw·d),以纯的虾青素含量为剂量标准,阳性对照组及虾青素酯高、低剂量组灌胃剂量分别相当于纯虾青素剂量6、18、6mg/kg bw·d。
实验周期为60d,实验结束后,尾静脉取血测定小鼠空腹血糖及葡萄糖耐受量。摘眼球取血,脱颈椎处死小鼠,分离血清,测定血清胰岛素含量。迅速剥离脂肪组织(皮下脂肪、附睾脂肪和肾周脂肪),称重并记录。小鼠饲料配方见表1。
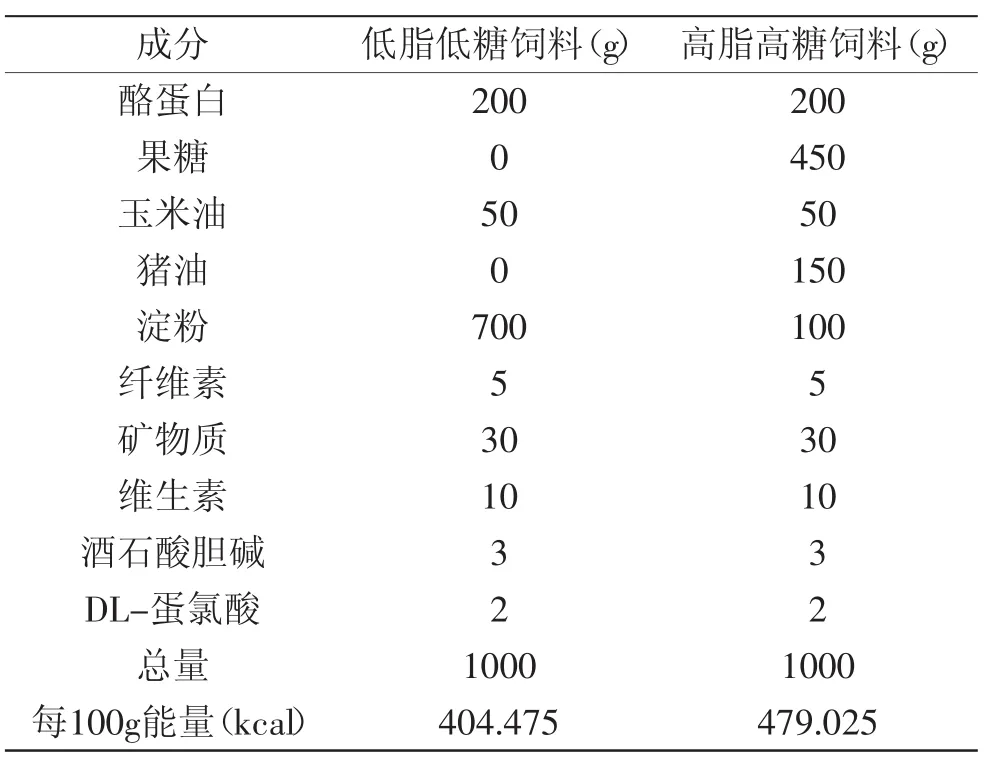
表1 动物实验饲料成分Table.1 Compositions of experimental diets
1.2.2空腹血糖及糖耐量的测定小鼠禁食不禁水8h,尾静脉取血,分离血清。根据葡萄糖试剂盒说明书测定空腹血糖浓度。于小鼠首次尾静脉取血后立即灌胃葡萄糖(2g/kg·bw),分别测定给葡萄糖后0.5、1、2h的血糖值,按式(1)计算血糖浓度——时间曲线下面积(area under the curve,AUC)。
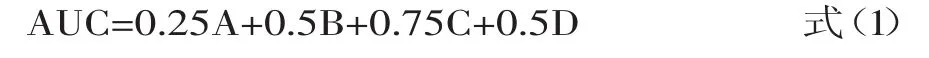
其中,A、B、C、D分别代表0、0.5、1、2h的血糖值。
1.2.3血清胰岛素含量的测定禁食不禁水10h的小鼠尾静脉取血,分离血清,参照ELISA试剂盒方法测定,并按式(2)、式(3)计算HOMA-IR及QUICKI的值。HOMA-IR是用于评价个体胰岛素抵抗程度的指标;QUICKI是用于评价个体胰岛素敏感性的指标。

1.2.4血清中促炎症因子FFA、NO、ROS、TNF-α、IL-6、IL-1β、CRP的水平参照各ELISA试剂盒方法,分别检测小鼠血清中FFA、NO、ROS、TNF-α、IL-6、IL-1β及CRP含量。
1.2.5血清中炎症抑制因子ADPN、IL-10水平参照ADPN试剂盒和IL-10试剂盒方法,测定小鼠血清中ADPN和IL-10含量。
1.3数据分析
数据分析采用SPSS11.0软件进行单因素方差分析,以最小显著差数法(LSD)进行两两比较,以p<0.05为具有统计学意义上的差异显著,实验结果用±S表示。
表2 虾青素酯对慢性炎症小鼠体重及脂肪重量的影响(n=10,±S)Table.2 Effect of astaxanthin esters on the weight of body and white fat of chronic inflammation mice(n=10,±S)
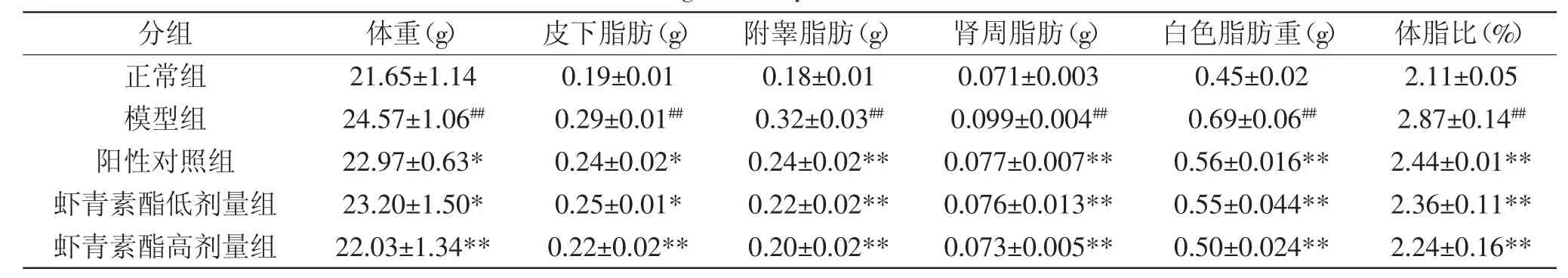
表2 虾青素酯对慢性炎症小鼠体重及脂肪重量的影响(n=10,±S)Table.2 Effect of astaxanthin esters on the weight of body and white fat of chronic inflammation mice(n=10,±S)
注:#表示与正常组相比差异显著(p<0.05),##表示与正常组相比差异极显著(p<0.01);*表示与模型对照组相比差异显著(p<0.05),**表示与模型对照组相比差异极显著(p<0.01);表3~表5、图3同。
分组 体重(g) 皮下脂肪(g) 附睾脂肪(g) 肾周脂肪(g) 白色脂肪重(g) 体脂比(%)正常组 2 1 . 6 5 ± 1 . 1 4 0 . 1 9 ± 0 . 0 1 0 . 1 8 ± 0 . 0 1 0 . 0 7 1 ± 0 . 0 0 3 0 . 4 5 ± 0 . 0 2 2 . 1 1 ± 0 . 0 5模型组 2 4 . 5 7 ± 1 . 0 6## 0 . 2 9 ± 0 . 0 1## 0 . 3 2 ± 0 . 0 3## 0 . 0 9 9 ± 0 . 0 0 4## 0 . 6 9 ± 0 . 0 6## 2 . 8 7 ± 0 . 1 4##阳性对照组 2 2 . 9 7 ± 0 . 6 3 * 0 . 2 4 ± 0 . 0 2 * 0 . 2 4 ± 0 . 0 2 * * 0 . 0 7 7 ± 0 . 0 0 7 * * 0 . 5 6 ± 0 . 0 1 6 * * 2 . 4 4 ± 0 . 0 1 * *虾青素酯低剂量组 2 3 . 2 0 ± 1 . 5 0 * 0 . 2 5 ± 0 . 0 1 * 0 . 2 2 ± 0 . 0 2 * * 0 . 0 7 6 ± 0 . 0 1 3 * * 0 . 5 5 ± 0 . 0 4 4 * * 2 . 3 6 ± 0 . 1 1 * *虾青素酯高剂量组 2 2 . 0 3 ± 1 . 3 4 * * 0 . 2 2 ± 0 . 0 2 * * 0 . 2 0 ± 0 . 0 2 * * 0 . 0 7 3 ± 0 . 0 0 5 * * 0 . 5 0 ± 0 . 0 2 4 * * 2 . 2 4 ± 0 . 1 6 * *
2 结果与分析
2.1虾青素酯对小鼠体重及脂肪重量的影响
肥胖是慢性炎症发生的重要诱发因素,如表2所示,模型组小鼠的体重及白色脂肪重量极显著(p<0.01)高于正常组,分别增加了13.49%和53.33%,体脂比极显著(p<0.01)增加了36.02%。灌胃高剂量虾青素酯后,模型小鼠的体重和白色脂肪重量分别降低7.96%和23.91%(p<0.01),体脂比下降了19.86%(p<0.01)。说明虾青素酯能极显著(p<0.01)抑制小鼠体重的增加,减少体内脂肪的积累。
表3 虾青素酯对慢性炎症小鼠空腹血糖、胰岛素抵抗的影响(n=10,±S)Table.3 Effect of astaxanthin esters on fasting blood-glucose and insulin resistant parameters in chronic inflammation mice(n=10,±S)
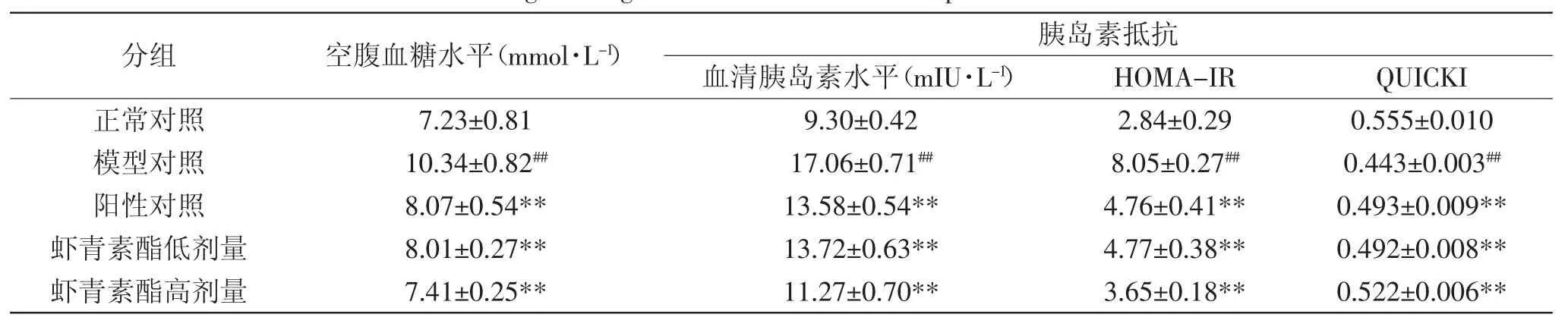
表3 虾青素酯对慢性炎症小鼠空腹血糖、胰岛素抵抗的影响(n=10,±S)Table.3 Effect of astaxanthin esters on fasting blood-glucose and insulin resistant parameters in chronic inflammation mice(n=10,±S)
分组 空腹血糖水平(m m o l · L-1) 胰岛素抵抗血清胰岛素水平(m I U · L-1) H O M A -I R Q U I C K I正常对照 7 . 2 3 ± 0 . 8 1 9 . 3 0 ± 0 . 4 2 2 . 8 4 ± 0 . 2 9 0 . 5 5 5 ± 0 . 0 1 0模型对照 1 0 . 3 4 ± 0 . 8 2## 1 7 . 0 6 ± 0 . 7 1## 8 . 0 5 ± 0 . 2 7## 0 . 4 4 3 ± 0 . 0 0 3##阳性对照 8 . 0 7 ± 0 . 5 4 * * 1 3 . 5 8 ± 0 . 5 4 * * 4 . 7 6 ± 0 . 4 1 * * 0 . 4 9 3 ± 0 . 0 0 9 * *虾青素酯低剂量 8 . 0 1 ± 0 . 2 7 * * 1 3 . 7 2 ± 0 . 6 3 * * 4 . 7 7 ± 0 . 3 8 * * 0 . 4 9 2 ± 0 . 0 0 8 * *虾青素酯高剂量 7 . 4 1 ± 0 . 2 5 * * 1 1 . 2 7 ± 0 . 7 0 * * 3 . 6 5 ± 0 . 1 8 * * 0 . 5 2 2 ± 0 . 0 0 6 * *
2.2虾青素酯对小鼠空腹血糖及葡萄糖耐受性的影响
葡萄糖耐受性与AUC成反比,结果见表3和图3,模型组小鼠的空腹血糖及AUC较正常组极显著(p<0.01)升高,表明模型小鼠出现了高血糖症状,且糖耐量受损严重。灌胃虾青素酯后,模型小鼠的空腹血糖水平和AUC极显著(p<0.01)下降了25.44%和17.23%。结果显示虾青素酯有一定的降血糖作用。
2.3虾青素酯对小鼠胰岛素抵抗的影响
慢性炎症是胰岛素抵抗的启动因子。HOMA-IR及QUICKI分别是评价胰岛素抵抗程度及胰岛素敏感性的指标。如表3所示,模型组血清胰岛素水平极显著(p<0.01)高于正常对照组。暗示高脂高果糖饲料饲喂小鼠可能增强胰岛素的分泌,以维持血糖的稳定。经灌胃虾青素酯后,模型小鼠的血清胰岛素水平降低了26.75%(p<0.01)。HOMA-IR和QUICKI指数分别降低了47.70%和升高了14.44%;显示虾青素酯可极显著(p<0.01)改善小鼠的胰岛素抵抗,增强胰岛素的敏感性。
2.4虾青素酯对小鼠血清中促炎症因子的影响
机体在发生慢性炎症反应时会释放许多介导细胞内炎症反应信号转导的炎症因子,诱导IR的发生,引起脂质代谢的异常,加重机体的炎症反应。这类介导炎症反应的因子称为促炎症因子。
高糖高脂喂养小鼠诱导的慢性炎症,会使机体内脂质代谢紊乱,游离脂肪酸含量上升,游离脂肪酸的含量与慢性炎症密切相关。能量和营养过剩能激发机体发生应激反应,直接活化炎症信号通路,阻断胰岛素功能并调节炎症因子的翻译表达。活性氧(reaetive oxygen speeies,ROS)会促进这个循环的发生,加重炎症反应且对胰岛素抵抗的发生发展起关键作用[12]。NO是血管舒张物质,维持血管张力。胰岛素抵抗患者常存在内皮依赖性血管舒张功能障碍,目前认为这种障碍的原因是内皮细胞一氧化氮生成减少或生物利用度降低[13]。NO水平代偿性的升高预示着胰岛素抵抗早期心血管疾病的发生。
表4 虾青素酯对慢性炎症小鼠促炎症因子水平的影响(n=10,±S)Table.4 Effect of astaxanthin esters on the levels of pro-inflammatory cytokines in chronic inflammation mice(n=10,±S)
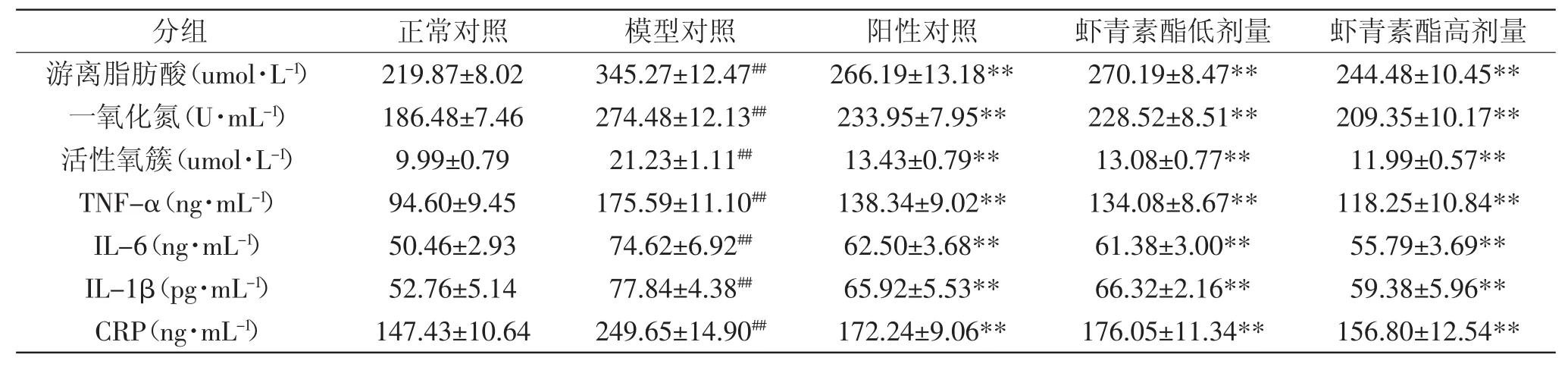
表4 虾青素酯对慢性炎症小鼠促炎症因子水平的影响(n=10,±S)Table.4 Effect of astaxanthin esters on the levels of pro-inflammatory cytokines in chronic inflammation mice(n=10,±S)
分组 正常对照 模型对照 阳性对照 虾青素酯低剂量 虾青素酯高剂量游离脂肪酸(u m o l · L-1) 2 1 9 . 8 7 ± 8 . 0 2 3 4 5 . 2 7 ± 1 2 . 4 7## 2 6 6 . 1 9 ± 1 3 . 1 8 * * 2 7 0 . 1 9 ± 8 . 4 7 * * 2 4 4 . 4 8 ± 1 0 . 4 5 * *一氧化氮(U · m L-1) 1 8 6 . 4 8 ± 7 . 4 6 2 7 4 . 4 8 ± 1 2 . 1 3## 2 3 3 . 9 5 ± 7 . 9 5 * * 2 2 8 . 5 2 ± 8 . 5 1 * * 2 0 9 . 3 5 ± 1 0 . 1 7 * *活性氧簇(u m o l · L-1) 9 . 9 9 ± 0 . 7 9 2 1 . 2 3 ± 1 . 1 1## 1 3 . 4 3 ± 0 . 7 9 * * 1 3 . 0 8 ± 0 . 7 7 * * 1 1 . 9 9 ± 0 . 5 7 * * T N F -α(n g · m L-1) 9 4 . 6 0 ± 9 . 4 5 1 7 5 . 5 9 ± 1 1 . 1 0## 1 3 8 . 3 4 ± 9 . 0 2 * * 1 3 4 . 0 8 ± 8 . 6 7 * * 1 1 8 . 2 5 ± 1 0 . 8 4 * * I L -6(n g · m L-1) 5 0 . 4 6 ± 2 . 9 3 7 4 . 6 2 ± 6 . 9 2## 6 2 . 5 0 ± 3 . 6 8 * * 6 1 . 3 8 ± 3 . 0 0 * * 5 5 . 7 9 ± 3 . 6 9 * * I L -1 β(p g · m L-1) 5 2 . 7 6 ± 5 . 1 4 7 7 . 8 4 ± 4 . 3 8## 6 5 . 9 2 ± 5 . 5 3 * * 6 6 . 3 2 ± 2 . 1 6 * * 5 9 . 3 8 ± 5 . 9 6 * * C R P(n g · m L-1) 1 4 7 . 4 3 ± 1 0 . 6 4 2 4 9 . 6 5 ± 1 4 . 9 0## 1 7 2 . 2 4 ± 9 . 0 6 * * 1 7 6 . 0 5 ± 1 1 . 3 4 * * 1 5 6 . 8 0 ± 1 2 . 5 4 * *
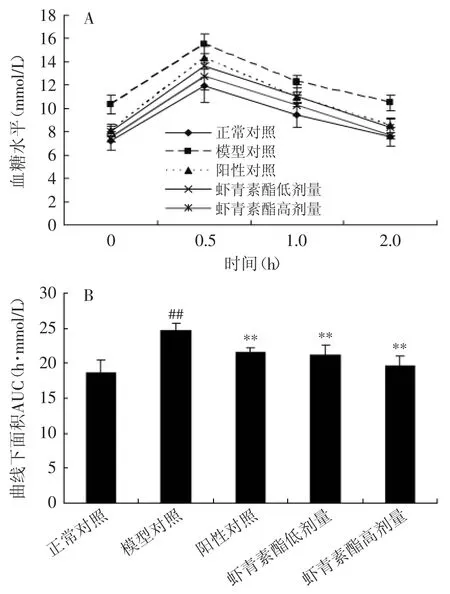
图3 虾青素酯对葡萄糖耐受性的影响(n=10,±S)Fig.3 Effect of astaxanthin esters on oral glucose tolerance in chronic inflammation mice(n=10,±S)
TNF-α可通过抑制胰岛素信号转导,促进脂解作用使外周FFA的含量增加,以及激活炎症通路NF-κB。同时TNF-α还可作用于其他炎症因子,如促进IL-6的生成,抑制脂联素的产生[14]。脂肪组织是IL-6的主要来源,高血糖会促进其分泌。在炎症反应早期,少量的IL-6可促进胰岛素的产生,导致高胰岛素血症[15]。IL-6可抑制胰岛素信号传导,抑制脂联素的表达及升高FFA的水平[16]。CRP是全身炎症反应的敏感性标志物,TNF-α及IL-6可刺激其合成。相反,CRP又可介导IL-6的产生,促进TNF-α的释放。IL-1β在接到胰岛素β细胞损伤中起着重要作用[17],且与其他细胞因子相互影响,相互制约。相关文献报道,IL-1β是细胞核组织在慢性炎症过程中的重要调节子[18-19]。
由表4所示,模型组小鼠血清中促炎症因子FFA、NO、ROS、TNF-α、IL-6、IL-1β及CRP的浓度极显著(p<0.01)高于正常组,灌胃虾青素酯后,分别降低了25.47%、20.24%、40.96%、28.14%、21.49%、19.26%、33.33%。结果表明虾青素酯能极显著(p<0.01)降低小鼠的促炎症因子FFA、NO、ROS、TNF-α、IL-6、IL-1β及CRP的分泌,缓解小鼠慢性炎症反应。
2.5虾青素酯对小鼠血清中炎症抑制因子的影响
机体在炎症反应时,除了释放促炎症因子还会分泌炎症抑制因子,抑制慢性炎症反应。如:脂联素、IL-10等。ADPN及IL-10是炎症抑制因子。研究发现,血浆ADPN随胰岛素敏感性下降而下降,ADPN可通过调节糖脂代谢,降低FFA改善IR[20],且抑制TNF-α的生成和释放,起一定的抗炎作用。IL-10是一种重要的抗炎性因子,可抑制IL-6、TNF-α的合成[21]。如表5所示,模型组小鼠炎症抑制因子ADPN及IL-10的水平极显著(p<0.01)低于正常对照组小鼠。灌胃虾青素酯后,慢性炎症小鼠血清中ADPN及IL-10水平分别增长了75.21%和56.29%(p<0.01)。表明虾青素酯可通过增加小鼠体内的炎症抑制因子的分泌来改善慢性炎症反应。
表5 虾青素酯对小鼠血清中炎症抑制因子的影响(n=10,±S)Table.5 Effect of astaxanthin esters on the levels of antiinflammatory cytokines of chronic inflammation mice(n=10,±S)

表5 虾青素酯对小鼠血清中炎症抑制因子的影响(n=10,±S)Table.5 Effect of astaxanthin esters on the levels of antiinflammatory cytokines of chronic inflammation mice(n=10,±S)
分组 A D P N(p g · m L-1) I L -1 0(p g · m L-1)正常对照 1 1 5 9 . 2 8 ± 3 2 . 8 9 1 7 9 . 3 0 ± 7 . 8 4模型对照 4 0 5 . 7 8 ± 6 7 . 4 5## 9 5 . 9 9 ± 1 0 . 1 7##阳性对照 5 7 2 . 5 5 ± 5 2 . 7 * * 1 3 7 . 3 8 ± 8 . 8 6 * *虾青素酯低剂量 6 2 1 . 3 2 ± 4 4 . 0 3 * * 1 4 3 . 6 0 ± 9 . 2 3 * *虾青素酯高剂量 8 0 0 . 6 4 ± 8 9 . 4 7 * * 1 5 6 . 4 5 ± 9 . 7 4 * *
3 结论
本实验采用高脂高果糖饲养的方法建立了慢性炎症小鼠模型,研究了虾青素酯对其慢性炎症的改善作用。结果显示,虾青素酯能显著(p<0.05,p<0.01)降低小鼠的体重及体脂比,降低空腹血糖水平,改善糖耐受损,抑制胰岛素抵抗,增加血清中促炎症因子含量,降低炎症抑制因子的含量。结果表明:虾青素酯可显著改善小鼠的慢性炎症反应,其作用机制可能是通过对炎症因子的调控实现的。本文的研究为虾青素酯的生物活性研究提供理论依据。对虾青素酯在食品中的应用具有重要的意义。
虾青素酯的脂肪酸组成复杂,结构及含量较难鉴定。目前提取的天然虾青素酯多以混合物形式存在。建议研究改进虾青素酯纯化鉴定的方法,纯化虾青素酯混合物的各组分及其构效关系,实现虾青素酯的高值化利用。
[1]詹莉莉,杨志秋,傅正伟.肥胖与慢性炎症的研究进展[J].中国细胞生物学报,2011,33(3):297-305.
[2]郑艳华,赖毛华,刘华,等.慢性炎症及氧化应激与PCOS远期患病风险的研究进展[J].现代妇产科进展,2013,22(8):674-676.
[3]Hotamisligil G S.Inflammatory pathways and insulin action [J].Int J Obes Relat Metab Disord,2003,27(Suppl 3):53-55.
[4]Creager M A,Luscher T F,Cosentino F,et al.Diabetes and vascular disease:pathophysiology,clinical consequences,and medical therapy:Part I[J].Circulation,2003,108(12):1527-32.
[5]Dietmar E.Breithaupt.Identification and Quantification of Astaxanthin Esters in Shrimp(Pandalus borealis)and in a Microalga(Haematococcus pluvialis)by Liquid Chromatography-Mass Spectrometry Using Negative Ion Atmospheric Pressure Chemical Ionization[J].Agric Food Chem,2004,52(12):3870-3875.
[6]Lorenz R T,Cysewski G R.Commercial potential for Haematococcus microalgaes anatural source of astaxanthin[J]. Tibtech,2000,18:160-167.
[7]Orosa M,Valero J F,Herrero C,et al.Comparison of the accumulation of astaxanthin in Haematococcus pluvialis and other green microalgae under N-starvation and high light conditions[J].Biotech Lett,2001,23:1079-1085.
[8]李浩明,高蓝.虾青素的结构,功能与应用[J].精细化工,2003,20(1):32-37.
[9]尹蔷.虾青素及其复方产品抗炎性能的研究[D].天津:天津科技大学.2010.
[10]Rao A R,Sindhuja H N,Dharmesh S M,et al.Effective inhibition of skin cancer,tyrosinase,and antioxidative properties by astaxanthin and astaxanthin esters from the green alga haematococcus pluvialis[J].Agric Food Chem,2013,61,3842-3851.
[11]Miao F,Lu D,Li Y,et al.Characterization of astaxanthin esters in Haematococcus pluvialis by liquid chromatographyatmospheric pressure chemical ionization mass spectrometry[J]. Anal Chem,2006,352(2):176-181.
[12]张冬燕,刘保林,刘康.氧化应激与胰岛素抵抗分子机制之联系[J].海峡药学,2012,24(9):1-5
[13]马向红,黄体钢,杨万松,等.胰岛素抵抗大鼠血清NO、血管紧张素Ⅱ和超氧阴离子水平的变化[J].中国慢性病预防和控制,2005,13(1):9-19.
[14]张豫文,洪洁.炎症因子与胰岛素抵抗[J].诊断学理论与实践,2010,9(1):90-94.
[15]Rotter V,Nagaev I,Smith U.Interleukin-6(IL-6)induces insulin resistance in 3T3-L1 adipocytes and is,like IL-8 and tumor necrosis factor-alpha,overexpressed in human fat cells from insulin-resistant subjects[J].J Biol Chem,2003,278(46):45777-45784.
[16]Banks W A,Willoughby L M,Thomas D R,et al.Insulin resistance syndrome in the elderly:assessment of functional,biochemical,metabolic,and inflammatory status[J].Diabetes Care,2007,30(9):2369-2373.
[17]Charles A,Dinarell O,Marc Y,et al.Role of IL-1β in type 2 diabetes[J].Current opinion in endocrinolog.Diabetes&Obesity,2010,17:314-321.
[18]Charles A,Dinarell O.Interleukin-1 in the pathogenesis and treatment of inflammatory diseasea[J].Blood,2011,117:3720-3732.
[19]吕敬雷,王鹏,隋雪琴,等.缺血后处理对脑缺血再灌注大鼠TNF-α和IL-1β表达影响[J].齐鲁医学杂志,2012,27(4):319-322.
[20]Yamauchi T,Kamon J,Ito Y,et al.Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J].Nature,2003,423:762-769.
[21]沈国函.牙周基础治疗对慢性牙周炎合并冠心病的老年患者IL-8、IL-10水平的影响[D].大连:大连医科大学,2012.
Effect of astaxanthin esters on chronic inflammation mice fed with high fructose and high fat diet
WANG Xue-juan,ZHAO Yan-lei,WANG Qian-rui,ZHOU Qing-xin,WANG Jing-feng*
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
This study investigated the effects of astaxanthin esters on chronic inflammation mice fed by high fat and high fructose diet(HFFD).The model mice were established by feeding HFFD.Male C57BL/6 mice were randomly assigned into the normal control(low fat and low fructose diet),model control(HFFD),positive control(HFFD+astaxanthin,6.32 mg/kg bw·d),high dose(HFFD+astaxanthin esters,60.45mg/kg bw·d)and low dose(HFFD+astaxanthin,20.15mg/kg bw·d)groups.All animals were fed with diet and water freely for 60 days. After experiments,the white fat weight,fasting serum glucose,serum insulin,serum pro-inflammatory cytokines,such as free fatty acids(FFA),NO,reactive oxygen species(ROS),tumor necrosis factor-α(TNF-α),interleukin-6(IL-6),interleukin-1β(IL-1β)and C-Reactive protein(CRP),and serum anti-inflammatory cytokines including adiponectin and interleukin-10(IL-10)levels were determined.Results showed that astaxanthin esters significantly decreased the white fat weight(p<0.05),Fasting serum glucose(p<0.01)and insulin levels(p<0.01),ameliorated insulin resistance(p<0.01),lowed serum pro-inflammatory cytokines FFA,NO,ROS,TNF-α,IL-6,IL-1βand CRP levels(p<0.01),and increased serum anti-inflammatory cytokines adiponectin and IL-10 levels(p<0.01).Astaxanthin esters significantly ameliorated the chronic inflammation of mice fed by HFFD and the mechanisms might involve the regulation of serum inflammation factors.
astaxanthin esters;chronic inflammation;pro-inflammatory cytokines;anti-inflammatory cytokines
TS254.9
A
1002-0306(2015)04-0352-05
10.13386/j.issn1002-0306.2015.04.068
2014-06-03
王学娟(1992-),女,硕士研究生,研究方向:食品加工与安全。
王静凤(1964-),女,博士,教授,研究方向:海洋生物活性物质。
国家自然科学基金(31371876);山东省资助创新专项项目(2012CX80201)。

