贝类中PSP毒素的脱除方法研究进展
毛丹卉,解万翠,杨锡洪,卞中园,章超桦
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,国家贝类加工技术研发分中心(湛江),广东湛江524088)
贝类中PSP毒素的脱除方法研究进展
毛丹卉,解万翠,杨锡洪*,卞中园,章超桦
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,国家贝类加工技术研发分中心(湛江),广东湛江524088)
为探讨麻痹性贝类毒素(PSP)的脱除方法,有效提高贝类食品安全性。本文从物理法、化学法以及生物法三个方面综述了PSP毒素在水产品中的脱除方法及净化效率;对温度处理,安全吸附,微生物降解,酶解转化等的研究成果进行了分析总结,以期为贝类脱除PSP毒素及贝类净化研究提供参考。
贝类,麻痹性贝类毒素,脱除方法,研究进展
麻痹性贝类毒素(Paralytic shellfish poisoning toxins,PSP toxins)是来源于赤潮中有毒藻类的一种神经毒素,可通过食物链蓄积传递给鱼类、贝类、鸟类及哺乳动物,对人类造成潜在威胁[1-2]。PSP种类及名称见表1。据报道人类首次PSP中毒,是误食了亚得里亚海的含PSP海鞘[3]。20世纪70年代以后,赤潮爆发的频率、范围增多,导致PSP中毒事件剧增[4-5]。当体液中PSP浓度达到1.2×10-9mol/L时,就可与细胞膜的钠通道结合,使影响动作电位的神经细胞或肌肉细胞的钠通道减少,PSP也可与Ca2+、K+通道结合,导致一系列神经中毒症状:麻木、晕眩、共济失调、复视、吞咽困难,甚至死亡[6-11]。
PSP是一类四氢嘌呤的三环化合物,现已发现20多种不同结构的PSP毒素[12],根据其取代基的不同分为三类(见图1,表1):氨基甲酸酯类毒素(Carbamate toxins),N-磺酰氨甲酰基类毒素(N-sulfocarbamoyl toxins),去氨甲酰基毒素(Decarbamoyl toxins)。
为避免PSP毒素在贝类体内富集并通过食物链传递给人类带来危害,许多国家已纷纷建立起相应的贝类监测体系,并制定了非常严格的贝类PSP毒素检测卫生标准[13]。PSP毒素的计算方法:
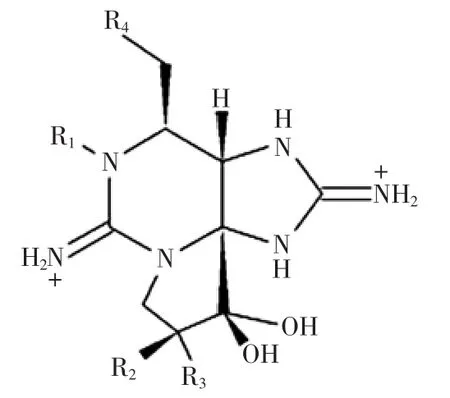
图1 麻痹性贝类毒素的分类及结构式Fig.1 Structure of paralytic shellfish poisoning
STXequ.=∑ni=1Xi×fi,
式中,Xi是PSP的含量,fi是PSP的影响因素[14]。
人体摄入PSP毒素1mg就可能导致死亡,以鼠单位MU表示的人中毒的范围约在300~2500mg STXdiHCl-eq./kg,致死剂量约为1500~15000mg STXdiHCl-eq./kg。国际上对于贝类的麻痹性贝毒规定通常是不超过800mg STXdiHCl-eq./kg。WHO和UNESCO(IOC)规定贝类体内不超过170mg STXdiHCleq./kg,欧盟91/492/EEC规定贝类体内PSP不得超过800mg STXdiHCl-eq./kg,一些发达国家,如挪威是不超过400mg STXdiHCl-eq./kg,我国规定上市贝类的麻痹性贝类毒素含量必须低于800mg STXdiHCleq./kg[15-17]。
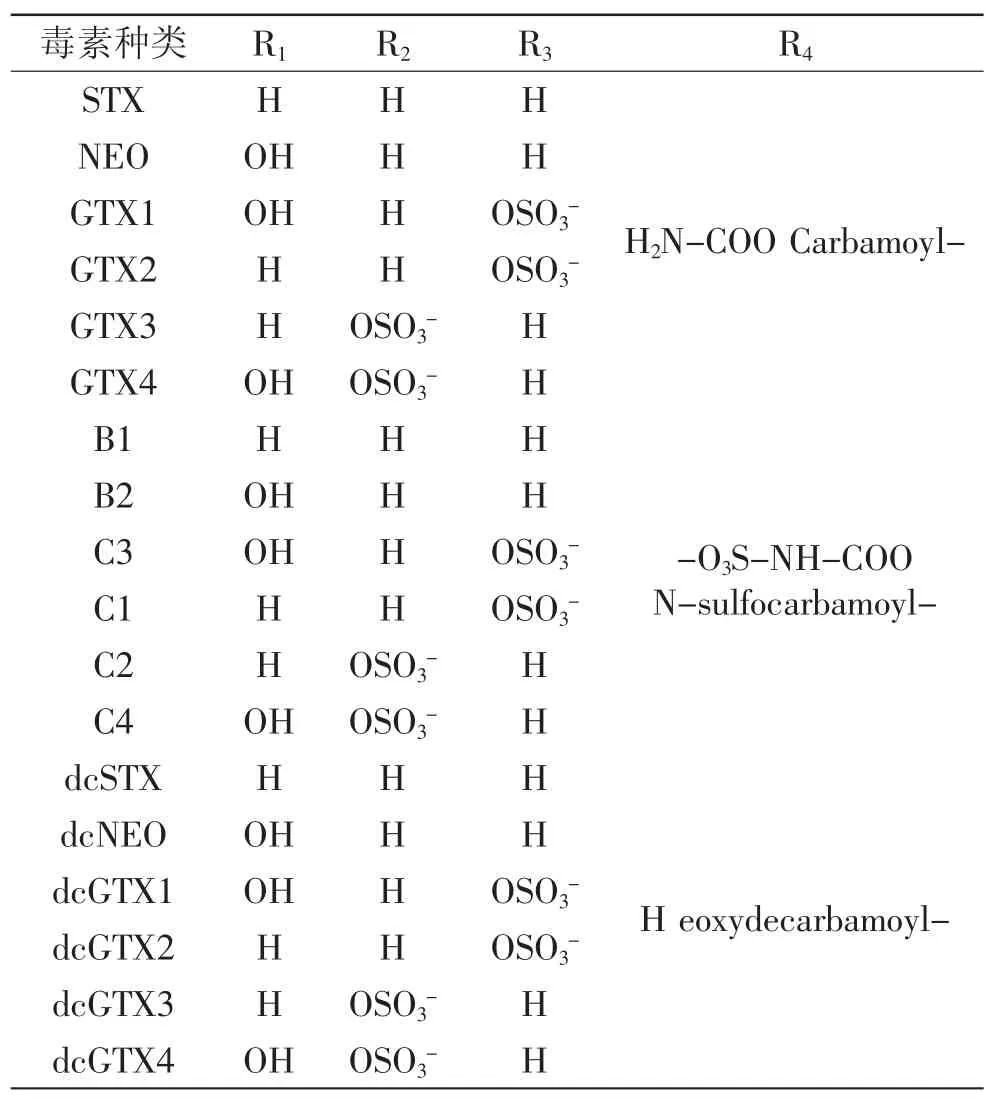
表1 麻痹性贝类毒素的种类及名称Table.1 The types and names of PSP toxins
含有PSP毒素的贝类,不仅对人类的健康造成严重威胁,而且也影响海产品出口贸易,使地方经济遭受巨大的损失。因此,如何降低贝类中超标麻痹性毒素的含量成为亟待解决的重大问题。鉴于贝类的PSP毒素净化技术对保障消费者饮食安全具有重要的现实意义,本文对已有毒素及净化方面的研究进行综述。
1 物理法
1.1温度处理
温度处理减少毒素的原理是通过高温或反复冻融将组织中毒素渗透出体外,但受组织结构的影响,因为组织比较疏松的肌肉易于溶出毒素,而组织僵硬的内脏却很难将毒素溶出体外,此外超高温(≥100℃)处理对毒素还会起到一定的降解作用。
Antonio等[18]在工业生产中,采用冷冻和热加工对染毒贻贝、蛤蜊、牡蛎进行处理,发现热加工中三者所含毒素从(405±5)mg STXdiHCl-eq./kg减少到350mg STXdiHCl-eq./kg,而冻融可以降低牡蛎中毒素含量,对蛤蜊没有任何影响,这可能是由于牡蛎较蛤蜊毒素多储存于非内脏组织中。Berenguer[19]证实罐头加工可以降低贝体内PSP毒素含量,选用毒素含量为800mg STXdiHCl-eq./kg的原材料在蒸煮(98℃,9min)和杀菌(115℃,45min)过程中,不同检测方法所测得结果分别下降:71.7%、81.8%(小鼠法检测);70.6%、90.9%(荧光法检测);77.9%、83.5%(HPLC方法检测)。Prakash[20]发现在中性pH条件下罐头高温加工可以清除90%~95%的毒素,而在室温下储藏一年后毒素将会继续降低36%~35%。Vieites等[21]在研究贻贝罐头生产中发现有超过50%的毒素加工时被清除并进入汤汁,因此大部分可被去除,所以罐头加工工艺对降低产品最终毒性具有显著效果,但不同毒素在带包装热加工中的降解显著不同。Indrasena等[22]发现热力破坏的程度与pH密切相关,将提纯后的C1/2、B1、1-4(GTX)、NEO和STX等毒素于温度90~130℃,pH3~7,时间10~20min条件下处理,C1/2毒素在低pH下迅速降解,GTX1/4在高温高pH下降解,GTX 2/3在低pH起初增加,随着继续加热减少,而STX在pH3~4持续增加,毒素在温度为130℃,pH6~7条件都有所下降解。
烹饪是家庭中常用的加工食用贝类方法,而且也是降低、避免PSP毒素危害的最后一道防线。Medcof等[23]利用3种典型的烹饪法(煮、蒸、炸)进行了实验,发现这三种烹饪方法并不能完全消除PSP毒素中毒危害,商业罐头也不能起到明显效果,因此,还没有一种可以用于商业净化的方法。Wong等[24]研究蒸煮对扇贝肌肉、内脏、鳃和外套膜中PSP排出的影响时发现,蒸煮分别可以排出53%、57%和69%的毒素,总排除毒素占扇贝总毒素的51%,但内脏和闭壳肌仍然保留37%的毒素水平,而性腺中的毒素没有显著减少。可见通过烹饪方法消除毒素危害将因贝的组织不同而存在差异,这就要求消费者在选择烹饪、食用贝类时,尽量选取易于消除毒素的部位。基于以往研究,可将温度处理进行总结,见表2,高温及超高温处理对PSP有脱除效果,而动融法处理因贝类不同而不同。

表2 PSP毒素在不同温度处理中的脱除情况Table.2 Desorption of PSP in diffident Temperature
1.2吸附法
吸附法通常指利用多孔性固体相物质吸着污染物的处理过程。吸着污染物的固体物质称做吸附剂。如活性炭、树脂等;常分为物理吸附、化学吸附和离子交换吸附等类型。
活性炭可用于PSP的脱除,图2为Honglan Shide等[25]通过计算机模拟的不同pH下STX各基团分布情况,得到10种STX,它们的带电位置(见图2)的带电情况见表3。
在计算机模拟假设基础上,经过验证实验发现,沥青基活性炭粉对STX的脱除能力,随pH增加而增强;中性时(如:pH7.05),活性炭浓度对吸附能力具有显著性影响,而在pH8.2和pH10.7时影响较小。
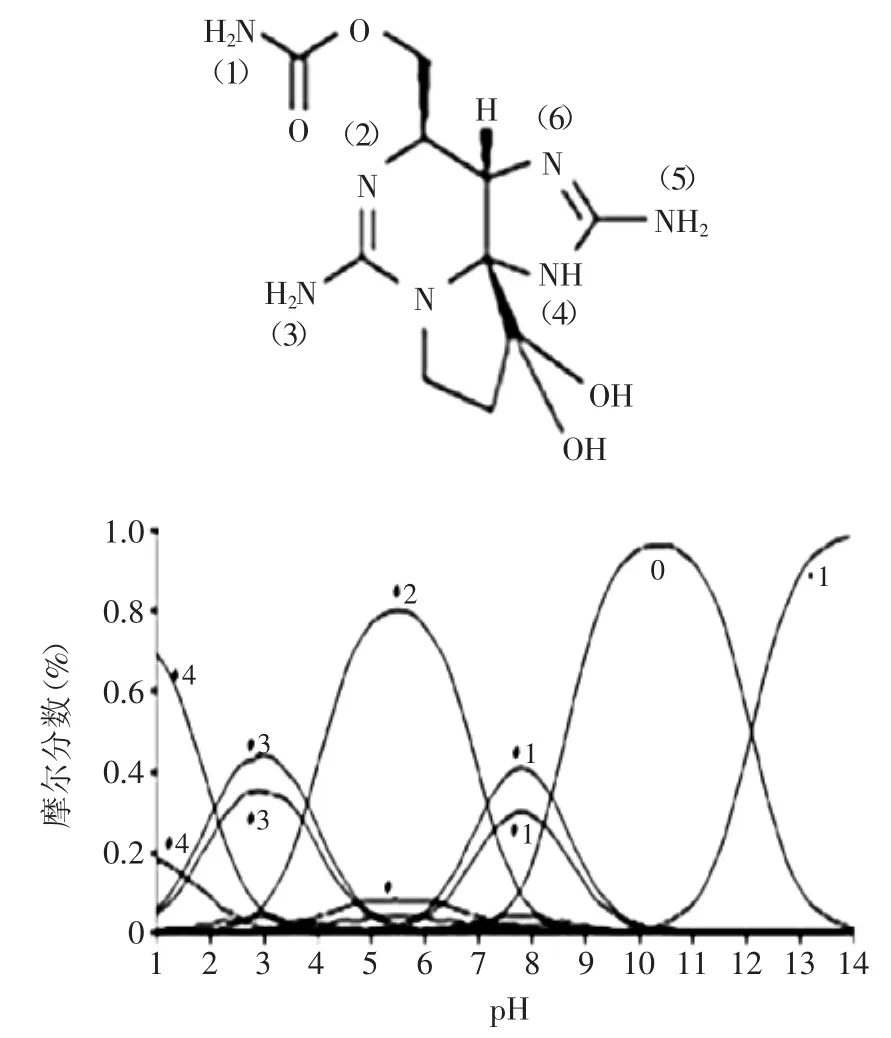
图2 计算机模拟不同pH中STX的分子带电结构Fig.2 Molecule structure and computed speciation of STX in aqueous solution of different pH levels
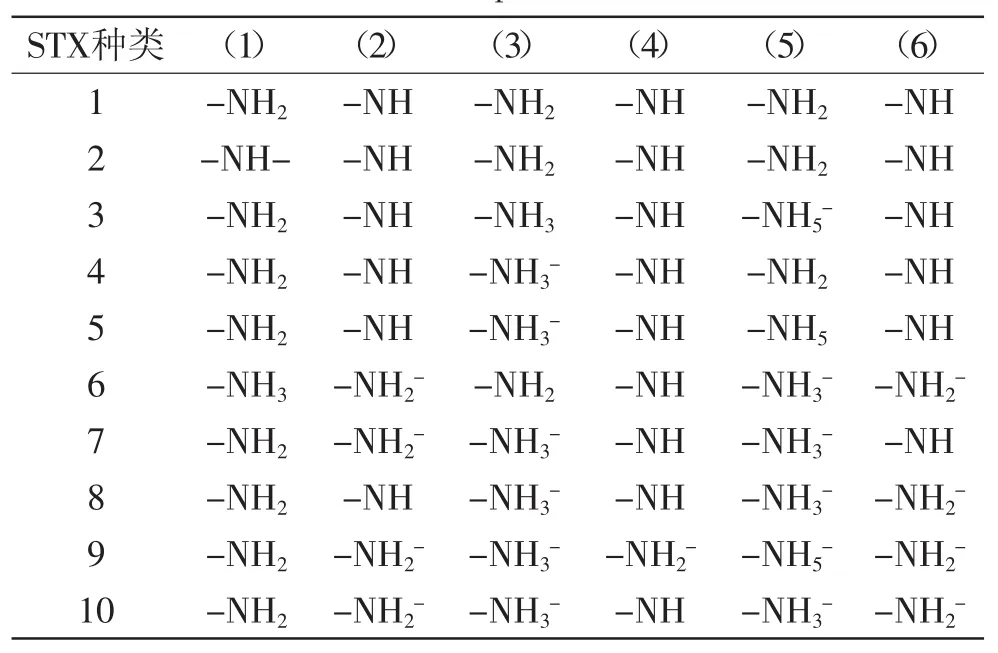
表3 计算机模拟的不同pH下的10种STX可能的带电情况Table.3 The Computed 10 speciation of STXs’electricity in different pH levels
壳聚糖是自然界中较丰富的天然聚合物之一,其分子链中含有大量的-NH2和-OH活性官能团,能与重金属离子配位形成络合物,不仅可以用作金属离子的吸附剂,而且可以将其应用于蛋白质、类毒素等的吸附。Xie等[26]发现壳聚糖也具有吸附PSP毒素的性能,其最佳吸附条件为:pH3.5,接触时间90min,温度40℃,CTS添加量3.5mL(2%),并建立了准一级反应和准二级反应模型。刘晓丽[27]在制备具有海产风味牡蛎酶解液时用壳聚糖微球对牡蛎浆液中的PSP进行净化,在pH接近中性、时间为120~180min、温度在室温25℃、壳聚糖微球的添加量为2~2.5g时,具有较高的吸附率,并且,壳聚糖微球很容易从牡蛎匀浆中分离出来。壳聚糖及其衍生物具有天然高分子物质生物可降解性,无毒,并且将其衍生化后可以增加其水溶性,可用于活体牡蛎脱除;它不仅可以吸附PSP毒素,而且可以吸附重金属;此外,它以虾蟹壳为原料,来源广泛且价廉,变废为宝,实现资源的利用。壳聚糖吸附法具有较好的安全性,但是其脱除机理尚无定论,因此目前的研究重点是对其机理的探索。
1.3暂养净化法
目前贝类净化的方法主要有:自然净化、暂养净化和工厂净化,而贝类暂养是指将贝类从受微生物污染的生长区域移到有管辖机构监管的区域,并在该区域内停留足够时间将污染降低到供人类消费的可接受水平(CAC/RCP 52-2003:水产与水产加工品操作规范),是目前采用较多的净化方法,然而不同的贝种对PSP毒素的排出表现出一定的差异性。
Bricelj等[28]根据毒素的排除率将双壳贝类分为快/中排出和慢排出两大类,属于快/中速排毒的紫贻贝每天排除率约为15%,而作为慢速排毒的栉孔扇贝,其内脏在毒素排出阶段的前15d平均每天排出3.7%,后6d只有1.2%。为此有研究人员向海水中添加无毒饵料藻来加快受污染贝类对毒素的排出,Marielle等[29]对比投喂无毒饵料藻——中肋骨条藻(Skeletonema Costatum)和不投喂饵料藻对牡蛎体内PSP毒素排出的影响,表明投喂无毒藻可以显著提高牡蛎对毒素的排出速率。
研究人员发现,尽管投喂饵料藻带来的贝类毒素排出速率的加快,但某些生物脱除剂可能更加速有毒物质的脱除速度[30],如壳聚糖。刘晓丽[31-32]通过分别投喂壳聚糖和羧甲基壳聚糖对贝类体内PSP进行净化,在pH接近中性、时间为120~180min、温度在室温25℃、壳聚糖微球的添加量为2~2.5g时,具有较高的吸附脱除率,因此壳聚糖衍生物加快了贝类中PSP毒素的脱除。Xie等[33-34]通过不同浓度毒藻对牡蛎进行富集喂养,又以无毒小球藻混合羧甲基壳聚糖投喂受PSP污染的牡蛎,发现混有羧甲基壳聚糖的小球藻投喂的牡蛎比单喂小球藻对PSP毒素的脱除效果好,7d投喂壳聚糖(CTS)和扁藻+壳聚糖(MA+CTS)分别使毒素从9.07MU/g减少至毒素1.41、0.12MU/g。
2 化学法
2.1臭氧降解
臭氧是一种强氧化剂,大量研究数据表明臭氧能降解甲藻毒素、河豚毒素等生物类毒素,产物和机理至今尚未完全研究清楚。Blogoslawski等[35]在1979年将臭氧处理应用于蛤蜊中毒素的脱除,研究发现暴露于臭氧处理2周的海水,蛤蜊的外套膜和鳃、内脏、虹吸管、触角以及肌肉都表现出快速的排毒现象,Orr等[36]用臭氧处理海水时发现臭氧不能破坏STX以及GTX2/3毒素,但可以破坏31%GTX-5、22%C1/2和77%dc-STX,然而相反的研究结果也存在[37]。
2.2氯水降解
利用PSP毒素的水溶性,经过消毒氯水处理可以降低贝肉的毒性,这一方法是欧盟委员会唯一授权的清除PSP毒素方法[38]。Rupam Sharma等[39]将从阿拉伯海采集到的染毒贝类样品,分别置于以25mg/h通臭氧和0.5ppm的次氯酸钙水溶液中处理,发现10d后臭氧处理组的样品已经完全脱毒,氯水处理组的样品也在5~10d毒素急剧下降。Newcombe[40]发现,氯水对毒素的清除速率,与pH密切相关,pH在6~9范围内能更有效的清除毒素。此外,Gacutan[41]比较了臭氧、氯气对牡蛎PSP毒素的脱除作用,发现臭氧比氯水更能有效的降低毒性。
3 生物法
3.1微生物降解法
生活在海洋中的贝类寄生着大量微生物,微生物对PSP毒素生物转化起着重要作用,不断有研究人员从贝类中分离出具有转化PSP毒素的微生物的报道,这种微生物与PSP毒素共存的环境中可能存在能够降解PSP的酶。首次发现微生物具有降解PSP毒素作用的学者是Sugawara[42],其从蛤蜊和鳎(一种鱼类)肠道分离得到的Acinetobacter和Pseudomonas具有分解GTX1/4、C1/2毒素能力。Smith等[43]的研究发现不同微生物转化PSP的能力不同,如:其分离得到命名为M12和R65的这两株菌可以转化GTX 1/4生成GTX 2/3,而命名为Q5的这株菌能降解GTX 1/4不产生GTXs。此外,Donovan等[44]在2008年研究微生物对PSP毒素的降解作用时,用受毒素污染的蓝贻贝(Mytilus edulis)以及有毒藻的提取物进行培养,从内脏中分离的72种微生物中有19种微生物具有分解毒素的能力,其中命名为C30、CSC、C100等的7株可以在3d内分解90%的毒素,并且其余12株可以将STX、NEO完全分解。利用微生物进行脱毒方面的研究很有价值,为PSP净化提供了新思路。
3.2酶促转化
海洋生物中的PSP毒素趋向于在消化腺中富集已经得到认同[45-46],同时,有研究表明消化腺有利于PSP毒素发生转化[47-50],这就说明可能存在毒素转化酶。
PSP转化酶最早是1981年在线纹布目蛤中发现的,之后也在其他蛤中发现了这种酶[51-53]。Yuko Cho等在日本蛤Mactra chinensis提纯出了毒素转化酶,鉴定为氨甲酰水解酶Ⅰ,它可以水解N-磺酰胺甲酰和氨基钾酸酯类毒素亚基,之后又提纯出来了一种新的PSP转化酶,可以水解N-磺酰胺甲酰类毒素亚基[54-55]。未来仍需要进一步研究分离出的毒素转化酶,测定其转化产物的毒性大小,从而找出合适的降毒酶制剂,加以应用。
4 结语
受污染的贝类在一定程度上给人们生活、社会经济带来威胁,我国各大沿海都有海产贝类养殖,而且也都有过PSP毒素污染的报道。到目前为止没有PSP毒素特效解毒剂,是否能利用微生物的分解作用,找到一种安全、有效、高活力的可降解PSP的微生物菌株,或者结合化学法处理提高解毒效果有效,还需进一步的研究。利用栅栏技术将利用暂养净化、壳聚糖衍生物脱除、高温处理等结合起来,对原料和成品进行脱毒,是较为有效的方法,今后可从这方面入手快速安全有效脱除PSP。此外,如何有效、快速的净化贝类毒素,成为避免PSP毒素给人类带来危害的关键,也应该是水产加工领域研究的重点。
[1]Llewellyn L E.Saxitoxin,a toxic marine natural product that targets a multitude of receptors[J].Natural Product Reports,2006,23(2):200-222.
[2]Mortensen A M.Massive fish mortalities in the Faroe Islands causedbyaGonyaulaxexcavataredtide[J].Toxicon Dinoflagellates,1985:165-170.
[3]Romana R B,Ivana U.PSP toxins profile in ascidian Microcosmus vulgaris(Heller,1877)after human poisoning in Croatia(Adriatic Sea)[J].Toxicon,2014,79(2):28-36.
[4]Hallagraef G M,Anderson D M,Cembella A D,et al.Manual on Harmful Marine Microalgae,IOC Manuals and Guides No.33 [M].UNESCO Publishing Paris,2003:25-49.
[5]Van Dolah F M.Marine algal toxins:origins,health effects,and their increased occurrence[J].Environ Health Perspect,2000,108:133-141.
[6]Hungerford J M.Algal Toxin in Seafood and Drinking Water:Control measures in shellfish and finfish industries in the USA. in:I.R.Falconer(Ed.)[M].Wekell,Marleen M,New York:Academic Press,1993:117-128.
[7]KaoC Y.Algal Toxin in Seafood and Drinking Water:Paralytic shellfish poisoning.in:I.R.Falconer(Ed.)[M].Wekell,Marleen M,New York:Academic Press,1993:75-86.
[8]Gessner B D,Moddaugh J P.Paralytic Shellfish Poisoning in Alaska:a 20-year retrospective analysis[J].Am J Epidemiol,1995,141(4):766-770.
[9]Gessner B D,Moddaugh J P,Doucette G J.Paralytic shellfish poisoning in Kodiak,Alaska[J].Ann J Epidemiol,1997,167:351-353.
[10]Narahashi T,Moore J W.Neuractive agents and nerve membrane conductaces[J].Gen Physiol,1968,51(5):93-101.
[11]Hille B.Ion Channels of Excitable Membranes:second editon [M].USA:Sinauer Associates Inc,1992.
[12]Etheride S M.Paralytic shellfish poisoning:Seafood safety and human health perspectives[J].Toxicon,2010,56(2):108-122.
[13]贝类生产环境卫生监督管理暂行规定[J].中国水产,1998(5):8-7,11.
[14]Sayfritz S J,Aasen J A,Aune T.Determination of paralytic shellfish poisoning toxins in Norwegian shellfish by liquid chromatography with fluorescence and tandem mass spectrometry detection[J].Toxicon,2008,52(2):330-340.
[15]Per A,Tore A,Daniel G B.et al.Report of the joint FAO/ WHO/IOC ad hoc expert consultation on biotoxins in bicalve molluscs[R].Norway,2004.
[16]Jan Alwxander,Diane Benford,Alan Boobis,et al.Marine biotoxins in shellfish-Summary on regulated marine biotoxins scientific opinion of the Panel on contaminants in the food China [J].EFSA,2009,1306(8):1-23.
[17]吴富忠.贝类麻痹性毒素的检测[J].中国卫生检验杂志,2005,15(11):1383-1386.
[18]Reboreda A,Lago J,Chapela M J,et al.Decrease of marine toxin content in bivalves by industrial processes[J].Toxicon,2010,55(2):235-243.
[19]Berenguer J A,Gonzalez L,Jimenez I,et al.The effect of commercial processing on the paralytic shellfish poison(PSP)content of naturally contaminated Acanthocardia tuberculatum L [J].Food Additives&Contaminants,1993,10(2):217-230.
[20]Prakash A.Fisheries Research Board of Canada:Paralytic shellfish poisoning in eastern Canada[M].Canada:Bulletins of the Fisheries Research Board,1971,177:58-65.
[21]Vieites J M,Botana L M,Vieytes M R,et al.Canning process that diminishes paralytic shellfish poison in naturally contaminated mussels(Mytilus galloprovincialis)[J].Journal of Food Protection,1999,62(5):515-519.
[22]Indrasena W M,Gill T A.Thermal degradation of partially purified paralytic shellfish poison toxins at different times,temperatures,and pH[J].Journal of Food Science,2000,65(6):948-953.
[23]Medcof J C,Leim A H,Needler A B,et al.Paralytic shellfish poisoning on the Canadian Atlantic coast[J].Bull Fish,1947,75:1-32.
[24]Wong C K,Hung P,Lee K L,et al.Effect of steam cooking on distribution of paralytic shellfish toxins in different tissue compartmentsofscallopsPatinopectenyessoensis[J].Food Chemistry,2009,114(1):72-80.
[25]Honglan Shi,Jie Ding,Terry Timmons,et al.pH effects on the adsorption of saxitoxin by powdered activated carbon[J]. Harmful Algae,2012,19:61-67.
[26]Wancui Xie,Xiaoli Liu,Xihong Yang,et al.Kinetics and Thermodynamics of Paralytic Shellfish Poisoning Adsorption on Chitosan[J].Biobased Materials and Bioenergy,2013,7(2):233-239.
[27]刘晓丽.壳聚糖及其衍生物脱除牡蛎中麻痹性贝类毒素的研究[D].湛江:广东海洋大学,2011.
[28]Bricelj V M,Shumway S E.Paralytic shellfish toxins in bivalve molluscs:occurrence,transfer kinetics,and Biotransformation[J]. Reviews in Fisheries Science,1998,6(4):315-383.
[29]朱明远,皱迎麟,吴荣军,等.栉孔扇贝体内麻痹性贝毒的累积与排出过程研究[J].海洋学报,2003,25(2):75-83.
[30]Marielle Guéguen,Michèle Bardouil,Régis Baron,et al. Detoxification of Pacific oyster Crassostrea gigas fedondiets of Skeletonema costatum with and without silt,following PSP contaminationbyAlexandriumminutum[J].AquaticLiving Resources,2008,21:13-20.
[31]Xiaoli Liu,Wancui Xie,Xihong Yang,et al.Optimization of Adsorption Technology of Chitosan with Paralytic Shellfish Poisoning(PSP)by Response Surface Methodology(RSM)[J]. Advanced Materials Research,2011,236(5):2673-2678.
[32]刘晓丽,章超桦,解万翠,等.链状亚历山大藻的培养及麻痹性贝类毒素的提取和检测[J].水产学报,2010,34(11):1783-1788.
[33]Wancui Xie,Xiaoli Liu,Xihong Yang,et al.Accumulation and depuration ofparalytic shellfish poisoning toxins in the oyster Ostrea rivularis Gould-Chitosan facilitates the toxin depuration [J].Food Control,2013,30(2):446-452.
[34]解万翠,卞中园,杨锡洪,等.微小亚历山大藻(A.minutum)对牡蛎清滤率以及麻痹性贝类毒素(PSP)蓄积的影响[J].水产学报,2013,37(12):1848-1853.
[35]Orr P T,Jones G J,Hamilton G R.Removal of saxitoxins from drinking water by granular activated carbon,ozone and hydrogen peroxide-implications for compliance with the Australian drinking water guidelines[J].Water Research,2004,38(20):4455-4461.
[36]Blogoslawski W J,Stewart M E.Paralytic shellfish poison in Spisula solidissima:anatomical location and ozone detoxification [J].Marine Biology,1978,45(3):261-264.
[37]White A W,Martin J L,Legresley M.Toxic dinoflagellates:Inability of ozonation to detoxify paralytic shellfish toxins in soft-shell clams[M].France:Sylvain Pare`,1985:473-478.
[38]96/77/EC:Commission Decision of 18 January 1996 establishing the conditions for the harvesting and processing of certain bivalve molluscs coming from areas where the paralytic shellfish poison level exceeds the limit laid down by Council Directive91/492/EEC[J].OfficialJournalof European Communities,1996,15(1):46-47.
[39]RupamSharma, VenkateshvaranK.Purushothaman,bioaccumulation and depuration of paralytic shellfish toxin in Perna viridis Meretrix meretrix from Mumbai,India[J].Marine Sciences,2011,40(4):542-549.
[40]Newcombe G,Nicholson B.Treatment options for the saxitoxin class of cyanotoxins[J].Water Science and Technology:Water supply,2002,2(5-6):271-275.
[41]Gacutan R Q.Toxic Red tides and Shellfish Toxicity in South East Asia:Detoxification of Pyrodinium generated paralytic shellfish poisoning toxin in Perna viridis from Western Samar[M]. Philippines,Singapore:SEAFDEC,1984:80-95.
[42]Sugawara A,Imamura T,Aso S,et al.Change of paralytic shellfish poison by the marine bacteria living in the intestine of the Japanese surf clam,Pseudocardium sybillae,and the brown sole,Pleuronectesherensteini[J].ScientificReportsofthe Hokkaido Fisheries Experimental Station,1997,50(3):35-42.
[43]Smith E A,Grant F,Ferguson C M,et al.Biotransformations of paralytic shellfish toxins by bacteria isolated from bivalve mollusks[J].Applied and Environmental Microbiology,2001,67(5):2345-2353.
[44]Donovan C J,Ku J C,Quilliam M A,et al.Bacterial degradation of paralytic shellfish toxins[J].Toxicon,2008,52(1):91-100.
[45]Cembella A D.Harmful marine algal blooms:Anatomical and spatio-temporal variation in PSP toxin composition in natural populations of the surf-clam Spisula solidissima in the gulf of MaineHarmful marine algal blooms 6th International conference on toxic marine phytoplankton[M].Paris:Lavoisier Science Publishers,1995:421-426.
[46]ChenC Y,Chou H N.Accumulation and depuration ofparalytic shellfish poisoning toxins by purple clam Hiatula rostrata Lighttoot[J].Toxicon,2001,39:1029-1034.
[47]SullivanJ J,Iwaoka W T,Liston J.Enzymatic transformation of PSP toxins in the littleneck clam(Protothaca staminea)[J]. Biochem Biophys,1983,114:465-472.
[48]Lu Y H,Hwang D F.Effects of toxins din flagellates and toxin biotransformation in bivalves[J].Toxins,2002,11(4):315-322.
[49]Fast M D,Cembella A D,Ross N W.In vitro transformation of paralytic shellfish toxins in the clams Mya arenaria and Protothaca staminea[J].Harmful Algae,2006,5(1):79-90.
[50]Kotaki Y,Oshima Y,Yasumoto T.Bacterial transformation of paralytic shellfish toxins in coral reef crabs and a marine snail [J].Fish/Nissuishi,1985,51(6):1009-1013.
[51]Sullivan J J,Iwaoka W T,Liston J.Enzymatic transformation of PSP toxins in the littleneck clam(Protothaca staminea)[J]. Biochem Biophys,1983,114:465-472.
[52]OshimaY.Harmful Marine Algal Blooms:Chemical and enzymatic transformation of paralytic shell fish toxins in marine organisms[M].Paris:Lavoisier Intercept,1995:475-480.
[53]Artigas M L,Vale P J,Gomes S S,et al.Profiles of paralytic shell fish poisoning toxins in shell fish from Portugal explained by carbamoylase activity[J].Chromatography A,2007,1160(1-2):99-105.
[54]Lin H P,Cho Y,Yashiro H,et al.Purification and characterization of paralytic shellfish toxin transforming enzyme from Mactra chinensis[J].Toxicon,2004,44(7):657-668.
[55]Yuko Cho,Noriyuki Ogawa,Miyako Takahashi,et al. Purification and characterization of paralytic shell fish toxintransforming enzyme,sulfocarbamoylase I,from the Japanese bivalve Peronidia venulosa[J].Biochimicaet Biophysica Acta,2008,1784(9):1277-1285.
食物中含铝很可怕吗?
国际癌症研究机构认为,铝元素不是人类致癌物,目前一些报道中"致癌物铝"的说法,可能会误导公众。
研究表明,铝在一定剂量下具有神经毒性、生殖毒性、发育毒性,过量摄入铝会影响儿童的智力发育,并与软骨病和骨质疏松的发生相关。尽管有部分研究提示过量摄入铝与老年性痴呆的发生存在一定相关,但联合国粮农组织和世界卫生组织下的食品添加剂联合专家委员会和欧盟食品安全局等认为,铝摄入与老年性痴呆的发生没有明显的相关性。
铝虽然具有毒性,但并不是只要摄入就会对人体健康产生危害。这不仅取决于食品中铝的含量,还与食用这些含铝食品的数量以及食用时间长短密切相关。世界卫生组织食品添加剂联合专家委员会的最新评估结果认为,人(全人群)终生每周每公斤体重经口摄入的铝不超过2mg,就不会引起健康危害,相当于每天每公斤体重摄入0.28mg。一个体重30公斤的儿童,每日摄入量不能超过约8mg,一个体重60公斤的成人,每日摄入量不能超过约17mg。所以,只要食品中铝残留量符合国家安全标准或全人群每周每公斤体重经口摄入的铝不超过2mg,就不会影响健康。根据国家食品安全风险评估专家委员会完成的中国居民膳食铝暴露风险评估结果显示,我国日常膳食中的含铝食品对一般居民健康造成不良影响的机会不大,但对于长期食用油条等此类高铝食品的消费者造成不良影响的机会较大。
我国对含铝食品添加剂有明确的使用标准,可以在豆类制品等食品中"按生产需要适量添加",但食品终产品中的铝残留限量100mg/kg。含铝食品添加剂可用作固化剂、膨松剂、稳定剂、抗结剂和染色料等。很多国家如美国、欧盟成员国、澳洲、新西兰、日本和我国等,都允许使用含铝食品添加剂。我国现行的《食品添加剂使用标准》(GB2760-2011)对含铝食品添加剂的使用品种和使用范围作出了严格规定,其中硫酸铝钾、硫酸铝铵作为膨松剂、稳定剂可应用于豆类制品、小麦粉及其制品、虾味片、焙烤食品、水产品及其制品、膨化食品中,其添加量“按生产需要适量添加”,而食品终产品中的铝残留限量100mg/kg。
2012年年底,原卫生部办公厅发文征求对调整含铝食品添加剂使用规定的意见,随后在《食品添加剂使用标准》的修订中,做了相应的调整,包括:缩小明矾使用范围,取消其在小麦粉及发酵面制品、膨化食品中的使用规定,仅允许在“油炸面制品”和“面糊(如用于鱼和禽肉的拖面糊)、裹粉、煎炸粉”中使用,此举可大大降低我国居民膳食铝摄入水平(大约可降低70%)。
摘自中国进口食品网
Review on depuration of paralytic shellfish poisoning in shellfish
MAO Dan-hui,XIE Wan-cui,YANG Xi-hong*,BIAN Zhong-yuan,ZHANG Chao-hua
(College of Food Science and Technology,Guangdong Ocean University,Guangdong Provincial Key Laboratory of Aquatic Products Processing and Safety,Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,National Research and Development Branch Center for Shellfish Processing(Zhanjiang),Zhanjiang 524088,China)
To explore the paralytic shellfish poison(PSP)removal methods and effectively improve the shellfish food safety,the physical method,chemical method and biological method and their purification efficiency were reviewed in three aspects.The treating temperature,safe adsorption,microbial degradation and enzymatic hydrolysis conversion and other research results were analyzed and summarized,for shellfish removal PSP toxins and shellfish purification research.
shellfish;paralytic shellfish poisoning toxins(PSP);depuration;review
TS917
A
1002-0306(2015)04-0391-06
10.13386/j.issn1002-0306.2015.04.076
2014-05-26
毛丹卉(1990-),女,在读硕士研究生,研究方向:食品科学。
杨锡洪(1963-),男,博士,教授,研究方向:水产品质量与安全。
国家自然科学基金资助项目(31271938);现代农业产业技术体系专项(GARS-48)。

