加热后兔肉中心温度的变化对其品质特性的影响
王兆明,贺稚非,2,余 力,黄 瀚,王 珊,徐明悦,李洪军,2,*
(1.西南大学食品科学学院,重庆 400716;2.重庆市特色食品工程技术研究中心,重庆 400716)
加热后兔肉中心温度的变化对其品质特性的影响
王兆明1,贺稚非1,2,余 力1,黄 瀚1,王 珊1,徐明悦1,李洪军1,2,*
(1.西南大学食品科学学院,重庆 400716;2.重庆市特色食品工程技术研究中心,重庆 400716)
为探讨不同中心温度对伊拉兔肉品质特性的影响,以伊拉兔配套系为研究对象,研究不同中心温度下兔肉基本食用品质、全质构特性和蛋白质溶解度的变化规律,并对兔肉升温特性曲线进行数学拟合。结果表明:随着中心温度的升高,兔肉汁液流失率不断增加;剪切力在25~50 ℃和60~80 ℃极显著增大,50~60 ℃极显著下降,80~90 ℃变化不显著;pH值先增加后几乎保持不变;L*值在25~40 ℃极显著上升,40~90 ℃基本维持不变,a*值在25~40 ℃极显著下降,40~90 ℃基本维持不变,b*值呈现出先增大后减小的趋势;硬度呈现极显著增大趋势;内聚性在25~40 ℃极显著增大,40~90 ℃变化不明显;弹性呈现出先下降后上升的趋势;胶着性在25~40 ℃和80~90 ℃极显著增大,40~80 ℃变化不显著;咀嚼性在25~40 ℃和70~90 ℃极显著增大,40~70 ℃变化不显著;肌原纤维蛋白溶解度在25~40 ℃和70~80 ℃极显著下降。在加热过程中蛋白质溶解度的变化与兔肉品质特性的变化密切相关。
中心温度;兔肉;食用品质;质构特性;蛋白质溶解度
兔肉营养价值高、保健性能好,具有“高蛋白、高赖氨酸、高消化率;低脂肪、低胆固醇、低热量”的特点,Dalle Zotte[1]认为兔肉中含有大量的多不饱和脂肪酸、共轭亚油酸、二十碳五烯酸、二十二碳六烯酸、VE和硒等生物活性物质,能够降低n-3/n-6脂肪酸比例,对控制心血管病及其他慢性疾病有重要的作用;Hermida等[2]研究发现高钾、低钠的特点使兔肉特别适用于高血压病人的饮食;此外,兔肉具有美容功能,在日本被称为“美容肉”;兔肉是中国营养改善行动计划倡导发展的肉类[3]。伊拉兔又被称为伊拉配套系肉兔,是2000 年从法国引进并推广的杂交品种,具有生长周期短和出肉率高的特点。目前,我国对伊拉兔的研究主要集中在脂肪酸和风味物质上[4-5],而对加工过程中肉品质的变化研究较少。
加热处理是肉制品熟化和杀菌的一种常用方式,Davey等[6]曾将加热定义为把肉加热到足以使蛋白质变性的温度。在加热过程中,肉自身会发生大量的物理及生化反应,导致肉品质特性和微观结构的变化,这直接导致了肉类五大品质指标[7](嫩度、多汁性、风味、色泽和系水力)发生不同程度的变化,本实验以伊拉兔背部最长肌为研究对象,探讨伊拉兔肉在热处理过程中的品质特性变化规律,并对兔肉的升温特性进行数学拟合,以期为兔肉制品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
实验兔为伊拉配套系商品代,购自重庆市高校草食动物工程研究中心种兔场;采用60 日龄的伊拉兔20 只,按常规方法击晕宰杀去皮后,分割背部最长肌冷冻处理,备用。
结晶牛血清白蛋白为生化试剂,其他化学试剂均分析纯。
1.2 仪器与设备
CT-3质构分析仪 美国Brookfield公司;台式高速离心机 德国Eppendorf公司;TA.XT2i物性测定仪英国Stable Micro System公司;UltraS can PRO测色仪美国HunterLab公司;722型可见分光光度计 上海元析仪器有限公司;UB-7 pH计 德国Sartorius AG公司;电子分析天平 赛多利斯科学仪器有限公司; ZWY-2102C恒温培养振荡器 上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 实验设计与肉样加热处理
将背部最长肌在4 ℃条件下过夜解冻,切成4 cm×2 cm×2 cm的块状,质量为(20±1)g,随机分为7 组,用滤纸吸干表面水分,准确称质量并记录,用高温蒸煮袋包装,尽量排出内部空气。实验分为1 个对照组和6 个处理组,对照组不经加热处理,置于25 ℃条件下,处理组在100 ℃水浴锅中加热到中心温度分别为40、50、60、70、80、90 ℃。用数字温度计(精度为0.1 ℃)记录中心温度的变化,中心温度达到后立即取出,在流动水中冷却至室温,用滤纸吸干表面水分,精确称质量,置于4 ℃条件下待分析。
1.3.2 pH值测定
将5 g肉样剪碎,加入45 mL超纯水摇匀,将电极直接插入其中,待稳定后读数。每个样品重复测定3 次,取平均值[8]。
1.3.3 汁液损失率测定
肉样加热前精确称质量,记为m1,加热后将肉样在流水中冷却后,精确称质量,记为m2。

1.3.4 色泽测定
采用测色仪测定色泽,测色仪先用校正板标准化,然后将肉样垂直紧扣在镜口,测定并记录亮度(L*)值、红度(a*)值、黄度(b*)值。
1.3.5 剪切力测定
用TA.XT2i物性测定仪测定剪切力,参数设置如下:测前速率1.50 mm/s,测中速率1.50 mm/s,测后速率10 mm/s;距离30.0 mm;触发力40 g。测定时将兔肉沿肌纤维方向切取1 cm×1 cm×4 cm的肉条状,用物性测定仪连接的V型刀头,垂直肌纤维方向剪切。
1.3.6 质地多面分析(texture profi le analysis,TPA)
应用美国Brookfield公司生产的CT-3质构分析仪,通过Texture Loader软件加以控制。测定方法应用TPA质构分析,测定参数如下:目标50%;触发点负载5 g,测试速率1.00 mm/s,返回速率1 mm/s;循环次数2.0,探头TA44。肉块切成规则的正方体(1 cm×1 cm×1 cm)测定。
1.3.7 肌原纤维和肌浆蛋白溶解度测定
参照Li Chao等[9]的方法并根据实验条件修改,测定肌原纤维和肌浆蛋白的溶解度。
肌浆蛋白浓度测定:精确称取1 g肉样,放入100 mL离心管中,加入10 mL冰浴磷酸钾缓冲液(0.025 mol/L,pH 7.2),低速匀浆(6 500 r/min)2 次,每次30 s,间隔30 s。匀浆液放于摇床,在4 ℃条件下抽提12 h,对抽提液进行离心分离(4 ℃、1 500×g,20 min),分离上清液,双缩脲法测定上清液中蛋白浓度。双缩脲标准曲线线性方程为y=0.046 0x+0.007 5(R2=0.999 1),其中横坐标为蛋白浓度,纵坐标为吸光度。
总可溶性蛋白浓度测定:精确称取0.5 g肉样,放入100 mL离心管中,加入10 mL冰浴碘化钾提取液(1.1 mol/L碘化钾溶于0.1 mol/L磷酸钾缓冲液,pH 7.2),按上述步骤重复进行匀浆、抽提、离心上清液,测定蛋白浓度。
肌原纤维蛋白溶解度为总可溶性蛋白溶解度减去肌浆蛋白溶解度。肌原纤维蛋白溶解度和肌浆蛋白溶解度分别为肌原纤维蛋白和肌浆蛋白占肉质量的百分比。
1.4 数据处理
运用SPSS 19.0对实验数据进行单因素方差分析(analysis of variance,ANOVA)、最小显著差异法(least significant difference,LSD)多重比较以及Pearson相关性分析,用Orign 8.1作图。
2 结果与分析
2.1 兔肉的升温特性曲线

图1 兔肉升温特性拟合曲线Fig.1 Temperature rising curve fi tting of rabbit meat
图1为兔肉升温特性拟合曲线,以兔肉中心温度为横坐标,加热到某一温度所需时间为纵坐标,拟合曲线参数模型为y=0.004 4x3-0.666 1x2+36.055 1x-558.2820 (R2=0.990 9)。由图1可知,随着加热时间的延长,肉块中心温度不断上升。加热过程中,热量从肉表面传递到中心需要一定的时间,起始阶段加热速率较慢;40~70 ℃范围内速率较快,70~90 ℃范围内,肉块表面蛋白质变性,形成凝胶,对热量的传递形成阻碍,升温速率再次减缓。
2.2 中心温度对兔肉汁液流失率的影响

图2 中心温度对兔肉汁液流失率的影响Fig.2 Effect of central temperature on drip loss
汁液流失、质量减少是肉类在加热过程中最明显的变化,流失的汁液中既包括了肉中的自由水,还包括了从肌纤维细胞中溶出的微量脂肪、肌浆蛋白、弹性蛋白等汁液以及由热溶性胶原蛋白形成的“明胶”溶出物[10]。由图2可知,随兔肉中心温度的升高,汁液流失率不断增加(P<0.05),肌球蛋白与肌动蛋白降解,引起肉内部结构变化,肌浆汁液从肌纤维结构中渗出,汁液流失率增加[11]。汁液流失主要发生在80~90 ℃(P<0.01),该温度段升温速率较慢,升温时间长,同时降解或析出的肌浆蛋白与肌原纤维蛋白质发生结合,降低骨架蛋白的保水性[12],汁液流失率显著增大。
2.3 中心温度对兔肉剪切力的影响

图3 中心温度对兔肉剪切力的影响Fig.3 Effect of central temperature on shear force
肉的嫩度是反映肉品质特性的重要指标,剪切力的大小可以反映肉的嫩度,剪切力减小,嫩度增大[13],兔肉剪切力随中心温度的变化如图3所示。剪切力随温度的变化呈现三阶段变化趋势,在25~50 ℃和60~80 ℃范围内剪切力极显著增大(P<0.01),50~60 ℃极显著下降(P<0.01),与Combes等[14]的研究结果相似。针对剪切力的两阶段上升趋势,Bailey等[15]认为第一阶段的上升是由肌原纤维变性引起的,第二阶段是由肌动球蛋白的收缩和脱水引起的;Huang Feng等[16]认为第一阶段主要是由结缔组织的降解引起的,第二阶段可能与肌原纤维蛋白的降解效应,胶原蛋白的收缩以及肌动球蛋白收缩和脱水有关。在50~60 ℃剪切力有一个下降的过程,可能是因为组成肌束膜的结缔组织中胶原蛋白发生变性,导致了肌束膜的拉断力下降而引起剪切力下降[17]。
2.4 中心温度对兔肉pH值和色泽的影响

表1 不同中心温度对兔肉pH值和色泽的影响Table 1 Effect of central temperature on pH and color of rabbit meat
由表1可知,随着兔肉中心温度的升高,pH值呈现出先增加后几乎保持不变的趋势。在25~40 ℃内pH值极显著增大(P<0.01),与Huang Feng等[16]的研究结果基本吻合,可能是由于加热后兔肉肌肉蛋白质的酸性基团减少导致的[18]。L*值在25~40 ℃极显著增大(P<0.01),40~90 ℃变化不显著(P>0.05),可能是由于加热使球蛋白构象破坏,色素错位或蛋白质交联引起的[12];a*值在25~40 ℃极显著下降(P<0.01),40~90 ℃基本维持不变,加热使肌浆蛋白通过分子内二硫键与蛋白凝聚物桥联,致使肌肉中肌浆蛋白可提取性降低,肌浆蛋白析出后将红色掩饰,使得肌肉颜色变得苍白[19],红度下降;b*值呈现出先增大后减小的趋势,与吴兵等[20]的研究结果相似。
2.5 中心温度对兔肉质构特性的影响

表2 中心温度对兔肉质构特性的影响Table 2 Effect of central temperature on TPA characteristics of rabbit mmeeaatt
由表2可知,与生肉相比,兔肉在加热处理后硬度极显著增大(P<0.01),可能是因为肌原纤维蛋白变性凝固,肌间胶原蛋白收缩以及肌动球蛋白的脱水收缩共同作用,使硬度变大;内聚性在加热处理后极显著增大(P<0.01),40~90 ℃变化不明显(P>0.05),可能是因为加热使兔肉细胞间结合力变大,内聚性升高;弹性呈现出先下降后上升的趋势,从室温至50 ℃极显著下降(P<0.01),在50 ℃时达到最小值,50~90 ℃极显著上升(P<0.01),兔肉在加热处理后内部的疏水基团暴露出来,形成二硫键,大量的疏基和二硫键的存在,使分子间交联作用加强,形成凝胶,弹性增大;胶着性在加热后呈现出增大趋势,25~40 ℃极显著增大(P<0.01),40~80 ℃变化不明显(P>0.05),80~90 ℃极显著增大(P<0.01);咀嚼性整体上呈现出增大趋势,25~40 ℃极显著增大(P<0.01),40~70 ℃变化不显著(P>0.05),70~90 ℃极显著增大(P<0.01)。兔肉在加热过程中蛋白质变性,汁液流失,质构特性发生变化[21]。
2.6 中心温度对兔肉总蛋白溶解度的影响

图4 中心温度对兔肉总蛋白溶解度的影响Fig.4 Effect of central temperature on total protein solubility of rabbit meat
蛋白质溶解度是评价蛋白质变性程度的重要指标,与蛋白质功能特性密切相关,是在蛋白质-蛋白质和蛋白质-溶剂相互作用之间平衡的热力学表现形式[22]。兔肉在加热过程中,总蛋白(肌原纤维蛋白和肌浆蛋白)溶解度随中心温度的变化规律如图4所示。加热处理显著降低兔肉总蛋白溶解度,在25~50 ℃、70~80 ℃极显著下降(P<0.01),50~70 ℃和80~90 ℃变化不明显(P>0.05),说明兔肉蛋白质变性主要发生在25~50 ℃和70~80 ℃范围内。维系蛋白质二级及高级结构的重要作用包括氢键、配位键、疏水作用、二硫键等,在外界条件发生变化时,这些作用会被破坏和重组,蛋白质的结构也随之改变[23],兔肉在加热过程中,随着温度升高,蛋白质变性,溶解度下降。
2.7 中心温度对兔肉肌原纤维蛋白溶解度的影响
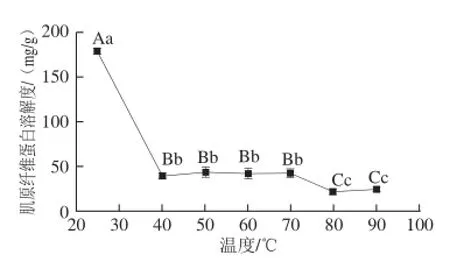
图5 中心温度对兔肉肌原纤维蛋白溶解度的影响Fig.5 Effect of central temperature on rabbit myofi brillar protein solubility
由图5可知,从总体上说,加热处理显著降低兔肉的肌原纤维蛋白溶解度。肌原纤维蛋白溶解度在25~40 ℃和70~80 ℃两个阶段极显著降低(P<0.01),在40~70 ℃和80~90 ℃阶段变化不显著(P>0.05),说明伊拉兔肉肌原纤维蛋白热变性主要发生在40 ℃以前和70~80 ℃两个阶段。随着兔肉中心温度升高,肌原纤维蛋白二级结构中α-螺旋含量逐渐降低,β-折叠含量逐渐增加,肌原纤维蛋白经历高级结构破坏、形成蛋白-蛋白聚合体和凝胶化的过程[24-25],最终发生不可逆热变性,引起兔肉品质特性的变化。肌球蛋白的热稳定性较差,在加热过程中率先变性,导致肌原纤维蛋白溶解度第一阶段显著下降;肌动蛋白热稳定性较好,变性温度一般在71~83 ℃之间[26],引起了肌原纤维蛋白溶解度第二阶段的显著下降。
2.8 各品质指标相关性分析
表3反映不同中心温度下兔肉各品质指标之间的相关性。由表3可知,兔肉总蛋白溶解度和肌原纤维蛋白溶解度对其基本食用品质和全质构特性有显著或极显著的影响。基本食用品质方面,总蛋白溶解度对所有品质指标均有极显著影响,与L*、a*值和pH值的相关系数均在0.9以上;质构特性方面,总蛋白溶解度对剪切力、硬度、内聚性、胶着性和咀嚼性有极显著影响。汁液流失率对硬度、内聚性、胶着性和咀嚼性等质构指标有极显著影响。

表3 兔肉各品质指标相关性分析Table 3 Correlation analysis of rabbit meat quality parameters
3 结 论
兔肉在加热过程中,随着中心温度的升高,兔肉蛋白质保水性下降,汁液流失不断增加;剪切力呈现三阶段变化趋势,25~50 ℃和60~80 ℃范围内极显著增大,50~60 ℃极显著下降。
基本食用品质中,pH值呈现出先增加后几乎保持不变的趋势;L*值在25~40 ℃极显著上升,40~90℃基本维持不变,a*值在25~40 ℃极显著下降(P<0.01),40~90 ℃基本维持不变,b*值呈现出先增大后减小的趋势。
全质构特性方面,硬度极显著增大;内聚性在25~40 ℃极显著增大,40~90℃变化不明显;弹性呈现出先下降后上升的趋势,胶着性在25~40 ℃和80~90 ℃内极显著增大,40~80 ℃变化不明显;咀嚼性在25~40 ℃和70~90 ℃内极显著增大,40~70 ℃变化不显著。
蛋白质溶解度方面,随着中心温度的升高,总蛋白溶解度在25~50 ℃和70~80 ℃极显著下降,肌原纤维蛋白溶解度在25~40 ℃和70~80 ℃两个阶段呈现下降趋势。
兔肉在加热过程中,随着肉块中心温度的升高,蛋白质变性,温度越高,变性程度越严重,在80 ℃时完全变性,蛋白质变性程度不同引起兔肉品质特性的变化。
[1] DALLE ZOTTE A, SZENDRO Z. The role of rabbit meat as functional food[J]. Meat Science, 2011, 88(3): 319-331.
[2] HERMIDA M, GONZALEZ M, MIRANDA M, et al. Mineral analysis in rabbit meat from Galicia (NW Spain)[J]. Meat Science, 2006, 73(4): 635-639.
[3] 姜颖. 兔肉腥味物质的鉴定及其形成机理初探&人胎肝磷酸化蛋白质表达谱的构建[D]. 南京: 南京农业大学, 2003.
[4] 王毅, 贺稚非, 李洪军, 等. 不同部位伊拉兔肉脂肪酸组成的对比分析[J]. 食品科学, 2014, 35(4): 137-141. doi: 10.7506/spkx1002-6630-201404028.
[5] 陈康, 李洪军, 贺稚非, 等. 不同性别伊拉兔肉挥发性风味物质的SPME-GC-MS分析[J]. 食品科学, 2014, 35(6): 98-102. doi: 10.7506/ spkx1002-6630-2-140620.
[6] DAVEY C L, GILBERT K V. Temperature-dependent cooking toughness in beef[J]. Journal of the Science of Food and Agriculture, 1974, 25(8): 931-938.
[7] DALLE ZOTTE A. Perception of rabbit meat quality and major factors infl uencing the rabbit carcass and meat quality[J]. Livestock Production Science, 2002, 75(1): 11-32.
[8] 余小领, 李学斌, 赵良, 等. 常规冷冻冻藏对猪肉保水性和组织结构的影响[J]. 农业工程学报, 2008, 24(12): 264-268.
[9] LI Chao, WANG Daoying, XU Weimin, et al. Effect of fi nal cooked temperature on tenderness, protein solubility and microstructure of duck breast muscle[J]. LWT-Food Science and Technology, 2013, 51(1): 266-274.
[10] PALKA K, DAUN H. Changes in texture, cooking losses, and myofi brillar structure of bovine M. semitendinosus during heating[J]. Meat Science, 1999, 51(3): 237-243.
[11] MURPHY R Y, MARKS B P. Effect of meat temperature on proteins, texture, and cook loss for ground chicken breast patties[J]. Poultry Science, 2000, 79(1): 99-104.
[12] 戴妍. 欧姆加热对猪肉蛋白质降解, 氧化以及凝胶特性的影响[D].北京: 中国农业大学, 2014.
[13] 徐为民, 殷燕涛, 诸永志, 等. 不同腌制方式对鸭肉腌制速率及肉质的影响[J]. 现代食品科技, 2014, 30(8): 201-205.
[14] COMBES S, LEPETIT J, DARCHE B, et al. Effect of cooking temperature and cooking time on Warner-Bratzler tenderness measurement and collagen content in rabbit meat[J]. Meat Science, 2004, 66(1): 91-96.
[15] BAILEY A J, LIGHT N D. Connective tissue in meat and meat products[M]. Amsterdam: Elsevier Applied Science Publishers Limited, 1989: 155-157.
[16] HUANG Feng, HUANG Ming, ZHOU Guanghong, et al. Infl uence of heat on protein degradation, ultrastructure and eating quality indicators of pork[J]. Journal of the Science of Food and Agriculture, 2011, 91(3): 443-448.
[17] 董晗. 鸭肉肌动球蛋白解离因素分析及其对嫩度的影响研究[D]. 南京: 南京财经大学, 2013.
[18] 周婷, 陈霞, 刘毅, 等. 加热处理对北京油鸡和黄羽肉鸡质构以及蛋白特性的影响[J]. 食品科学, 2007, 28(12): 74-77.
[19] CHOI Y M, RYU Y C, LEE S H, et al. Effects of supercritical carbon dioxide treatment for sterilization purpose on meat quality of porcine longissimus dorsi muscle[J]. LWT-Food Science and Technology, 2008, 41(2): 317-322.
[20] 吴兵, 张立彦. 加热对三黄鸡腿肉特性的影响研究[J]. 食品工业科技, 2011, 32(5): 108-112.
[21] BERTOLA N C, BEVILACQUA A E, ZARITZKY N E. Heat treatment effect on texture changes and thermal denaturation of proteins in beef muscle[J]. Journal of Food Processing and Preservation, 1994, 18(1): 31-46.
[22] 彭增起. 肌肉盐溶蛋白质溶解性和凝胶特性研究[D]. 南京: 南京农业大学, 2005.
[23] 罗俊杰. 蛋白质解折叠及其影响磷脂膜结构与相行为的机理研究[D].北京: 清华大学, 2013.
[24] 杨玉玲, 游远, 彭晓蓓, 等. 加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[J]. 中国农业科学, 2014, 47(10): 2013-2020.
[25] 李超, 徐为民, 王道营, 等. 加热过程中肉嫩度变化的研究[J]. 食品科学, 2009, 30(11): 262-265.
[26] 吴兵. 鸡肉的热致变化研究[D]. 广州: 华南理工大学, 2011.
Effect of Different Central Temperatures of Rabbit Meat on Quality Characteristics after Heating
WANG Zhaoming1, HE Zhifei1,2, YU Li1, HUANG Han1, WANG Shan1, XU Mingyue1, LI Hongjun1,2,*
(1. College of Food Science, Southwest University, Chongqing 400716, China; 2. Chongqing Engineering Research Center of Regional Food, Chongqing 400716, China)
This study was aimed to investigate the effects of different central temperatures on quality characteristics in heated Hyla rabbit meat. Variations in the eating quality, textural properties, protein solubility of Hyla rabbit meat were studied. The heating mathematical curve was fi tted. The results showed that the drip loss was increased gradually. As the central temperature rose, shear force was significantly increased at 25-50 ℃ and 60-80 ℃, but significantly decreased at 50-60 ℃, and did not signifi cant change at 80-90 ℃. pH remained almost unchanged after the initial increase. L* value was signifi cantly increased at 25-40 ℃, and remained unchanged at 40-90 ℃. a* value was signifi cantly decreased at 25-40 ℃, and remained unchanged at 40-90 ℃. b* value showed a decreasing trend after an initial increase. Hardness exhibited a signifi cant increasing trend. Cohesion was significantly increased at 25-40 ℃, followed by no significant change at 40-90 ℃. Elasticity showed an upward trend after an initial fall. Gumminess exhibited a significant increase at 25-40 ℃ and 80-90 ℃, but no signifi cant change at 40-80 ℃. Chewiness revealed a signifi cant increase at 25-40 ℃ and 70-90 ℃, but no signifi cant change at 40-70 ℃. Myofi brillar protein solubility signifi cantly decreased at 25-40 ℃ and 70-80 ℃. The variation in quality characteristics of rabbit meat is closely related to the change in protein solubility during the heating process.
central temperature; rabbit meat; eating quality; textural property; protein solubility
TS251.1
A
1002-6630(2015)19-0067-05
10.7506/spkx1002-6630-201519012
2014-12-25
国家现代农业(兔)产业技术体系建设专项(CARS-44-D-1);公益性行业(农业)科研专项(201303144)
王兆明(1990-),男,硕士研究生,研究方向为肉类科学与酶工程。E-mail:706947252@qq.com
*通信作者:李洪军(1961-),男,教授,博士,研究方向为肉类科学与酶工程。E-mail:983362225@qq.com

