磷酸脲对羔羊血清和肌肉钙、磷含量及血清相关代谢激素含量的影响
张 帆 纪守坤 张乃锋 姜成钢 王黎文丁 健 司丙文 屠 焰 刁其玉*
(1.中国农业科学院饲料研究所,农业部饲料生物技术重点实验室,北京 100081;2.农业部畜牧兽医总站,北京 100026)
近年来,随着人们生活水平的提高,我国畜牧业得到了快速的发展,特别是牛羊类产品也更是供不应求,然而蛋白质饲料在我国处于严重紧缺状况,我国目前大豆对外国的依赖度达到80%,反刍动物有特殊的消化器官——瘤胃,瘤胃中生长着大量的微生物,其中部分微生物可将尿素等非蛋白氮(NPN)合成微生物的菌体蛋白(MCP),供机体利用,为其提供维持与生产的需要[1],因此寻找可供反刍动物利用的非蛋白氮,并对其安全性做出评价是缓解我国蛋白质饲料紧缺的重要途径。目前可供反刍动物利用的非蛋白氮饲料,最常见的是尿素,然而尿素在瘤胃中的释放速度较快,而瘤胃内微生物的数量有限,其利用氨合成菌体蛋白的速度较为缓慢,瘤胃中多余的氨一部分进入肝脏转化成尿素随尿液排出体外,另一部分则进入血液与二氧化碳反应生成氨基甲酸,而氨基甲酸会使羊发生中毒,因此在饲喂尿素时牛羊容易发生尿素氨中毒。磷酸脲(urea phosphate)中的氨释放速度低于尿素,相当于尿素分解速度的0.25 倍[2],且磷酸脲中含有磷元素,因此磷酸脲在生产中更有优势,是一种新型、安全的非蛋白氮[3],在反刍动物饲粮中是较为理想的非蛋白氮饲料添加剂,低毒性[4],无致畸变作用,安全性高于尿素,可部分替代豆饼粕等蛋白质饲料,扩大饲料来源,降低饲养成本,提高经济效益,同时弥补我国蛋白质饲料资源不足[5]的困境。这种添加剂最初由德国巴斯夫(BASF)化学公司开发利用,20世纪70年代开始广泛应用于发达的欧、美地区国家以及日本等的牛羊饲养业,它是欧共体(EC)饲料业法定Ⅰ类添加剂,联合国粮农组织(FAO)推荐使用的反刍动物专用营养添加剂和磷的补充剂。我国于20世纪80年代后期开始对磷酸脲进行研究和开发利用,易建明等[6]的研究表明每头奶牛每天喂磷酸脲150 g,喂60 d,产奶量可提高2.8%,乳脂率提高 5.6%。
关于尿素对肉羊的安全性,已有研究从尿素对肉羊的生长性能、屠宰性能、肉品质方面[7]及血液学、血清学、组织病理学方面[8]进行探讨,结果表明在1.5%的尿素添加量下不会产生显著影响,但在2.5%的添加量下会使肉羊发生中毒症状。
血液和肌肉中钙(Ca)、磷(P)的含量是反映动物健康状况的重要指标。钙、磷的缺乏会影响动物的骨骼形成、生长速度、食欲、繁殖性能等。磷酸脲中含有家畜所需的重要元素磷,血液的钙、磷平衡对家畜的生理健康有着重要的作用。因此在利用磷酸脲作为羔羊非蛋白氮源时,通过血液和肌肉中钙、磷的含量及相关激素含量来评价磷酸脲对羔羊的安全性有重要意义。本试验选用的羔羊初始体重为(25.86±4.07)kg,在试验结束时各组(除最高添加量组)平均体重为42~43 kg,此时期是羔羊育肥的最佳阶段,选用磷酸脲作为非蛋白氮来源代替植物蛋白质具有重要利用价值和经济效益。
关于磷酸脲对反刍动物生产性能和替代蛋白质饲料的作用已经有相应的研究,但磷酸脲对肉羊的血清和肌肉中钙、磷含量的影响还鲜有报道,本试验旨在研究不同磷酸脲添加量对血清和肌肉钙、磷含量及血清相关激素含量的影响,同时对磷酸脲在肉羊饲养中作为饲料添加剂进行安全性评价。
1 材料与方法
1.1 试验时间与地点
本试验与2014年4月8日至2014年6月30日于北京市大兴区佟营羊场进行,历时72 d,其中预试期12 d,正试期60 d。
1.2 试验动物与试验设计
本试验采用单因子随机分组设计,选用80只3 月龄、平均体重为(25.86±4.07)kg 的健康 F1 代杜寒杂交公羔羊,按体重一致的原则随机分为5组,每组8个重复,每个重复2只羊。对照组饲喂不添加磷酸脲的精料,试验组分别在精料中添加1.0%、2.0%、4.0%、8.0%的磷酸脲以替代部分豆粕等蛋白质饲料。每日饲喂2次(08:00、20:00),先喂粗料,后喂精料。预试期内饲喂精料和粗料比保持1∶1,自由采食。正试期内肉羊精料和粗料采食量比保持1∶1,各组实际采食饲粮中的磷酸脲含量分 别为 0(对照 组)、0.5%(0.5% 组)、1.0%(1.0%组)、2.0%(2.0%组)和 4.0%(4.0%组),每天的加料量根据前1天的采食量进行调整。整个试验过程肉羊采用全舍饲方式饲养,自由饮水,试验光照、温度、免疫按常规程序进行。
1.3 试验饲粮
试验肉羊基础饲粮的精料参考NRC(2007)[9]及试验需求配制,由北京市中农兴饲料科技有限公司制作,粗料为大豆秸,试验饲粮组成及营养水平见表1。
1.4 试验材料
本试验所用磷酸脲为无色透明棱柱状晶体,由中化云龙有限公司提供,含非蛋白氮(尿素态氮)16%、磷17%。
1.5 样品的采集及相关指标的检测
1.5.1 血清钙、磷及相关激素含量的测定
分别于1(预试期开始当天)、13(正试期开始当天)、73 d(正试期结束后第1天)每组随机选取8只羔羊在晨饲前用真空管于颈静脉穿刺采血约10 mL,离心(1 100×g,10 min)分离血清,血清收集于2 mL的离心管中,-20℃保存,待测。测定的指标为 1、13、73 d的钙、磷含量及 1、13 d的甲状旁腺素(PTH)、降钙素(CT)、25羟基维生素D(25-OH-VD)含量。试剂盒购于中生北控股份有限公司,钙含量测定采用邻甲酚酞络合酮比色法,磷含量采用紫外终点法按照试剂盒操作说明在日立7160全自动生化分析仪上上测定。PTH、CT、25-OH-VD含量采用放射免疫法测定。血清中的各项指标均由北京华英生物技术研究所测定。

表1 试验饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
1.5.2 肌肉钙、磷含量的测定
73 d时每组选取6只羔羊进行屠宰,选取背腰最长肌于-20℃中冷冻保存,待测。将冷冻的肌肉于冷冻干燥机中干燥后,经回潮,使用干灰化法进行前处理,采用火焰原子吸收仪(perkin Elmer AAS800)测定钙的含量,用钒钼酸铵比色法在紫外分光光度计(752型)中测定总磷的含量[11],波长采用420 nm。
1.5.3 饲粮营养水平的测定
对精料和粗料中的干物质(DM)、粗蛋白质(CP)、钙、磷的含量进行测定,测定方法参照《饲料分析及饲料质量检测技术》[12]进行。
1.6 统计分析
数据整理采用Excel 2007进行,采用SAS 8.1统计软件将试验所得的数据进行平衡试验设计的方差分析(ANOVA),平均值的多重比较采用Duncan氏法进行,显著水平为 P<0.05,各组结果以平均值±标准差表示。
2 结果
2.1 血清钙、磷含量
由表2可以看出,1 d时,各组血清中钙、磷含量差异不显著(P>0.05)。13 d 时,4.0%组羊的血清中钙含量显著低于其他各组(P<0.05);在血清磷含量中,1.0%组羊与其他各组间差异不显著(P>0.05),4.0%组显著高于除 1.0%组的其他各组(P<0.05),对照组、0.5%组、2.0%组间差异不显著(P>0.05)。73 d时磷酸脲的添加量对血清中钙含量影响不显著(P>0.05);血清磷含量中4.0%组显著高于对照组、0.5%组(P<0.05),对照组显著低于1.0%组、2.0%组、4.0%组(P<0.05),0.5%组、1.0%组、2.0%组间差异不显著(P>0.05)。13 和 73 d,随着磷酸脲添加量的增加血清中钙的含量有降低的趋势,磷的含量有增加的趋势。在同一组中,随时间延长,各组血清钙含量有降低的趋势,血清磷含量除对照组外其他各组有增加的趋势。

表2 不同磷酸脲添加量对羔羊血清钙、磷含量的影响Table 2 Effects of different levels of dietary urea phosphate on serum calcium and phosphorus contents of lambs mmol/L
2.2 肌肉钙、磷含量
由表3可以看出,不同的磷酸脲添加量对肌肉中钙、磷含量的影响均不显著(P>0.05),但随着磷酸脲添加量的增加,肌肉中钙含量有降低趋势,磷含量有增加的趋势。
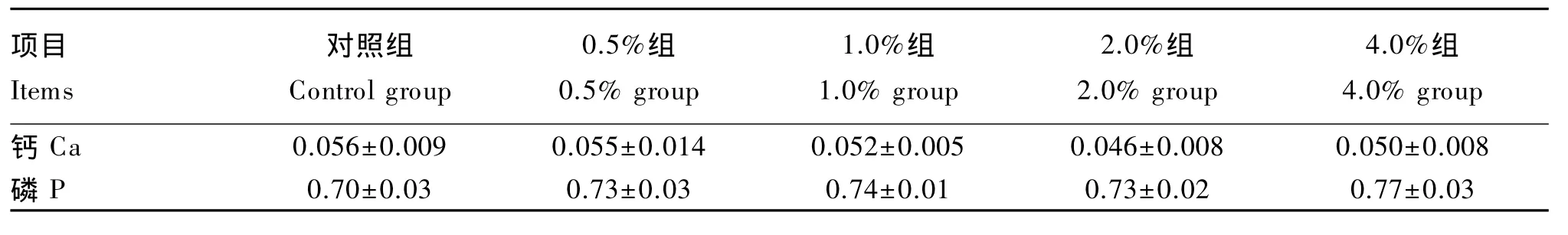
表3 不同磷酸脲添加量对羔羊肌肉钙、磷含量的影响(风干基础)Table 3 Effects of different levels of dietary urea phosphate on muscle calcium and phosphorus contents of lambs(air-dry basis) %
2.3 血清相关激素含量
由表4可以看出,磷酸脲的添加量对血清PTH和25-OH-VD含量影响差异不显著(P>0.05)。13 d 时,1.0%组和2.0%组的 CT 含量显著低于对照组和 4.0%组(P<0.05),0.5%组、1.0%组、2.0%组间差异不显著(P>0.05),对照组、0.5%组、4.0%组间差异不显著(P>0.05),13 d 时除4.0%组外的其他各组的血清中CT含量随磷酸脲添加量增加有降低趋势,而4.0%组出现突然的增加。13 d时的4.0%组血清25-OH-VD含量远低于同期其他各组。在同组间13 d的血清PTH、CT、25-OH-VD含量都高于1 d。
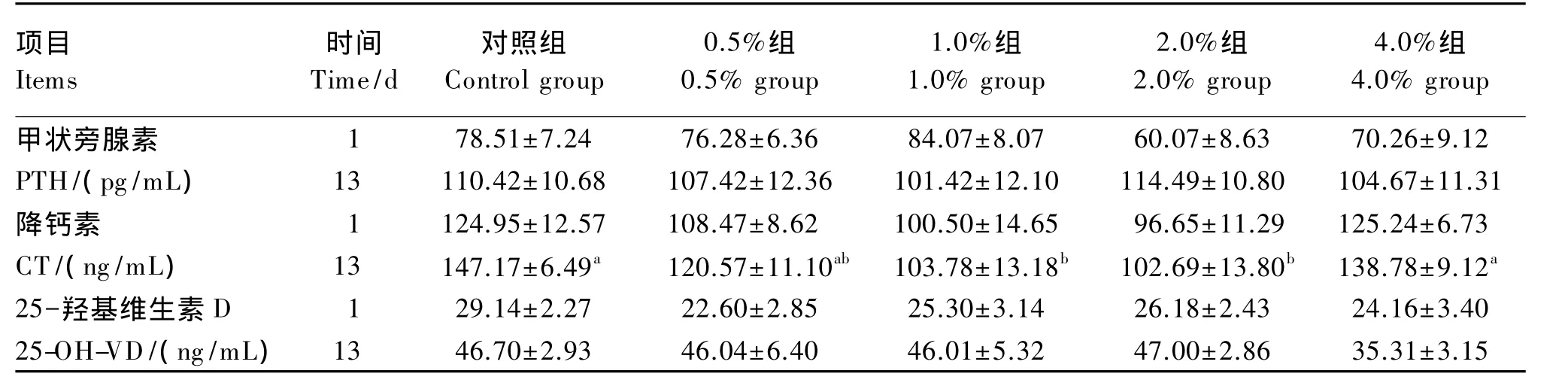
表4 不同磷酸脲添加量对羔羊血清甲状旁腺素、降钙素和25-羟基维生素D含量的影响Table 4 Effects of different levels of dietary urea phosphate on serum PTH,CT and 25-OH-VD contents of lambs
3 讨 论
3.1 磷酸脲对羔羊血清钙、磷含量的影响
张力等[13]报道,奶牛血清磷含量在 1.06~3.39 mmol/L之 间,血 清 钙 含 量 在 2.43 ~3.05 mmol/L之间。Peterson 等[14]报道奶牛血清磷含量平均值在 2.09~2.17 mmol/L,血清钙含量在 2.35~2.47 mmol之间。Kaneko[15]研究绵羊的血清钙含量的正常值为 2.5~3.0 mmol/L,而王小龙[16]和王俊东等[17]的绵羊血清钙含量参考值均为 2.88~3.20 mmol/L,本试验的羔羊血清钙含量均低于该参考值的下限,或者仅有少数在Kaneko[15]报道正常值的下限。在对照组中血清的钙含量也较低,因此这可能与此次试验的环境条件及羔羊的生长状况有关。本次试验的肉羊处于3~5月龄,正是羔羊的快速生长阶段,机体的快速生长特别是骨骼的生长容易导致血清钙含量的降低,这可能也是各组73 d的羔羊血清钙含量低于1和13 d的原因。试验组的血清中钙含量的降低除与羔羊的机体生长有关,可能也与磷酸脲的添加有关。在正试期中,各组血清钙含量随着磷酸脲的添加量增加呈明显的下降趋势,这可能与磷酸脲溶液的酸性有关。磷酸脲溶液有较强酸性,1.0%的磷酸脲溶液pH为1.89,因此作为反刍动物添加剂,我们必须考虑它可能引发的瘤胃酸中毒,赵晨旭等[18]的研究表明,当肉牛发生亚急性瘤胃酸中毒时,血液中钙的含量降低,因此随着磷酸脲添加量的增加,瘤胃液的pH降低,从而导致细胞外液的氢离子(H+)浓度增加而进入细胞内,使得钾离子(K+)逸出细胞外以维持细胞外的pH的恒定。K+的外流使得细胞超极化,导致钙离子(Ca2+)的通道关闭,Ca2+无法转移到细胞外,特别使得血液中Ca2+浓度降低。本试验过程中没有出现羊的严重瘤胃酸中毒导致的死亡,这可能是在预试期的适应使得肉羊的自身调剂能力增强,但磷酸脲较强的酸性还是会导致瘤胃液pH降低,进而使血清钙含量随磷酸脲添加量增加而降低。13 d时4.0%组羔羊血清中的钙含量显著低于对照组,而在73 d时尽管血清钙含量仍低于对照组,但差异不显著,说明羔羊对机体内的钙、磷含量有一定的调节能力,以维持其平衡。
据王俊东等[17]的报道,绵羊血清无机磷含量的正常参考值在 1.61~2.35 mmol/L之间。本试验中各组羊的血清磷含量均在该参考值范围内,说明磷酸脲在这几个添加量下是安全的。苏月娟等[19]研究发现,猪血清中钙、磷含量与饲粮中磷含量的高低呈强相关性,且随饲粮磷水平的升高表现出先升高后降低的二次曲线变化趋势;陈娟[20]研究发现随饲粮中磷含量的增加,肉鸡血清中钙的含量显著降低,血清中磷的含量显著增加。在本试验中血清中磷的含量随磷酸脲添加量的增加而增加,这可能与试验饲粮中因磷酸脲的添加量增加引起的饲粮中磷含量的增加有关。血清中钙含量的降低与饲粮中磷水平的增加也有一定的关系。
3.2 磷酸脲对羔羊肌肉钙、磷含量的影响
肌肉是肉羊的重要产品,肌肉中的钙、磷含量变化是肉羊肉用性能的重要参数,本试验中,肌肉中的钙、磷含量差异不显著,钙的含量随磷酸脲的添加量增加而有降低的趋势,磷的含量也稍有增加的趋势,但各组间的钙、磷含量基本处于恒定。肌肉中钙、磷含量的变化趋势与血清相似,杨凤[21]的研究表明矿物质在动物体内的分布处于一个动态的平衡中,因此血清中相关矿物质含量的增加或减少会引起肌肉中对应矿物质含量的变化。纪守坤[22]的研究表明肉羊的饲喂水平对其肌肉中的钙、磷含量没有显著的影响,其经试验测得的同期杜寒杂交羔羊每100 g肌肉(鲜重)含钙11.89 mg,磷 181.13 mg,对应的干样中含钙 0.040 3%,磷0.614%。此结果略小于本试验结果,原因可能为本试验选取肌肉位置为羊背腰最长肌部位,而纪守坤[22]的羊肉采集部位为全身羊肉的混合样。此次试验的肉羊肌肉钙、磷含量与对照组相比差异不显著,说明磷酸脲在此饲喂条件下对肌肉钙、磷的含量作用不明显,各个试验组与对照组相比处于恒定状态,说明动物具有一定的自我调控能力,维持肌肉中矿质元素保持恒定。
3.3 磷酸脲对羔羊血清相关激素含量的影响
反刍动物的钙、磷代谢调控主要由PTH、CT和25-OH-VD 3种激素共同调节,这3种激素对血清中钙、磷的平衡具有重要的调节作用。PTH是由甲状旁腺主细胞分泌的碱性单链多肽类激素,分子质量9 ku。它的主要功能是调节脊椎动物体内钙和磷的代谢,促使血清钙含量升高,血清磷含量下降。CT的分泌与流经甲状腺的血液中钙含量有关,它可以降低血清钙含量。25-OH-VD对体内骨骼组织的矿质化过程有着非常重要的作用,它可以提高动物对钙、磷的吸收,使血清钙和磷的含量达到饱和程度,促进生长和骨骼钙化,促进牙齿健全;通过肠壁增加磷的吸收,并通过肾小管增加磷的再吸收,25-OH-VD是重要的维生素代谢产物,临床应用于骨代谢指标联合检测骨质疏松和佝偻病,用以诊断钙的缺乏。因此研究血清中PTH、CT、25-OH-VD含量的变化是研究磷酸脲对血清和肌肉中钙、磷含量变化的重要基础。
血清钙的平衡是一个复杂的摄入、排出和再循环的过程[23]。本试验中,各组间因磷酸脲添加量的增加,使得饲粮中磷摄取量增加,促使血清钙含量降低,血清磷含量增加。血清钙和磷含量的变化又会反馈调节机体内的PTH、CT、25-OH-VD的含量。当血清钙含量降低时,会刺激甲状旁腺合成和分泌PTH[24],增强肾小球对钙的重吸收;同时刺激肝和肾中1,25-二羟维生素D3合成,使得骨钙被活化,提高体内血清钙的含量。在本试验过程中13 d时的各组血清钙含量低于1 d,但PTH和25-OH-VD的含量在13 d时明显高于1 d。CT是体内降低血清钙含量的主要激素,它的含量与血清钙含量呈正相关。在本试验中,除4.0%组外其他各组的血清CT含量随磷酸脲添加量增加而降低,与血清钙含量变化趋势相同。Kichura等[25]用含10和82 g磷的饲粮饲喂奶牛,高磷饲粮组血浆25-OH-VD和血清钙含量低于低磷组,高磷组的血清磷含量高于低磷组,高于6.0 mg/dL,该结果与本试验结果相一致。饲粮中磷含量的增加引起血清中钙含量的降低,磷含量的增加,进而反馈调节血清中PTH、CT、25-OH-VD的含量。13 d时4.0%组血清CT含量没有随磷酸脲量的增加而继续降低,而是突然地增加,其含量与对照组差异不显著,原因可能是尽管该组的饲粮中加入高水平磷酸脲,但该组羊处于中毒状态,其采食量低于其他各组,从而采食的磷酸脲也降低,影响了血清中 CT的含量。4.0%组的25-OH-VD含量平均值为35.31 ng/mL,而同期的其他各组的含量在 46.01~47.00 ng/mL 之间,相应的血清钙含量也低于对照组,其原因可能为4.0%组的高的含磷量及磷酸脲的强酸性,体内的钙和25-OH-VD含量的降低,血清磷含量的显著增加。
在本试验过程中试验开始时(1 d)对照组、0.5%组、1.0%组、2.0%组和 4.0%组的平均体重依次是 26.01、25.84、25.94、25.93 和 25.56 kg,而试验结束时(73 d)各组的平均体重依次是42.34、42.57、43.59、42.45 和 28.38 kg。由此可以看出,仅4.0%组很少增重,其他各组在试验结束时体重相近,推测4.0%组处于中毒状态而影响到了生长性能。但4.0%组的血清和肌肉中钙、磷及相关激素含量中,仅血清磷含量显著高于对照组。而血清磷含量的增加主要缘于饲粮中的磷水平提高,由此可见通过血清磷和肌肉中钙、磷含量及血清相关激素含量并不能很好反映羔羊的中毒情况,因此也不能作为磷酸脲对羔羊安全性的最佳评价指标。
4 结论
磷酸脲添加量的增加会引起饲粮磷含量增加,使饲粮钙、磷比发生变化,引起羔羊血清中钙含量的降低,磷含量的增加,肌肉中的钙、磷的含量基本处于恒定状态。血清中磷含量增加会反馈调节血清中相关激素含量,对血清中PTH和25-OH-VD没显著影响,但会引起CT含量的显著变化。
饲粮中添加4.0%的磷酸脲会抑制羔羊的增重。
[1] 李芸,张英杰.羊蛋白质营养研究进展[C]//中国畜牧兽医学会养羊学分会2014年全国养羊生产与学术研讨会议论文集.聊城:中国畜牧兽医学会养羊学分会,2014:23-26.
[2] 李华慧.高效尿素添加剂的研究与应用[J].中国畜牧兽医,2007,34(2):17-20.
[3] 张宏.磷酸脲产品的开发研究现状[J].青海大学学报,2000,18(2):17-21.
[4] 郭萍.新型饲料添加剂——磷酸脲[J].中国饲料,1996(2):24-25.
[5] 王成章,王恬.饲料学[M].北京:中国农业出版社,2003:10-11.
[6] 易建明,朱蓉华,倪宗平,等.奶牛日粮添加磷酸脲增奶试验[J].湖北农业科学,1996(3):51-53.
[7] 王波,姜成钢,纪守坤,等.饲粮中添加不同水平尿素对肉羊有效性和安全性的影响[J].动物营养学报,2014,26(5):1302-1309.
[8] 王波,姜成钢,纪守坤,等.日粮尿素水平对肉羊血液学、血清学指标和消化器官的影响[J].畜牧兽医学报,2014,45(9):1449-1456.
[9] NRC.Nutrient requirements of small ruminants:sheep,goats,cervids,and new world camelids[S].10th ed.Washington,D.C.:National Academy Press,2007.
[10] 刘洁,刁其玉,赵一广,等.肉用绵羊饲料养分消化率和有效能预测模型的研究[J].畜牧兽医学报,2012,43(8):1230-1238.
[11] 纪守坤,许贵善,姜成钢,等.20~35 kg体重阶段杜泊×小尾寒羊F1代公羔体内钙、磷、钠、钾、镁含量及分布特点[J].畜牧兽医学报,2013,44(12):1946-1953.
[12] 张丽英.饲料分析及饲料质量检测技术[M].2版.北京:中国农业大学出版社,2003:45-100.
[13] 张力,周学辉,龚伟宏,等.宁夏利通区奶牛围产期钙磷盈亏状况调查[J].中国草食动物,2003,23(3):12-13.
[14] PETERSON A B,ORTH M W,GOFF J P,et al.Periparturient responses of multiparous Holstein cows fed different dietary phosphorus concentrations prepartum[J].Journal of Dairy Science,2005,88(10):3582-3594.
[15] KANEKO J J.Clinical biochemistry of domestic animals[M].3rd ed.London,Toronto,Sydney and San Francisco:Academic Press,1980:792-795.
[16] 王小龙.兽医临床病理学[M].北京:中国农业出版社,1995.
[17] 王俊东,刘宗平.兽医临床诊断学[M].北京:中国农业出版社,2004.
[18] 赵晨旭,王晓旭,宋玉祥,等.肉牛亚急性瘤胃酸中毒相关血液指标测定分析[C]//中国畜牧兽医学会第三届中国兽医临床大会论文集.兰州:中国畜牧兽医学会第三届中国兽医临床大会,2012:81-84.
[19] 苏月娟.30~60 kg生长猪磷需要量研究[D].硕士学位论文.长春:吉林农业大学,2012.
[20] 陈娟.饲粮磷水平对肉鸡生长性能和磷利用的影响及其机理研究[D].硕士学位论文.长沙:湖南农业大学,2012.
[21] 杨凤.动物营养学[M].北京:中国农业出版社,2002.
[22] 纪守坤.20~35 kg杜泊×小尾寒羊F1代羔羊体内主要矿物质分布规律及需要量参数的研究[D].硕士学位论文.北京:中国农业科学院,2013.
[23] GOFF J P.Physiologic factors to consider in order to prevent periparturient disease in the dairy cow,with special emphasis on milk fever[C]//Western Dairy Management Conference.Las Vegas Nevada:[s.n.],1999:100-112.
[24] CARMELIET G,VAN CROMPHAUT S,DACI E,et al.Disorders of calcium homeostasis[J].Best Practice&Research Clinical Endocrinology&Metabolism,2003,17(4):529-546.
[25] KICHURA T S,HORST R L,BEITZ D C,et al.Relationships between prepartal dietary calcium and phosphorus,vitamin D metabolism,and parturient paresis in dairy cows[J].The Journal of Nutrition,1982,112(3):480-487.

