内切纤维素酶协助TEMPO氧化制备纳米纤维1
赵海儒, 吴淑芳*, 宋君龙, 丁少军
(南京林业大学 江苏省制浆造纸科学与技术重点实验室,江苏 南京 210037)
内切纤维素酶协助TEMPO氧化制备纳米纤维1
赵海儒, 吴淑芳*, 宋君龙, 丁少军
(南京林业大学 江苏省制浆造纸科学与技术重点实验室,江苏 南京 210037)
利用内切型纤维素酶(EG1)预处理全漂硫酸盐针叶浆,再经过超声波协助2,2,6,6-四甲基哌啶氧自由基(TEMPO,2,2,6,6-tetramethylpiperidine-1-oxyl radical)氧化制备纳米纤维。通过氧化还原滴定和电导滴定监测TEMPO氧化过程中残余有效氯和纤维中的羧基含量的变化,并利用纤维粒度分析仪、毛细管粘度计和透射电镜分析制备纤维样品的尺寸分布、流动性能以及纤维形貌,研究了EG1预处理对超声波协同TEMPO氧化制备纳米纤维的影响。结果表明:相同的TEMPO氧化条件下,经10 U/g EG1预处理12 h、24 h和48 h后,纤维羧基含量分别由2.05 mmol/g增加到2.35 mmol/g、3.03 mmol/g和3.13 mmol/g;与对照相比,经EG1预处理再TEMPO氧化制备的样品透明度增加,纤维尺寸减小,流动性下降。
内切纤维素酶;纳米纤维;TEMPO氧化;漂白针叶浆
超声波协同2,2,6,6-四甲基哌啶氧自由基(TEMPO)催化氧化是一种制备纳米纤维的有效方法之一[1]。在TEMPO催化氧化过程中,TEMPO能够选择性地将纤维表面的C6羟基氧化成羧基,羧基在碱性条件下呈现出负电荷,因静电斥力作用,制备得到的纳米纤维能够相对稳定地存在于水中;超声波能够打开纤维的层次结构,从而使反应速率增加。纤维素酶用于制备纳米纤维的研究中,常与机械法或者化学法结合,用来弥补单纯的机械法能耗较高,或者TEMPO氧化制备的纳米纤维尺寸分布不均等缺陷[2-5]。
EG1是重组中性内切型纤维素酶[6],本文利用EG1预处理漂白针叶浆,而后以超声波协同TEMPO氧化的方式制备纳米纤维,探讨EG1预处理对TEMPO氧化纤维中羧基含量、流动性能、粒径分布以及形貌尺寸等性能的影响。
1 实验
1.1材料与仪器
2,2,6,6-四甲基哌啶氧自由基购于百灵威公司公司,酵母汁和蛋白胨购于sigma公司,实验所用其它试剂均为国产分析纯试剂。
全漂硫酸盐(KP)针叶浆,好声牌,产自加拿大。浆板手工撕碎,浸泡过夜后疏解,离心脱水后撕成小碎片,放置在冰箱备用。菌种pPIC51-EG1-GS115,来自于南京林业大学微生物实验室。
恒温空气浴摇床(DH2-2102型,上海精宏实验设备有限公司),探头式超声波(XO-650,南京先欧仪器制造有限公司),电导率仪(DDB-305,上海盛磁仪器有限公司),纳米粒度分析仪(BT-90,丹东百特仪器有限公司),透射电镜(JEM-1400,日本电子株式会社)。
1.2实验方法
1.2.1 培养基及试剂配制
YPD:将酵母汁、蛋白胨、山梨醇(终浓度分别为10 g/L、20 g/L、1 M)溶于蒸馏水,加入琼脂(终浓度20 g/L),于121℃高温高压下灭菌20 min;冷却至60℃时加入经滤膜过滤灭菌的葡萄糖溶液(终浓度20 g/L)。
BMGY:10 g 酵母汁,20 g 蛋白胨溶于700 mL水,高温高压灭菌,冷却到室温后加入100 mL pH6.0的1M的磷酸钾缓冲液(高温高压灭菌),100 mL 10倍的YNB(滤膜灭菌),2 mL 500倍B(20 mg 生物素溶于100 mL的水,滤膜灭菌),100 mL 10倍GY(100 mL甘油溶于900 mL水高温高压灭菌),混合均匀后4℃保存。
BMMY:10 g Yeast Extract,20 g peptone溶于700 mL水,高温高压灭菌,冷却到室温后加入100 mL pH 6的1 M的磷酸钾缓冲液(高温高压灭菌),100 mL 10倍YNB(滤膜灭菌),2 mL 500倍B(20 mg biotin溶于100 mL的水,滤膜灭菌),100 mL 10倍M(5%的甲醇),混合均匀后4℃保存。
Somogyi 试剂:(A)溶液:Na2CO324 g、CuSO4·5H2O 4 g、NaHCO316 g、Na-K-Tartr(4H2O)12 g,溶于290 mL蒸馏水中;(B)溶液:Na2SO4180 g溶于500 mL蒸馏水,煮沸后冷却。(A)加入(B)定容到1 L,2天后用Whatman滤纸过滤,37℃保存。
Nelson试剂:(C)溶液:(NH4)6Mo24· 4H2O 5 g溶于450 mL蒸馏水;(D)溶液:21 mL浓H2SO4与3 g溶于25 mL蒸馏水的Na2HAsO4· 7H2O混合。将(C)与(D)混合,定容至500 mL,37℃静置2天后使用。
1.2.2 EG1培养
EG1的培养参见文献[7]:将含有EG1的酵母细胞转接至2 mL YPD培养基中,加2 μL Zeocin,30℃,275 r/min培养24 h。分别取6 mL上述培养液转至600 mL BMGY培养基中,30℃,275 r/min培养至OD600达到3~4,室温下1 500 r/min离心10 min后重新加入200 mL BMMY培养基,30℃,275 r/min培养6天,每隔24 h加甲醇诱导,保持其浓度为0.5%(V/V)。培养完毕离心收集上清液测定酶活。
1.2.3 酶活测定
酶活测定采用Somogyi-Nelson法:1.5 mL 总反应体系中含有0.9 mL 浓度0.1 mol/L(pH7.5)磷酸钠缓冲液、0.5 mL 2%CMC-Na和0.1 mL适当稀释的纤维素酶液。50℃水浴反应30 min,加入0.5 mL Somogyi试剂煮沸15 min,冷却至室温,加入0.5 mL Nelson试剂,静置20 min,10 000 r/min离心10 min后,测定上清液于520 nm的吸光值。以煮沸灭活的相同浓度的酶液作为参比。定义每分钟产生1 μmol 葡萄糖的酶量为1U,酶活单位为U/mL。
1.2.4 EG1预处理
150 mL三角瓶中加入1 g绝干纤维,10 mL 0.1 mol/L的磷酸氢二钠―磷酸二氢钠缓冲溶液(pH7.5)、90 mL去离子水和0.05%(相对绝干纤维)抗生素。将三角瓶固定在恒温空气浴摇床中,按设定的时间于50℃和160 r/min转速下处理,至规定时间后80℃灭活10 min。自然冷却后,置于4℃冰箱中备用。对照用缓冲液代替酶液,其它处理条件相同。
1.2.5 超声波协同TEMPO氧化
将EG1预处理后的悬浮液转移至250 mL烧杯中,加入0.16 g NaBr、0.016 g TEMPO和20 mmol NaClO,用0.1 mol/L NaOH溶液调节pH至10,室温下反应50 min后,用探头式超声波仪处理10 min,功率300 W。继续TEMPO氧化50 min,超声波处理10 min,依次循环,至反应8 h后,加入0.1 mol/L硫代硫酸钠终止反应。
1.3分析方法
1.3.1 反应体系中有效氯含量的测定
利用碘当量法测定反应体系的有效氯含量[8]:测试体系中含有2 mL反应悬浮液,10 mL 20%醋酸溶液和5 mL 100 g/L的KI溶液,用0.1 mol/L标准硫代硫酸钠溶液滴定。
1.3.2 羧基含量的测定
纤维中羧基含量测定采用电导滴定法(DDB-305电导率仪)[10]:0.200 0 g绝干氧化纤维素样品分散于100 mL的0.001 mol/L NaCl溶液中,在氮气保护和磁力搅拌下,用0.05 mol/L NaOH标准溶液滴定。
1.3.3 氧化纤维素尺寸分布分析
利用纳米粒度分析仪测定纤维尺寸分布。TEMPO氧化结束后,取1~2滴样品加入到样品瓶中,用去离子水稀释,调节样品浓度,控制光子数在20~40范围内。利用对纤维投影测出氧化后纤维尺寸。
1.3.4 纳米纤维流动性能分析
借鉴毛细管粘度计测定粘度的方法,在25℃恒温下,检测TEMPO氧化后纤维悬浮液(浆浓1%)流过毛细管粘度计所用的时间。
1.3.5 纳米纤维尺寸测量
将氧化纤维素样品滴在带有碳膜的铜网上,风干,滴上磷钨酸溶液进行染色。干燥后利用透射电镜在加速电压80 kV下进行观察。纳米纤维尺寸的测量是通过手工测量纳米纤维的TEM图像进行的。通过测量TEM图像上纳米纤维的长度、宽度,并且与TEM图像自带的标尺进行对比,得到纳米纤维的长宽数据。
2 结果与讨论
2.1 EG1预处理对TEMPO氧化过程中氯耗及纤维素羧基含量的影响
关于超声波协同TEMPO氧化制备纳米纤维,钱赟做了大量的探索工作[1]。本研究借鉴其摸索出的TEMPO氧化条件,改变EGI预处理条件对漂白针叶浆进行预处理,而后进行超声波协同TEMPO催化氧化制备纳米纤维,研究酶处理条件对纳米纤维素性能的影响。
图1显示的是EG1用量10 U/g,改变酶处理时间对TEMPO氧化过程中残余有效氯和纤维羧基含量的影响。由图1可以看出,无论对照还是经EG1处理的样品,TEMPO氧化过程中随着时间的延长,反应液中有效氯含量均呈下降趋势。并且TEMPO氧化4 h前下降速度比较快,4 h后趋于平缓。相应的,TEMPO氧化纤维上的羧基含量则随着氧化时间延长呈上升趋势,这与钱赟的研究结果基本一致。与对照相比,经EG1处理后样品TEMPO氧化过程中有效氯消耗量增加,相应的氧化纤维素中羧基含量也高于对照样品,并且EG1预处理时间越长,氧化后产品中的羧基含量越高。经EG1预处理48 h的样品,在本研究所采用的条件下氧化8 h,羧基含量由对照的2.05 mmol/g增加到3.13 mmol/g。EG1在预处理纤维的过程中随机切断纤维素长链,产生了更多的还原性末端和纤维碎片,暴露出更多的C6羟基,有利于后续超声波协同作用下TEMPO催化氧化的进行,因而,氧化产生的C6羧基也较多。

图1 EG1处理时间对TEMPO氧化过程中残余有效氯和纤维中羧基含量的影响
改变EG1用量预处理纤维48 h,同样在超声波协同TEMPO催化氧化过程中测定残余有效氯和纤维样品中羧基含量的变化,结果如图2所示。

图2 EG1用量对TEMPO氧化过程中残余有效氯和纤维中羧基含量的影响
由图2可以看出,随着酶用量的增加,预处理后样品在TEMPO氧化过程中残余有效氯降低,即消耗的有效氯随酶用量增加而增加,氧化后纤维中羧基含量也随酶用量增加呈缓慢上升趋势。TEMPO氧化4 h后羧基含量增加速度趋于缓慢,此时,酶用量从5 U/g增加到20 U/g,羧基含量则由2.01 mmol/g增加到2.31 mmol/g。
2.2纤维经EG1预处理再超声波协同TEMPO催化氧化后尺寸分布
图3为超声波协同TEMPO催化氧化8 h后,利用纳米纤维粒径分析仪测得的粒径尺寸分布情况。由图3可以看出,与对照样品相比,经EG1预处理再TEMPO氧化后的样品,纤维粒径均向小尺寸范围移动。EG1预处理12 h、24 h和48 h,氧化后样品粒径大于1 000 nm的比例分别由对照的14%降低至12%、6%和5%。对照样品400~600 nm尺寸范围的比例最高,而经过EG1预处理48 h后样品尺寸主要集中在20~400 nm。

图3 EG1预处理纤维TEMPO氧化8 h后样品尺寸分布
2.3经EG1预处理再超声波协同TEMPO催化氧化后的分散液流动性及纤维形貌
图4为对照及10 U/g用量下EG1预处理12 h、24 h和48 h后TEMPO氧化反应8 h制备的样品。由图4可以看出,经过TEMPO氧化后的纳米纤维(浓度1%,pH 9~10)呈现出半透明胶状,而EG1预处理可以提高产品透明度,并且预处理时间越长产品的透明度越高。相应的,产品的粘度也随着EG1预处理时间的延长而增大。

图4 对照和EG1预处理样品经TEMPO氧化8 h后制备的纳米纤维
借鉴毛细管粘度计测定粘度的方法,在25℃恒温下,检测TEMPO氧化后的纤维样品流经毛细管粘度计的时间,表征氧化后分散液的流动性能,结果如图5所示。
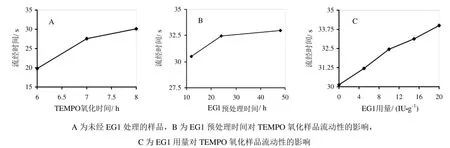
图5 EG1预处理对TEMPO氧化后的样品流动性能的影响
由图5可以看出,未经EG1处理的纤维,超声波协同TEMPO氧化后样品流经毛细管粘度计所用的时间随着反应时间的增加而增加,TEMPO氧化6 h、7 h和8 h后,流经毛细管粘度计所用的时间分别为19.8 s、27.5 s和30.1 s。纤维经EG1预处理12 h、24 h和48 h后再TEMPO氧化8 h,样品流经毛细管粘度计所用的时间分别比对照高了1.0%、8.0 % 和 9.6%;增加预处理时的酶用量也会增加氧化后产品的粘度,酶用量由10 U/g增加至20 U/g,则氧化后产品流经毛细管粘度计的时间由32.5 s增加到34.0 s,增加了4.6%。粘度上升是由于增加预处理酶用量而导致后续氧化过程中解纤程度增加,即纳米尺寸纤维数量增加所致。
利用透射电镜观察TEMPO氧化后样品的形貌,测量纤维的长宽尺寸,结果如图6和表1所示,A、B分别为对照和EG1用量10 U/g 预处理48 h后的样品。EG1预处理后,纤维的长度和宽度尺寸均小于对照样品。对照氧化纤维长度多为200~800 nm,预处理后降至150~600 nm;经EG1预处理后氧化纤维素的宽度也由对照的10~30 nm 减小至10~25 nm,减少了约一个基原纤维宽度。

图6 对照和EG1预处理48h的纤维经TEMPO氧化后TEM图像

表1 TEMPO氧化纤维素样品的尺寸
3 结论
漂白针叶浆经内切纤维素酶EG1预处理后再利用超声波协同TEMPO氧化制备纳米纤维,与未经EG1
处理的对照样品相比,EG1预处理可增加纤维羧基含量,10 U/g EG1用量条件下预处理48 h,羧基含量增加约10%;经EG1预处理再TEMPO氧化制备的纳米纤维,其长度和宽度均小于对照样品,均一度增加;经EG1处理的TEMPO氧化纤维素的粘度也高于对照样品。
[1] 钱赟. TEMPO氧化制备纳米纤维的技术改良[D]. 南京林业大学硕士论文, 2013.
[2] Pääkkö M, Ankerfors M, Kosonen K, et al. Enzymatic hydrolysis combined with mechanical shearing and high-pressure homogenization for nanoscale cellulose fibrils and strong gels[J]. Biomacromolecules, 2007, 8(6): 1934-1941.
[3] 李珊珊, 张洋, 王超, 等. 纤维素酶协同机械法制备微/纳纤丝[J]. 天津农业科学, 2013, 19(11): 4-8.
[4] 李伟, 王锐, 刘守新. 纳米纤维素的制备[J]. 化学进展, 2010, 22(10): 2060-2070.
[5] Isogai A. Wood nanocelluloses: Fundamentals and applications as new bio-based nanomaterials[J]. J Wood Sci, 2013, 59: 449-459.
[6] 叶代勇. 纳米纤维素的制备[J]. 化学进展, 2007, 19(10): 1568-1575.
[7] Ding S, Ge W, Buswell J A. Secretion, purification and characterisation of a recombinant Volvariella volvacea endoglucanase expressed in the yeast Pichia pastoris[J]. Enzyme & Microbial Technology, 2002, 31(5): 621-626.
[8] 石淑兰, 何福望. 制浆造纸分析与检测[M]. 北京: 中国轻工业出版社, 2010.
[9] Perez D, Montanari S, Vignon M R. TEMPO-mediated oxidation of cellulose Ⅲ[J]. Biomacromolecules, 2003, 4(5): 1417-1425.
[10] Saito T, Isogai A. TEMPO-mediated oxidation of native cellulose: The effect of oxidation conditions on chemical and crystal structures of the water-insoluble fractions[J]. Biomacromolecules, 2004, 5(5): 1983-1989.
Endo-glucanase Assisted Preparation of TEMPO Oxidized Cellulose Nanofibers
ZHAO Hai-ru, WU Shu-fang*, SONG Jun-long, DING Shao-jun
(Jiangsu Provincial Key Laboratory of Pulp and Paper Science and Technology, Nanjing Forestry University, Nanjing 210037, China)
Bleached softwood pulp was pretreated by EG1, then cellulose nanofiber (CNF) was prepared by a 2,2,6,6-tetramethylpiperidine-1-oxyl radical (TEMPO) oxidation with ultrasonic. The residual active chlorine of cellulose/water slurry or dispersions and carboxyl group content of fiber could be monitored by redox and conductivity titration during TEMPO oxidation process. The particle size distribution, viscosity of dispersions and fiber morphology of nanofibers could be characterized by nanoparticle size analyzer, capillary viscometer and transmission electron microscopy (TEM) respectively. The results indicated that under the same conditions of TEMPO oxidation, carboxyl group content of cellulose was improved to 2.35 mmol/g, 3.03 mmol/g and 3.13 mmol/g from 2.05 mmol/g at 12 h, 24 h and 48 h respectively. Comparison with control sample, viscosity and transparency of nanofibers was increased, fiber size distribution was more uniform.
endo-glucanase; cellulose nanofiber; TEMPO oxidation; bleached softwood pulp
TS71.1
A
1004-8405(2015)04-0055-06
10.16561/j.cnki.xws.2015.04.13
2015-10-12
国家自然科学基金项目(31470593)。
赵海儒(1987~),男,硕士研究生;研究方向:制浆造纸工程。
* 通讯作者:吴淑芳(1968~),女,副教授,博士;研究方向:制浆化学及生物质精炼。njwusf@163.com

