毕赤酵母干粉吸附还原氯金酸制备金纳米颗粒
黄晓丹,李先学
(莆田学院 环境与生物工程学院,福建 莆田 351100)
伴随着时代的飞速发展,纳米科学技术成为了21 世纪信息时代的核心,纳米颗粒的制备、应用及其微观层次上性能的研究吸引了广大研究人员的不断探索。金纳米颗粒是一种新型的催化剂,在催化氧化反应中具有很高的活性,同时金纳米还具有很多特性,如具有介电特性、很高的电子密度和可以与各种生物分子结合且不会使生物体失去活性,正是由于这些特性让金纳米颗粒在各大领域都有很大的应用价值[1]。
金纳米颗粒的制备方法有化学法、物理法和生物法三大类。物理法对仪器设备要求较高,生产费用昂贵,且对贵金属纳米材料形貌的调控能力有限[2-4];化学制备方法条件简单、成本低、产量大,所以,目前对于金纳米颗粒的制备方法研究最多的是化学法,但给环境带来了一定程度的污染[5-10],显然,不符合现在的可持续发展理念。近几年来,材料制备过程绿色化的研究日趋活跃,生物法受到了越来越多的重视,其反应过程中不用添加除金属前驱体外的其他化学试剂,且反应条件温和[11],因此,本文利用毕赤酵母干粉还原氯金酸制备金纳米颗粒。
1 实验部分
1.1 试剂与仪器
氯金酸、无水乙醇、氢氧化钠、盐酸、葡萄糖均为分析纯;大豆蛋白胨,生化试剂。
SHZ-82 气浴恒温振荡器;SPX-150B-Z 生化培养箱;YX-280D 高压灭菌锅;SW-CJ-1FD 超净工作台;SHZ-82 恒温振动器;BS124 电子天平;SIGMA3-18K 冷冻离心机;Cary 5000 紫外可见近红外分光光度计;TAS-986 原子吸收分光光度计;TECNAI F30场发射透射电镜;X’Pert Pro X 射线粉末衍射仪;Nicolet IR200 傅里叶变换红外光谱仪。
1.2 毕赤酵母干粉及金纳米颗粒的制备
1.2.1 HAuCl4(48.56 mmol/L)溶液的配制 把1 g 氯金酸,置于50 mL 烧杯中,用20 mL 去离子水溶解,然后移入50 mL 容量瓶并定容至50 mL,即为48.56 mmol/L HAuCl4溶液。
1.2.2 毕赤酵母干粉的制备 大豆蛋白胨20 g/L,酵母粉10 g/L,葡萄糖20 g/L。在30 ℃、150 r/min下振荡培养48 h。将培养好的菌体在4 000 r/min条件下,离心20 min,除去上清液,菌体用去离子水洗涤3 次,将湿菌体置于80 ℃烘箱中干燥至恒重,冷却后研磨成粉,用60 目筛过筛,过筛物即为毕赤酵母干粉(60 目),存于干燥器中备用。
1.2.3 毕赤酵母干粉还原HAuCl4制备金纳米颗粒 在100 mL 锥形瓶中,加入一定量的去离子水、一定量的HAuCl4(48.56 mmol/L)溶液,用盐酸或氢氧化钠调节溶液pH 值,再加入一定量的毕赤酵母干粉,置于恒温培养摇床(转速为150 r/min)中振摇混合,每隔一段时间取样分析。
1.3 毕赤酵母干粉对[AuCl4]-吸附量的测定
毕赤酵母干粉对[AuCl4]-的吸附量Q(mg/g)计算式为:
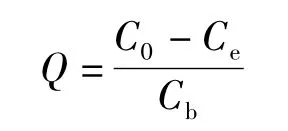
式中 C0——HAuCl4溶液的初始浓度,mg/L;
Ce——溶液中残余[AuCl4]-的浓度,mg/L;
Cb——毕赤酵母干粉的浓度,g/L。
1.4 金纳米颗粒的表征
1.4.1 紫外-可见光谱(UV-Vis) 取1 mL 反应液,稀释一定倍数后,倒入1 cm ×1 cm 的比色皿中,以水为参比,在紫外可见近红外分光光度计上进行检测,扫描波长范围为400 ~1 100 nm,扫描步长为1 nm。
1.4.2 电镜观察、选区电子衍射、X 射线能谱分析透射电镜(TEM)、高分辨透射电镜(HRTEM)、选区电子衍射(SAED)、X 射线能谱(EDX)是利用场发射透射电镜,在加速电压为300 kV 下,对样品进行表征。应用Sigma Scan Pro 4 软件统计TEM 图片中金纳米颗粒的粒径,为了确保数据的准确性,统计的金纳米颗粒数目均在200 个以上。
1.4.3 X 射线粉末衍射(XRD) 将毕赤酵母干粉与HAuCl4反应后的离心物用去离子洗涤5 次,干燥后,利用X 射线粉末衍射仪,以CuKα 为辐射源(λ=0.154 18 nm),在电压为40 kV、电流为30 mA 的条件下扫描,扫描范围为10 ~90°,步长为0.016 7(°)/步,每步扫描时间约为10 s。
1.4.4 傅里叶变换红外光谱仪(FTIR) 将毕赤酵母干粉及毕赤酵母干粉与HAuCl4反应后的离心物置于60 ℃烘箱中干燥,将干燥的KBr 粉末取少量待测样品均匀混合(KBr 与样品比例大约为1∶100),研磨成粉并压片,用FTIR 光谱仪检测样品的红外光谱。
2 结果与讨论
2.1 还原条件对毕赤酵母干粉吸附[AuCl4]-吸附量的影响
2.1.1 吸附时间 图1 为时间对毕赤酵母干粉吸附[AuCl4]-吸附量的影响,反应条件:HAuCl4浓度1.00 mmol/L,毕赤酵母干粉4 g/L,pH 4,温度30 ℃。

图1 时间对毕赤酵母干粉吸附[AuCl4]-吸附量的影响Fig.1 Effect of adsorption time on adsorption capacity of[AuCl4]- by Pichia pastoris powder
由图1 可知,在5 ~20 min 内,毕赤酵母干粉对[AuCl4]-吸附量随时间的增加而快速增加,40 min后吸附量随时间的增加变化不大,吸附量维持在49.75 mg/g 左右,即40 min 即可达到吸附平衡。
2.1.2 pH 值 图2 为溶液pH 值对毕赤酵母干粉吸附[AuCl4]-吸附量的影响,反应条件:HAuCl4浓度1.00 mmol/L,毕赤酵母干浓度4 g/L,温度30 ℃。
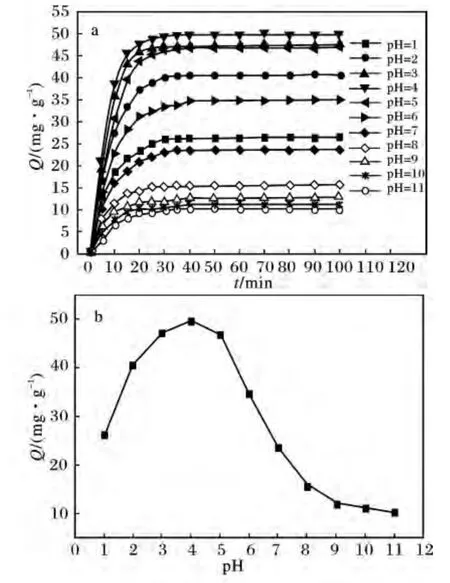
图2 溶液pH 值对毕赤酵母干粉吸附[AuCl4]-吸附量的影响Fig.2 Effect of pH on adsorption capacity of[AuCl4]- by Pichia pastoris powder
由图2a 可知,不同pH 值对毕赤酵母干粉吸附[AuCl4]-吸附量的影响很大,但40 min 之后吸附量变化不大,即达到吸附平衡。图2b 为pH 值对毕赤酵母干粉吸附[AuCl4]-平衡吸附量的影响,由图2b可知,pH 在3 ~5 范围内,毕赤酵母干粉对[AuCl4]-的吸附量在46.93 mg/g 以上,pH =4 时,其吸附量最大,为49.75 mg/g,这可能是由于在酸性介质中,菌体表面的一些功能基团,如—NH2质子化为—NH3+,使细胞带正电,可以与[AuCl4]-产生静电吸附作用。但是pH≤2 时,吸附量明显下降,这可能是由于在强酸性介质中,有大量的H+和H3O+形成,它们与细胞壁上带正电荷的功能基团竞争[AuCl4]-,导致毕赤酵母干粉对[AuCl4]-的吸附量下降;pH =6 时,吸附量也明显下降,这可能是菌体上的羧基等功能基团发生解离形成为—COO-,同时—NH2以游离的形式存在,使细胞表面的电负性增强,不利于[AuCl4]-的吸附,这与刘月英等[12]利用金霉素链霉菌废菌丝吸附[AuCl4]-得到的结果是一致的,而pH >7 时,吸附量下降更为明显,这可能是因为溶液中引入了OH-,细胞表面的电负性更强,使细胞表面上可与[AuCl4]-结合的带正电的官能团大大减少。可见,溶液的pH 值对毕赤酵母干粉吸附[AuCl4]-的吸附量影响较大。2.1.3 温度 图3 为温度对毕赤酵母干粉吸附[AuCl4]-吸附量的影响。反应条件:HAuCl4浓度1.00 mmol/L,毕赤酵母干粉浓度4 g/L,pH 4,时间40 min。
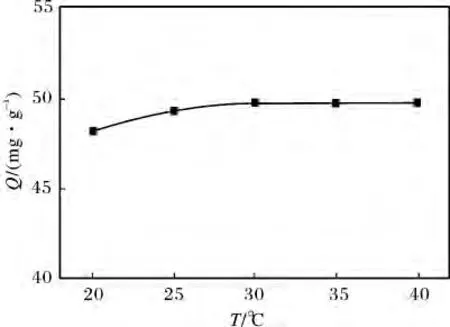
图3 温度对毕赤酵母干粉吸附[AuCl4]-吸附量的影响Fig.3 Effect of temperature on adsorption capacity of[AuCl4]- by Pichia pastoris powder
由图3 可知,随温度的升高(20,25,30,35,40 ℃),毕 赤 酵 母 干 粉 对[AuCl4]-的 吸 附 量(48.23,49.34,49.75,49.75,49.75 mg/g)并未发生明显的变化,说明毕赤酵母干粉对[AuCl4]-的吸附作用与温度的关系不大。
2.1.4 HAuCl4浓度 图4 为HAuCl4初始浓度对毕赤酵母干粉吸附[AuCl4]-吸附量的影响。反应条件:毕赤酵母干粉浓度4 g/L,pH 4,温度30 ℃。
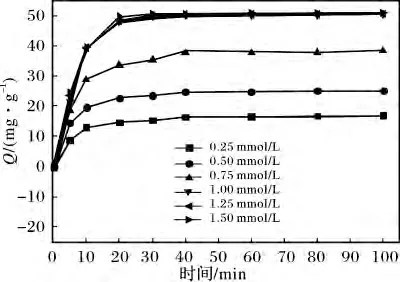
图4 HAuCl4 初始浓度对毕赤酵母干粉吸附[AuCl4]-吸附量的影响Fig.4 Effect of the initial concentration of HAuCl4 on adsorption capacity of[AuCl4]- by Pichia pastoris powder
由图 4 可知,在 HAuCl4的浓度低于1.00 mmol/L时,随着HAuCl4浓度的增加,其平衡吸附量也随之增大,但HAuCl4的浓度为1. 00,1.25,1.50 mmol/L 这三条吸附曲线基本重叠,这说明,当HAuCl4的浓度>1. 00 mmol/L 时,随着HAuCl4的浓度的增加,平衡吸附量基本不变。可见对于4 g/L 的毕赤酵母干粉,当HAuCl4的浓度达到1.00 mmol/L 时,毕赤酵母干粉表面的吸附位点已经基本饱和。
图5 为不同HAuCl4初始浓度下毕赤酵母干粉吸附还原HAuCl4所制得的金纳米颗粒的TEM 图和粒径分布图,反应条件:毕赤酵母干粉浓度4 g/L,pH 4,温度30 ℃,时间40 min。
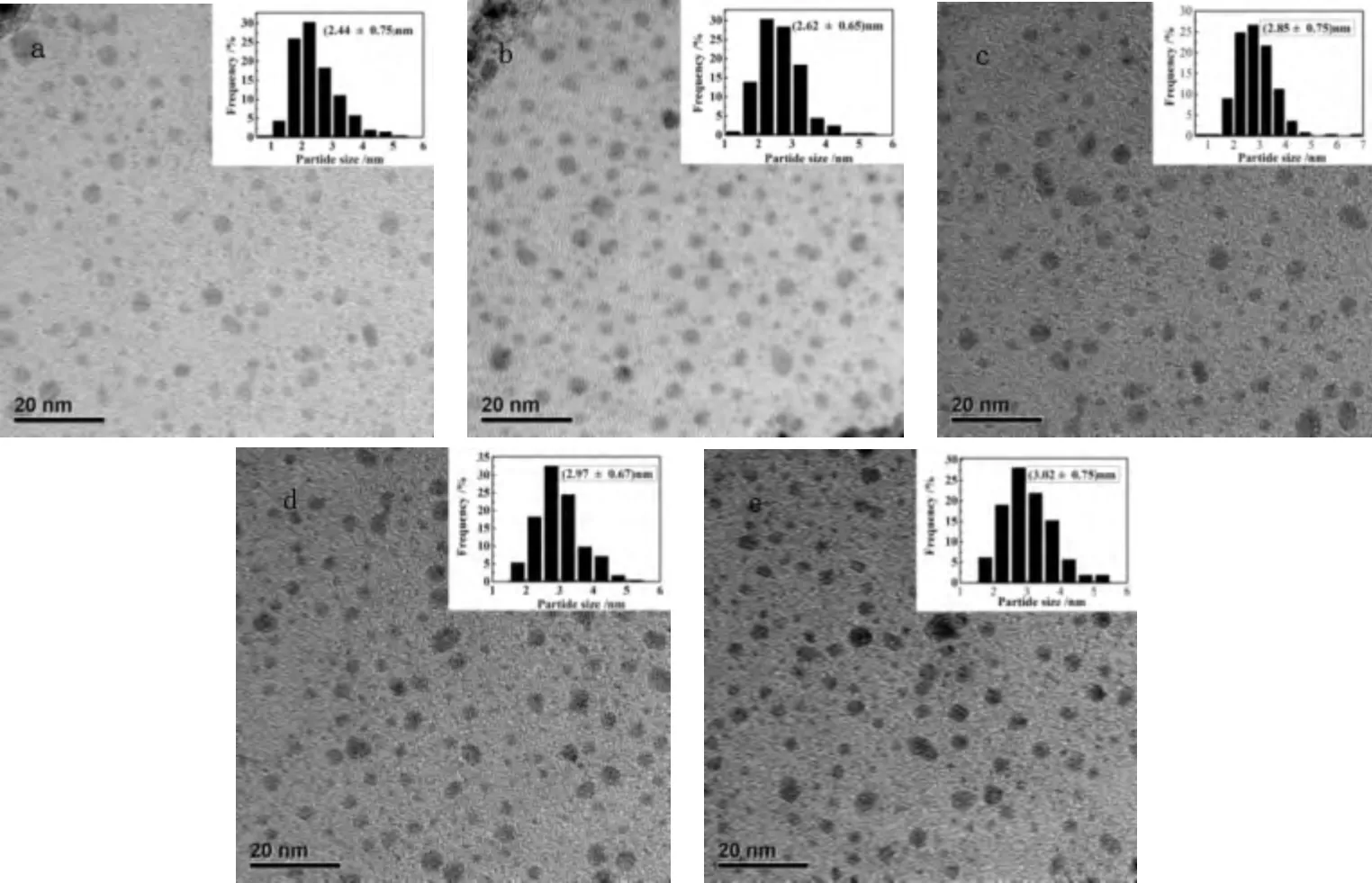
图5 不同HAuCl4 初始浓度下毕赤酵母干粉吸附还原[AuCl4]-所制得的金纳米颗粒的TEM 图和粒径分布图Fig.5 TEM photograph of gold nanoparticles prepared by the adsorption and reduction of different initial concentration of HAuCl4 by Pichia pastoris powder and the graphs of particle size distribution a.0.25 mmol/L;b.0.50 mmol/L;c.1.00 mmol/L;d.1.25 mmol/L;e.1.50 mmol/L
由图5 可知,随着HAuCl4初始浓度的增大,金纳米颗粒的平均粒度随着浓度的增大而逐渐增大[(2.44 ±0.75)nm、(2.62 ±0. 65)nm、(2. 85 ±0.75)nm、(2.97 ±0.67)nm、(3.02 ±0.75 nm)],但增大不明显。
2.2 金纳米颗粒的表征
2.2.1 UV-Vis 表征 在HAuCl4浓度为1.00 mmol/L、毕赤酵母干粉浓度为4 g/L、pH 为4、温度为30 ℃的条件下,发现溶液的颜色由淡黄色逐渐变为紫红色,表明有金纳米颗粒的生成,该溶液随时间变化的UV-Vis 吸收光谱图见图6。
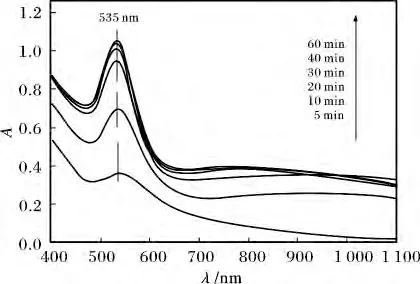
图6 毕赤酵母干粉吸附还原氯金酸溶液的UV-Vis吸收光谱图Fig.6 UV-Vis spectra of the adsorption and reduction of HAuCl4 solution by Pichia pastoris powder
由图6 可知,在535 nm 处出现金纳米颗粒的表面等离子共振吸收峰,并且该峰强度随着时间的延长而逐渐增强,但在40 min 后吸光度达到最大,这表明氯金酸还原反应的完成。
2.2.2 金纳米颗粒的SAED、HRTEM、EDX、XRD表征 图7a ~图7d 分别是金纳米颗粒的SAED、HRTEM、EDX、XRD 图,反应条件:HAuCl4浓度1.00 mmol/L,毕赤酵母干粉浓度4 g/L,pH 4,温度30 ℃,时间40 min。
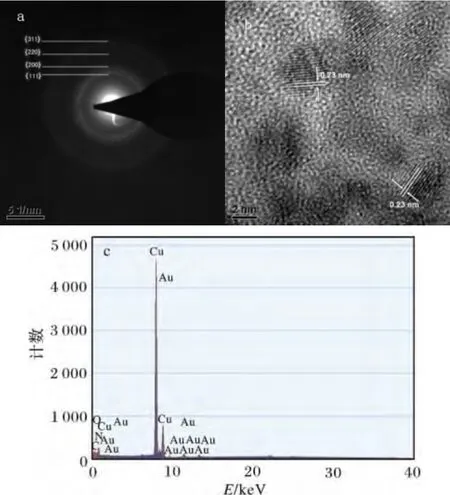
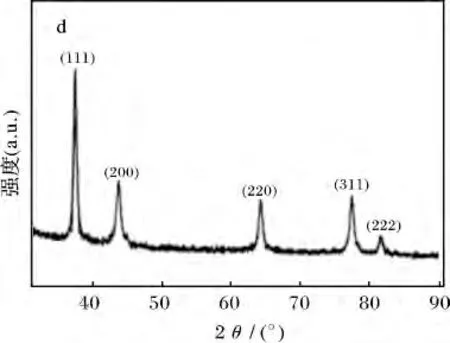
图7 毕赤酵母干粉还原制备金纳米颗粒表征Fig.7 Characterization of gold nanoparticles prepared by reduction of HAuCl4 solution using Pichia pastoris powder a.SAED 图;b.HRTEM 图;c.EDS;d.XRD 图
由图7a 可知,所得金纳米颗粒具有面心立方金的(111)、(200)、(220)、(311)等4 个特征晶面,衍射花样呈环状,表明产物为多晶金颗;由图7b 可知,金纳米颗粒的晶面间距约为0.23 nm,与面心立方Au 的(111)面相吻合;由图7c 可知,选区中含有大量的Au(其中C、O、N 等元素来自于毕赤酵母干粉残留的物质);图7d 为金纳米颗粒的XRD 表征图,样品明显出现了单质金晶体的5 个特征衍射峰,这5 个特征衍射峰与pdf 卡(pdf 卡片号:00-001-1172)是相吻合的。通过SAED、HRTEM、EDX、XRD 等表征,可以进一步证实毕赤酵母干粉吸附还原氯金酸溶液可制得金纳米颗粒。
2.3 FTIR 表征
图8 给出了毕赤酵母干粉吸附还原HAuCl4前后的FTIR 图。反应条件:HAuCl4浓度1.00 mmol/L,毕赤酵母干粉浓度4 g/L,pH 4,温度30 ℃,时间40 min。

图8 毕赤酵母干粉吸附还原HAuCl4 前后的FTIR 谱图Fig.8 TIR spectra of yeast Pichia pastoris before and after the biosorption/bioreduction with HAuCl4
图8a 为毕赤酵母干粉的 FTIR 图,谱带3 381 cm-1处为N—H 和O—H 的伸缩振动峰,1 651 cm-1处为蛋白质酰胺I 带的 C O伸缩振动,1 545 cm-1处为蛋白质酰胺II 带的N—H 弯曲振动和C—N 伸缩振动,1 400 cm-1处为离子化羧基的CO对称伸缩振动,而1 240 cm-1的谱带可能为酰胺III 带的C—N 伸缩振动峰。由图8b 可知,毕赤酵母干粉吸附还原HAuCl4后,3 381 cm-1和1 651 cm-1的 谱 带 分 别 蓝 移 至3 409 cm-1和1 655 cm-1,1 400 cm-1处的吸收明显减弱并红移至1 384 cm-1,1 076 cm-1的吸收峰迁移至1 074 cm-1,说明了酵母菌上的—COO-、多糖化合物的—OH 和蛋白质的酰胺成分可能参与了[AuCl4]-的生物吸附/还原过程(—N…Au,C—O…Au 和—COO…Au)。Lin 等[13]研究了啤酒酵母废菌丝对Au3+的吸附过程,FTIR 表征结果发现反应结束后在1 725 cm-1出现了一个新的吸收峰,该峰归属于羧基的—CO伸缩振动,他们认是细胞还原糖的醛基将Au3+还原成Au。图8b 曲线在1 700 ~1 800 cm-1并未有新的吸收峰出现,但是1 600 ~1 750 cm-1之间的峰明显宽化,因此也有可能是附近有一些吸收较弱的峰被掩盖了。
3 结论
以毕赤酵母干粉(4 g/L)吸附还原氯金酸制备金纳米颗粒,探讨了还原条件(时间、pH 值、温度、HAuCl4浓度)对毕赤酵母干粉吸附[AuCl4]-吸附量的影响,结果表明,毕赤酵母干粉(4 g/L)对HAuCl4(1.00 mmol/L)吸附的最佳pH 为4,40 min即可达到吸附平衡(吸附量为49.75 mg/g)。UVVis、SAED、HRTEM、EDX、XRD 表征结果证实该法制得了单质纳米颗粒为金纳米颗粒;FTIR 表征,发现毕赤酵母菌上的—COO-、多糖化合物的—OH和蛋白质的酰胺成分可能参与了[AuCl4]-的生物吸附还原过程。
[1] 周全法,刘维桥,尚通明.贵金属纳米材料[M].北京:化学工业出版社,2008.
[2] 黄开金.纳米材料的制备及应用[M].北京:冶金工业出版社,2009.
[3] Simakin A V,Voronov V V,Shafeev G A,et al.Nanodisks of Au and Ag produced by laser ablation in liquid environment[J].Chemical Physics Letters,2001,348(3/4):182-186.
[4] 刘伟,张现平,崔作林,等. 氢电弧等离子体法制备纳米金粒子[J].稀有金属,2004,28(6):1082-1084.
[5] Liu X Y,Cui C Y,Cheng Y W,et al.Shape control technology during electrochemical synthesis of gold nanoparticles[J].International Journal of Minerals,Metallurgy and Materials,2013,20(5):486-492.
[6] Huang C,Wang Y,Chiu P,et al.Electrochemical synthesis of gold nanocubes[J]. Material Letters,2006,60(15):1896-1900.
[7] Pal A. Photochemical synthesis of gold nanoparticles via controlled nucleation using a bioactive molecule[J]. Materials Letters,2004,58(3/4):529-534.
[8] Huang W,Chen S M,Liu Y S,et al.The controlled synthesis of stable gold nanoparticles in quaternary ammonium ionic liquids by simple heating[J].Nanotechnology,2011,22(2):025602.
[9] Chen F X,Xu G Q,Hor T S A.Preparation and assembly of colloidal gold nanoparticles in CTAB-stabilized reverse microemulsion[J]. Materials Letters,2003,57 (21):3282-3286.
[10] Epifani M,Giannini C,Tapfer L,et al. Sol-Gel synthesis and characterization of Ag and Au nanoparticles in SiO2,TiO2,and ZrO2thin films[J].Journal of the American Ceramic Society,2000,83(10):2385-2393.
[11]郑炳云,黄加乐,孙道华,等.贵金属纳米材料生物还原制备技术的研究进展[J]. 厦门大学学报:自然科学版,2011,50(2):378-386.
[12]刘月英,傅锦坤,胡洪波,等.金霉素链霉菌废菌丝体吸附金(Au3+)特性的表征[J].科学通报,2001,46(14):
1179-1182.
[13]Lin Z Y,Wu J M,Xue R,et al.Spectroscopic characterization of Au3+biosorption by waste biomass of Saccharomyces cerevisiae[J]. Spectrochimica Acta Part A,2005,61(4):761-765.

