丙酮酸差量法测定大蒜中大蒜辣素含量方法的建立*
朱君芳,许建,高杰
(新疆农业大学林学与园艺学院,新疆乌鲁木齐830052)
大蒜(Allium sativum L.)是百合科(Liliaceae)葱属(Allium)草本植物,是一种葱蒜类蔬菜,以鳞茎、嫩叶和花茎为食用器官,是一种重要的调味蔬菜[1]。原产于欧洲南部、西亚和中亚,西汉时期传入我国[2]。目前大蒜在我国已广泛栽培,主要产地有河南、山东、河北、甘肃、江苏及新疆等地[3-4]。
大蒜有消炎、杀菌、降低胆固醇、抗癌、以及增强免疫力等多种功效。大蒜的药用价值主要来源于大蒜辣素(allicin)。大蒜辣素极易挥发,是一种具有特殊气味的无色油状物质[5-9]。大蒜辣素以前体物质蒜氨酸存在于大蒜中,在完整的细胞中,蒜氨酸存在于细胞质中,而蒜氨酸酶存在于液泡中,细胞破碎后二者接触,继而蒜氨酸发生转化,生成大蒜辣素[10-11]。大蒜辣素药用价值大,可加工为保健品和药品等,应用前景较广阔。
目前,大蒜辣素含量的测定方法主要有气相色谱(GC)、气相色谱-质谱连用(GC-MS)、液相色谱(LC)、高效液相色谱(HPLC)、硝酸汞滴定法、定硫法和分光光度计法等。其中分光光度计法不需大蒜辣素标准样品,操作简单、快速、成本低,较为实用,因此该方法的应用最为广泛[12-16]。目前,虽然关于分光光度计法测定大蒜辣素的研究很多,但相关报道却不一致,如待测指标、药品试剂、提取方法和提取条件等有所不同。由于大蒜辣素稳定性差,因此测定较为困难[14-15]。本文采用丙酮酸差量法测定大蒜鳞茎中的大蒜辣素,不需大蒜辣素标准样品,操作简单、快捷、准确性高,较为实用。
1 试验原理及材料方法
1.1 试验原理
应用曹建康[17]等测定果蔬组织中丙酮酸含量的方法,大蒜鳞茎组织提取液中所含的丙酮酸与2,4-二硝基苯肼发生反应,生成丙酮酸-2,4-二硝基苯腙,此产物在碱性环境中呈樱桃红色,并且在520 nm处有显著光吸收。该反应所呈现的颜色深浅程度与溶液中的丙酮酸含量呈正相关。
本试验中,2分子蒜氨酸在蒜氨酸酶的作用下,分解产生1分子大蒜辣素,同时产生2分子丙酮酸,反应式如下:

由于未经受损的大蒜鳞茎组织中含有丙酮酸,故应将大蒜鳞茎经灭酶处理,去除本底的影响,再计算得出鳞茎组织中的大蒜辣素含量。计算方法如下:
经灭酶后测得灭酶组的吸光度值分别为A1、A2、A3,测定组的吸光度值分别为A1'、A2'、A3'。可由标准曲线查得丙酮酸的质量,从而计算出丙酮酸的含量。灭酶组丙酮酸含量(即本底)为m1、m2、m3,测定组丙酮酸含量为 m1'、m2'、m3'。计算大蒜辣素生成过程中产生丙酮酸的量为M=(m1'+m2'+m3')/3-(m1+m2+m3)/3;由此得:
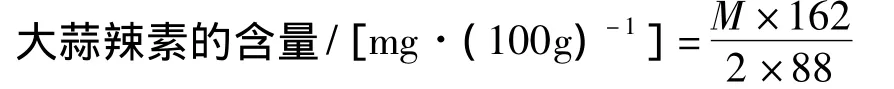
1.2 试验材料与试剂
市购新疆吉木萨尔县的白皮大蒜,置于(0±1)℃冷库中保存。
三氯乙酸、2,4-二硝基苯肼、氢氧化钠、丙酮酸、浓盐酸:分析纯,天津盛奥化学试剂有限公司。
1.3 试验仪器与设备
电子天平,AR2130/C 型,Pine Brook,NJ,USA;打浆机,飞利浦HR2860/60/A型,珠海飞利浦家庭电器有限公司;电热恒温水箱,-600型,上海一恒科学仪器有限公司;离心机,XYJ80-2型,江苏姜堰市医疗器械有限公司;可见光分光光度计,721型,上海菁华科技仪器有限公司。
1.4 试验方法
1.4.1 丙酮酸标准曲线的制作
取6支试管,分别编号,按表1加入各种试剂。

表1 绘制丙酮酸标准曲线时各试剂加入量Table 1 The amount of each reagent drawing pyruvic acid standard curve
在上述各试管中分别加入1.0 mL 1g/L的2,4-二硝基苯肼溶液,摇匀,再加入5.0 mL 1.5 mol/L的NaOH溶液,摇匀,进行显色反应10 min。然后以0号试管为空白参比,在波长520 nm处进行比色测定,并以吸光度值为纵坐标,丙酮酸的质量(μg)为横坐标,制作标准曲线,求得线性回归方程。
1.4.2 丙酮酸差量法测定大蒜辣素条件的优化
1.4.2.1 大蒜本底中丙酮酸含量的测定及灭酶时间的优化
取完整无损伤的大蒜鳞茎鲜样约20 g,去皮,在100 ℃水浴条件下分别加热0、10、20、30、40 min 进行灭酶。然后打浆,分别取样3份,各2 g,并用80 g/L的三氯乙酸溶液定容至25 mL,摇匀。4 000×g离心10 min后可收集上清液,即为提取液。
取0.5 mL提取液于试管中,加入80 g/L的三氯乙酸溶液2.5 mL、1 g/L的2,4-二硝基苯肼溶液1.0 mL,摇匀。再加入1.5 mol/L的NaOH溶液5.0 mL,摇匀,进行显色反应10 min后,按照与制作标准曲线相同的方法,以0号试管为空白参比,在波长520 nm处进行比色测定,并记录吸光度值。
1.4.2.2 大蒜辣素最佳酶促反应时间的优化
取鲜样约40 g,打浆,将样品置于30℃水浴锅内水浴加热,进行酶促反应。分别在反应0、10、20、30、40、50、60 min时各取样 3 份,每份2 g,用80 g/L 的三氯乙酸溶液定容至25 mL,摇匀。4 000×g离心10 min后,收集上清液即为提取液。
取0.1 mL提取液于试管中,分别加入80 g/L的三氯乙酸溶液2.9 mL、1 g/L的2,4-二硝基苯肼溶液1.0 mL,摇匀。再加入1.5 mol/L的NaOH溶液5.0 mL,摇匀,进行显色反应10 min,然后在波长520 nm处进行比色测定,并记录吸光度值。
1.4.2.3 大蒜辣素最佳酶促反应温度的优化
取鲜样约20 g,重复6次,打浆均匀后分别置于20、25、30、35、40、45 ℃ 水浴锅内进行酶促反应 10 min,各取样3份,每份2 g,用80 g/L的三氯乙酸溶液定容至25 mL,摇匀。4 000×g离心10 min后,收集上清液即为提取液。
取0.1 mL提取液于试管中,加入80 g/L的三氯乙酸溶液2.9 mL、1 g/L的2,4-二硝基苯肼溶液1.0 mL,摇匀。再加入1.5 mol/L的NaOH溶液5.0 mL,摇匀,进行显色反应10 min,在波长520 nm处进行比色测定,并记录其吸光度值。
1.4.3 丙酮酸差量法测定大蒜辣素方法的评价
1.4.3.1 稳定性试验
称取无损伤的大蒜鳞茎20 g并打浆,按照试验所确定的最佳反应条件制备样品提取液。取样品提取液,按照测定条件反应完全后,分别静置0、0.5、1、1.5、2、2.5、3 h后测定并记录吸光度值,分析吸光度值的变化情况,以评价该测定方法在一定时间段内的稳定性。
1.4.3.2 精密度试验
应用本试验所确定的最佳酶促反应条件制备样品提取液,并重复10次取该提取液,按照测定条件反应完全后,进行吸光度测定,计算出各自大蒜辣素的含量,然后计算相对标准偏差,以评价该测定方法的精密度。
1.4.3.3 重现性试验
按照最佳酶促反应条件制备大蒜鳞茎组织样品,取5份该样品,每份2 g,并制备样品提取液,分别取样品提取液并按照测定条件反应完全,然后测定吸光度,计算它们的相对标准偏差,以评价该测定方法的重现性。
2 结果与分析
2.1 标准曲线的建立
按照1.4.1的方法,以丙酮酸的质量为横坐标,以吸光度值为纵坐标,建立丙酮酸测定标准曲线。丙酮酸浓度在10~50 μg/mL内与吸光度呈良好的线性关系,y=0.013 5x-0.000 4(R2=0.999 9)
2.2 丙酮酸差量法最佳测定条件的确定
2.2.1 最佳灭酶时间的确定
分别对灭酶 0,10,20,30,40 min 后的提取液进行吸光度测定,计算得出丙酮酸含量依次为354.25、72.14、68.42、69.51、69.38 mg/100g(图 1)。灭酶0 min时丙酮酸含量最高,灭酶10 min后丙酮酸含量逐渐降低,灭酶时间为20,30,40 min时丙酮酸含量趋于稳定,因此,水浴加热30 min可彻底灭酶,故本试验灭酶时间选择30 min。

图1 丙酮酸含量随灭酶时间的变化Fig.1The effect of enzyme inactivation time on content of pyruvic acid
2.2.2 最佳酶促反应时间的确定
分别在 0,10,20,30,40,50,60 min 后取样并测定吸光度值,计算可得大蒜辣素含量分别为355.56,378.11,348.98,301.00,268.14,233.82,181.01 mg/100g(图2)。大蒜鳞茎打浆10 min内,大蒜辣素含量逐渐增大,10~60 min内,大蒜辣素含量逐渐下降,由此可知,丙酮酸差量法测定大蒜辣素含量的最佳酶促反应时间为10 min。
2.2.3 最佳酶促反应温度的确定
将样品分别置于20,25,30,35,40,45 ℃水浴锅内进行酶促反应,10 min后取样,经测定、计算可得大蒜辣素含量分别为322.43,324.43,354.92,322.95,271.62,204.81 mg/100g(图3)。温度在20~30℃内,大蒜辣素含量随温度的升高而增大,30~45℃内,大蒜辣素含量随温度的升高而减小,30℃时进行酶促反应使得大蒜辣素含量最高,由此可知,丙酮酸差量法测定大蒜辣素含量的最佳酶促反应温度为30℃。该方法与朱平华[18]等在正交试验优化大蒜素的提取试验中的研究结果一致。
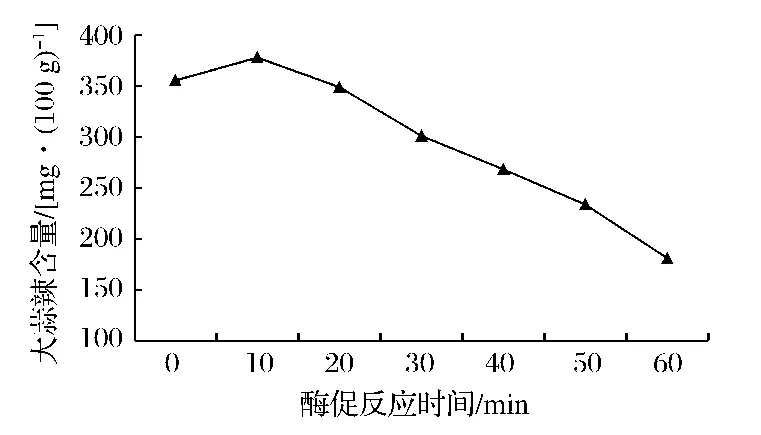
图2 大蒜辣素含量随酶促反应时间的变化Fig.2 Effect of enzymatic reaction time on content of allicin
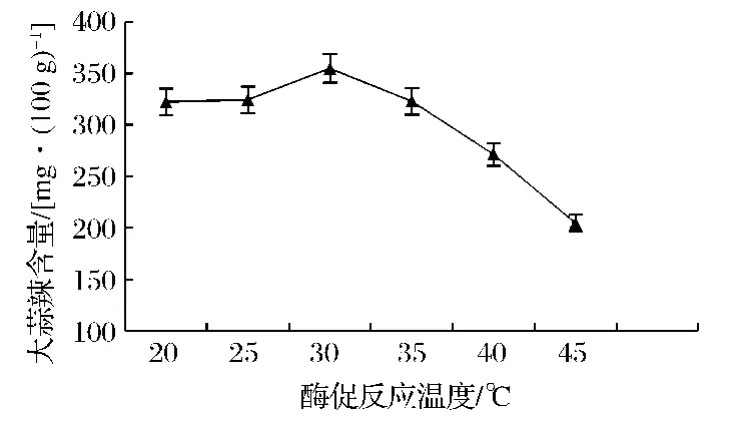
图3 大蒜辣素含量随酶促反应温度对的变化Fig.3 Effect of enzymatic reaction temperature on content of allicin
2.3 丙酮酸差量法测定大蒜辣素方法的评价
2.3.1 稳定性试验
同一样品的提取液经显色反应后在不同时间段测定其吸光度,如表2所示,计算得相对标准偏差为3.409%。吸光度值减少量约0.01/0.5 h,故样品反应液的吸光度需在0.5 h内测定,即可将误差控制在0.01内,3 h后吸光度值减少0.05。因此,该试验的样品提取液经显色反应后需尽快测定吸光度值,以减少误差。

表2 稳定性试验Table 2 Results of stability experiment
2.3.2 精密度试验
对同一大蒜鳞茎组织的提取液测定10次吸光度,计算得大蒜辣素含量分别为380.17,385.47,392.74,387.25,385.61,383.22,386.79,383.69,389.09,385.74 mg/100g,计算得出平均大蒜辣素含量为385.98 mg/100g,相对标准偏差为0.88%,由此可知,该测定方法的精密度较好。
2.3.3 重现性试验
测定5份经同样处理的样品提取液的吸光度值,分别为 0.457、0.446、0.458、0.452、0.453,其相对标准偏差为1.05%,由此可知此方法具有较好的重现性。
3 结论
该方法借鉴2,4-二硝基苯肼法测定丙酮酸含量的方法,通过测定灭酶后和经酶促反应后大蒜鳞茎中丙酮酸的含量,由丙酮酸的差量计算出大蒜鳞茎中大蒜辣素的含量。
试验优化测定条件为,100℃水浴加热灭酶30 min,酶促反应温度为30℃,酶促反应时间为10 min,在520 nm处测定吸光度值,丙酮酸含量浓度在10~50 μg/mL内与吸光度呈良好的线性关系(R2=0.999 9),精密度相对标准偏差为0.88%,重现性相对标准偏差为1.05%。由此可见,此方法耗材少,操作简单,精密度较高,重现性好,适宜测定大蒜鳞茎中大蒜辣素含量。
[1] 蔬菜栽培学各论.北方本[M].北京:农业出版社,2004:171-172.
[2] 韭菜葱蒜栽培技术[M].北京:金盾出版社,2013:164.
[3] 樊治成,高兆波,李建友.我国葱蒜类蔬菜种质资源和育种研究现状[J].中国蔬菜,2004(6):38-41.
[4] 徐培文.我国大蒜产业化与品种改良[J].长江蔬菜,2003(3):10-11.
[5] 李晓亮,崔金玮.天然大蒜的药用潜力探讨[J].中国农学通报,2008,24(5):136-139.
[6] Bakri I M,Douglas C W.Inhibitory effect of garlic extract on oral bacteria[J].Arch Oral Biol,2005,50(7):645.
[7] 邓中国,余晟,魏金凤.大蒜素的研制及其药用价值[J].泰山医学院学报,2004,25(3):325.
[8] J.A.Milner.A historical perspective on garlic and cancer[J].The Journal of Ntrition,2001,131(3):1 027-1 031.
[9] 周黎黎.大蒜素的提取工艺及其降血脂产品的开发[D].西华大学,2006.
[10] 方圆.大蒜素的生成与降解控制条件及抗氧化活性研究[D].江苏大学,2007.
[11] 林守峰.大蒜辣素生物合成、稳定性研究及相关物质分析[D].新疆医科大学,2010.
[12] 张丽霞,张国强.大蒜素含量的测定方法研究[J].湖北农业科学,2009,48(3):713-714.
[13] 熊伟.大蒜素的提取工艺研究[D].南昌:南昌大学,2006.
[14] 吴刘健.大蒜素测定及膜分离纯化工艺研究[D].南昌:南昌大学,2006.
[15] 马茜.硫酸钡吸光比浊法测定大蒜中大蒜素含量[J].光谱实验室,2007,34(3):10-12.
[16] 王婕.大蒜素提取工艺的研究[J].哈尔滨师范大学自然科学学报,2013,29(6):86-89.
[17] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:137-139.
[18] 朱平华,王勇.正交试验优化大蒜素的提取工艺[J].食品研究与开发,2011,32(3):10-12.

