大豆蛋白-结冷胶复合乳液凝胶的质构性质和油滴缓释能力*
崔竹梅,俞明杰,朱亚莉,朱桂兰,华欲飞,郑丽雪,黄友如,王立梅
1(常熟理工学院生物与食品学院,江苏常熟,215500)2(合肥师范学院生命科学系,安徽合肥,230601)
3(江南大学食品学院,江苏 无锡,214122)
蛋白乳液凝胶在食品中有着广泛的应用,如使用于布丁、热狗、奶酪以及其他不同的奶制品中。近年来,乳液凝胶的性能及其机理被深入研究。与单纯蛋白凝胶相比,乳液凝胶所需的连续相中的蛋白浓度相对较低,具有经济价值。同时油滴作为“活性填充颗粒”,极大地增强了凝胶的强度[1],且让乳液凝胶还具有了优于单纯蛋白凝胶的功能,如载体功能。与传统热凝胶相比,酶交联凝胶等低温凝胶可以在温和的条件下进行,过程可控性更强,这更加拓宽了乳液凝胶在食品、药品等领域中的应用。
蛋白质和多糖都是天然高分子聚合物,来源广泛,可再生、无毒、与人体亲合力强,是食品体系中最重要的两类生物大分子。一般来说,蛋白质具有乳化且稳定的能力,多糖则有良好的增稠和持水能力,如果将两者复合使用,则可使体系显示出更优越的性能。它们在乳液体系中既可以协同稳定油水界面[2-4],又可在连续相中形成高性能的复合凝胶[5-7]。结冷胶是近年来在食品领域中应用最广泛的凝胶剂,具有良好的稳定性、耐酸性等特点。目前国内外对大豆蛋白乳液凝胶的研究只要集中在油相、pH、离子强度等对凝胶形成的影响,以及凝胶机械性质的研究方面[8-11]。而对大豆蛋白/结冷胶复合乳液凝胶的研究则非常有限。
本研究通过构建大豆蛋白-结冷胶复合乳液凝胶,研究了其凝胶性质与油滴体外释放能力之间的关系。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(SPI),实验室自制;高酰基结冷胶,C.P.Kel Co公司;微生物转谷氨酰胺酶(MTG酶),江苏一鸣生物技术有限公司;其他试剂,中国国药集团。
1.2 仪器与设备
物性测试仪XT21,美国TA仪器公司;CR21GⅡ冷冻高速离心机,日本 Hitachi公司;高速剪切分散器,德国Fluko公司;APV1000高压均质机,英国APV公司;Mastersizer 2000激光力度分布仪,英国Marlven公司;EX30的显微镜,宁波舜宇仪器有限公司。
1.3 实验方法
1.3.1 乳液制备
采用碱溶酸沉法制备大豆分离蛋白,经微量凯氏定氮法测定蛋白含量为91.2%。将1% 蛋白分散在0.01 mol/L的磷酸盐缓冲液内,4℃浸泡12 h,充分溶解,乳液制备。乳液体系中包含20% 的玉米油和80% 的蛋白质溶液(1.0%SPI,pH 7.0)。混合体系先预乳化(10 000 r/min,2 min),再高压均质2次(40 MPa),4℃保存备用。
1.3.2 乳液粒度的测定
采用Mastersizer 2000粒度分布仪测定乳状液滴的粒径。参数设置为:颗粒折射率:1.520;颗粒吸收率:0.001;分散剂:水;分散剂折射率:1.330。实验采用d32,即表面积平均直径表征液滴粒度的大小。
1.3.3 乳液粒径观察
取20 μL乳液于载玻片上,盖上盖玻片,确保载玻片与盖玻片之间没有空隙。用配有100×物镜的EX30相差显微镜观察油滴粒径大小和分布,并拍摄样品照片。
1.3.4 乳液凝胶的制备
蛋白-多糖的混合乳液凝胶的制备参考 Tang等[10]和 Guo 等[12]的方法,并做改动。将 7.5% 蛋白分散在0.01 mol/L的磷酸盐缓冲液内,4℃浸泡12 h。取1%的结冷胶多糖分散于0.01 mol/L的磷酸缓冲液里(pH 7.0),搅拌4 h,然后70℃加热30 min。将蛋白溶液和结冷胶溶液混合均匀后备用,80℃加热20 min,然后50℃保温。混合体系的蛋白终浓度为60 g/L,结冷胶浓度0~3 g/L。
在50℃下,将预热的乳液与蛋白-结冷胶混合体系以体积比1∶1混合,加入0.2 mol/L的NaCl和MTG酶(酶浓度为50 U/g蛋白),混合均匀,快速装入玻璃容器或塑料离心管中,真空脱气,封口后立即冷却至20℃保持10 min,让结冷胶多糖凝胶化。然后37℃下反应20 h,然后冷却至室温,让大豆蛋白凝胶化。
除检测凝胶的持水性外,所有乳液样品4℃放置24 h后,用于检测各种指标。乳液凝胶中蛋白终浓度为35 g/L,油相10%,结冷胶浓度0~1.5 g/L。每种样品至少4个以上平行。
1.3.5 凝胶质构的测定
采用物性测试仪对制备的乳凝胶进行质地分析。穿刺模式检测乳液凝胶的破断应力和破断应变,P/5探头(探头直径5 mm),测定条件:测前速度为1 mm/s,测试速度1 mm/s,测后速度1 mm/s,触发力1.0 g穿刺距离为样品总高度的50%,时间20 s。
TPA模式检测凝胶硬度等指标,P/0.25S探头测定条件:测前速度为1 mm/s,测试速度1 mm/s,测后速度1 mm/s,触发力1.0 g,压缩距离为50%,时间20 s。取得4个指标为:硬度、脆度、弹性、内聚性。
1.3.6 凝胶样品持水性检测
凝胶样品转移到50 mL离心管中,5 000 r/min离心30 min(4℃)。离心管倒置倾倒液体,并用干燥滤纸小心吸除离心管内壁和凝胶样品上的剩余液体。称量装有凝胶样品的离心管在离心前后的质量。

其中:mT是凝胶样品总水分含量。
1.3.7 凝胶析水性检测
制备好的凝胶样品,冰箱4℃放置36 h,分别称取凝胶和析出水的质量。

1.3.8 乳液凝胶的体外油释放试验
乳液凝胶的模拟消化实验参考美国药典(USP,2004),以及 Liang 等[13]和 Marambe 等[14]的方法进行,并略做改动。
采用生理盐水、模拟胃液和模拟肠液等3种环境来考察乳液凝胶油滴的释放情况。释放时间为7 h,模拟胃液和肠液中分别含有胃蛋白酶和胰酶。为保证所有样品与液体的接触面积一致,在体外释放试验前,先用注射器将凝胶样品挤压出,成为大小均匀的颗粒凝胶。
模拟生理空白环境:每4 g凝胶,装入10 mL一次性注射器内(不装针头),挤压成小颗粒,模拟口腔咀嚼成的小块状。颗粒状样品分散在100 mL空白环境内(pH 7.0,含0.2%NaCl和3 g/L的吐温-80装于250 mL锥形瓶中,37℃水浴摇床振荡(100 r/min)30 min。
模拟胃消化:调节混合体系pH值至1.2,添加3.2 g/L胃蛋白酶,37℃水浴振荡30 min(167 r/min)。用NaOH把溶液的pH值调至7.4,使胃蛋白酶失活,以终止胃液消化阶段。
模拟肠道消化。胃液消化阶段的终产物(pH 7.4)添加含2 g/L脱氧胆酸盐和3 g/L吐温-80,37℃水浴摇床振荡5 min,然后加入1.0%胰酶,37℃水浴摇床(167 r/min)振荡6 h。
空白环境和胃液环境阶段结束时,各取5 mL样品体系溶液,待测溶液里从凝胶中释放出来的油脂。模拟肠道消化阶段,每隔1 h抽取5 mL体系溶液,待测油脂含量。每次抽取样品后的体积差,用该反应阶段的体系溶液补平。酶空白实验中,没有蛋白底物,其他条件一样。样品空白实验中,有样品,没有酶,其他条件一样。消化过程中释放油脂的检测,参照Sala等[15]方法。
1.3.9 数据分析与处理
所有的实验都需做3次平行,采用SPSS 13.0统计软件进行数据分析处理和方差分析,处理间P<0.05的为差异显著。
2 结果与讨论
2.1 大豆蛋白乳液油滴粒径的检测
油滴粒径分布是评价乳液基本性质的重要参数。大豆蛋白的良好乳化性能已经被广泛证明[16-18],实验中制备的乳液样品油滴细腻,平均粒径0.722 μm,粒径分布图狭窄而均匀分布。显微镜图像更直观的展示了乳液油滴的分布,图1中透明小球为乳液油滴,显微镜的图像与粒径检测的结果一致。
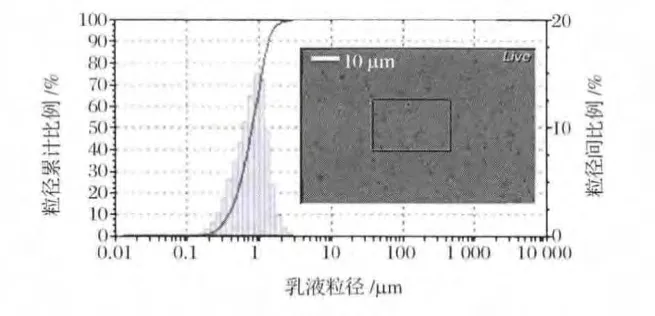
图1 大豆蛋白乳液油滴粒径(内插图为乳液油滴显微镜照片)Fig.1 Size of soy protein emulsion oil droplet
2.2 蛋白-结冷胶乳液凝胶的外观形态
在NaCl和MTG酶诱导下,含有不同浓度结冷胶的乳液凝胶有着相似的宏观外观,乳白色不透明,质地均匀而柔软,未出现明显的相分离(图2)。
油滴作为“填充颗粒”,使形成凝胶所需的最低蛋白浓度大为降低,在空白样品中(不含结冷胶),3.5%的蛋白终浓度已经能形成的质地良好的凝胶。而添加了0.15%结冷胶的乳液凝胶,不仅具有光泽度,且手感弹性和韧度更好。

图2 不同浓度结冷胶的大豆蛋白乳液凝胶Fig.2 Soy protein emulsion gel with different concentration of gellan gum
2.3 乳液凝胶的质构性质
阳离子可诱导结冷胶形成凝胶,直接添加Ca2+会促使蛋白和结冷胶同时胶凝,不利于有序结构的形成[19]。KCl在浓度达到一定时,有明显咸味和苦涩味。故本实验中选用NaCl来诱导结冷胶的凝胶化。随结冷胶浓度的提高,乳液凝胶的断裂应力和断裂应变都有了明显的提高。断裂应力反映凝胶的坚度(硬度),对应的应变则反映凝胶的内聚性[20]和可变形性。断裂应力和断裂应变随聚合物浓度增高而增加(图3),因为形成了更密集的网络结构[21]。
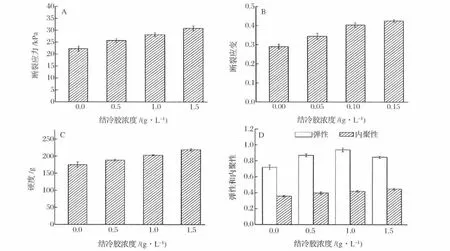
图3 结冷胶浓度对乳液凝胶质构性能的影响Fig.3 Effect ofgellan gum concentration on texture properties of emulsion gel
在pH 7.0的中性环境下,大豆蛋白和结冷胶多糖都是阴离子生物高聚物,两者间既有静电排斥作用,也有热力学不相容性,所以它们在混合体系里各自形成亲水网络结构,而不是聚合物间的重排。用金属阳离子和转谷氨酰胺酶同时做胶凝剂,可形成结冷胶和大豆蛋白的双网络体系。虽然不能排除部分小分子蛋白可以和结冷胶的羧基等基团通过形成氢键等非共价键而发生关联的可能,但这不影响双网络结构的最终形成。Guo[12]等通过扫描电镜等手段证实了这种双网络体系的存在。双网络凝胶结构相对于单一的蛋白凝胶,显著提高了乳液凝胶体系的抗压韧性。
蛋白-多糖凝胶结构的形成是凝胶化 (聚合)和相分离之间相互竞争的结果[22],受凝胶速率和电荷的共同影响。本实验中,蛋白和多糖的质量比例超过23∶1,且两者采用不同的交联机制,因此没有观察到宏观的相分离。TPA实验显示,结冷胶的加入,增大了乳液凝胶的硬度,但在结冷胶1.0 g/L时弹性最好,而后随着结冷胶浓度的增加,弹性反而略下降。蛋白-结冷胶混合乳液凝胶体系中,结冷胶是决定凝胶硬度的关键性因素,即主要来自于结冷胶的网络结构。弹性也是表征凝胶性质的一个重要的参数,随着结冷胶浓度的增加,多糖网络增强,凝胶弹性增加。但浓度超过1.5 g/L后,由于排斥体积效应[23],弹性不再有显著的上升。
2.4 持水力和析水性测定
如图4所示,结冷胶的添加显著提高了乳液凝胶的持水性,结冷胶0.5 g/L时,持水力提高近10%;而结冷胶达到1.5 g/L时,乳液凝胶的持水力可高达82.8%,远高于空白蛋白样品。析水率正好与持水性负相关,随结冷胶的浓度上升而下降。48 h后,含有较高浓度的结冷胶的乳液凝胶没有明显自发的脱水收缩现象,依然呈白色饱满且富有弹性的外观。结冷胶赋予乳液凝胶优良的持水性、保水性,与其高度亲水的分子结构有关。
2.5 乳液凝胶的体外油滴释放试验
乳液凝胶除了赋予凝胶食品新的物性性质外,还可以作为许多脂溶性生理活性物质的载体,Liang[13]等研究发现,β-乳球蛋白乳液凝胶对α-生育酚有良好的包埋和缓释能力。本实验考察大豆蛋白/结冷胶乳液凝胶对油滴在模拟消化道环境中的释放过程(图5)。
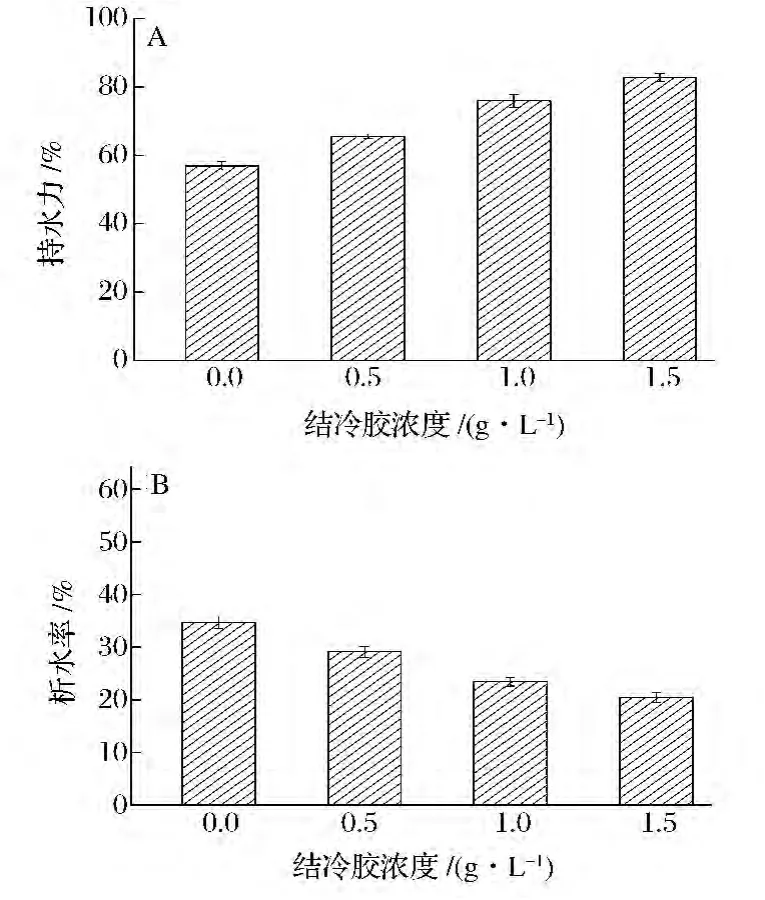
图4 结冷胶浓度对乳液凝胶持水力和析水率的影响Fig.4 Effect of gellan gum concentration on water holding capacity and water separating proportion of emulsion gel

图5 大豆蛋白-结冷胶乳液凝胶在模拟胃肠液中油滴连续释放过程Fig.5 Oil droplet release profiles obtained in simulated gastrointestinal environments
实验显示,蛋白-结冷胶乳液凝胶在生理盐水和pH 7.4的磷酸缓冲液中连续放置6.5 h,几乎无油滴的释放,凝胶块也无明显溶解和崩塌现象。模拟胃肠道的条件下,在模拟胃液环境下释放0.5 h,然后再在模拟肠液环境中释放6.5 h。结果发现,空白蛋白乳液凝胶在胃环境中释放高达40.3%,再经6.5 h的肠液环境后,油滴几乎完全释放,凝胶块崩塌,体系呈乳液状态。而结冷胶的加入,明显降低了其在胃环境中的油滴释放率。当结冷胶添加浓度为1.0 g/L时,油滴在胃环境中的释放率几乎降至空白样品的一半;当结冷胶浓度为1.5 g/L时,油滴的在胃环境中的释放率仅为12.5%,说明随着结冷胶添加量的增加,凝胶对油滴的缓释能力越高,更能够保护油滴到达肠道。继续让乳液凝胶在模拟肠液条件下进行释放,由于胰蛋白酶的作用以及 pH值的变化,油滴继续稳定释放,但结冷胶含量越大的凝胶其缓释能力更强,经过6.5 h在模拟肠液中释放后,空白蛋白乳液凝胶的油滴被完全释放于体系当中;而结冷胶浓度为1.5 g/L时,凝胶经过6.5 h时释放率为39.6%。
凝胶中油滴的释放主要依靠胃蛋白酶、胰酶对于蛋白质凝胶网络的分解而达到释放的效果。乳液凝胶对油滴的缓释效应,主要是由于大豆蛋白与结冷胶结冷胶形成了双网络体系,使得油滴被更加紧密地包裹在凝胶网络中,扩散受阻;同时结冷胶网络阻碍了胃蛋白酶进入蛋白质网络结构,胃蛋白酶对凝胶的侵蚀速率缓慢;形成的紧致网络结构是不可逆的[24],阻碍了下一步中胰蛋白的进入和侵蚀,使得油滴在整个模拟消化的过程中释放速率变缓。可以利用这一缓释性能,将大豆蛋白-结冷胶乳液凝胶应用于功能脂溶性物质的载体。
3 结论
(1)质构实验表明,结冷胶可提高大豆蛋白乳液凝胶的断裂应力和断裂应变,同时是复合乳液凝胶硬度的决定性因素;但在浓度1.0 g/L时,乳液凝胶的弹性较好。
(2)结冷胶的添加提高了乳液凝胶的持水力,并明显抑制了凝胶的缩水收缩现象。
(3)结冷胶的添加,使乳液凝胶对油滴的缓释能力提高。
总之,在大豆蛋白-结冷胶复合乳液凝胶体系中,大豆蛋白和结冷胶形成亲水双网络结构,显著提高乳液凝胶体系的质构和保水性能。双网络结构可改善蛋白乳液凝胶本身性能的不足,从而拓宽蛋白乳液凝胶的应用,为今后应用乳液凝胶作为脂溶性功能物质的食品级载体提供参考。
[1] Dickinson E.Emulsion gels:the structuring of soft solids with protein-stabilized oil droplets[J].Food Hydrocolloids,2012,28(1):224-241.
[2] GU Y S,Decker E A,McClements D J.Influence of ι-carrageenan on droplet flocculation of β-loactoglobulin-stabilized oil-in-water emulsions during thermal processing[J].Langmuir,2004,20(22):9 565-9 570.
[3] LI Y,McClements D J.Controlling lipid digestion by encapsulation of protein-stabilized lipid droplets within alginate chitosan complex coacervates[J].Food Hydrocolloids,2011,25(5):1 025-1 033.
[4] XU D,YUAN F,GAO Y,et al.Influence of whey proteinbeet pectin conjugate on the properties and digestibility of β-carotene emulsion during in vitro digestion[J].Food Chemistry,2014,156:374-379.
[5] Çakır E,Daubert C R,Drake M A,et al.The effect of microstructure on the sensory perception and textural characteristics of whey protein/k-carrageenan mixed gels[J].Food Hydrocolloids,2012,26(1):33-4.
[6] 闵维,杨晓泉.不同分子量葡聚糖对大豆分离蛋白冷致混合凝胶的流变性质和质构性质的影响[J].食品工业科技,2010,31(5):72-75.
[7] ZHANG J,WU N,YANG X,et al.Improvement of microbial transglutaminase-induced gelation of β-conglycinin by conjugation with dextran[J].International Journal of Food Science & Technology,2014,49(4):976-982.
[8] LI F,KONG X,ZHANG C,et al.Effect of heat treatment on the properties of soy protein-stabilized emulsions[J].International Journal of Food Science& Technology,2011,46(8):1 554-1 560.
[9] LI F,HUA Y.Rheological properties of acid-induced soy protein-stabilized emulsion gels in the absence and presence of N-ethylmaleimide[J].Food hydrocolloids,2013,30(2):641-646.
[10] TANG C H,CHEN L,Foegeding E A.Mechanical and water-holding properties and microstructures of soy protein isolate emulsion gels induced by CaCl2,glucono-δ-lactone(GDL),and transglutaminase:Influence of thermal treatments before and/or after emulsification[J].Journal of Agricultural and Food Chemistry,2011,59(8):4 071-4 077.
[11] Abhyankar A R,Mulvihill D M,Autya M A E.Combined microscopic and dynamic rheological methods for studying the structural breakdown properties of whey protein gels and emulsion filled gels[J].Food Hydrocolloids,2011,25(3):275-282.
[12] GUO J,LIU Y,YANG X,et al.Fabrication of edible gellan gum/soy protein ionic-covalent entanglement gels with diverse mechanical and oral processing properties[J].Food Research International,2014,62:917-925.
[13] Liang L,Line V L S,Remondetto G E,et al.In vitro release of α-tocopherol from emulsion-loaded β-lactoglobulin gels[J].International Dairy Journal,2010,20:176-181.
[14] Marambe H K,Shand P J,Wanasundara J P D.Release of angiotensin I-converting enzyme inhibitory peptides from flaxseed(Linum usitatissimum L.)protein under simulated gastrointestinal digestion[J].Journal of Agricultural and Food Chemistry,2011,59(17):9 596-9 604.
[15] Sala G,Velde F,Stuart M,et al.Oil droplet release from emulsion-filled gels in relation to sensory perception[J].Food Hydrocolloids,2007,21(5/6):977-985.
[16] HU M,McClements D J,Decke E A.Lipid oxidation in corn oil-in-water emulsions stabilized by casein,whey protein isolate,and soy protein isolate[J].Journal of Agricultural and Food Chemistry,2003,51(6):1 696-1 700.
[17] Guzey D,McClements D J.Formation,stability and properties of multilayer emulsions for application in the food industry[J].Advances in Colloid and Interface Science,2006(128-130):227-248.
[18] Berton C,Ropers M,Bertrand D,et al.Oxidative stability of oil-in-water emulsions stabilized with protein or surfactant emulsifiers in various oxidation conditions[J].Food Chemistry,2012,131(4):1 360-1 369.
[19] Vilela J A P,Cavallieri  L F,Cunha R L.The influence of gelation rate on the physical properties/structure of saltinduced gels of soy protein isolate-gellan gum[J].Food Hydrocolloids,2011,25(7):1 710-1 718.
[20] Foegeding E A,Bowland E L,Hardin C C.Factors that determine thefracture propertiesand microstructure of globular protein gels[J].Food Hydrocolloids,1995,9(4):237-249.
[21] Yamamoto F,Cunha R L.Acid gelation of gellan:Effect of final pH and heat treatment condition[J].Carbohydrate Polymers,2007,68(3):517-527.
[22] Jong S,Klok H J,Velde F.The mechanism behind microstructure formation in mixed whey protein-polysaccharide cold-set gels[J].Food Hydrocolloids,2009,23(3):755-764.
[23] Zasypkin D V,Braudo E E,Tolstoguzov V B.Multicomponent biopolymer gels[J].Food Hydrocolloids,1997,11(2):159-170.
[24] 张烨.大豆蛋白透明水凝胶的制备及控释性质研究[D].广州:华南理工大学,2012:67-68.

