甲状腺素T3对四氧嘧啶诱导糖尿病小鼠胰腺的保护作用
成向荣,丁寅翼,武 旭,夏淑芳,施用晖,乐国伟
(江南大学食品学院,江苏 无锡 214122)
甲状腺素T3对四氧嘧啶诱导糖尿病小鼠胰腺的保护作用
成向荣,丁寅翼,武 旭,夏淑芳,施用晖,乐国伟
(江南大学食品学院,江苏 无锡 214122)
目的:研究甲状腺素T3对四氧嘧啶(alloxan,ALX)诱导糖尿病小鼠胰腺损伤的预防和保护作用。方法:24 只雄性昆明小鼠随机分成4 组,分别给予一次性腹腔注射生理盐水、ALX、ALX和甲状腺素T3、甲状腺素T3,在注射后1、4、6、12、24 h各时间点测定小鼠血液活性氧(reactive oxygen species,ROS)水平,并在注射后28 d内定期测定小鼠血糖水平变化。28 d后,处死小鼠,取出胰腺进行形态学和生物化学指标分析:检测甲状腺素T3对小鼠胰腺超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力以及还原型谷胱甘肽(glutathione,GSH)和氧化型谷胱甘肽(oxidized glutathione,GSSG)含量的影响,分析甲状腺素T3对胰腺细胞抗氧化酶相关基因Nrf2、SOD、GSH-Px、CAT,细胞凋亡相关基因Caspase-3、Caspase-9、Bax、Bcl-2表达的影响。结果:经ALX诱导的小鼠血糖和血液ROS水平极显著升高(P<0.01),血液胰岛素水平极显著下降(P<0.01),血液和胰腺抗氧化酶的活力均极显著下降(P<0.01)。此外,抗氧化酶相关基因以及细胞凋亡相关基因表达水平均出现了极显著变化(P<0.01)。注射甲状腺素T3能够改善由ALX引起的小鼠血糖水平上升和胰岛素分泌不足,显著或极显著地缓解抗氧化酶活力下降及抗氧化相关基因表达下调(P<0.05或P<0.01),极显著抑制Caspase-3、Caspase-9、Bax等促凋亡基因表达的升高(P<0.01),促进抗凋亡基因Bcl-2的表达。结论:甲状腺素T3能够改善ALX诱导的糖尿病小鼠机体氧化还原状态,调节胰腺细胞凋亡相关基因的表达水平,保护胰腺组织,避免胰腺出现β细胞凋亡的情况,从而维持和保护胰腺调节血糖水平的功能。
甲状腺素T3;四氧嘧啶;糖尿病;胰腺
糖尿病已经成为一种严重威胁人类健康的代谢性疾病,开发新型降血糖功能因子及功能食品是当前研究热点之一。多种生理、病理因子参与了糖尿病的发生、发展与转归,而糖尿病和机体氧化应激之间的关系尤为密切。糖尿病患者的许多组织、器官都会受到活性氧(reactive oxygen species,ROS)的攻击,并丧失部分的相关功能[1-2]。ROS可能直接或间接地来源于糖代谢紊乱,进而引起细胞结构的损伤及功能的破坏,例如引发胰腺β细胞凋亡,导致胰腺分泌胰岛素功能的丧失[3]。多种抗氧化功能因子,如白藜芦醇、α-硫辛酸、槲皮素等能有效缓解氧化应激对胰岛β细胞的损伤作用[4-6]。
甲状腺素T3调控哺乳动物的生长、发育,并参与绝大多数组织器官的代谢过程。目前,已有研究报道了甲状腺素T3对链脲佐菌素诱导的糖尿病模型小鼠胰腺β细胞的抗凋亡作用[7]。本课题组前期在过氧化氢诱导的HepG2细胞模型中发现甲状腺素T3对氧化损伤的HepG2细胞具有明显的保护作用,其抗氧化保护功能与提高抗氧化酶的活性及细胞内抗氧化相关基因的表达水平有关。甲状腺素T3能够诱导细胞产生低水平的ROS,从而激活某些转录因子,包括核转录因子kappa B(nuclear factor-kappa B,NF-κB)、信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)、激活蛋白-1(activated protein-1,AP-1)等,从而进一步激活下游的细胞因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1(interleukin-1,IL-1)、IL-6等,最终促进抗氧化酶和抗凋亡基因的表达[8]。
胰腺是代谢系统中十分重要的腺体,其主要作用是分泌多种酶类和激素,参与代谢过程,其中包括促进糖代谢以供能。最近的研究表明,胰腺β细胞的凋亡以及氧化还原失衡可能是导致胰腺无法正常分泌足够胰岛素的两个关键因素,从而导致了糖尿病的发生[1-2]。本研究旨在探究甲状腺素T3是否能够通过改善糖尿病小鼠机体及胰腺组织的氧化还原状态,以及保护胰腺β细胞避免凋亡这两个方面来改善糖尿病的病征,进而为开发预防和改善糖尿病的食品功能因子提供新思路。
1 材料与方法
1.1 材料与试剂
四氧嘧啶(alloxan,ALX)、甲状腺素T3 北京百灵威科技有限公司;5,5-二甲基-1-吡咯啉-N-氧化物(5,5-dimethyl-1-pyrroline-N-oxide,DMPO)(纯度97%) 美国Sigma-Aldrich有限公司;血糖试纸 美国强生公司;苏木精-伊红(hematoxylin-eosin,HE)染液试剂盒、过氧化氢酶(catalase,CAT)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒、还原型谷胱甘肽(glutathione,GSH)测试盒、氧化型谷胱甘肽(oxidized glutathione,GSSG)测试盒南京建成生物工程研究所;Trizol试剂盒、SYBR反转录实时荧光定量聚合酶链式反应(reverse quantity real-time transcript polymerase chain reaction,qRT-PCR)试剂盒美国Applied Biosystems公司;小鼠胰岛素酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒厦门慧嘉生物技术有限公司;小鼠胰高血糖素ELISA试剂盒 上海美旋生物科技有限公司。
1.2 仪器与设备
血糖仪 美国强生公司;EMXplus-10/12电子自旋共振谱仪(electron spin resonance,ESR) 德国Bruker公司;7900HT实时荧光定量PCR仪 美国Applied Biosystems公司;ASP200S自动组织脱水机、EG1150H石蜡包埋机、RM2245石蜡切片机 德国Leica公司。
1.3 动物
清洁级6 周龄健康雄性昆明小鼠24 只,体质量(25±2) g,购于上海斯莱克实验动物有限公司,饲养于江南大学动物实验中心,饲养环境中无致病菌,光-暗周期为12 h,室温控制(23±1) ℃,相对湿度55%~65%,小鼠食物为江苏省协同生物工程有限责任公司提供的小鼠标准颗粒饲料,自由饮用纯净水,实验期为28 d。
1.4 方法
1.4.1 动物分组与处理
24 只雄性小鼠适应性饲喂1 周后,随机分为4 组,每组6 只,分别为正常对照组(CON组)、ALX注射组(ALX组)、ALX和甲状腺素T3注射组(ALX+T3组)、甲状腺素T3注射组(T3组),分别予以一次性腹腔注射生理盐水、125 mg/kg ALX(以小鼠体质量计,下同)、125 mg/kg ALX和3 mg/kg甲状腺素T3、3 mg/kg甲状腺素T3。腹腔注射后24 h内,在0、1、4、6、12、24 h各时间点对小鼠尾部采血,测定血液ROS水平。注射28 d内,每3 d通过尾部采血测定小鼠血糖水平。在28 d实验期末,禁食10 h后,用乙醚麻醉小鼠,眼球取血,断颈处死小鼠。全血用于生化指标测定,胰腺用于形态学研究、基因表达水平以及抗氧化指标的测定。
1.4.2 小鼠全血ROS水平测定
DMPO原液用超纯水稀释10 倍。取小鼠全血25 μL,加入20 μL已稀释的DMPO用以测定血液ROS水平。ESR设定参数:中心磁场强度:3 480 G;磁场扫描宽度:100 G;扫描时间:25 s;接收增益:50 dB;模式放大:3 G;衰减:10 dB;微波功率:20 mW。以ESR信号中央峰的峰高表示ROS的水平。
1.4.3 小鼠血清和胰腺抗氧化酶活力的测定
小鼠眼球采血,血液置于肝素钠抗凝管中,4 000 r/min、4 ℃离心10 min,取上清液得到血清。取一定量的胰腺,用生理盐水制成质量分数10%的匀浆液,3 000 r/min离心10 min,取上清液。按照试剂盒说明书方法测定小鼠血清T-AOC活力,胰腺GSH、GSSG含量及SOD、CAT、GSH-Px活力。
1.4.4 小鼠胰腺总RNA提取、逆转录及实时荧光定量PCR

表1 qRT-PCR基因的引物序列Table 1 Primer sequences for qRT-PCR
根据Trizol试剂盒说明书方法提取胰腺总RNA。通过测定A260nm/A280nm值(应在1.8~2.0之间)检测RNA纯度及浓度。根据浓度取2 μg RNA,加入随机引物和脱氧核糖核苷三磷酸各2 μL,用DEPC水补足体系至10 μL,70 ℃水浴5 min后,迅速冰浴冷却;随后加入5×RT Buffer 5 μL、40 U/μL RNA酶抑制剂0.25 μL、200 U/μL M-MLV逆转录酶0.5 μL、DEPC水9.25 μL。37 ℃水浴1.5 h,95 ℃水浴3 min,得到的cDNA于-20 ℃条件下保存。
应用实时荧光定量PCR技术检测组织中相关基因mRNA的相对表达量。PCR板每孔加入组织cDNA样品0.5 μL、上游引物和下游引物各0.4 μL、SYBR酶5 μL、灭菌双蒸水3.7 μL,体系总体积为10 μL。所用组织内参基因均为β-actin。基因引物由生工生物工程(上海)股份有限公司设计合成。引物序列见表1。qRT-PCR产物的特异性由熔解曲线评估。扩增条件:阶段1:95 ℃,5 min;阶段2:95 ℃,20 s;60 ℃,30 s;72 ℃,20 s,45 个循环;阶段3:72 ℃,2 min。
1.4.5 小鼠胰腺形态学分析
小鼠胰腺用10 g/100 mL的多聚甲醛磷酸缓冲液固定,在组织自动脱水机中脱水,用石蜡包埋机进行石蜡包埋,在石蜡切片机上制成厚度为5 μm的连续切片。根据试剂盒说明书方法进行HE染色,光学显微镜下观察组织形态并拍照。
1.5 数据统计分析
2 结果与分析
2.1 小鼠空腹血糖及胰岛素、胰高血糖素水平
注射ALX后,小鼠的血糖水平出现了显著上升。在为期28 d的实验期内,CON组小鼠的血糖水平稳定在4.49~4.69 mmol/L之间,而ALX组小鼠的血糖水平始终极显著高于CON组(P<0.01);同时注射甲状腺素T3后,能够极显著缓解由ALX引起的血糖水平上升现象(P<0.01);单独注射甲状腺素T3后3 d时,小鼠血糖水平极显著低于CON组(P<0.01),6 d后,小鼠血糖水平恢复至正常水平(图1A)。28 d实验周期结束后测定小鼠血液胰岛素水平,显示经ALX给药小鼠的胰岛素水平由正常的(5.24±0.94) mU/L极显著降低至(2.83±0.76) mU/L(P<0.01),而ALT+T3组小鼠血液胰岛素水平显著高于ALX组,并恢复至CON组水平,T3组小鼠血液胰岛素水平略高于CON组,但无显著差异(P>0.05)(图1B)。注射给予ALX后,小鼠胰高血糖素水平从CON组的(390±24) pg/mL极显著下降至(225±35) pg/mL(P<0.01),而T3组小鼠胰高血糖素水平则升高至(450±30) pg/mL,同时给予ALX和T3,小鼠胰高血糖素则恢复至CON组水平(图1C)。

图1 各组小鼠血糖(A)及血清胰岛素(B)、胰高血糖素(C)水平比较Fig.1 Comparison of blood glucose (A), plasma insulin (B) and glucagon (C) levels in mice from 4 groups
2.2 小鼠血液及胰腺氧化应激水平

图2 注射给药后24 h内小鼠血液ROS水平变化Fig.2 Time dependence of ALX and T3 on blood ROS level at 24 h after injection
注射给药后,从小鼠尾部取血测定血液ROS水平,用ESR信号中间峰的峰高表示。如图2所示,接受注射后,各组小鼠血液ROS水平均出现了上升,但是接受ALX注射的小鼠血液ROS水平上升程度显著高于CON组,并在注射后4 h时出现最高值(P<0.01),同时注射甲状腺素T3能显著降低ALX组小鼠在1、4、6 h时的血液ROS水平(P<0.01或P<0.05)。单独注射甲状腺素T3后,也出现了ROS水平上升的现象,并且在4 h时出现最高值(P<0.01)。28 d实验周期结束后,测定小鼠血清T-AOC活力,结果发现ALX处理能够极显著降低小鼠血液T-AOC活力(P<0.01),而同时注射甲状腺素T3能够缓解ALX对于血清T-AOC活力的影响(图3)。

图3 实验第28天各组小鼠血液T-AOC活力比较Fig.3 Comparison of blood T-AOC in mice from 4 groups mice on day 28

图4 各组小鼠胰腺氧化应激水平比较Fig.4 Oxidative stress status of pancreas from mice in 4 groups
对胰腺抗氧化酶活力的测定结果如图4所示,ALX组小鼠的SOD、CAT、GSH-Px活力极显著低于CON组(P<0.01),T3组小鼠的抗氧化酶活力与CON组小鼠相比无显著差异。注射甲状腺素T3能够缓解ALX对于小鼠抗氧化酶活力的下调作用,恢复SOD活力至CON组水平。
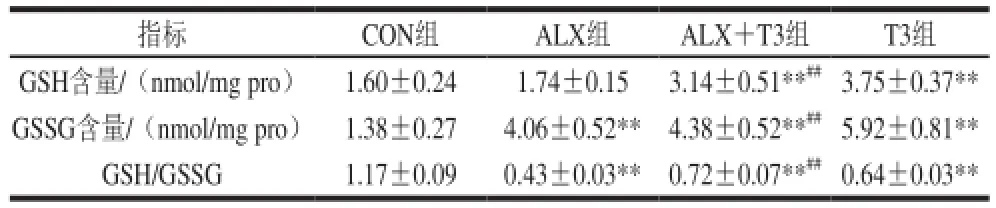
表2 各组小鼠胰腺GSH和GSSG水平及GSH/GSSG值比较Table 2 Effect of ALX and T3 on GSH/GSSG ratio in pancreas
如表2所示,单独注射ALX对小鼠胰腺GSH水平无明显影响,但可以极显著升高GSSG水平,从而降低GSH/GSSG值(P<0.01)。与CON组相比,单独注射甲状腺素T3能极显著提高小鼠胰腺GSH和GSSG水平,升高GSH/GSSG值(P<0.01)。ALX+T3组小鼠胰腺GSH和GSSG水平均极显著高于CON组和ALX组,并极显著地缓解了由注射ALX引起的小鼠胰腺GSH/GSSG水平下降(P<0.01)。
2.3 小鼠胰腺抗氧化酶基因表达水平
采用qRT-PCR技术对各组小鼠胰腺抗氧化酶相关基因的水平进行了分析,结果如图5所示。单独注射ALX极显著下调了小鼠胰腺Nrf2、GSH-Px-1、GSH-Px-4、CAT、MnSOD、Cu-ZnSOD基因的表达(P<0.01)。单独注射甲状腺素T3后,与CON组相比,Nrf2、Cu-ZnSOD、GSH-Px-1、GSH-Px-4基因表达水平极显著上调(P<0.01),但对MnSOD、CAT的基因表达水平影响不大。在注射ALX的同时给予甲状腺素T3,则能够有效缓减ALX造成的小鼠胰腺抗氧化相关基因表达水平下降的现象,并恢复至CON组水平。


图5 各组小鼠胰腺抗氧化酶相关基因表达水平比较Fig.5 Comparison of expression levels of antioxidant enzyme genes in pancreas
2.4 小鼠胰腺形态学分析

图6 各组小鼠胰腺形态学比较(HE,×40)Fig.6 Effect of T3 on histopathological changes in pancreatic tissue (HE, × 40)
28 d实验周期结束后,取各组小鼠的胰腺组织切片,经HE染色后如图6所示,与CON组相比,ALX组小鼠胰腺β细胞群的面积比明显减小,且β细胞群呈现不规则的形态,同时注射甲状腺素T3能够缓解ALX对于胰腺β细胞的影响。与CON组相比,单独注射甲状腺素T3对于胰腺β细胞没有显著影响。
2.5 小鼠胰腺促/抗细胞凋亡基因表达水平

图7 各组小鼠胰腺促凋亡(Caspase-3、Caspase-9、Bax)及抗凋亡(Bcl-2)基因水平的比较Fig.7 Comparison of expression levels of pro-apoptosis genes (Caspase-3, Caspase-9 and Bax) and anti-apoptosis gene (Bcl-2) in pancreas
进一步采用qRT-PCR技术分析各组小鼠胰腺促细胞凋亡基因Caspase-3、Caspase-9、Bax和抗凋亡基因Bcl-2的表达水平,实验结果如图7所示。注射ALX后,能够极显著上调小鼠胰腺促凋亡基因Caspase-3、Caspase-9、Bax的表达水平(P<0.01),并下调抗凋亡基因Bcl-2的表达水平(P<0.01)。单独注射甲状腺素T3,能极显著上调小鼠胰腺抗凋亡基因Bcl-2的表达水平(P<0.01),但对促凋亡基因Caspase-3、Caspase-9、Bax的表达水平无显著影响。与ALX组相比,ALX+T3组极显著缓解了由ALX引起的小鼠胰腺促凋亡基因表达的上调(P<0.01),并极显著提高了抗凋亡基因的表达水平(P<0.01)。
3 结论与讨论
目前,糖尿病已成为继心脑血管疾病和癌症之后的第三大疾病,严重危害人类健康。胰腺β细胞凋亡以及氧化还原状态紊乱,被认为可能是导致胰岛素分泌相对或绝对不足,从而引发糖尿病的两个关键因素[1-2]。临床研究发现,在糖尿病患者中,出现了甲状腺素分泌异常、血清中游离甲状腺素T3水平下降、甲状腺功能减退的亚临床症状[9-11]。在2型糖尿病小鼠中,补充甲状腺素T3能够缓解糖尿病肾病,降低小鼠的蛋白尿发生率[12]。体外研究表明,甲状腺素T3可以提高胰岛素诱导的Akt磷酸化和VAMP2的转录,促进3T3-L1脂肪细胞对葡萄糖的利用[13]。本研究从小鼠胰腺的氧化应激和胰腺β细胞的凋亡这两个角度来探究甲状腺素T3对糖尿病的预防和缓解作用。
本实验采用对小鼠腹腔注射ALX来诱导糖尿病。实验结果表明,以ALX处理后,小鼠出现了血糖水平上升、胰岛素水平下降的现象,实验期末的小鼠胰腺切片分析结果显示,注射ALX后,小鼠胰腺β细胞群的面积比明显减小,导致机体胰岛素水平不足,肝脏、肌肉的葡萄糖转运出现阻碍,最终表现为高糖血症[14]。此外,ALX组小鼠胰高血糖素水平也出现下降,表明ALX对胰岛α细胞也具有损伤作用。本实验中,单独注射甲状腺素T3的小鼠血糖水平略低于CON组,并且血液胰岛素水平有一定的升高,表明甲状腺素T3对于机体葡萄糖利用有一定的促进作用,而这可能是通过促进Akt磷酸化实现的[7]。给ALX+T3组小鼠同时注射甲状腺素T3,能够有效缓解高糖血症和低胰岛素血症的现象,进一步表明甲状腺素T3对小鼠糖尿病的缓解作用,这与前期文献[7]报道的甲状腺素T3缓解链脲佐菌素诱导的小鼠糖代谢紊乱、保护胰腺功能的研究结果一致。
采用ALX诱导小鼠糖尿病的同时,小鼠血液、胰腺组织出现显著的氧化应激,表现为ROS水平显著升高,而抗氧化酶水平显著下降,而ROS的攻击也是导致细胞凋亡的因素之一[13]。甲状腺素T3能够通过提高机体抗氧化酶活力而增强清除自由基的能力[8,15]。在本实验中,单独注射甲状腺素T3的小鼠抗氧化酶活力高于CON组,而给ALX+T3组小鼠同时注射甲状腺素T3,缓解了由ALX引起的小鼠胰腺抗氧化酶活力下降的现象。Nrf2是调节Ⅱ相解毒酶和抗氧化酶基因转录的关键因子,其活化后可调节一些重要抗氧化酶类的表达,可以保护机体免受ROS攻击,其调控的下游靶基因包括HO-1、NQO1等Ⅱ相解毒酶基因,以及过氧化还原酶Prdx1、金属硫蛋白MT1等抗氧化酶[16-17]。研究发现,甲状腺素T3能够显著提升肝脏细胞核中Nrf2的表达水平,降低Nrf2在细胞质中的水平,说明甲状腺素T3能够促进Nrf2由细胞质向细胞核的迁移,并激活由Nrf2诱导的基因转录作用,而Nrf2能够通过激活下游抗氧化酶基因的转录而加速对于ROS的清除,从而保护细胞[18-20]。在本实验中,ALX+T3组及T3组小鼠胰腺的Nrf2基因均呈现不同程度的上调,结合这两组小鼠较高的血清T-AOC活力及胰腺SOD、CAT、GSH-Px活力,进一步证明了甲状腺素T3能够上调Nrf2相关的抗氧化系统,降低由ALX引起的ROS对于胰腺的损伤。此外,在高糖诱导的小鼠胰岛素瘤RIN-m5F细胞中,研究T3对胰岛β细胞的保护作用,也观察到甲状腺素T3可显著下调GSK-3β及Keap-1 mRNA表达水平,增强Nrf2通路相关的抗氧化系统,提高细胞抗氧化能力[21]。
胰腺组织切片和小鼠胰腺促/抗凋亡基因分析结果表明,ALX组小鼠胰腺β细胞群面积显著降低,胰腺β细胞出现了严重的凋亡现象,而这必然引起胰腺功能损伤,导致机体胰岛素水平不足。已有研究表明甲状腺素T3具有很好的细胞保护作用,能够上调抗凋亡基因的表达水平,下调促凋亡基因的表达水平[22-23]。在高糖诱导的RIN-m5F细胞中,发现甲状腺素T3能显著提高线粒体膜电位,上调抗凋亡因子Bcl-2 mRNA表达水平,下调凋亡因子Bax基因表达水平,对抗细胞凋亡[21]。本研究结果也证实了这一点,甲状腺素T3能够通过调节促/抗凋亡基因的水平,维持胰腺在ALX诱导条件下的正常生理功能。
本实验采用腹腔注射ALX诱导产生1型糖尿病小鼠模型,探究甲状腺素T3在1型糖尿病模型中对小鼠胰腺的保护作用。实验结果表明,甲状腺素T3能够改善糖尿病小鼠血糖水平过高以及胰岛素分泌不足的现象。T3能够通过改善机体和胰腺氧化还原状态,提高抗氧化酶基因的表达水平及抗氧化酶活力,提高机体的ROS清除能力,从而保护胰腺,维持胰腺正常生理功能。此外,T3能够通过调节与细胞凋亡相关的基因,改善糖尿病小鼠胰腺细胞凋亡的现象。综合上述实验结果,可得出以下结论:甲状腺素T3可以作为一种胰岛β细胞保护剂或抗氧化剂,而相应地,一些能够促进机体甲状腺素T3合成、分泌的食品功能因子有应用于糖尿病的预防和治疗的潜力。
[1] KASSAB A, PIWOWAR A. Cell oxidant stress delivery and cell dysfunction onset in type 2 diabetes[J]. Biochimie, 2012, 94(9): 1837-1848.
[2] 任春久, 张瑶, 崔为正, 等. 氧化应激在2型糖尿病发病机制中的作用研究进展[J]. 生理学报, 2013, 65(6): 664-673.
[3] ROSENGREN A H, BRAUN M, MANDI T, et al. Reduced insulin exocytosis in human pancreatic beta-cells with gene variants linked to type 2 diabetes[J]. Diabetes, 2012, 61(7): 1726-1733.
[4] 赵赛. 白藜芦醇对2型糖尿病大鼠胰岛细胞保护作用及其机制的研究[D]. 石家庄: 河北医科大学, 2011: 8-30.
[5] 王莉萍. α-硫辛酸对2型糖尿病大鼠氧化应激致胰岛β细胞凋亡的影响[D]. 上海: 上海交通大学, 2013: 17-57.
[6] COSKUN O, KANTER M, KORKMAZ A, et al. Quercetin, a flavonoid antioxidant, prevents and protects streptozotocin-induced oxidative stress and β-cell damage in rat pancreas[J]. Pharmacological Research, 2005, 51(2): 117-123.
[7] FALZACAPPA C V, MANGIALARDO C, MADARO L, et al. Thyroid hormone T3 counteracts STZ induced diabetes in mouse[J]. PLoS ONE, 2011, 6(5): e19839. doi: 10.1371/journal.pone.0019839.
[8] 陈立立, 唐雪, 徐圆媛, 等. 甲状腺素对HepG2细胞氧化损伤的保护作用[J]. 食品与生物技术学报, 2014, 33(9): 935-940.
[9] GILANI B B, MACGILLIVRAY M H, VOORHESS M L, et al. Thyroid hormone abnormalities at diagnosis of insulin-dependent diabetes mellitus in children[J]. Journal of Pediatrcs, 1984, 105(2): 218-222.
[10] FUJII S, AKAI T, TANAKA S, et al. Thyroid hormone abnormalities in patients with diabetes mellitus[J]. Journal of Endocrinol Investigation, 1981, 4(1): 71-74.
[11] 谈力欣, 王军芬. 2型糖尿病患者甲状腺激素和促甲状腺素的相关性研究[J]. 河北医药, 2014, 36(17): 2598-2599.
[12] LIN Yi, SUN Zhongjie. Thyroid hormone ameliorates diabetic nephropathy in a mouse model of type II diabetes[J]. Journal of Endocrinology, 2011, 209(2): 185-191.
[13] LIN Yi, SUN Zhongjie. Thyroid hormone promotes insulin-induced glucose uptake by enhancing Akt phosphorylation and VAMP2 translocation in 3T3-L1 adipocytes[J]. Journal of Cellular Physiology, 2011, 226(10): 2625-2632.
[14] BECK-NIELSEN H, HOTHER-NIELSEN O, VAAG A, et al. Pathogenesis of type 2 (non-insulin-dependent) diabetes mellitus: the role of skeletal muscle glucose uptake and hepatic glucose production in the development of hyperglycaemia[J]. Diabetologia, 1994, 37(2): 217-221.
[15] KIM W H, LEE J W, SUH Y H, et al. AICAR potentiates ROS production induced by chronic high glucose: roles of AMPK in pancreatic beta-cell apoptosis[J]. Cellular Signalling, 2007, 19(4): 791-805.
[16] GIUDICE A, ARRA C, TURCO M C. Review of molecular mechanisms involved in the activation of the Nrf2- ARE signaling pathway by chemopreventive agents[J]. Transcription Factors, 2010, 647: 37-74.
[17] CHARTOUMPEKIS D V, KENSLER T W. New player on an old field; the keap1/Nrf2 pathway as a target for treatment of type 2 diabetes and metabolic syndrome[J]. Current Diabetes Reviews, 2013, 9(2): 137-145.
[18] FERNÁNDEZ V, TAPIA G, VARELA P, et al. Redox regulation of thyroid hormone-induced Kupffer cell-dependent IκB-α phosphorylation in relation to inducible nitric oxide synthase expression[J]. Free Radical Research, 2005, 39(4): 411-418.
[19] ROMANQUE P, CORNEJO P, VALDES S, et al. Thyroid hormone administration induces rat liver Nrf2 activation: suppression by N-acetylcysteine pretreatment[J]. Thyroid, 2011, 21(6): 655-662.
[20] VIDELA L A, CORNEJO P, ROMANQUE P, et al. Thyroid hormoneinduced cytosol-to-nuclear translocation of rat liver Nrf2 is dependent on Kupffer cell functioning[J]. Scientific World Journal, 2012: 301494. doi: 10.1100/2012/301494.
[21] 高翠翠. 三碘甲腺原氨酸对氧化应激RIN-m5F细胞的保护作用及机制探究[D]. 无锡: 江南大学, 2014: 1-38.
[22] VERGA FALZACAPPA C, PANACCHIA L, BUCCI B, et al. 3,5,3’-Triiodothyronine (T3) is a survival factor for pancreatic betacells undergoing apoptosis[J]. Journal of Cellular Physiology, 2006, 206(2): 309-321.
[23] VERGA FALZACAPPA C, MANGIALARDO C, RAFFA S, et al. The thyroid hormone T3 improves function and survival of rat pancreatic islets during in vitro culture[J]. Islets, 2010, 2(2): 96-103.
Thyroid Hormone T3 Counteracts Pancreastic Dysfunction in Alloxan-Induced Diabetic Mice
CHENG Xiangrong, DING Yinyi, WU Xu, XIA Shufang, SHI Yonghui, LE Guowei
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Objective: The protective effects of thyroid hormone T3 on the dysfunction of pancreas in alloxan (ALX)-induced diabetic mice were investigated in this study. Methods: Twenty-four Kunming mice were randomly divided into four groups, including negative control group, ALX group, ALX plus T3 (ALX + T3) group, and T3 group, which were subjected to intraperitoneal administration of normal saline, ALX, ALX plus T3, and T3, respectively. The levels of reactive oxygen species (ROS) in blood were tested at 1, 4, 6, 12, and 24 h after injection. Blood glucose was tested every 3 days. Mice were sacrificed at 28 days after injection. Whole pancreas and plasma were utilized for morphological and biochemical analyses. The activities of superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GSH-Px), the contents of reduced and oxidative glutathione (GSH and GSSG), the expression levels of antioxidant enzyme genes including Nrf2, SOD, GSH-Px, and CAT, and the expression levels of the apoptosis-associated genes Caspase-3, Caspase-9, Bax, Bcl-2 were examined in each group. Results: ALX induced a high level of blood glucose and ROS (P < 0.01), low level of insulin in plasma (P < 0.01), and lower activities of antioxidant enzymes in plasma and pancreas (P < 0.01), as well as down-regulation of the antioxidant enzyme genes and apoptosis-related genes (P < 0.01). T3 could ameliorate the enhancement of blood glucose and defective insulin secretion. The redox imbalance caused by ALX, including the decrease of antioxidant enzyme activities and gene expression levels, was counteracted by T3. Moreover, the up-regulated pro-apoptosis genes (Caspase-3, Caspase-9 and Bax) and down-regulated anti-apoptosis Bcl-2 gene were counteracted by T3 remarkably (P < 0.01). Conclusion: T3 couldimprove the redox status of ALX-induced diabetic mice and protect pancreatic β-cells from cell death to maintain normal physiological function of pancreas.
thyroid hormone T3; alloxan; diabetes; pancreas
TS201.4
A
1002-6630(2015)21-0207-07
10.7506/spkx1002-6630-201521039
2015-06-23
“十二五”国家科技支撑计划项目(2012BAD33B05)
成向荣(1985—),男,副教授,博士,研究方向为食品营养与功能因子。E-mail:cheng-xiangrong@hotmail.com

