多西他赛注射液制备工艺研究
陈 兰 王雪莲
(西南药业股份有限公司,中国 重庆400038)
多西他赛为紫杉醇类抗肿瘤药,通过干扰细胞有丝分裂和分裂间期细胞功能所必须的微管网络而起抗肿瘤作用。多西他赛可与游离的微管蛋白结合,促进微管蛋白装配成稳定的微管,同时抑制其解聚,导致丧失了正常功能的微管束的产生和微管的固定,从而抑制细胞的有丝分裂。多西他赛自1995年在墨西哥、南非被批准用于治疗乳腺癌及非小细胞肺癌(NSCLC)以来,已在世界范围内51个国家获准使用,且在其中24个国家中,它是唯一被批准用于治疗晚期NSCLC的药物[1]。
1 试验材料
1.1 仪器
Agilet 1100高效液相色谱仪(美国安捷伦公司),pHS-3C型pH计(上海雷磁仪器厂),YB-2型澄明度检测仪(天津大学精密仪器厂),AB204-E电子天平(梅特勒-托利多)。
1.2 药品与试剂
多西他赛(重庆泰濠制药有限公司,批号:DO-0811001);吐温-80(日本三洋有限公司;无水乙醇(成都科龙有限公司);活性炭(上海针用活性炭厂)。
2 方法与结果
2.1 多西他赛注射液的制备
准确称取多西他赛原料,放入配料罐中,并加入配置总量80%的无水乙醇,搅拌使原料完全溶解。在药液中加入吐温-80,搅拌均匀。将溶液稀释至总重量。调节产品pH值。最后加入活性炭,搅拌静止15分钟,灌装,冷冻干燥抽取乙醇,轧盖。
2.2 多西他赛含量测定试验
2.2.1 色谱条件与系统适用性试验
仪器:高效液相色谱仪 色 谱 柱:C18(4.6×250mm,5μm,安捷伦)。流动相:以水为流动相A,乙腈为流动相B,按下表进行线性梯度洗脱。检测波长:232nm。柱温为45℃;流速为1.2ml/min;进样体积:20μl。称取多西他赛定性对照品(包括多西他赛,杂质b,杂质d,杂质e和杂质f)适量,用溶剂[乙腈-水-乙酸(100:100:0.1)]溶解并稀释至1mg/ml的溶液,作为系统适用性溶液。取对照品溶液用溶剂配制成0.2μg/ml的溶液,作为灵敏度溶液。分别精密量取系统适用性试验溶液各20μl进样,系统性试验溶液色谱图中多西他赛和杂质b的分离度应大于3.5,对照品溶液主峰面积的相对标准偏差应不大于1.0%[2]。
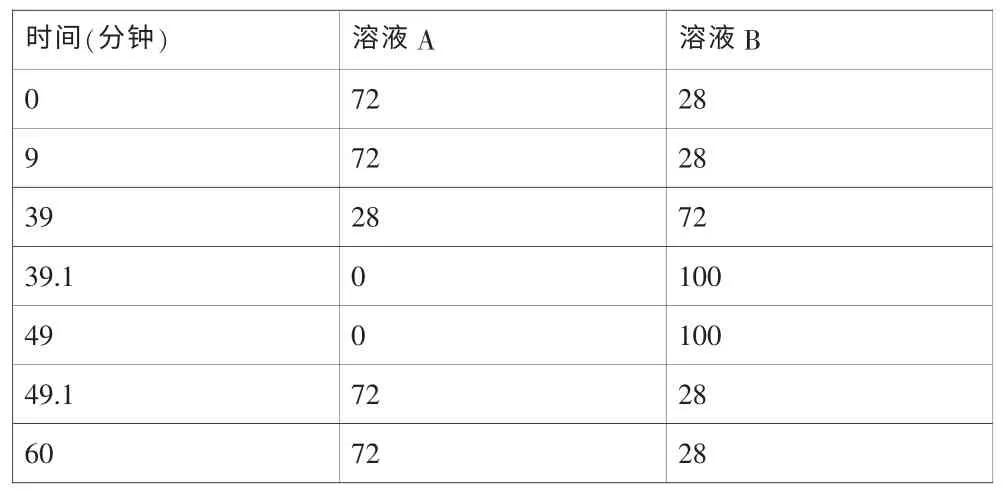
表1
2.2.2 测定法
取本品的内容物适量,精密称定,用溶剂溶解并稀释制成0.2mg/ml的溶液,摇匀,作为供试品溶液。精密称取多西他赛对照品约10mg,置50ml量瓶中,加2ml乙醇使溶解,加溶剂稀释制成约含多西他赛0.2mg/ml的溶液,作为对照品溶液。精密量取供试品溶液和对照品溶液各20μl,注入液相色谱仪,记录色谱图;按外标法以峰面积计算,即得。
2.2.3 系统适用性试验
精密称取内容物适量,用溶剂溶解并稀释制成含多西他赛约0.2mg/ml的溶液,共6份,分别进样。

表2 含量系统适用性试验结果
6份样品的主峰面积的相对标准偏差为0.23%,主峰保留时间得相对标准偏差为0.16%,均小于1%,表明该方法系统适用性不错。
2.2.4 空白试验
按处方比例称取辅料约10mg和制剂12mg各一份,分别置于10ml量瓶中,加溶剂溶解并稀释至刻度,摇匀,分别进样,同时进一份溶剂。结果:溶剂和辅料的吸收峰在主峰保留时间处均未有吸收峰出现,不干扰含量测定。
2.2.5 精密度试验
①重复性试验
精密称取内容物适量,并稀释制成含多西他赛约0.2mg/ml的溶液,共6份,分别取20μl进样。结果见表3。

表3 含量重复性试验结果
结果:6次进样的平均峰面积为98.7%,RSD=0.46%,表明含量的重复性较好。
②中间精密度试验
由另外一人,另一天,用另外一台液相检测,结果见表4。
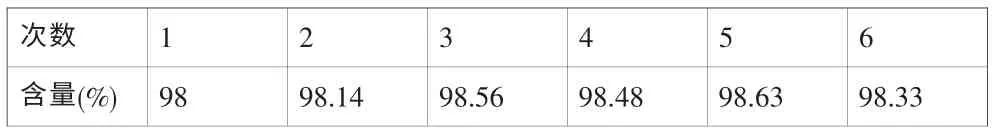
表4 含量中间精密度试验结果
重复性和中间精密度试验12份溶液含量的相对标准偏差为0.41%,可见此方法测定含量精密度较好。
2.2.6 溶液的稳定性
取重复性试验的样品溶液1份,在室温下放置不同的时间,计算含量。结果见表5。
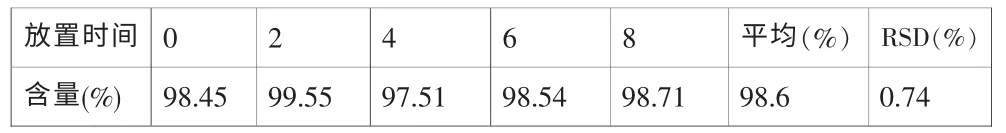
表5 含量溶液稳定性试验结果
供试品溶液在放置8小时后,含量基本无变化,可见溶液稳定性很好。
2.2.7 回收率试验
精密称取多西他赛原料各三份,分别置于量瓶中,用溶剂溶解并稀释至100ml,摇匀,分别进样,计算回收率。结果见表6。
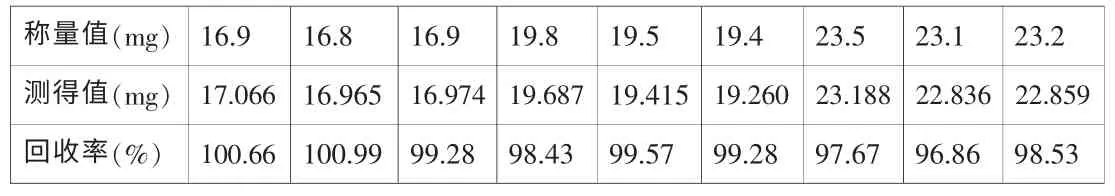
表6 含量回收率试验结果
三个浓度下的平均回收率为99.0%,相对标准偏差为1.34%,表明此方法测定含量的准确度很好,可以对多西他赛进行准确定量。
2.3 注射用多西他赛制备工艺的考察
2.3.1 质量指标
①性状:白色冻干块状物。②pH测定:pH值应为3.0~4.5。③水分:取本品,照水分测定法(中国药典2010年版二部附录ⅧM第一法A)测定,含水分不得过3.0%。④有关物质测定:单个杂质峰面积不的过2.0%,总杂质峰面积不得过5.0%。⑤含量测定:多西他赛含量用高效液相法测定,多西他赛含量应在90%~105%范围内。
2.3.2 药用炭的筛选
将多西他赛用无水乙醇溶解后,加入吐温-80搅拌均匀后,分别加入0.01%、0.05%、0.1%的活性炭,搅拌均匀后,静止15分钟,粗滤,再通过0.22μm精滤,灌装,冷冻抽乙醇后轧盖。加入不同药用炭试验,结果见表7。

表7 活性炭筛选结果表
结果显示,活性炭对多西他赛的吸附不是很明显,但一定量的活性炭有助于保证产品质量,在多西他赛药液中加入0.01%的活性炭,在大生产过程中既保证细菌内毒素合格,又保证过滤系统能顺利进行。
2.3.3 冻干时间的筛选
多西他赛原料难溶于水,我们使用无水乙醇作为产品溶剂。因此多西他赛注射液需控制乙醇残留量。为保证有效去除无水乙醇,采取了分阶段程序升温的办法,同时保证高真空度的条件下去除无水乙醇。我们分别考察了32小时、36小时、40小时、44小时时本品的无水乙醇残留量最终确定本品的冷冻干燥时间。无水乙醇残留量的测定采用气相色谱法测定。
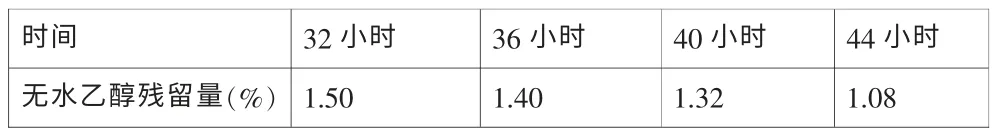
表8 冻干时间与无水乙醇残留量研究
根据实验的测定结果,冷冻干燥32小时乙醇的残留量符合标准要求,为保证在大生产过程中,产品的乙醇残留量符合标准规定,因此选择冷冻干燥时间为44小时。
2.3.4 结果
多西他赛溶液配制后加入0.01%活性炭后搅拌静止15分钟,药液经过0.45μm及0.22μm两级过滤后灌装,冷冻干燥44小时后,轧盖。中试生产的三批样品(批号:20130301、20130302、20130303),样品经过质量检测,各项指标均符合质量标准规定。结果见表9。
3 讨论
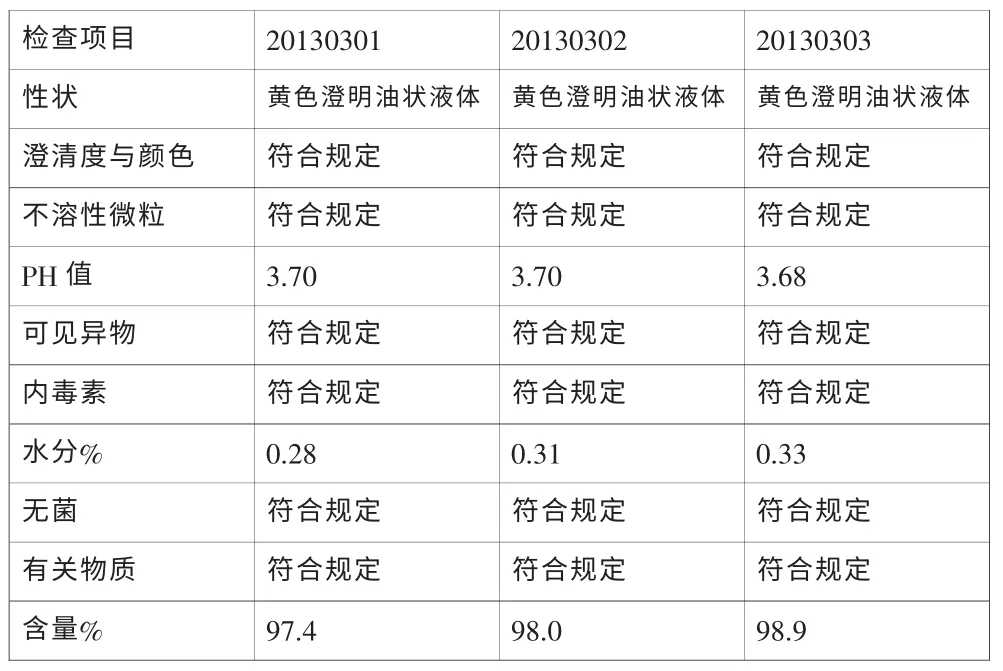
表9 三批试验结果表
多西他赛的药理作用比紫杉醇强,在细胞内浓度比紫杉醇高3倍,作为微管稳定剂和装配促进剂,活性比紫杉醇大2倍;作为微管解聚抑制剂,活性比紫杉醇大2倍[3],目前已在64个国家上市。因原料药多西他赛难溶,使用乙醇作为溶剂。再与吐温-80混合形成溶液,再采取冷冻干燥技术将混合溶液中的无水乙醇抽除。我们对多西他赛注射液进行了处方筛选、冻干曲线的摸索等试验研究工作,研究结果表明,按照研制工艺中试生产的三批样品均符合质量要求,处方和工艺合理,利于生产操作,能保证产品质量,生产效率高。
[1]姚和际,等.多西紫杉醇研究进展及市场分析[J].中国制药信息,2001,17(5):29-30.
[2]美国药典[Z].USP35版.
[3]孙燕,李雏廉,管忠震.泰索帝治疗晚期乳腺癌和肺癌[J].中国新药杂志,1998,7(3):165-167.
——水芹主要害虫识别与为害症状

