肺腺癌A549细胞KDR基因沉默后对厄罗替尼敏感性的影响
肺腺癌A549细胞KDR基因沉默后对厄罗替尼敏感性的影响
张秀义勾建强
(承德市中心医院呼吸内科,河北承德067000)
摘要〔〕目的研究激酶功能区受体(KDR)基因沉默对人肺腺癌A549细胞增殖和对化疗药物厄罗替尼敏感性的影响。方法设计合成KDR的siRNA序列,LipofectamineTM2000 转染人A549细胞。RT-PCR和Western印迹检测KDR在干扰后mRNA和蛋白的表达情况,通过流式细胞仪检测细胞周期。MTT法和细胞克隆形成试验观察KDR基因沉默后A549细胞对厄罗替尼的敏感性。结果KDR基因沉默48 h后,A549细胞的KDR基因和蛋白表达明显降低(P<0.05)。细胞周期被阻滞在G0/G1期,S期细胞数明显减少(P<0.05)。KDR基因沉默组细胞对厄罗替尼的敏感性显著性增强。结论KDR特异性siRNA能显著沉默A549细胞KDR基因,抑制细胞增殖,并增强A549细胞对厄罗替尼的敏感性。
关键词〔〕激酶功能区受体(KDR); siRNA; 肺腺癌;A549细胞;厄罗替尼
中图分类号〔〕R734.2〔文献标识码〕A〔
第一作者:张秀义(1977-),女,主治医师,主要从事呼吸系统疾病研究。
肺腺癌是肺癌一种组织学类型,发病率逐年上升,发病年龄也逐渐年轻化,早期可出现淋巴或血行转移,对放化疗不敏感,严重制约肺腺癌5年生存率〔1,2〕。肿瘤的增殖与基因调控有关,为临床医生提供了新的有效治疗肿瘤途径〔3〕。研究表明肺腺癌细胞的发病、侵袭、转移涉及许多基因的激活、失活〔4〕。研究发现〔5〕激酶功能区受体(KDR)基因在肺腺癌细胞增殖中发挥重要作用,可作为肿瘤治疗的新靶点。在肺腺癌综合治疗过程中化疗占有重要的位置,厄罗替尼是肺腺癌最常用、最有效的化疗药物之一〔6〕。本研究探讨KDR基因沉默对人肺腺癌A549细胞增殖的影响,并与厄罗替尼联用后增强人肺腺癌A549细胞对厄罗替尼的敏感性。
1材料与方法
1.1主要材料肺腺癌细胞株A549购于中国科学院上海细胞究所。RPMI1640培养液、胰蛋白酶和胎牛血清均购自美国Gibco公司。LipofectamineTM2000脂质体转染试剂和TRIzol购自美国Invitrogen公司;RT-PCR两步法试剂盒(北京赛百盛基因技术有限公司), cDNA合成试剂盒(日本TOYOBO公司);AMV逆转录试剂盒(杭州博日);厄罗替尼(Erlotinib,商品名特罗凯)由罗氏公司惠赠;siRNA基因片段由上海吉玛化学公司合成;G418购自美国Klontech公司;KDR鼠抗人单克隆抗体购自美国Santa Cruz公司;5%四甲基偶氮唑蓝、HRP标记的羊抗鼠二抗购自北京中杉公司;厄罗替尼(AstraZeneca UK Limited);流式细胞仪(COULTER XL;Coulter);550酶标仪(美国Biorad公司),生物倒置显微镜(Olympus CKX4)。电化学发光(ECL)试剂盒购自美国Thermo公司;放射免疫测定(RIPA)蛋白裂解液购自江苏碧云天公司。
1.2siRNA设计、合成及转染依据文献〔7〕KDR siRNA和阴性对照组 siRNASCR(scramble siRNA)序列分别为:5'-GCCACCAUGUUCUCUAAUA'I’I'-3’(正义链)5'-UAUUAGAGAACAUGGUGGCAT-3’(反义链);5'-UUCUCCGAACGUGUCACGU'IT-3’(正义链),5'-ACGUGACACGUUCGGAGAATI’-3’(反义链)。均由上海吉玛化学公司合成,MGC-803细胞培养于含体积分数10%小牛血清的RPMI1640完全培养液(37℃恒温、5%CO2、饱和湿度)中培养。每3~4 d传代1次,取对数生长期细胞用于实验。按1×105个/孔将胃癌MGC-803接种于24孔板中,当融合率达70%时以脂质体法进行转染,转染时分为3组:转染pGenesil-1-KDR-siRNA载体者为A549/KDR-siRNA组(实验组),转染随机对照载体者为A549/control组(对照组),未转染的肺腺癌细胞株A549细胞为A549组(空白组)。于转染后48 h行RNA干扰效应的检测。
1.3RT-PCR检测弃培养液后PBS冲洗细胞3次,用TRIzol法提取总RNA,通过cDNA合成试剂盒反转录合成cDNA。分别扩增KDR和内参GAPDH。KDR上游引物:5’-CTGGCATGGTCTFCTGTGAAGCA-3’,下游引物:5’-AATACCAGTGGATGTGATGCGG-3’,扩增产物795 bp;内参照GAPDH上游引物:5’-CGTGGAAGGACTCATGACCA-3’,下游引物:5’TCCAGGGGTCTTACTCCTTG-3’,扩增产物为509 bp。PCR反应条件为94℃变性2 min,按94℃变性45 s、62℃退火1 min、72℃延伸1 min进行反应,循环35次,再于72℃延伸8 min。2%琼脂糖水平板电泳,100 V电压电泳45 min。用凝胶自动成像及分析系统(法国VI)进行吸光度扫描,用KDR吸光度/GAPDH吸光度值作为mRNA表达的相对强度。
1.4Westem印迹检测细胞弃培养液后PBS冲洗3次,加入预冷的RIPA裂解液150 μl,RIPA裂解液预先加PMSF 1.5 μl使其终浓度为1 mmol/L。操作在冰上进行, 4℃下,10 000 r/min离心5 min后取上清液,通过BCA法测蛋白浓度后,99 ℃ 变性10 min。取50 μg蛋白行10%SDS-PAGE电泳,通过电转移印迹到PVDF膜上,封闭液中孵育1 h加入1∶1 000稀释的KDR一抗,4℃过夜。TBST洗膜5 min,共3次,加入1∶5 000 HRP标记的二抗和GAPDH,于37℃孵育2 h PBS洗涤,采用ECL法检测。
1.5流式细胞仪检测细胞周期 收集3组细胞,调整细胞浓度为1×106/L,冷PBS 洗涤2 次,加入70 %的冷乙醇(4℃) 固定24 h后,洗涤细胞,与含10 μg/ml RNA 酶的Tris-HCl缓冲液(pH7.4) 共同孵育30 min。50 μg/ml 碘化丙啶(PI)进行细胞的DNA 染色,1 h 内通过流式细胞仪分析细胞的DNA含量分布,并计算出各个周期细胞所占的百分率。
1.6MTT检测干扰KDR后A549对厄罗替尼的敏感性 细胞转染干扰质粒48 h后,收集转染和未转染的A549细胞, 接种于96孔板, 每个样本做3个复孔, 当细胞贴壁后,加入不 同浓度的厄罗替尼(10、25、50、100、200 μmol/L)培养48 h ;每孔加MTT 20 μl(浓度为5 mg/ml),放置孵箱内4 h后弃上清加入10%的十二烷基磺酸钠(SDS)200 μl,过夜。震荡15 min,用全自动酶标仪检测490 nm处的吸光度值(A值)。抑制率(%)=(A对照-A实验)/(A对照-A空白)×100%。
1.7平板克隆检测干扰KDR后A549对厄罗替尼的敏感性细胞转染干扰质粒48 h后,收集转染和未转染的A549细胞, 接种于6孔板 , 每个样本做3个复孔, 细胞贴壁后,加入不 同浓度的厄罗替尼(10、25、50、100、200 μmol/L)培养中培养7 d,去除培养液,PBS洗2次,95%乙醇固定10 min,吉姆萨染液染色10 min,自来水冲洗后,晾干,通过Quantity One软件计算克隆数。克隆形成抑制率(%)=1-(实验组克隆数/对照组克隆数)×100%。
1.8统计学方法采用SPSS14.0统计软件进行t检验、方差分析。
2结果
2.1siRNA抑制KDR mRNA的表达实验组条带明显变窄,实验组KDR mRNA表达(0.28±0.06)与对照组(0.56±0.07)和空白组(0.57±0.08)差异均有统计学意义(P<0.05)。见图1。
2.2siRNA抑制KDR蛋白的表达实验组条带明显变窄, 实验组KDR蛋白灰度值(0.32±0.06)与对照组(0.71±0.08)和空白组(0.70±0.09)差异显著(P<0.05)。见图1。
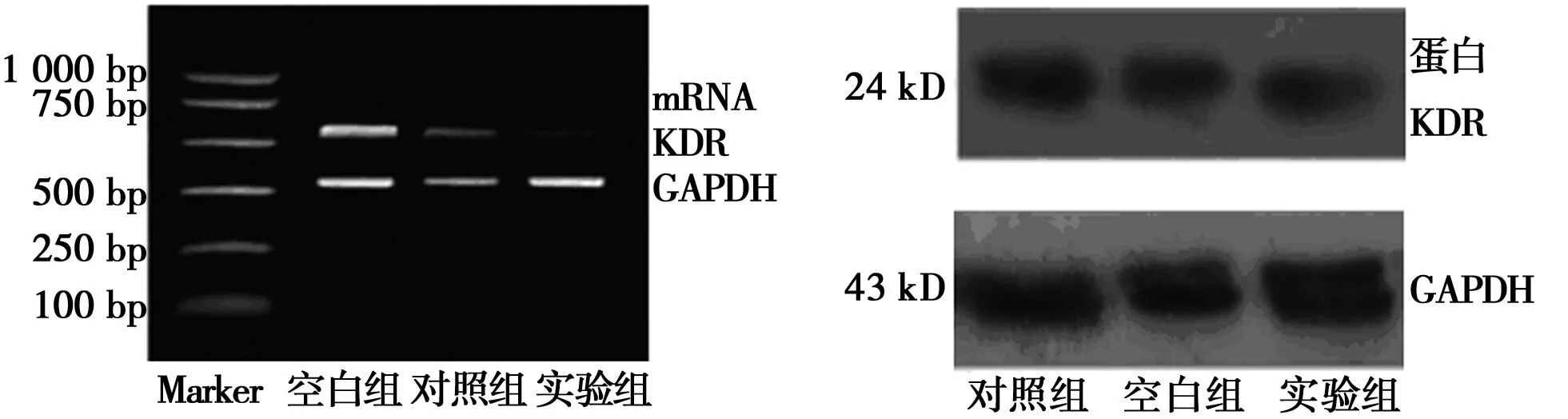
图1 A549细胞中KDR mRNA和蛋白的表达
2.3流式细胞仪检测细胞周期G0/G1期实验组较对照组和空白组明显增加,S期明显减少(P<0.05),3组M期细胞无明显变化(P>0.05)。说明实验组有明显的S期阻滞。见表1,图2。

图2 流式细胞仪分析A549细胞的细胞周期
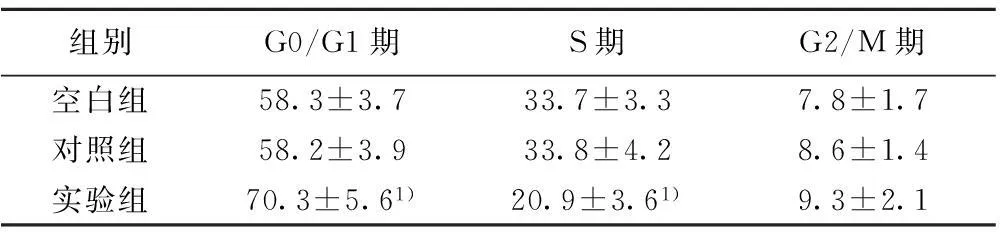
组别G0/G1期S期G2/M期空白组58.3±3.733.7±3.37.8±1.7对照组58.2±3.933.8±4.28.6±1.4实验组70.3±5.61)20.9±3.61)9.3±2.1
和空白组、对照组比较:1)P<0.05;下表同
2.4干扰KDR后A549对厄罗替尼的敏感性提高转染pgsiRNA-KDR后,A549细胞对不同浓度的厄罗替尼敏感性均提高。随着药物浓度的增加,厄罗替尼对细胞的抑制率也增加,呈现出剂量依赖性,实验组细胞对不同浓度的厄罗替尼敏感性显著高于对照组和空白组(P<0.05)。见表2。
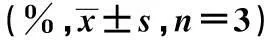

厄罗替尼浓度(μmol/L)空白组对照组实验组1016.34±1.5716.23±1.4526.45±1.351)2522.67±1.3423.23±1.6337.24±1.351)5030.85±2.2331.52±1.3650.45±3.021)10040.45±3.2341.65±2.2878.52±2.361)20050.45±3.8050.42±3.2491.42±4.681)
2.5对A549细胞集落形成的影响转染 pgsiRNA-KDR后,A549细胞对不同浓度的厄罗替尼敏感性均提高,细胞克隆形成数明显减少,克隆形成抑制率明显增高(P<0.05)。随着药物浓度的增加,厄罗替尼对细胞的克隆形成抑制率也增加,呈现出剂量依赖性,实验组细胞对不同浓度的厄罗替尼克隆形成抑制率显著高于对照组和空白组(均P<0.05)。见表3。
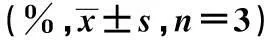
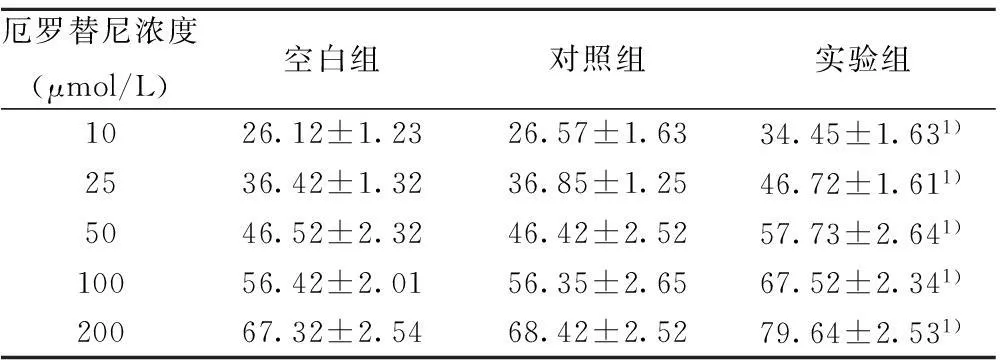
厄罗替尼浓度(μmol/L)空白组对照组实验组1026.12±1.2326.57±1.6334.45±1.631)2536.42±1.3236.85±1.2546.72±1.611)5046.52±2.3246.42±2.5257.73±2.641)10056.42±2.0156.35±2.6567.52±2.341)20067.32±2.5468.42±2.5279.64±2.531)
3讨论
肺腺癌作为一种全身性疾病,早期可出现淋巴或血行转移,发病率呈逐年上升、发病年龄呈逐渐年轻化的趋势〔1〕。目前国内外临床医生对肺腺癌患者主要采去手术治疗、化疗、放疗、内分泌治疗、生物分子靶向治疗等综合治疗方案,但其复发、转移仍然是目前临床医生面临的巨大难题。随着人类基因组计划的完成及功能基因学的不断发展,目前肿瘤基因治疗成为科研上研究热点,并且在肿瘤综合治疗上基因治疗得到了医学界广泛的重视〔7〕。肺腺癌细胞增殖与众多基因结构、功能异常有关,明确肺腺癌发病中的关键基因对临床上预防、诊断及治疗肺腺癌具有重大意义〔8〕。
近些年来随着RNA干扰技术的不断发展,其已经成为肿瘤基因治疗中的研究热点,由dsRNA分子介导的转录后沉默基因,具有高效、特异的抑制与肿瘤发病及耐药有关的多种基因表达的特点,广泛用于肿瘤、基因等疾病研究,开辟了有效治疗肿瘤新路径〔9〕。KDR广泛分布在血管内皮细胞,在血管内皮细胞的生长分化中起重要作用,具有增加血管通透性、促进新生血管生成和血管内皮细胞增殖的作用,成为近年来热点研究对象〔5,10〕。通常情况下血管内皮细胞更新缓慢,但在肿瘤组织中的血管内皮细胞增殖活跃,KDR高表达,介导血管内皮生长因子在肿瘤新生血管中形成〔11,12〕。在肺腺癌的综合治疗中化疗占有重要的地位,化疗在肺腺癌的综合治疗中占有重要位置,肺腺癌最常用、最有效的化疗药物是厄罗替尼〔6,13〕。本研究提示,KDR基因沉默导入肺腺癌A549细胞内,特异性干扰KDR 基因表达能够有效抑制人肺腺癌细胞增殖并对厄罗替尼的化疗敏感性显著性增强,KDR的siRNA序列为治疗人肺腺癌提供了新的理论依据〔14〕。KDR基因沉默及厄罗替尼两者结合,能在一定程度上有效诱发人肺腺癌A549细胞的自发凋亡及提高其对化疗药物厄罗替尼的敏感性。
综上,KDR siRNA可以显著沉默A549细胞KDR基因和蛋白的表达,抑制人肺腺癌A549细胞增殖,显著影响人肺腺癌A549细胞的生长速度,与厄罗替尼联用,具有明显的协同效应,增强人肺腺癌A549细胞对厄罗替尼的化疗敏感性。
4参考文献
1Tsuta K,Kawago M,Yoshida A,etal.Primary lung adenocarcinoma with morule-like components:a unique histologic hallmark of aggressive behavior and EGFR mutation〔J〕.Lung Cancer,2014;85(1):12-8.
2Lortet-Tieulent J,Soerjomataram I,Ferlay J,etal.International trends in lung cancer incidence by histological subtype:adenocarcinoma stabilizing in men but still increasing in women〔J〕.Lung Cancer,2014;84(1):13-22.
3Santos SC,Miguel C,Domingues I,etal.IVEGF and VEGFR-2(KDR) internalization is required for endothelial recovery during wound healing〔J〕.Experim Cell Res,2007;313(8):1561-74.
4Iannolo G,Sciuto MR,La Rosa C,etal.MARCH-I expression in cord blood CD34+KDR+cells〔J〕.Clin Biochem,2011;44(8-9):725-7.
5Cantoni S,Cavallini C,Bianchi F,etal.Vasculogenic response of human placental stem cells through PI3K/AKT pathway〔J〕.Pharmacol Res,2012;65(3):275-84.
6Renouf DJ,Tang PA,Hedley D,etal.A phase Ⅱ study of erlotinib in gemcitabine refractory advanced pancreatic cancer〔J〕.Eur J Cancer,2014;50(11):1909-15.
7Frank D,Rinkevich,Cathy Su,etal.Multiple evolutionary origins of knockdown resistance(kdr) in pyrethroid-resistant Colorado potato beetle,leptinotarsa decemlineata〔J〕.Pestic Biochem Physiol,2012;104(3):192-200.
8Gatecki P,Orzechowska A,Berent D,etal.Vascular endothelial growth factor receptor 2 gene(KDR) polymorphisms and expression levels in depressive disorder〔J〕.J Affect Disord,2013;147,(1-3):144-9.
9Curtin ML,Heyman HR,Frey RR,etal.Pyrazole diaminopyrimidines as dual inhibitors of KDR and Aurora B kinases〔J〕.Bioorgan Med Chem Lett,2012;22(14):4750-5.
10Adham SA,Coomber BL.Glucose is a key regulator of VEGFR2/KDR in human epithelial ovarian carcinoma cells〔J〕.Communications,2009;390(1):130-5.
11Holmes DI,Zachary IC.Vascular endothelial growth factor regulates stanniocalcin-1 expression via neuropilin-1-dependent regulation of KDR and synergism with fibroblast growth factor-2〔J〕.Cell Signal,2008;20(3):569-79.
12Kim CW,Son KN,Choi SY,etal.Human lactoferrin upregulates expression of KDR/Flk-1 and stimulates VEGF-A-mediated endothelial cell proliferation and migration〔J〕.FEBS Lett,2006;580(18):4332-6.
13Vickers MM,Powell ED,Asmis TR,etal.Comorbidity,age and overall survival in patients with advanced pancreatic cancer-Results from NCIC CTG PA.3:a phase III trial of gemcitabine plus erlotinib or placebo〔J〕.Eur J Cancer,2012;48(10):1434-42.
14Foster KA,Regan HK,Danziger AP,etal.Delayed administration of a novel small molecule KDR kinase inhibitor〔J〕.Neurosci Res,2009;63(1):10-6.
〔2013-12-17修回〕
(编辑苑云杰)
·心脑血管、代谢性疾病·

