发状念珠藻胞外多糖对小鼠免疫活性的影响
发状念珠藻胞外多糖对小鼠免疫活性的影响
郭金英,杜洁,李彤辉,任国艳,张玉先
(河南科技大学 食品与生物工程学院,河南 洛阳 471023)
摘要:采用BG-11培养液,悬浮培养发状念珠藻,提取发状念珠藻胞外多糖。分别以发状念珠藻胞外多糖25 mg/kg、50 mg/kg、100 mg/kg这 3个剂量灌胃小鼠,连续两周后,皮下注射氢化可的松一周,处死小鼠。测定小鼠脏器指数、碳粒廓清指数、迟发型变态反应和脾脏抗体生成细胞数,分析发状念珠藻胞外多糖的体内免疫活性。研究结果表明:与模型对照组相比,多糖组小鼠的脏器指数、廓清指数、吞噬指数及足跖增厚值都显著增大,脾脏B细胞分泌抗体能力显著增强。发状念珠藻胞外多糖具有增强小鼠免疫功能的作用。
关键词:发状念珠藻;胞外多糖;免疫活性
基金项目:河南省科技攻关计划基金项目(142102110038)
作者简介:郭金英(1971-),男,河南南阳人,副教授,博士,硕士生导师,主要从事食物新资源方面的研究.
收稿日期:2014-03-03
文章编号:1672-6871(2015)01-0072-04
中图分类号:TS201.4
文献标志码:A
0引言
发状念珠藻(Nostocflageliforme)主要分布于中国西北部干旱和半干旱的荒漠地区,是一种常见陆生蓝藻[1]。其营养丰富,富含蛋白质、多糖和氨基酸等,具有较高的经济和药用价值[2]。发状念珠藻多糖是一种酸性杂多糖,由木糖、甘露糖、半乳糖、葡萄糖以及葡萄糖醛酸组成,为藻体正常的分泌物质,是一种极具开发潜力的天然药物资源[3],具有重要的生物功能,它可使离体培养的肿瘤细胞死亡[2],还具有抗病毒[4]、抗氧化等功能。
目前,发状念珠藻多糖的结构、理化性质等方面的研究已有报道。文献[5]对分离纯化后的发状念珠藻多糖作了初步的结构分析;文献[6]确定了提取发状念珠藻多糖的最佳工艺条件并对多糖性质进行了研究;文献[7]提取纯化了发状念珠藻胞外多糖与荚膜多糖,并研究了它们的理化特性。但是,关于发状念珠藻多糖生物活性的研究尚处于起步阶段,发状念珠藻多糖免疫活性的研究还未见报到。因此,本文以小鼠为试验对象,研究发状念珠藻多糖对免疫低下模型小鼠的体内免疫活性的作用,为发状念珠藻多糖的开发应用提供依据。
1材料与方法
1.1 发状念珠藻胞外多糖的制备
热水提取—木瓜蛋白酶水解蛋白质—乙醇沉淀—蒸馏水溶解—sevag试剂脱蛋白—乙醇沉淀—蒸馏水溶解—冷冻干燥。通过硫酸-苯酚法测得胞外多糖纯度(质量分数)为82.50%。
1.2 试剂
盐酸左旋咪唑:山西太原药业有限公司;氢化可的松:上海索莱宝生物科技有限公司;印度墨汁:青岛海博生物技术有限公司;其他均为国产分析纯。
1.3 试验动物
健康ICR小鼠,雄性,体质量18~22 g;健康豚鼠,雌雄不限,体质量300~400 g,购自河南科技大学动物实验中心。
1.4 试验仪器
CKX41倒置显微镜:广州市明美光电技术有限公司;TG-16G离心机:上海安亭科学仪器厂;SW-CJ-1F单人双面超净工作台 :苏州净化设备有限公司;722S可见分光光度计:上海精密科学仪器有限公司。
1.5 方法
1.5.1绵羊红细胞
无菌条件下,抽取健康绵羊静脉血注入到灭菌的加有玻璃珠的三角瓶内,轻轻摇晃几分钟以去除纤维蛋白,加入2倍体积的Alsever液摇匀后置于4 ℃冰箱保存。使用时先用生理盐水漂洗:前两次以1 500 r/min离心5 min,后两次以2 000 r/min离心5 min,去掉上清,即得到绵羊红细胞(SRBC)。
1.5.2豚鼠血清补体
采集豚鼠心血,常温放置25 min,离心制得血清。将豚鼠血清与SRBC按照体积比5∶1混合,置4 ℃、30 min,然后2 000 r/min离心5 min,取上清冷冻保存。用时以生理盐水稀释10倍。
1.5.3动物分组及处理
将48只ICR小鼠随机分为6组,分别为正常对照组、模型对照组、阳性对照组、多糖低剂量组(25 mg/kg)、多糖中剂量组(50 mg/kg)和多糖高剂量组(100 mg/kg)。正常对照组和模型对照组小鼠灌胃生理盐水,阳性对照组小鼠灌胃盐酸左旋咪唑(25 mg/kg),剂量为每10 g体质量0.1 mL。灌胃两周后,除了正常对照组小鼠皮下注射生理盐水外,其他各组小鼠均注射氢化可的松(15 mg/kg),连续注射一周。
1.5.4免疫器官指数测定
小鼠于末次处理后,12 h内禁食不禁水,然后脱颈椎处死,称其质量;剥离胸腺、脾脏、肝脏,用滤纸吸除表面水分污垢并称质量。计算胸腺质量与小鼠质量之比即胸腺指数,脾脏质量与小鼠质量之比即脾脏指数,肝脏质量与小鼠质量之比即肝脏指数。
1.5.5碳粒廓清试验
注射用墨汁由印度墨汁用生理盐水稀释4倍制成。小鼠最后一次处理后12 h,准确称取各组小鼠体质量,尾静脉注入注射用墨汁(0.01 mL/g),之后用玻璃毛细管于2 min(t1)、10 min(t2)分别从小鼠内眦静脉丛取血并定量吸取20 μL,立即将其加入到2 mL、质量分数为0.1%的Na2CO3溶液里。用分光光度计于650 nm波长下测2 min和10 min时的OD值,即OD1和OD2,以Na2CO3溶液作为空白对照。处死小鼠后,取出肝脏和脾脏并称质量。按下列公式计算小鼠碳廓清指数K和吞噬指数α:
K=(lgOD1-lgOD2)/(t2-t1);
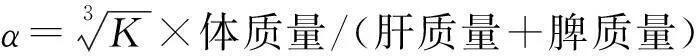
1.5.6迟发型变态反应
小鼠处理至第17天时,腹腔注射0.2 mL、2%(体积分数)的SRBC进行致敏。4 d后用数显游标卡尺测它们的左后足跖厚度,同一部位测定3次,取其平均值。然后用20 μL、20%(体积分数)的SRBC于测定部位进行皮下注射,1 d后再次测定并读取左后足跖厚度,取3次平均值。计算两次左后足跖的厚度差值。
1.5.7脾脏抗体生成细胞测定
小鼠处理至第17 d时,腹腔注射0.2 mL、5%(体积分数)的SRBC进行致敏。最后一天处理后12 h脱颈椎处死小鼠。将无菌摘取的脾脏过200目网筛,用磷酸缓冲液(PBS)洗涤3次,制备脾淋巴细胞悬液,调整脾淋巴细胞浓度为1×107mL-1。每组一个离心管,分别加0.2%(体积分数)的SRBC、脾淋巴细胞悬液、稀释10倍的豚鼠血清各0.5 mL;另一离心管以生理盐水代替补体作为空白对照,放于37 ℃水浴锅中1 h,冰浴终止反应。然后3 000 r/min离心5 min后取出吸取上清液,测吸光度A450 nm。
1.6 统计学处理
2结果与分析
2.1 多糖对小鼠免疫器官指数的影响
人工合成的氢化可的松也是天然存在的糖皮质激素,除具有抗炎、抗毒、抗休克作用外,还有免疫抑制作用。发状念珠藻胞外多糖对小鼠免疫器官指数的影响见表1。由表1可以看出:与正常对照相比,模型对照组小鼠脾脏指数和胸腺指数均显著下降(P<0.05),说明成功建立了免疫低下小鼠模型。同模型对照相比,阳性对照组小鼠肝脏指数和脾脏指数均显著提高(P<0.05),而胸腺指数没有明显提高;多糖低剂量小鼠肝脏指数和胸腺指数没有明显差异,而脾脏指数显著提高(P<0.05);多糖中、高剂量组小鼠3个器官指数均显著提高(P<0.05),并且随着多糖浓度的增大,小鼠器官指数逐渐增大,差异显著(P<0.05)。

表1 多糖对小鼠肝脏、脾脏和胸腺指数的影响 mg/g
注:同列中不同的字母表示差异显著(P<0.05),下同。
2.2 多糖对小鼠碳粒廓清指数和吞噬指数的影响
多糖对小鼠碳粒廓清指数和吞噬指数的影响见表2。由表2可见:与正常对照组相比,模型对照组小鼠廓清指数K和吞噬指数α显著降低(P<0.05);与模型对照组相比,阳性对照组小鼠廓清指数和吞噬指数均显著增大,多糖低、中、高剂量组小鼠的廓清指数和吞噬指数也显著增大(P<0.05);多糖低、中、高剂量之间的廓清指数差异显著(P<0.05),而吞噬指数差异不显著。

表2 多糖对小鼠碳粒廓清指数和吞噬指数的影响
2.3 多糖对小鼠迟发型变态反应的影响
发状念珠藻胞外多糖对小鼠迟发型变态反应的影响见表3。由表3可以看出:与正常对照组相比,模型对照组小鼠足跖增厚显著降低(P<0.05)。与模型对照组相比,阳性对照组小鼠足跖增厚值显著增加(P<0.05);多糖低、中剂量的足跖增厚值增加,但不显著,而多糖高剂量的足跖增厚值显著增加(P<0.05)。与阳性对照组相比,多糖中、高剂量组小鼠足跖增厚值差异不显著,而多糖低剂量组差异显著(P<0.05)。
2.4 多糖对小鼠脾脏B细胞分泌抗体能力的影响
多糖对小鼠脾脏B细胞分泌抗体能力的影响见表4。由表4可知:与正常对照组相比,模型对照组小鼠A450 nm值显著降低(P<0.05)。与模型对照组相比,阳性对照组,多糖低、中、高剂量组小鼠A450 nm值显著增大(P<0.05)。与阳性对照组相比,多糖低、中剂量组小鼠A450 nm差异显著(P<0.05),而多糖高剂量组的差异不显著。
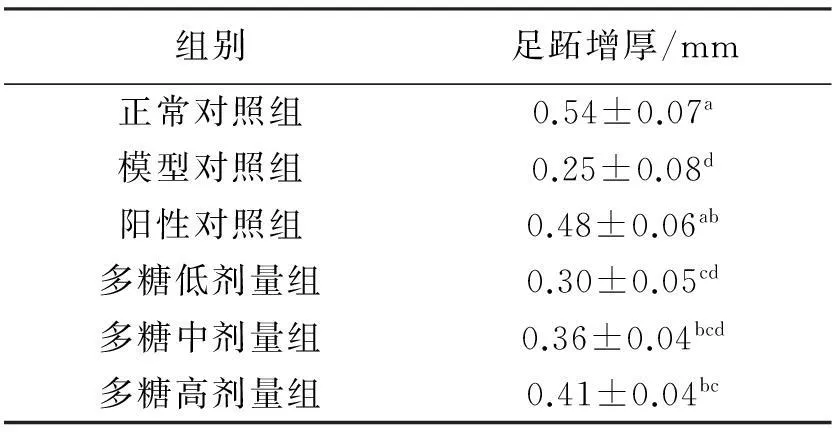
表3 多糖对小鼠迟发型变态反应的影响

表4 多糖对小鼠脾脏B细胞分泌抗体能力的影响
3讨论
脾脏与胸腺是机体首要的两个免疫器官,当注射氢化可的松等抑制免疫时,淋巴器官体积有缩小趋势;当喂入盐酸左旋咪唑等增强免疫时,淋巴器官体积增大,质量增加。因此,一定程度上,脾脏和胸腺指数可以表明机体的免疫功能强弱[8]。本文研究结果表明:发状念珠藻多糖中、高剂量使注射了氢化可的松的小鼠的脾脏指数与胸腺指数显著提高,说明发状念珠藻多糖对抑制免疫的小鼠淋巴器官有促进生长作用。
巨噬细胞吞噬能力很强,当碳粒等异物从小鼠尾部静脉注射进去后,可导致巨噬细胞迅速增多并将其吞噬,从而降低了血浆中异物的浓度,这是机体非特异性免疫防御的一项重要指标[9]。文献[10]研究提取出的厚壳贻贝多糖免疫活性时,发现多糖溶液对小鼠碳廓清有增强功效,且同样存在一定剂量依赖关系。文献[11]对马尾藻多糖免疫活性进行了研究,结果显示多糖使小鼠吞噬指数显著提高,增强了巨噬细胞杀伤能力。本试验中,发状念珠藻多糖组小鼠的廓清指数和吞噬指数明显大于模型对照小鼠,证明发状念珠藻多糖对抑制免疫的小鼠巨噬细胞吞噬能力有增强作用。
定量溶血分光光度法,由溶血空斑试验的原理衍化得来,反映机体的体液免疫水平,其结果用吸光度表示,抗体产生量与其成正比。文献[12]研究发现枸杞粗多糖可使SAMP8脾脏抗体形成细胞数显著增多。而本试验中,发状念珠藻多糖组在450 nm处的吸光度明显比模型对照组大,说明发状念珠藻多糖有助于小鼠脾脏B细胞生成并分泌抗体,体液免疫活性增强。
综上所述,发状念珠藻胞外多糖在一定程度上对小鼠的机体免疫活性有提高的功效,并表现出剂量效应关系。
参考文献:
[1]Ding Z,Jia S R,Han P P,et al.Effects of Carbon Sources on Growth and Extracellular Polysaccharide Production of Nostoc Flagelliforme Under Heterotrophic High-cell-density Fed-batch Cultures[J].J Appl Phycol,2013(25):1017-1021.
[2]Chen X F,Jia S R,Wang Y,et al.Biological Crust ofNostocFlagelliforme(Cyanobacteria) on Sand Bed Materials[J].J Appl Phycol,2011,23:67-71.
[3]Yu H F,Jia S R,Dai Y J.Accumulation of Exopolysaccharides in Liquid Suspension Culture ofNostocFlagelliformeCells[J].Appl Biochem Biotechnol,2010,160:552-560.
[4]Kanekiyo K,Lee J B,Hayashi K,et al.Isolation of an Antiviral Polysaccharide Nostoflan from a Terrestrial CyanobacteriumNostocFlagelliforme[J].Journal of Narural Products,2005,68(7):1037-1041.
[5]李一当.发状念珠藻多糖的提取、分离与结构研究[D].西安:陕西科技大学,2008.
[6]林永贤,于海峰,许鹏,等.发状念珠藻多糖的提取及性质研究[J].现代食品科技,2007,23(5):34-36.
[7]陈雪峰,李一当,贾士儒.发状念珠藻多糖的提取、纯化鉴定及理化特性研究[J].食品与发酵工业,2008,34(10):174-177.
[8]石磊,高欣,赵艳威,等.岩藻多糖对小鼠免疫功能的影响[J].食品研究与开发,2012,33(12):194-196.
[9]赵海.黑木耳多糖对免疫功能及其抗炎作用的实验研究[J].吉林中医药,2005,25(8):54-55.
[10]姚滢,魏江洲,王俊,等.厚壳贻贝多糖的提取和免疫学活性研究[J].第二军医大学学报,2005,26(8):896-899.
[11]王士长,陈静,潘健存,等.马尾藻多糖的提取及其免疫活性[J].食品科学,2006,27(9):257-260.
[12]齐春会,张永祥,赵修南,等.枸杞粗多糖的免疫活性[J].中国药理学与毒理学杂志,2001,15(3):180-184.


