大孔树脂共吸附固定葡聚糖-脂肪酶催化合成香茅酯

大孔树脂共吸附固定葡聚糖-脂肪酶催化合成香茅酯
于敏,周海燕,任立伟,蒋振华,周华,韦萍
(南京工业大学生物与制药工程学院,江苏南京211800)
摘要:以大孔树脂为载体对脂肪酶和葡聚糖进行共吸附固定,考察葡聚糖的共吸附对脂肪酶固定化效果的影响,并应用所得固定化酶在无溶剂体系催化合成月桂酸香茅酯。结果表明:在固定化过程中添加终质量浓度为0.75 mg/mL的葡聚糖可提高固定化酶酶活回收率,使用该固定化酶在无溶剂体系催化月桂酸与香茅醇酯化,酶的催化效率及操作稳定性均有提高。在底物月桂酸与香茅醇物质的量的比为1∶1,加入1 U的固定化脂肪酶,在50 ℃时无溶剂体系中反应10 h,反应的酯化率达95.3%。添加终质量浓度为0.75 mg/mL的T-20及T-40(葡聚糖相对分子质量为2×10`4和4×10`4)制备的固定化酶可将到达95%酯化率的反应时间缩短至6 h,其中添加T-40的固定化酶经10次连续催化后,仍保持75%以上的催化活性。
关键词:脂肪酶;葡聚糖;共固定;无溶剂;月桂酸香茅酯
doi:10.3969/j.issn.1672-3678.2015.06.004
收稿日期:2014-04-13
基金项目:国家重点基础研究发展计划(973计划)(2009CB724706)
作者简介:于敏(1991—),女,江苏如皋人,硕士研究生,研究方向:工业生物催化;周华(联系人),教授,E-mail:zhouhua@njtech.edu.cn
中图分类号:Q814
文献标志码:A
文章编号:1672-3678(2015)06-0018-06
Abstract:Lipase and dextran were co-immobilized on a macroporous resin synchronously,the influence on co-immobilization of dextran was investigated and the immobilized lipase was used as the catalyst for the synthesis of citronellyl laurate. As a result,the co-immobilization of dextran with final concentration of 0.75 mg/mL during the immobilization procedure improved enzyme activity recovery and thermal stability,the esterification rate reached 95.3% after 10 h,when 1 U of immobilized lipase was dosed and the reaction was carried out at 50 ℃ in the solvent-free system with the molar ratio of lauric acid to citronellol of 1∶1. More importantly,the reaction time could be further shortened to 6 h by adding dextran T-20 (Mw=2×10`4) and T-40 (Mw=4×10`4) with final concentration of 0.75 mg/mL during the immobilization procedure,and the relative activity of immobilized lipase was still above 75% after ten recycles.
Keywords:lipase; dextran; co-immobilization; solvent-free; citronellyl laurate
Co- immobilization of dextran and Candida rugosa lipase on macroporous resin and synthesis of citronellyl esters
YUMin,ZHOUHaiyan,RENLiwei,JIANGZhenhua,ZHOUHua,WEIPing
(CollegeofBiotechnologyandPharmaceuticalEngineering,NanjingTechUniversity,Nanjing211800,China)
糖类物质是生物机体的重要组成成分和能量供应者,自然界中存在很多活性多糖,已被应用于治疗肿瘤及增强免疫力等方面。除此之外,糖类物质也被用作酶、疫苗等生物活性材料的保护剂。其中,海藻糖由于其极佳的保护效果已引起国内外学者的关注,海藻糖对酶活性的保护机制主要有水替代学说、玻璃态假说及优先排阻学说[2-4]。杨基础等研究了海藻糖对纤维素酶在干燥和存放过程中的保护作用,发现海藻糖能有效地减少干燥过程中酶的热失活,而且能提高纤维素酶存放过程中的热稳定性。杨小民等发现在高温下,葡聚糖对纤维素酶也有明显的保护作用。柴丽红等的研究也证明海藻糖及葡聚糖均能提高乳链菌肽热处理后的稳定性。所以,除已被深入研究的海藻糖外,葡聚糖在酶活性保护作用方面也极具潜力。
酶的固定化技术经过近几十年的研究,从固定化材料到固定化方法均已取得较大的发展[8-10],但固定化酶在活性、稳定性、工业应用性等方面仍存在一些问题。已有学者尝试在酶固定化及催化过程中添加一定浓度的糖醇类物质对酶进行保护以提高固定化酶的性能[11-12],现有的方法是先将酶吸附或共价于固定化载体再浸渍小分子二糖后烘干,这种固定化方法的不足之处是糖与载体的相互作用不明确且存在容易脱落等缺点。Jiang等[13]在非水相催化合成植物甾醇酯的过程中添加微量海藻糖溶液,显著提高了固定化脂肪酶的催化效率及操作稳定性,但海藻糖来源有限,其价格较高,且每次反应前均需要重新添加,增加了成本及工作量。
笔者以大孔树脂为载体,同时对脂肪酶和葡聚糖进行吸附,尝试通过最简单的方法将酶与大分子多糖共同固定于孔道微环境,使两者在非水相催化过程中可稳定存在于载体内,以进一步提高脂肪酶在无溶剂体系催化香茅醇与脂肪酸酯化反应能力,并提高固定化酶的催化稳定性,建立一种简单、高效的固定化方法。
1材料与方法
1.1 材料与仪器
Candida rugosalipase(CRL),Sigma公司;大孔树脂NKA,南开大学化工厂;正己烷(AR)、月桂酸(CP),国药集团化学试剂有限公司;葡聚糖(相对分子质量为0.6×104、2×104、4×104、7×104,>98%),美国Pharmacia公司;对硝基苯基乙酸酯(AR),日本TCI公司;β-香茅醇(95%)、丁酸丁酯(99.5%,色谱纯),阿拉丁试剂。
THZ-C型摇床,江苏太仓实验设备厂;BS124S型电子天平,德国赛多利斯公司;Agilent6890型气相色谱仪,美国安捷伦公司;DZF-6020型真空干燥箱,上海博迅实业公司;NicoletiS5型傅里叶红外光谱仪,ThermoFisher公司。
1.2 脂肪酶的固定化
按照供应商提供的方法对大孔树脂NKA进行预处理。将适量CRL用pH5.0(0.02mol/L)的磷酸盐缓冲液配制成质量浓度为4mg/mL的酶溶液,4 ℃、10 000r/min离心5min以去除不溶物,取5mL上清液并添加不同相对分子质量的葡聚糖(0.6×104、2×104、4×104、7×104,分别简写为T-6、T-20、T-40、T-70)至终质量浓度分别为0.1、0.3、0.75、1.2 和1.5mg/mL,混匀后加入0.1g载体。30 ℃吸附5h后,用砂芯漏斗抽滤提取固定化酶,并用5mLpH5.0(0.02mol/L)的缓冲液冲洗固定化酶数次。再用少量pH7.0(0.02mol/L)的磷酸盐缓冲液浸泡固定化酶20min后,将固定化酶于30 ℃真空干燥48h,利用酶的“pH记忆性”将脂肪酶的构象调至最适宜催化的状态。
1.3 蛋白及葡聚糖装载量测定
采用Bradford法[14]测定蛋白装载量,以牛血清白蛋白作为标准蛋白绘制标准曲线,测定原酶液、固定化后余液和洗脱液中的酶蛋白含量。酶蛋白装载量(Pa)
Pa=(ρi-ρf)Vi/ m
(1)
式中:ρi表示溶液中固定化前酶蛋白的初始质量浓度(mg/mL); ρf表示固定化过程中未被结合的酶蛋白的最终质量浓度(mg/mL);Vi表示加入酶液的体积(mL);m表示载体质量(g)。
葡聚糖装载量采用蒽酮-硫酸法测定[15]。
1.4 固定化酶酶活测定
以对硝基苯基乙酸酯(p-NPA)为底物,采用比色法测定游离和固定化脂肪酶的水解活性[16],配制浓度为0.05mol/L的 p-NPA的乙腈溶液,取5mL加入到35mL的磷酸缓冲液(pH7.0,0.02mol/L)中,加入适量固定化酶或游离酶。37 ℃反应10min后,迅速取出1mL上清液并进行适当稀释,在410nm处测吸光值。空白以空载体代替固定化酶。在37 ℃、pH7.0的条件下,1min内水解产生1μmolp-NP所需要的酶量定义为一个活力单位(U)。酶活回收率为固定化酶总活力与加入游离酶酶活之比[17]。
1.5 固定化酶热稳定性测定
将游离酶和固定化酶分别溶解或悬浮于pH5.0的磷酸盐缓冲液中,在50 ℃水浴中分别放置0.5、1、2、3、4和5h后,迅速冷却至室温。再测定经过热处理的游离酶和固定化酶的相对活性。
1.6 固定化酶 pH稳定性测定
以比色法测定脂肪酶水解活性为基础,改变部分反应条件测定固定化酶水相催化最适pH。其他条件不变,将底物p-NPA的乙腈溶液分别加入到pH4.0~8.0(0.02mol/L)的缓冲液中,以此为反应液分别测定游离酶和固定化酶的水解活性。
1.7 月桂酸香茅酯的合成及检测
向10mL具塞锥形瓶中加入2mmolβ-香茅醇和2mmol月桂酸,50 ℃摇床中预热,待酰基供体熔解后加入1U干燥后的固定化脂肪酶(约0.05g)和4μL去离子水,摇床转速200r/min,50 ℃反应2h后,加入0.5g的4Å分子筛,间隔一定时间取样10μL,用790μL正己烷稀释,加入200μL50mmol/L的丁酸丁酯作为内标,0.22μm有机滤膜过滤。采用Agilent6890型气相色谱仪测定香茅醇的转化率,色谱条件如下:载气N2;检测器FID,290 ℃;气化室240 ℃;色谱柱PEG-20M(15m×0.25mm×0.25μm);柱室温度50 ℃,维持2min,以20 ℃/min升温至210 ℃并维持3min。通过内标法计算香茅醇的含量。
酯化率=[1-(m2/m1)]×100%
(2)
式中:m1、m2分别为反应前后反应液中香茅醇的质量。固定化酶的回收方法参照文献[18]。
1.8 红外图谱分析
对脂肪酶CRL、葡聚糖及葡聚糖处理后的CRL进行分析。采用KBr压片法(质量比1∶100),图谱采集范围为400~4 000cm-1,图谱以透过率的方式表示。
2结果与讨论
2.1 大孔树脂对葡聚糖的吸附效果
分别添加不同浓度及不同分子量的葡聚糖,考察大孔树脂对葡聚糖的吸附能力,结果如图1所示。由图1可知,随着葡聚糖浓度的增加,进入大孔树脂的糖量也随之上升,当糖质量浓度达0.75mg/mL时,载体内的糖装载量已接近饱和。大孔树脂NKA对T-20及T-40的装载量高于对T-6及T-70的装载量,这可能是由于疏水性大孔树脂NKA对分子量较小、亲水性相对较强的T-6吸附能力较弱,而T-70则因其分子体积较大,进入NKA孔道相对困难所致。

图1 大孔树脂对葡聚糖的吸附效果 Fig.1 Adsorption capacity of NKA to different dextrans
2.2 葡聚糖浓度对蛋白吸附量的影响
在制备固定化酶的过程中,分别添加不同浓度的葡聚糖T-20,考察共吸附固定过程中葡聚糖的装载量及其对蛋白装载量的影响,结果如图2所示。

图2 共固定对葡聚糖及蛋白装载量的影响 Fig.2 Effects of co-immobilization to loading amount of both lipase and dextran
由图2可知,蛋白装载量未受到明显影响,但是糖的装载量与NKA仅吸附葡聚糖时相比,几乎削减一半。这可能是由于被吸附的葡聚糖填充于酶与大孔树脂的空隙内,或者葡聚糖通过氢键等非共价作用力均匀结合于游离脂肪酶分子的外表面后,随脂肪酶一同被大孔树脂吸附。在共吸附过程中,葡聚糖质量浓度从0.1增至0.75mg/mL时,大孔树脂对糖的吸附量呈明显增加趋势,糖质量浓度大于0.75mg/mL时,共吸附的糖量仅有略微上升,这与NKA仅吸附葡聚糖趋势相同,结合经济角度考虑,0.75mg/mL的葡聚糖浓度是与酶共吸附的最适浓度。
2.3 葡聚糖对固定化酶酶活的影响
考察葡聚糖对固定化酶酶活回收率的影响,结果如表1所示。由表1可知,当糖质量浓度为0.3mg/mL时,T-6、T-20、T-40和T-70的装载量分别为(5.12±0.34)、(7.55±0.48)、(6.05±0.36)和(4.85±0.54)mg/g,仅有T-20和T-40的酶活回收率高于未与葡聚糖共吸附的固定化酶酶活回收率(30.01±1.14)%。当糖质量浓度为0.75mg/mL时,T-6、T-20、T-40和T-70的装载量分别为(10.49±0.23)、(15.11±0.43)、(15.25±0.76)、(10.23±0.35)mg/g,固定化酶酶活回收率均明显提高。由此可见,葡聚糖的装载量是影响酶活回收率的重要因素,在一定范围内随着葡聚糖装载量的增加,固定化酶酶活回收率也相应提高。
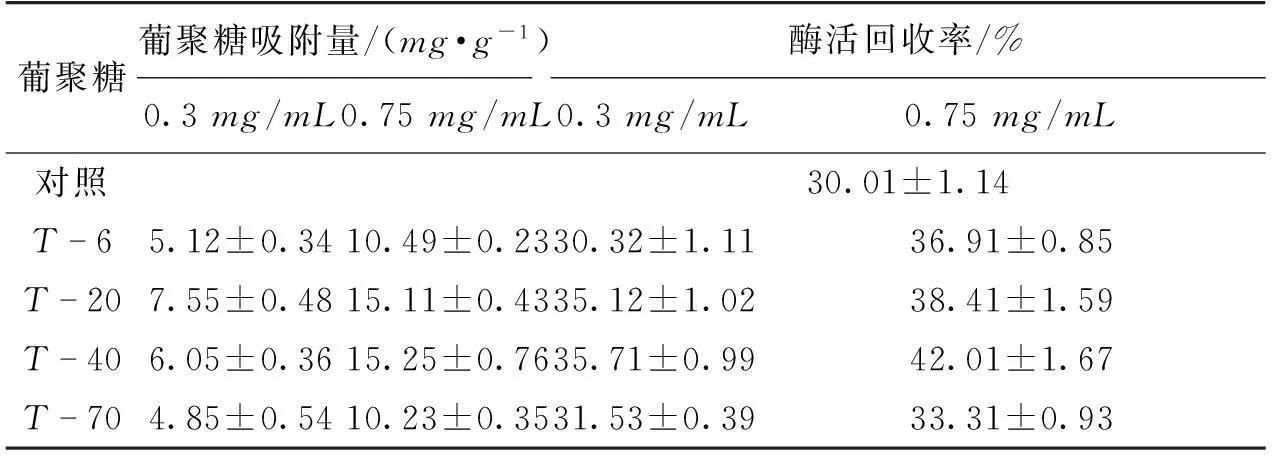
表1 不同葡聚糖对酶吸附量和酶活回收率的影响
2.4 葡聚糖共吸附对脂肪酶热稳定的影响
热稳定性是固定化酶应用的重要条件,选取与0.75mg/mL葡聚糖T-20共吸附固定的脂肪酶进行热稳定性测定,50 ℃的热失活曲线如图3所示。由图3可知,在1h内,游离酶活性迅速降低。对酶进行固定化后,脂肪酶CRL的稳定性有所提高,当将T-20与酶进行共固定后,固定化酶的热稳定性得到了明显提高,表明葡聚糖的共吸附对脂肪酶CRL产生了良好的保护作用。
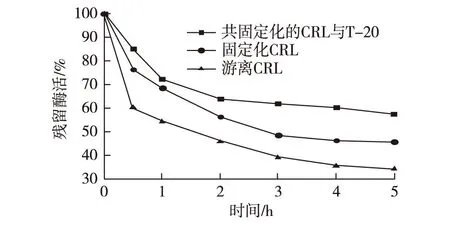
图3 脂肪酶热失活曲线 Fig.3 Thermal deactivation of CRL
2.5 葡聚糖共吸附对脂肪酶 pH稳定性的影响
考察游离酶和固定化酶的pH稳定性,结果见图4。由图4可知,游离酶和固定化酶的最适反应pH均为7.0,当与葡聚糖共吸附固定后,脂肪酶对环境pH的敏感度较游离酶和普通固定化酶而言有明显降低,说明葡聚糖的引入有利于增强脂肪酶的pH耐受性。
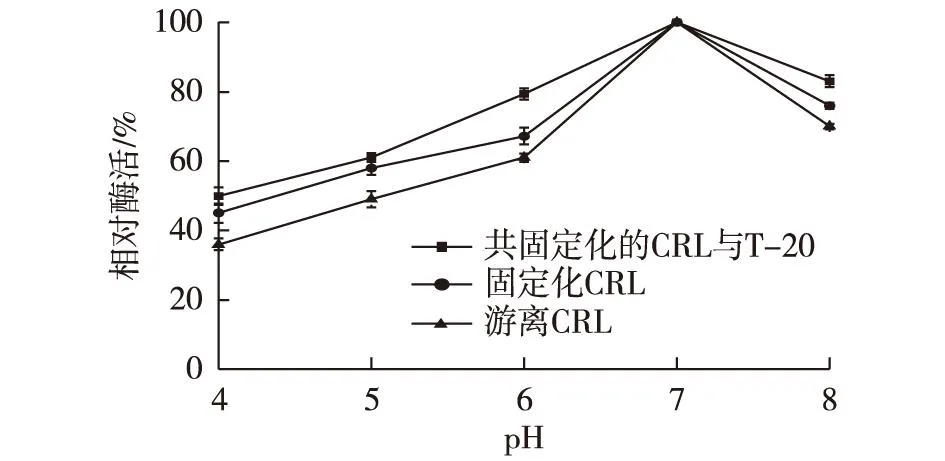
图4 固定化酶和游离酶的最适反应pH Fig.4 Optimized pH value of free and immobilized lipase
2.6 葡聚糖共吸附固定化脂肪酶催化合成月桂酸香茅酯
以香茅醇和月桂酸为模式底物,以大孔树脂共吸附固定的葡聚糖-脂肪酶为催化剂合成月桂酸香茅酯,并分别考察葡聚糖的相对分子质量(2.0×104、4.0×104)及葡聚糖质量浓度(0.3、0.75mg/mL)对固定化酶催化性能的影响。
2.6.1葡聚糖共固定化对催化速率的影响
分别选择葡聚糖质量浓度为0.3mg/mL和0.75mg/mL制备的固定化酶,考察共固定于载体的不同相对分子质量的葡聚糖对固定化酶无溶剂体系催化合成月桂酸香茅酯的影响,结果如图5所示。

图5 葡聚糖与脂肪酶共吸附固定对催化香 茅醇酯化反应影响 Fig.5 Time course of esterification catalyzed by co-immobilized lipase with 0.3 mg/mL and 0.75 mg/mL dextran
由图5可知,葡聚糖共吸附固定化的脂肪酶几乎均可提高反应速率。主要原因可能是葡聚糖表面的非共价作用力促进了脂肪酶催化活性中心周围底物浓度增加[19],并且葡聚糖与脂肪酶共存于大孔树脂孔道内后,可帮助维持酶活性构象所需的“必需水”,且能够使脂肪酶非水相催化所处的微环境更接近生物体内亲水性、较为拥挤的自然状态[20]。因此,葡聚糖的共固定可提高该体系中脂肪酶的催化效率。与质量浓度为0.3mg/mL的T-20及T-40共吸附制备的固定化酶催化到达反应平衡的时间为8h,当固定化过程中葡聚糖质量浓度增加到0.75mg/mL时,反应6h即可到达反应平衡,说明影响催化效率的主要因素是葡聚糖的装载量,在一定范围内,葡聚糖装载量越大,对脂肪酶催化活性的提高也越显著,但前文研究结果已证明添质量浓度为0.75mg/mL的葡聚糖几乎已达到大孔树脂对其的吸附饱和状态,所以无法通过进一步提高葡聚糖装载量来获得更高的催化活性。
2.6.2葡聚糖共吸附固定化脂肪酶操作稳定性
在底物物质的量比为1∶1、温度为50 ℃,转速为200r/min、加入酶活为1U的条件下,使用不含葡聚糖及共吸附有葡聚糖的脂肪酶重复催化无溶剂体系月桂酸香茅酯合成反应,考察操作稳定性,结果如图6所示。
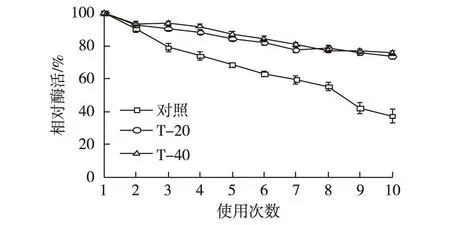
图6 固定化酶的重复利用能力 Fig.6 Reusability of different immobilized lipase
由图6可知,固定化脂肪酶连续10批次催化后,酶活已降至40%左右。而共固定有葡聚糖T-20和T-40的固定化脂肪酶酶活分别维持在70%和75%以上,证明葡聚糖与酶共固定不仅可以提高脂肪酶的催化活性,还可以增加固定化酶的操作稳定性。NKA具有较大的孔径,催化过程中难免有部分脂肪酶从孔道中泄漏至反应液,而葡聚糖的引入使载体孔道内变得更为拥挤,在一定程度上可防止酶分子的流失。此外,葡聚糖共固定化脂肪酶单批次催化反应所需时间的缩短,可减少多次重复利用过程中酶热失活因素的累积。因此,葡聚糖共固定化脂肪酶能够在无溶剂体系催化合成香茅酯的过程中展现出更高的稳定性。
2.7 红外图谱表征结果


图7 脂肪酶CRL、葡聚糖T-20及其混合物的红外图谱 Fig.7 Infrared spectra of CRL,dextran T-20 and their associated compound
葡聚糖的红外吸收峰在3 390cm-1处为O—H的伸缩峰,因易缔合产生氢键而峰强度大且宽;2 930cm-1波数左右为C—H伸缩峰; 1 480~1 300cm-1处为O—H弯曲峰,振动偶合产生多重分裂峰;1 300~1 000cm-1处为C—O伸缩峰,不对称结构振动产生了多重分裂峰,1 160cm-1处为C—O—C对称伸缩振动,900cm-1波数左右为—OH的变形振动峰。
葡聚糖酶混合物的红外吸收峰在3 359cm-1处的N—H因氢键形成发生红移,波数降低至3 337、2 934cm-1处的C—H伸缩振动向低波数移动20cm-1左右,峰带变宽,葡聚糖保护后酶的红外吸收峰与未保护的明显不同,也与葡聚糖的明显不同。葡聚糖2 930cm-1的C—H伸缩峰向低波数移动,1 360cm-1的—CH2剪式振动向低波数移动20cm-1左右,900cm-1左右的—OH变形振动峰波形也发生了较大改变。说明酶和葡聚糖之间有键合作用或相互作用。
3结论
笔者将酶与大分子多糖共同固定于大孔树脂NKA,讨论了不同相对分子质量葡聚糖对酶固定化过程及催化性能的影响。结果表明:在固定化过程中,大孔树脂对中等相对分子质量的葡聚糖T-20及T-40吸附效果较好,加入终质量浓度为0.1~1.5mg/mL的葡聚糖并不会明显影响蛋白装载量,且随着糖装载量的增大,所制备的固定化酶酶活回收率也相应提高。利用该固定化酶在50 ℃的温度下催化合成月桂酸香茅酯可获得95%以上的酯化率,与未添加葡聚糖的固定化酶相比,到达反应平衡的时间最多可缩短4h,连续10批次催化后仍可保持70%以上的催化活性,表明葡聚糖的共吸附固定对酶的活性起到了良好的保护作用,为开发简单、高效的酶固定化方法提供了实验支撑。
参考文献:
[1]KangMS,JangH,KimMC,etal.Developmentofastabilizerforlyophilizationofanattenuatedduckviralhepatitisvaccine.PoultSci,2010,89(6):1167-1170.
[2]Lopez-DiezEC,BoneS.Theinteractionoftrypsinwithtrehalose:aninvestigationofproteinpreservationmechanisms.BiochimBiophysActa,2004,1673(3):139-148.
[3]AlptekinA,MehmetT.Isothermaldesiccationandvitrificationkineticsoftrehalose-dextransolutions.Langmuir,2004,20(13):5521-5529.
[4]LuisE,CarolinaS,NormaS.Stabilityofenzymesandproteinsindriedglassy:effectofsimulatedsunlightconditions.BiotechnolProg,2004,20(4):1220-1224.
[5]杨基础,董燊,杨小民.海藻糖对固定化酶的保护作用.化工学报,2000,51(2):193-197.
[6]杨小民,杨基础.不同糖对纤维素酶保护的机理研究.清华大学学报:自然科学版,2000,40(2):55-58.
[7]柴丽红,李忻怡,王宏元.海藻糖和葡聚糖对Nisin热稳定性的保护效应.食品研究与开发,2011,32(1):38-41.
[8]LaurentN,HaddoubR,FlitschSL.Enzymecatalysisonsolidsurfaces.TrendsBiotechnol,2008,26(6):328-337.
[9]汪海萍,魏荣卿,沈斌,等.双醛淀粉柔性固定木瓜蛋白酶研究.生物加工过程,2004,2(1):25-29.
[10]王伟,朱凯,杨波,等.表面改性SBA-15材料固载猪胰脂肪酶.生物加工过程,2012,10(2):40-44.
[11]NoelM,CombesD.Rhizomucor mieheilipase:differentialscanningcalorimetryandpressure/temperaturestabilitystudiesinpresenceofsolubleadditives.EnzymeMicrobTech,2003,33(2):299-308.
[12]NoureddiniH,GaoX,JoshiS.ImmobilizationofCandida rugosalipasebysol-gelentrapmentanditsapplicationinthehydrolysisofsoybeanoil.JAmOilChemSoc,2003,80(11):1077-1083.
[13]JiangZH,YuMin,RenLW,etal.Synthesisofphytosterolesterscatalyzedbyimmobilizedlipaseinorganicmedia.ChinJCatal,2013,34(12):2255-2262.
[14]BradfordMM.Arapidandsensitivemethodforthequantitationofmicrogramquantitiesofproteinutilizingtheprincipleofprotein-dyebinding.AnalBiochem,1976,72:248-254.
[15]匡扶,朱照静,马俐安,等.葡聚糖T20作为白芨多糖含量测定标准品可行性研究.重庆医科大学学报,2008,33(5):570-574.
[16]OzyilmazG.TheeffectofspacerarmonhydrolyticandsyntheticactivityofCandida rugosalipaseimmobilizedonsilicagel.JMolCatalB:Enzymatic,2009,56(4):231-236.
[17]喻本青,闫云君,刘涛,等.海藻酸-SiO2杂化凝胶固定化洋葱伯克霍尔德菌脂肪酶的研究.生物加工过程,2010,8(1):16-22.
[18]任立伟,徐田,蒋振华,等.无溶剂体系脂肪酶动力学拆分2-辛醇及产物的非均相共沸蒸馏提取.生物加工过程,2014,12(4):55-59.
[19]MintonAP.Implicationsofmacromolecularcrowdingforproteinassembly.CurrOpinStrucBiol,2000,10(1):34-39.
[20]WangAM,ZhouC,WangH,etal.Covalentassemblyofpenicillinacylaseinmesoporoussilicabasedonmacromolecularcrowdingtheory.ChinJChemEng,2007,15(6):788-790.
(责任编辑荀志金)

