层积处理对草果种子萌发的影响
, ,2, ,
(1.广西药用植物园/广西药用资源保护与遗传改良重点实验室, 南宁 530023;2.湖北民族学院,林学园艺学院, 湖北 恩施 445000)
草果(AmomumtsaokoCrevost et Lemarie)为广西道地药材草果的基源植物,隶属于姜科(Zingiberaceae)豆蔻属,产于云南、广西、贵州等省区[1-2]。以干燥成熟果实入药,具有燥湿温中,截疟除痰之效,用于寒湿内阻,脘腹胀痛,痞满呕吐,疟疾寒热和瘟疫发热[3]。此外,草果是传统的常用辛香料,是药食两用大宗中药材[4]。目前,有关草果的研究主要集中在化学成分及药理研究方面[5],对其种子繁育方面的研究较少。在生产上,草果以种子繁殖为主,但直接播种的草果种子发芽缓慢,萌发率低,出苗不整齐[6];草果种子采收后不能干燥贮藏,种子干燥脱水后容易失去活力。已有研究证实草果种子存在休眠,是其发芽率低的主要原因[7],但迄今为止尚未找到有效的解除草果种子休眠的方法。本试验结合草果种子不耐干藏的特点,研究不同的层积处理方式对草果种子萌发的影响,以期找到草果种子休眠解除最佳的层积处理方法,为其规范化栽培提供参考依据。
1 材料与方法
1.1 材 料
供试草果种子来自于广西那坡县大红草果专业种植农场。采集新鲜成熟、无病虫害的草果果实,室温下堆放2 d后剥除果皮,将种子置于清水中搓洗,去除果肉及剔除杂质、瘪粒后,将草果种子置于室内通风阴凉处晾干备用。
1.2 方 法
1.2.1 种子生活力检测
生活力测定采用氯化三苯基四唑染色法。将种子置于25 ℃恒温箱内吸胀12 h后,用解剖刀将胚小心取出,浸在盛有1.0%TTC溶液的培养皿中,于35 ℃黑暗条件下染色,24 h后统计染色情况,确定种子有无生活力。每个培养皿放置25粒种子,4次重复。
1.2.2 温度和光照试验
设置20,25,30 ℃恒温和15 ℃/25 ℃、20 ℃/30 ℃变温共5个温度条件,并在每个温度下设置交替光照(12 h光/12 h暗)和连续黑暗2种光照条件。以珍珠岩为萌发基质,将种子置于不同的温度及光照条件下培养,28 d后统计萌发率,以胚根突破种皮记为萌发。每处理设4次重复,每重复50粒种子。
1.2.3 新鲜种子层积处理
将新鲜种子与湿珍珠岩以1∶3的比例混合后分成4份,密封于自封袋中。将2份种子分别放入5 ℃冰箱和15 ℃培养箱中进行层积,层积时间设为30,60,90 d和120 d。另外2份种子进行变温层积处理,处理条件分别为5 ℃ 30 d+15 ℃ 30 d,15 ℃ 30 d+5 ℃ 30 d。以珍珠岩为萌发基质,将层积后的种子置于20,25,30 ℃培养箱及15 ℃/25 ℃、20 ℃/30 ℃培养箱中,在12 h光/12 h暗的交替光照条件下进行培养,28 d后统计其萌发率。每处理4个重复,每重复50粒种子。以新鲜种子为对照。
1.2.4 种子脱水后层积
采用硅胶干燥法对种子进行脱水处理,脱水时间分别设为0,6,12,18,24,48 h。脱水后的种子含水量用烘干称重法进行测定[8]。将种子置于(103±1)℃鼓风干燥箱中烘17 h,在干燥器中冷却后称重。以样品烘干前后的重量差值除以鲜质量计算种子含水量,4次重复,每重复10粒种子。脱水后获得的种子含水量分别为34.0%、20.6%、18.7%、15.3%、10.2%和5.4%。将脱水后的种子与湿珍珠岩按1∶3体积比混合,密闭于自封袋中,在15 ℃恒温培养箱中放置90 d后取出,以珍珠岩为基质进行萌发测试,28 d后统计其萌发率。每处理4次重复,每重复50粒种子。以未脱水的种子为对照。
1.2.5 数据统计分析
所有数据均使用SPSS 13.0进行统计分析,萌发率数据在统计分析前先进行反正弦转换。使用One-way ANOVA进行单因素方差分析,用LSD法进行检验。
2 结果与分析
2.1 种子生活力测定
用TTC法测定草果种子生活力达93.0%±1.7%,说明草果新采收种子具有很高的萌发潜力。
2.2 新鲜种子的萌发率
由图1可知,新鲜草果种子仅在25 ℃、15 ℃/25 ℃和20 ℃/30 ℃下萌发,且在25 ℃、15 ℃/25 ℃下的萌发率极低,在20 ℃/30 ℃变温条件下萌发率较高,为31.0%。交替光照条件下草果的种子萌发率虽高于全暗条件下的种子萌发率,但方差分析结果表明,两者之间差异不显著,说明草果种子为光不敏感型种子。草果种子生活力显著高于萌发率,说明种子具有显著的休眠现象。
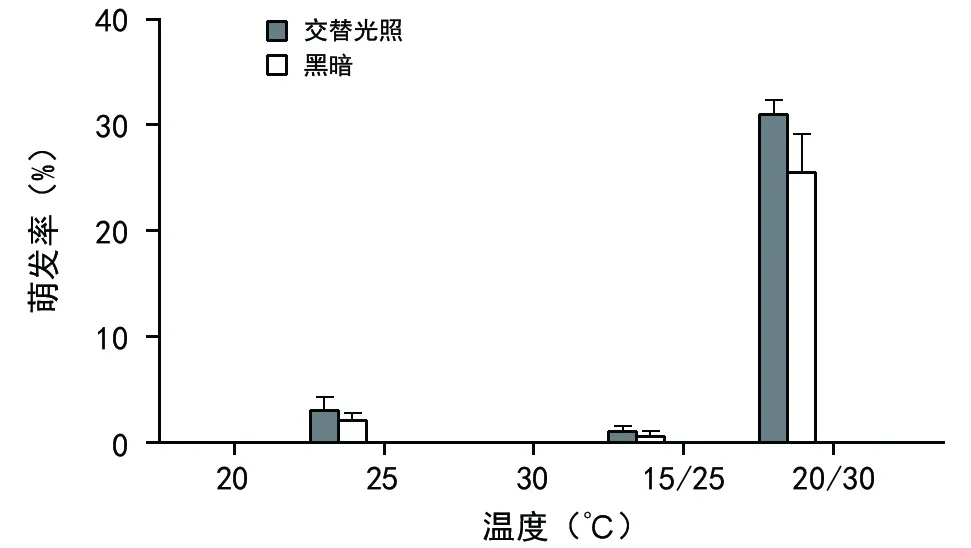
图1 不同温度和光照条件下草果种子的萌发率
2.3 层积对草果种子萌发的影响
2.3.1 恒温层积对种子萌发的影响
由表1可知,低温层积和暖温层积均能打破草果种子休眠。在20 ℃/30 ℃变温条件下,草果种子萌发率随低温层积或暖温层积时间的延长,呈现出先上升后下降的趋势。低温层积至30 d时,草果种子萌发率为40.5%,与对照相比差异显著;随着层积时间的延长,种子休眠得到进一步解除,层积至90 d时萌发率最高,达64.0%,但层积至120 d后,萌发率显著下降。暖温层积至30 d时,草果种子萌发率为42.5%,与对照相比差异显著;随着层积时间的延长,种子萌发率进一步提高,层积至90 d时萌发率最高,达82.0%。暖温层积至120 d,草果种子萌发率虽有所下降,但仍维持在较高的萌发水平,为71.0%。此外,暖温层积还能促进草果种子在其他温度下的萌发。在25 ℃恒温条件下,暖温层积至90 d时,草果种子萌发率有所提高,为10.5%,与对照相比差异显著。
表1 恒温层积对草果种子萌发的影响

层积方式层积时间(d)种子萌发率(%)20℃25℃30℃15℃/25℃20℃/30℃ck00a3.0b0a1.0a31.0d低温层积300a1.5b0a1.5a40.5c600a3.0b0a3.0a52.0c901.5a4.5ab1.5a6.0a64.0b1200a1.0b0a2.0a45.5c暖温层积300a3.0b0a1.0a42.5c600a3.0b1.5a3.0a71.0b900a10.5a0a3.0a82.0a1200a0b0a1.0a70.0b
注:同列不同字母表示差异显著(p≤0.05)。下同。
2.3.2 变温层积对种子萌发的影响
变温层积对草果种子休眠的解除也起到一定的促进作用(表2)。20 ℃/30 ℃培养温度下,2种变温层积方式均促进了种子萌发,层积后萌发率分别达54.0%和53.5%,与对照相比差异显著。2种变温层积方式还促进草果种子在15 ℃/25 ℃下萌发,层积后种子萌发率分别为14.0%和11.0%。此外,5 ℃ 30 d+15 ℃ 30 d变温层积处理提高了草果种子在25 ℃下的萌发率,但15 ℃ 30 d+5 ℃ 30 d的变温条件并未能提高相同培养温度下的萌发率。
表2 变温层积对草果种子萌发的影响
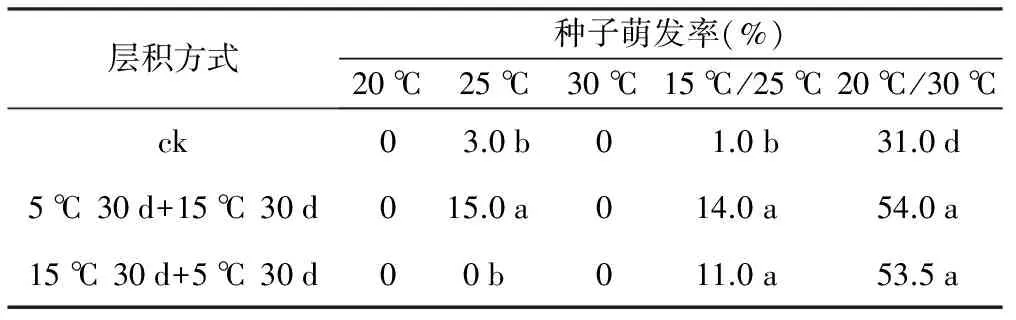
层积方式种子萌发率(%)20℃25℃30℃15℃/25℃20℃/30℃ck03.0b01.0b31.0d5℃30d+15℃30d015.0a014.0a54.0a15℃30d+5℃30d00b011.0a53.5a
2.3.3 脱水后层积对种子萌发的影响
表3 脱水后层积对种子萌发的影响
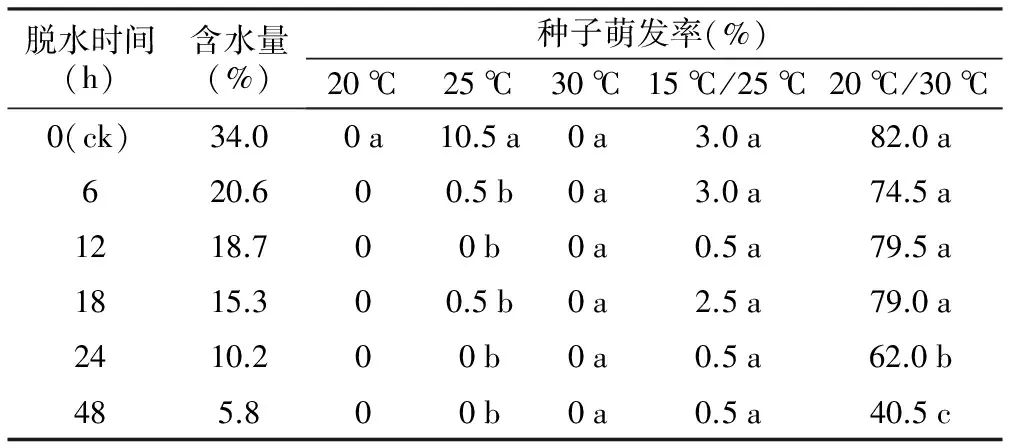
脱水时间(h)含水量(%)种子萌发率(%)20℃25℃30℃15℃/25℃20℃/30℃0(ck)34.00a10.5a0a3.0a82.0a620.600.5b0a3.0a74.5a1218.700b0a0.5a79.5a1815.300.5b0a2.5a79.0a2410.200b0a0.5a62.0b485.800b0a0.5a40.5c
由表3可知,新鲜草果种子含水量较高,为34.0%。将种子进行脱水后再层积,种子萌发率随着脱水时间的增加呈下降的趋势。在20 ℃/30 ℃培养条件下,当种子含水量分别降至20.6%、18.7%和15.3%时,草果种子的平均萌发率虽然有所下降,但与对照相比差异不显著。进一步降低种子含水量至10.2%时,草果种子萌发率仅为62.0%,显著低于对照。当脱水至含水量为5.8%时,草果种子萌发受到进一步的抑制,萌发率仅为40.5%。在其他培养温度条件下,脱水并不能促进草果种子萌发。
3 讨 论
生产上,草果种子萌发率低、发芽不整齐是制约其规范化栽培的重要因素。对草果种子生活力进行测定,发现草果种子活力高达93.0%±1.7%,但草果种子可萌发范围狭窄,仅在20 ℃/30 ℃变温下具有较高的萌发率,在其他温度条件下不萌发或萌发率极低,说明草果种子具有显著的休眠现象。
层积处理是休眠性种子常用的破除休眠方法之一[9,10]。层积处理可以增加种皮透性,加速种子内部的新陈代谢,促进赤霉素和细胞分裂素等激素合成,降解或转化脱落酸等抑制激素,从而促进种子萌发[11]。本实验中,恒温层积和变温层积均能不同程度地解除草果种子休眠。其中,15 ℃暖温层积处理效果最佳,暖温层积90 d后种子萌发率高达82.0%。雷恩等研究表明,使用H2SO4、GA3和NaOH对草果种子进行浸种,能够一定程度上提高草果种子萌发率,但处理后种子萌发率最高仅为58.4%[7]。本实验中,层积处理能够更好地解除草果种子休眠,可能与层积处理增加了草果种皮透性的同时,改变了内源激素含量有关。
草果种子不耐干藏,生产上常采用现采现播的方式[12]。若采回的种子不能及时播种,则用湿沙进行拌种贮藏[13]。本研究发现,草果种子含水量显著影响种子萌发率。当种子含水量降低至15%时,对种子萌发率影响不大,但进一步降低种子含水量,则导致萌发率显著下降。因此,在生产实践中,对于不能及时播种的草果种子,应注意避免种子过度脱水,进行种子保存时以大于15%含水量的种子为佳。
[1]邓家刚,韦松基.广西道地药材[M].北京:中国中医药出版社,2007.
[2]中国科学院中国植物志编辑委员会.中国植物志(第16卷第2分册)[M].北京:科学出版社,1996:100.
[3]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:222-223.
[4]罗晓霞.草果与拟草果的性状与显微鉴别[J].中药材,2014,37(2):227-229.
[5]尹安强,王芳艳,杨永红,等.我国草果研究文献的分析[J].中国医药指南,2014,12(34):263-264.
[6]管艳红,李荣英.草果种子苗繁殖实验研究[J].时珍国医国药,2004,15(7):464.
[7]雷恩,刘艳红,田学军,等.不同化学试剂对草果种子发芽的影响[J].种子,2010,29(12):79-80.
[8]宋松泉,程红焱,龙春林,等.种子生物学研究指南[M].北京:科学出版社,2005:3.
[9]鱼小军,王芳,龙瑞军.破除种子休眠方法研究进展[J].种子,2005,24(7):46-49.
[10]青格乐,王玉芝,张琼琳,等.植物种子休眠及破除方法研究进展[J].安徽农业科学,2013,41(11):4 715-4 716.
[11]徐是雄,唐锡华,傅家瑞.种子生理的研究进展[M].广州:中山大学出版社,1987:172-176.
[12]郑家文.云南扩大草果种植的情况分析[J].云南农业经济,2012(2):37-39.
[13]周淑荣,郭密,郭文场,等.草果的种植关键技术[J].特种经济动植物,2012(11):34-35.

