海洋解淀粉芽孢杆菌GM-1变异菌株的特性及其抑菌作用研究
汪晶晶,王 琦,王军强,顾春霞,暴增海*,马桂珍,王淑芳,贾 杰
(1.淮海工学院 江苏省海洋资源开发研究院,江苏 连云港 222005;2.宣化县第二中学,河北 宣化 075100; 3.江苏耕耘化学有限公司,江苏 连云港 222005)
海洋解淀粉芽孢杆菌GM-1变异菌株的特性及其抑菌作用研究
汪晶晶1,王 琦1,王军强1,顾春霞2,暴增海1*,马桂珍1,王淑芳1,贾 杰3
(1.淮海工学院 江苏省海洋资源开发研究院,江苏 连云港 222005;2.宣化县第二中学,河北 宣化 075100; 3.江苏耕耘化学有限公司,江苏 连云港 222005)
为了明确海洋解淀粉芽孢杆菌(Bacillusamyloliquefaciens)GM-1自发突变菌株的变异与抗菌作用的关系,进一步获得优良菌种,通过形态学观察、生理生化试验及16S rDNA和gyrB基因序列分析,对变异菌株GM-1-2特性进行分析;以8种植物病菌为供试菌,采用平板对峙法和牛津杯法分别测定变异菌株GM-1-2及其发酵液的抑菌作用;采用硫酸铵沉淀法对变异菌株产生的抑菌物质进行初步分析。结果发现,变异菌株GM-1-2的菌落形态、颜色、菌体大小与原始菌株GM-1存在明显差异,但其生理生化特性、16S rDNA和gyrB序列与解淀粉芽孢杆菌的同源性等均与原始菌株相同。变异菌株GM-1-2及其发酵液对小麦根腐病菌、棉花黄萎病菌、小麦赤霉病菌、大豆菌核病菌、小麦雪腐病菌、甘蓝枯萎病菌、斑点落叶病菌、黄瓜枯萎病菌的菌丝生长均有较强的抑制作用,且抑制作用明显高于原始菌株GM-1,其中菌株的抑菌带宽度提高了0.2~9.0 mm,无菌发酵液的抑制率提高了1.1%~153.7%。变异菌株的抑菌物质主要存在于硫酸铵沉淀中,沉淀后的上清液无明显的抑菌作用。以上结果表明,变异菌株GM-1-2的抑菌活性提高,其产生的抑菌物质与原始菌株存在差异,具有潜在的开发价值。
海洋解淀粉芽孢杆菌; 变异菌株; 16S rDNA;gyrB基因; 抑菌作用
解淀粉芽孢杆菌(Bacillusamyloliquefaciens)是芽孢杆菌属中的一个种,在1980年之前鲜有报道,1987年Priest等[1]发现并建立了解淀粉芽孢杆菌模式菌株ATCC23350。2007年公布了解淀粉芽孢杆菌FZB42的全基因组序列,基因组全长3 918 kb,包含3 693个蛋白质编码序列[2]。一些学者从多种植物及土壤中分离到对半裸镰刀菌(Fusariumsemitectum)、青枯病菌(Ralstoniasolanacearum)、人参锈腐病菌(Cylindrocarpondestructans)、人参黑斑病菌(Alternariabrassicicola)、番茄早疫病菌(Alternariasolani)、荔枝炭疽病菌(Colletotrichumgloeosporioides)、荔枝霜疫霉病菌(Peronophythoralitchii)等多种植物病原菌有较强抑制作用的解淀粉芽孢杆菌[3-9],美国Taegro公司已研发出商品化的解淀粉芽孢杆菌 FZB42菌剂,主要用于防治农作物的枯萎病和根腐病[10]。
已有报道的解淀粉芽孢杆菌主要来自陆源,有关来自海洋的解淀粉芽孢杆菌的研究较少。淮海工学院抗菌微生物及其代谢产物研究与应用重点实验室从连云港海域海水中分离得到1株对多种植物病原真菌有较强抑制作用的海洋解淀粉芽孢杆菌菌株GM-1,并对该菌株的抑菌作用、发酵条件进行了初步研究,发现其表现出良好的开发应用前景[11-13]。在对该菌株的研究与应用过程中发现,经过连续多代培养,出现了与原始菌落形态不同的菌落,分离纯化后作为变异菌株记为GM-1-2,该菌株经多代连续培养特性稳定。本试验对变异菌株GM-1-2的特性和抑菌作用进行研究,旨在明确菌株的变异与抗菌作用的关系,为进一步获得优良菌种提供理论依据。
1 材料和方法
1.1 材料
1.1.1 菌株 海洋细菌GM-1为淮海工学院抗菌微生物及其代谢产物研究与应用重点实验室从连云港海域分离得到;变异菌株GM-1-2由菌株GM-1自发突变得到。供试植物病原菌为小麦根腐病菌(Bipolarissorokiniana)、棉花黄萎病菌(VerticilliumdahliaeKleb)、小麦赤霉病菌(Fusariumgraminearum)、大豆菌核病菌(Sclerotiniasclerotiorum)、小麦雪腐病菌[Fusariumnivale(Fr)Ces]、甘蓝枯萎病菌(Fusariumoxysporumf.sp.Conglutinans)、斑点落叶病菌(Alternariaalternate)、黄瓜枯萎病菌(Fusariumoxysporumf.sp.Cucumerinum),由中国农业科学院植物保护研究所土传病害实验室提供。
1.1.2 培养基 菌株GM-1、GM-1-2菌体活化培养基:PDA培养基。菌株GM-1、GM-1-2种子和发酵用培养基:蔗糖10 g/L、牛肉膏16 g/L、酵母膏3 g/L、FeSO40.4 g/L、水1 000 mL,pH值7.0[12]。
1.1.3 试剂 细菌基因组DNA提取试剂盒购自杭州宝赛生物科技有限公司;2K DNA Marker、2×EasyTaqSuperMix购自北京全式金生物技术有限公司;10×Loading Buffer为TaKaRa公司产品。
1.2 方法
1.2.1 变异菌株形态特征观察 将变异菌株GM-1-2 和原始菌株GM-1分别接种于PDA培养基平板上,28 ℃恒温培养24 h,观察记录菌落形态、颜色,进行革兰氏染色、芽孢染色、鞭毛染色以及荚膜染色,比较变异菌株GM-1-2 和原始菌株GM-1形态的异同点。液体PD培养观察:将培养24 h的GM-1-2菌株斜面加入适量无菌水,制成109cfu/mL的菌悬液,按10%接种量接入到装有60 mL PD培养液的250 mL三角瓶中,28 ℃、180 r/min摇床振荡培养24 h,观察培养液颜色等。
1.2.2 变异菌株生理生化试验 生理生化试验参考布坎南等《伯杰细菌鉴定手册》[14]和东秀珠等《常见细菌系统鉴定手册》[15]中的方法,主要测定M.R.试验、V.P.试验、硫化氢试验、接触酶试验、糖醇发酵试验、半固体琼脂穿刺试验、明胶液化等生理生化指标,并与原始菌株进行比较。
1.2.3 变异菌株16S rDNA序列分析 采用细菌基因组DNA提取试剂盒提取菌株DNA。16S rDNA基因PCR扩增引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′);扩增反应体系(25 μL):模板(变异菌株GM-1-2 和原始菌株GM-1的总DNA)1.5 μL,上、下游引物各0.5 μL,2×EasyTaqSuperMix 12.5 μL,ddH2O 10 μL。PCR扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。将PCR扩增产物送上海生工生物工程技术服务公司测序,序列提交NCBI数据库,应用BLAST程序与数据库中已有的细菌16S rDNA序列进行相似性比较,采用MEGA 5软件包以邻接法(Neighbour-Joining,bootstrap 500)进行序列同源性分析,并构建系统发育树。比较变异菌株GM-1-2 和原始菌株GM-1的16S rDNA序列。
1.2.4 变异菌株gyrB序列分析gyrB基因PCR引物为UP-1(5′-GAAGTCATCATGACCGTTCTGCAYGGNGGNAARTTYGA-3′)和UP-2 (5′-AGCAGGCTACGGATGTGCGAGCCRTCNACRTCNGCKTCNGTCAT-3′);扩增体系(25 μL):模板(变异菌株GM-1-2 和原始菌株GM-1的总DNA)1.0 μL,上、下游引物各0.5 μL,2×EasyTaqSuperMix 12.5 μL,ddH2O 10.5 μL。PCR 扩增条件、PCR产物测序、序列同源性分析、进化树构建等方法同1.2.3。
1.2.5 变异菌株对植物病原真菌的抑制作用测定 采用平板对峙法。在PDA培养基平板中央接种直径为8 mm的植物病原菌菌苔,在菌苔周围距离培养皿边缘1.5 cm处划线接种拮抗菌株,重复3次,于28 ℃倒置恒温培养4~5 d,测定抑菌带宽度,比较变异菌株GM-1-2与原始菌株GM-1的抑菌作用。
1.2.6 变异菌株发酵液对植物病原真菌的抑制作用测定
1.2.6.1 种子液与无菌发酵液的制备 采用摇瓶发酵培养法。将活化的GM-1-2菌株斜面用适量无菌水洗下,制成109cfu/mL的菌悬液,按10%接种量接入装有60 mL种子培养液的250 mL三角瓶中,28 ℃、180 r/min摇床振荡培养24 h,即为种子液。按10%的接种量,将种子液接种到装有50 mL发酵培养液的250 mL三角瓶中,于28 ℃、180 r/min摇床振荡培养60 h,得到发酵液,10 000 r/min离心15 min,上清液经微孔滤膜(0.22 μm)过滤得到无菌发酵液。
1.2.6.2 抑菌作用测定 采用牛津杯法。在平板中央分别接入8 种不同种类的植物病原真菌菌苔(直径8 mm),在病原菌周围距离平板边缘10 mm处等距离放置牛津杯,取无菌滤液200 μL加入牛津杯中,28 ℃恒温培养4~5 d。以无菌水为对照,每种病原真菌为1个处理,每处理重复3次。采用十字交叉法测量菌落直径,计算抑菌率,比较变异菌株与原始菌株发酵液的抑菌作用。
抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌苔直径)×100%。
1.2.7 变异菌株发酵液抑菌物质的初步定位 冰浴条件下分别在200 mL的变异菌株GM-1-2和原始菌株GM-1发酵液中加入硫酸铵粉末,使饱和度达到80%,搅拌2 h,硫酸铵全部溶解后放入4 ℃冰箱过夜。4 ℃、12 000 r/min离心10 min,收集上清液与沉淀,用10 mL PBS溶解沉淀,将沉淀与上清透析后,分别检测上清液和沉淀的抑菌活性,方法同1.2.6。
1.3 统计分析
采用Excel进行数据处理,用t检验进行差异显著性分析。
2 结果与分析
2.1 变异菌株GM-1-2的形态特征
在PDA平板上培养24 h,原始菌株GM-1菌落呈乳黄色,而变异菌株GM-1-2菌落为乳白色;变异菌株GM-1-2菌落表面干燥有褶皱,原始菌株GM-1菌落表面湿润光滑。PD培养液培养24 h,变异菌株与原始菌株的培养液颜色存在较大差异,变异菌株GM-1-2培养液呈橘红色,而原始菌株GM-1培养液呈黄褐色。
变异菌株GM-1-2与原始菌株GM-1菌体形态无差异,细胞呈杆状,G+,单个排列,也有链状排列,有芽孢、中生,极生单鞭毛;培养16 h变异菌株GM-1-2和原始菌株GM-1细胞大小分别为(1.73±0.22)μm×(0.64±0.07)μm和(2.00±0.22)μm×(0.65±0.05)μm,变异菌株GM-1-2细胞略小于原始菌株GM-1。说明变异菌株与原始菌株在菌落形态、颜色以及细胞大小等方面有所差异。
2.2 变异菌株GM-1-2生理生化试验结果
变异菌株GM-1-2可利用葡萄糖、蔗糖、果糖、甘露醇等糖醇进行发酵,不能利用鼠李糖、阿拉伯糖、麦芽糖、半乳糖、肌醇、山梨醇;V.P.试验、精氨酸双水解肉汤试验、赖氨酸脱羧酶肉汤试验呈阳性,M.R.试验、苯丙氨酸试验、硫化氢试验、西蒙氏枸橼酸盐试验呈阴性;在7% NaCl条件下可生长,具有运动性;在大分子试验中,Tween 80降解试验、明胶液化和淀粉水解试验、接触酶试验均显阳性。变异菌株GM-1-2与原始菌株GM-1的生理生化试验结果相同。
2.3 变异菌株GM-1-2 16S rDNA序列分析
以变异菌株GM-1-2的基因组DNA为模板,利用16S rDNA基因引物进行PCR扩增,得到1 452 bp的扩增产物,与原始菌株GM-1相同。将序列在GenBank中进行比对,变异菌株GM-1-2与解淀粉芽孢杆菌(KC692163.1)相似度达到98%。选取GenBank中相似度较高的模式菌株序列以及原始菌株GM-1 16S rDNA序列,采用MEGA 5软件构建系统发育树,变异菌株GM-1-2与GM-1 16S rDNA相似度达到99%,二者与解淀粉芽孢杆菌聚在同一分支(图1)。说明变异菌株的16S rDNA基因序列未发生明显改变。

图1 基于16S rDNA 基因序列的系统发育树
2.4 变异菌株GM-1-2gyrB序列分析
以变异菌株GM-1-2的基因组DNA为模板,利用gyrB基因引物进行PCR扩增,得到1 229 bp的扩增产物,其序列与原始菌株GM-1gyrB基因序列相似度达到99%。BLAST结果表明,变异菌株GM-1-2gyrB基因序列与解淀粉芽孢杆菌(JN859131.1)的相似度达到98%。采用MEGA 5软件构建系统发育树,可以发现变异菌株GM-1-2、原始菌株GM-1和解淀粉芽孢杆菌位于同一分支上(图2)。说明变异菌株的gyrB基因序列未发生明显改变。
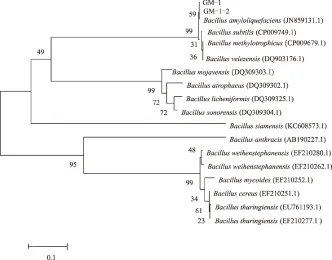
图2 基于gyrB 基因序列的系统发育树
2.5 变异菌株GM-1-2对几种植物病原真菌的抑制作用
从表1可以看出,变异菌株GM-1-2对8种供试植物病原菌的菌丝生长均具有较强的抑制作用,抑菌带宽度为14.0~37.7 mm,较原始菌株提高0.2~9.0 mm。与原始菌株相比,其对小麦雪腐病菌、甘蓝枯萎病菌、斑点落叶病菌、黄瓜枯萎病菌的抑制作用极显著提高,抑菌带宽度增加22.2%~47.9%;另外,其对小麦根腐病菌和大豆菌核病菌的抑制作用也显著提高。
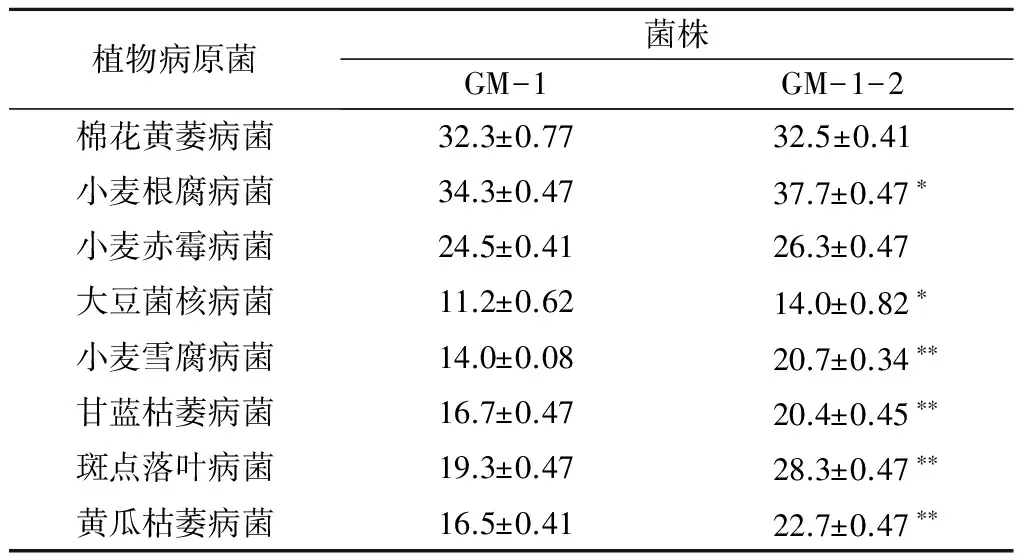
表1 变异菌株GM-1-2对8种植物病原菌的抑菌带宽度 mm
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下同。
2.6 变异菌株GM-1-2发酵液对几种植物病原真菌的抑制作用
从表2可以看出,变异菌株GM-1-2发酵液对8种供试植物病原菌的菌丝生长均具有较强的抑制作用,其中对小麦根腐病菌的抑制作用最强,抑制率达到61.19%,对黄瓜枯萎病菌的抑制作用最弱,抑制率为20.03%。菌株GM-1-2发酵液对8种植物病原真菌的抑制作用明显高于原始菌株,抑制率提高了1.1%~153.7%,其中对除斑点落叶病菌外的7种植物病原菌的抑制作用与GM-1相比均达到了极显著差异水平。
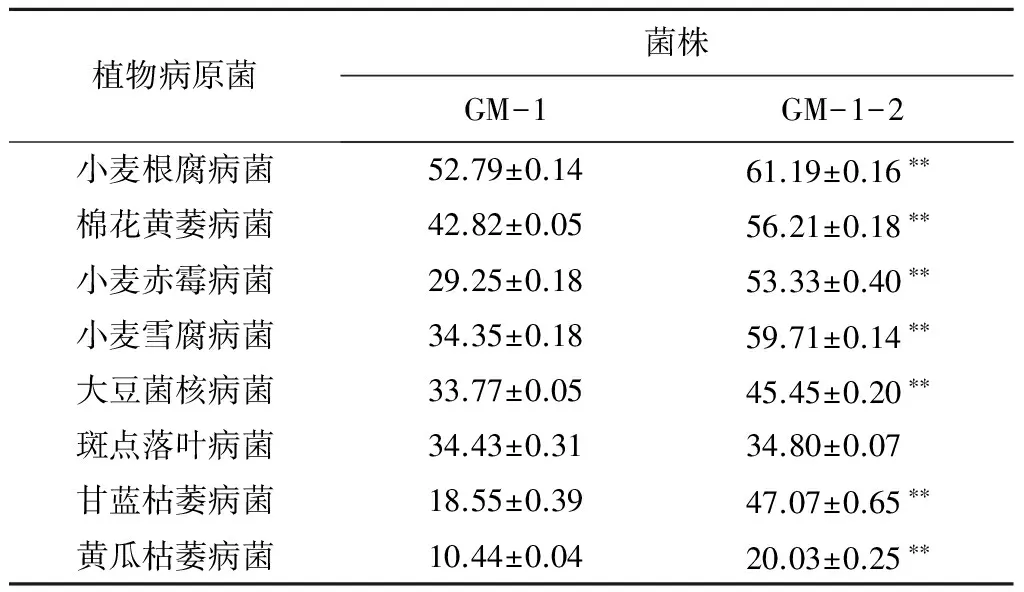
表2 变异菌株GM-1-2无菌发酵液对8种植物病原菌的抑制率 %
2.7 变异菌株与原始菌株发酵液抑菌物质的初步定位
经硫酸铵沉淀、透析后的原始菌株GM-1发酵上清液和沉淀对小麦根腐病菌均具有明显的抑菌活性(图3),抑菌率分别为58.91%、41.36%;变异菌株GM-1-2沉淀的抑菌活性更明显(图4),抑菌率达到66.10%,而上清液无明显的抑菌作用。据此初步认为变异菌株GM-1-2与原始菌株GM-1所产生的抑菌物质有所不同。
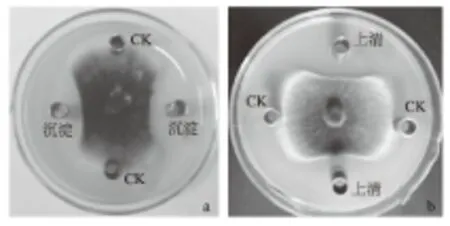
图3 原始菌株GM-1发酵液硫酸铵沉淀后沉淀(a)与上清液(b)对小麦根腐病菌的抑菌作用

图4 变异菌株GM-1-2发酵液硫酸铵沉淀后沉淀(a)与上清液(b)对小麦根腐病菌的抑菌作用
3 结论与讨论
本研究结果表明,变异株菌GM-1-2在菌落形态、PD培养液颜色等方面与原始菌株GM-1存在显著差异,但其生理生化试验结果、16S rDNA 序列和gyrB基因序列与原始菌株基本一致,未发生明显改变;变异菌株GM-1-2及其发酵液对8种植物病原菌的抑菌活性高于原始菌株GM-1,同时变异菌株GM-1-2产生的抗菌物质可以被80%饱和度的硫酸铵沉淀,与原始菌株明显不同,说明变异菌株所产生的抑菌物质特性和作用机制有所不同。解淀粉芽孢杆菌是一类重要的生防菌,在生长过程中可以产生一系列的抗菌物质,如抗菌蛋白[16]、β-1,3-葡聚糖酶[17]、伊枯草菌素A[18]、表面活性素[19]、类细菌素[20]等。有关原始菌株GM-1和变异菌株GM-1-2产生的抗菌物质的种类和性质,以及抗菌物质的纯化等研究工作正在进行。
田黎等[21]对微生物产色素机制进行了多年的研究,结果表明,微生物产色素的功能很不稳定,受到营养、温度等外界条件变化的影响。变异菌株GM-1-2在PDA培养基与PD培养液上培养24 h产生的色素明显不同,PDA培养基上菌落呈乳白色,而PD培养液中培养呈橘红色,推测可能与培养基成分有关,这一问题有待进一步研究。
提高或改善原始菌株的功能,主要通过筛选变异菌株或转基因技术实现。芽孢杆菌菌株的自然突变率一般较低,突变幅度较小,通过自发突变获得功能改善突变菌株的概率较小,因而获得突变菌株的最有效途径是诱变。贾珂等[22]采用N+注入诱变获得芽孢杆菌B006 的突变株B841、B73,其表面活性素产量比野生菌株B006 分别升高15.9%、14.8%;薛林贵等[23]经2次重离子辐射诱变处理芽孢杆菌属菌株G-41,获得突变菌株15Gy-54,其产碱性蛋白酶活力比原始菌株G-41提高了2.65倍。由于通过自发突变使原始菌株功能改善的概率较低,有关自发突变菌株提高抑菌作用的研究尚未见报道。田成丽等[24]采用继代培养法选育出6株与原始芽孢杆菌菌株Snea253在菌落形态、颜色方面均有明显差异的自发突变菌株,但6株突变株的杀线虫活性均显著低于原始菌株。本研究中变异菌株GM-1-2对8种植物病原菌的抑制作用明显高于原始菌株GM-1,此结果对于优良抗菌菌株的筛选和应用具有一定的价值。
[1] Priest F G,Goodfellow M,Shute L A,etal.Bacillusamyloliquefacienssp.Nov,norn.Rev.[J].International Journal of Systematic Bacteriology,1987,37(1):69-71.
[2] Chen X H,Koumoutsi A,Scholz R,etal.Comparative analysis of the complete genome sequence of the plant growth-promoting bacteriumBacillusamyloliquefaciensFZB42[J].Nature Biotechnology,2007,25:1007-1014.
[3] Alvindia D G,Natsuaki K T.Biocontrol activities ofBacillusamyloliquefaciensDGA14 isolated from banana fruit surface against banana crown rot-causing pathogens [J].Crop Prot,2009,28:236-242.
[4] Lisboa M P,Bonatto D,Bizani D,etal.Characterization of a bacteriocin-like substance produced byBacillusamyloliquefaciensisolated from the Brazilian Atlantic Forest [J].International Microbiology,2006,9(2):111-118.
[5] 王玲,刘二明,周鑫钰,等.一株辣椒青枯病菌拮抗内生细菌的筛选鉴定与发酵条件优化[J].南方农业学报,2014,45(10):1781-1787.
[6] 金海强,朴光一,屈俊廷,等.解淀粉芽孢杆菌Y-S-Y12 菌株对人参锈腐病的生防作用[J].中国森林病虫,2015,34(2):1-5,22.
[7] 崔海洋,程仕伟,黄田红,等.产纤维素酶的解淀粉芽孢杆菌分离鉴定及酶学性质研究[J].食品科学技术学报,2014,32(3):43-47.
[8] 陈敏,郭旭文,李春远,等.解淀粉芽孢杆菌SC1150的抑菌活性及其液体发酵条件的优化[J].生态科学,2015,34(3):7-12.
[9] 段春华,刘幸红,牛赡光,等.一株拮抗细菌的鉴定及对植物炭疽病菌作用效果测定[J].江西农业学报,2014,26(3):94-97.
[10] Besrat T D,Lise K.Bacillussubtilisattachment,colonization,and survival onavocado flowers and its mode of action on stem-end rot pathogens [J].Biological Control,2006,37:68-74.
[11] 葛平华,马桂珍,付泓润,等.海洋解淀粉芽孢杆菌GM-1菌株发酵液抗菌谱及稳定性测定[J].农药,2012,51(10):730-741.
[12] 马桂珍,葛平华,刘兆普,等.海洋解淀粉芽孢杆菌GM-1培养基及摇瓶发酵条件优化[J].作物杂志,2013(3):36-41.
[13] 葛平华,马桂珍,付泓润,等.油菜菌核病菌拮抗海洋细菌GM-1菌株的种类鉴定及抑菌作用研究[J].植物保护,2013,39(2):50-56.
[14] 布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984.
[15] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:353-390.
[16] Wong J H,Ng T B.Studies on an antifungal protein and a chromatographically and structurally related protein isolated from the culture broth ofBacillusamyloliquefaciens[J].Protein Pept Lett,2009,16(11):1399-1406.
[17] Kim P I,Chung K C.Production of an antifungal protein for control ofColletotrichumlagenariumbyBacillusamyloliquefaciensMet0908[J].FEMS Microbiol Lett,2004,234:177-183.
[18] Yoshida S,Hiradate S,Tsukamoto T,etal.Antimicrobial activity of culture filtrate ofBacillusamyloliquefaciensRC-2 isolated from mulberry leaves[J].Phytopathology,2001,91:181-187.
[19] Romano A,Vitullo D,Di Pietro A,etal.Antifungal lipopeptides fromBacillusamyloliquefaciensstrain BO7[J].Journal of Natural Products,2011,74(2):145-151.
[20] Benitez L B,Caumo K,Brandelli A,etal.Bacteriocin-like substance fromBacillusamyloliquefaciensshows remarkable inhibition ofAcanthamoebapolyphaga[J].Parasitol Res,2011,108(3):687-691.
[21] 田黎,何培青,刘晨临,等.海洋细菌S-9801菌株的生物学特性与产色素的人工培养条件[J].海洋学报,2003,25(2):77-81.
[22] 贾珂,李世东,刘桂君,等.枯草芽孢杆菌B006产surfactin突变株特性及其对黄瓜枯萎病的抑制能力[J].中国生物防治学报,2013,29(4):538-546.
[23] 薛林贵,景春娥,赵旭,等.重离子诱变技术选育碱性蛋白酶高产菌株[J].微生物学通报,2010,37(6):845-851.
[24] 田成丽,朱峰,陈井生,等.链霉菌Snea253菌株的变异分析及对根结线虫活性影响[J].核农学报,2014,28(9):1541-1548.
Studies on Characteristics and Antibacterial Activity of Mutant Strain of MarineBacillusamyloliquefaciensGM-1
WANG Jingjing1,WANG Qi1,WANG Junqiang1,GU Chunxian2,BAO Zenghai1*, MA Guizhen1,WANG Shufang1,JIA Jie3
(1.Jiangsu Marine Resources Development Research Institue,Huaihai Institute of Technology,Lianyungang 222005,China; 2.Xuanhua Second Middle School,Xuanhua 075100,China; 3.Jiangsu Frey Agrochemicals Co.,Ltd.,Lianyungang 222005,China)
To make sure of the relationship between the mutation and antibacterial effect ofBacillusamyloliquefaciensGM-1 spontaneous mutants and further obtain excellent strains,such methods as morphology observation of colony,physiological and biochemical reactions,16S rDNA gene andgyrBgene sequences analysis,were applied for the properties analysis of GM-1-2 mutant.Cylinder-plate method and flat-stand method were used to evaluate the antagonistic effects on 8 plant pathogens of GM-1-2 mutant and its fermentation liquid,respectively.The antagonistic substances of GM-1-2 mutant were preliminarily studied by ammonium sulfate precipitation method.The results showed that there were obvious differences between the mutant and the original strain in the colony morphology,color and cell size.However,no obvious differences were found in the physiological and biochemical reactions and genes (16S rDNA andgyrB) sequences.The mutants showed high inhibitory effectsonBipolarissorokiniana,VerticilliumdahliaeKleb,Fusariumgraminearum,Sclerotiniasclerotiorum,Fusariumnivale(Fr)Ces,Fusariumoxysporumf.sp.Conglutinans,Alternariaalternate,Fusariumoxysporumf.sp.Cucumerinum.Antibacterial activities of the mutant and its fermentation broth were higher than the original strain and its fermentation broth,respectively.The inhibition zone diameter of the mutant increased by 0.2—9.0 mm and the inhibition rate of the fermentation liquid increased by 1.1%—153.7%.The antibacterial substances of the mutant mainly appeared in the ammonium sulfate precipitation,and the supernatant after precipitation had no obvious inhibitory effects.In a word,the spontaneous mutant GM-1-2 produced different antibacterial substances from the original strain GM-1 and showed higher antibacterial activity,which had potential development value.
marineBacillusamyloliquefaciens; mutant strain; 16S rDNA;gyrBgene; antibacterial activity
2016-05-15
江苏省科技厅现代农业研究开发示范类项目(BE2016335);连云港市科技局农业攻关项目(CN1307);连云港市“521人才工程”项目
汪晶晶(1991-),女,江苏连云港人,在读硕士研究生,研究方向:抗菌海洋微生物及其代谢产物的研究利用。 E-mail:763041067@qq.com
*通讯作者:暴增海(1962-),男,河北沧州人,教授,硕士,主要从事植物病害生物防治研究。 E-mail:baozh2008@aliyun.com
S476.1
A
1004-3268(2016)11-0065-06

