三七根总苷对电压依赖性钙离子和钾离子通道的作用
姜河海,年 寅,张阿梅
(1.昆明理工大学生命科学与技术学院,云南昆明 650504;2.中国科学院昆明动物研究所离子通道与药物研发中心,云南昆明 650223)
·论 著·
三七根总苷对电压依赖性钙离子和钾离子通道的作用
姜河海1,2,年 寅2,张阿梅1
(1.昆明理工大学生命科学与技术学院,云南昆明 650504;2.中国科学院昆明动物研究所离子通道与药物研发中心,云南昆明 650223)
目的 探讨三七根总皂苷(RPNS)对电压依赖性钙离子和钾离子通道的作用。方法 采用双电极电压钳检测RPNS 0.01,0.06,0.1,0.6,1及4 g·L-1对表达在爪蟾卵母细胞的Cav1.2的作用;检测RPNS 1 g·L-1对Cav2.1,Cav2.2,Cav3.1,KCNH2,KCNQ1,KCNQ1/KCNE1及大电导钙激活钾通道(BK)的作用。结果 双电极电压钳实验表明,RPNS对Cav1.2的抑制作用有明显的浓度效应关系,其EC50为0.048 g·L-1。与细胞对照组相比,RPNS 1 g·L-1对Cav1.2,Cav2.2和Cav3.1有明显的抑制作用,对其峰值电流的抑制率分别为(57.1±8.6)%,(17.2±0.7)%和(50.2±7.7)%(P<0.01);对BK通道有明显的激活作用,对其峰值电流激活率为(37.9±2.7)%(P<0.01);对Cav2.1,KCNH2,KCNQ1和KCNQ1/KCNE1通道无明显作用。结论RPNS明显抑制Cav1.2和Cav3.1,激活BK通道,但对Cav2.1,Cav2.2,KCNH2,KCNQ1及KCNQ1/KCNE1无明显作用。
总皂苷;三七;Cav1.2;Cav3.1;钾通道;爪蟾卵母细胞
高血压是一种以动脉血压持续升高的慢性疾病,目前常用的降血压药物包括了钙通道阻滞剂、血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)、血管紧张素受体阻滞剂(angiotensin receptor blocker,ARB)、利尿剂及α/β受体阻滞剂[1]。降血压可通过血管舒张完成,血管舒张主要通过内皮依赖性及非内皮依赖性的血管舒张途径。对于非内皮依赖性的血管舒张途径,高浓度氯化钾(KCl)可引起血管平滑肌细胞膜去极化,使得平滑肌细胞膜上的电压依赖性钙通道开放,导致钙离子内流,使血管平滑肌收缩。因此,钙通道阻滞剂可以通过阻止钙离子内流导致血管舒张而发挥降血压的作用。
三七(Panax notoginseng)为伞形目五加科人参属多年生草本植物,《本草纲目新编》记载:“三七根,止血之神药”,作为一种治疗高血压的中药已在临床中广泛使用。近年来,三七总苷(P.notogin⁃sengsaponins)在治疗心血管疾病方面的研究取得了迅速发展,被认为具有扩血管作用,在治疗高血压方面具有良好的疗效[2]。目前,对于三七总苷在心血管方面的研究主要集中在内皮依赖性血管舒张机制的研究。三七花总苷(flower saponins ofP. notoginseng)能通过激活血管内皮细胞一氧化氮合成酶和环氧合酶而引起血管舒张[3]。通过HPLCESI-MS/MS技术从三七总苷中分离出了一系列单体分子如Re,R1,Rc,Rd,Rb3和Rb1等[4]。三七皂苷Ft1通过内皮依赖性一氧化氮合酶来调节血管的舒张[5]。人参皂苷Rg1和Rg3可以引起内皮依赖性大鼠主动脉舒张[6],人参皂苷Rb1可以减缓由内皮依赖性3-磷脂酰肌醇激酶/丝苏氨酸蛋白激酶/内皮型一氧化氮合酶途径造成的血管收缩[7-8]。三七皂苷R1能促进胸腹动脉血管内皮细胞的一氧化氮释放,从而使得自发性高血压小鼠血压降低[9]。然而,也有研究表明,人参皂苷Rd能逆转由受体依赖性钙通道及储存门控钙通道造成的钙离子增加,但不能逆转电压门控钙通道,虽然Rd能减缓自发性高血压大鼠的脑血压,但并未明显改变外周血管的血压[10],三七总苷可通过抑制心肌细胞钙内流导致血管舒张[11]。提示三七总苷中有可能存在对血管平滑肌细胞膜上钙离子通道起抑制作用的成分。目前,三七根总苷(root saponins ofP.notogin⁃seng,RPNS)与血管舒张相关离子通道的研究未得到详细的阐明。因此,本研究采用双电极电压钳检测RPNS对与心血管及神经系统功能相关的离子通道的作用。
1 材料与方法
1.1 药物、试剂及主要仪器
RPNS由云南省中医学院饶高雄教授提供,参考2010版《中华人民共和国药典》,将三七根磨成粉末,用甲醇浸泡过夜,再80℃水浴微沸约2 h,过滤得滤液,干燥即得三七根总苷[12]。Cav1.2,Cav2.2,Cav3.1,Cav2.1,KCNQ1,KCNH2,KCNQ1/KCNE1及大电导钙激活钾通道(large-conductance calcium-activated potassium channels,BK)通道的重组质粒由哥伦比亚大学生物系杨建教授及华盛顿大学生物医学工程系崔建民教授提供。三卡因〔梯希爱(上海)化成工业发展有限公司〕,其他试剂均为国产分析试剂。用超纯水配置ND 96液(mmol·L-1:NaCl 96,KCl 2,CaCl21.8,MgCl21,HEPES 5,用NaOH调pH至7.4)、OR2液(mmol·L-1:NaCl 82.5,KCl 2,MgCl21,HEPES 5,用NaOH调pH至7.4)、钡离子溶液〔mmol·L-1:Ba(OH)240,NaOH 50,HEPES 2,KCl 2,BaCl22,用甲烷磺酸调pH至7.4〕、Kulori液(mmol·L-1:NaCl 89,KCl 2,CaCl 1,MgCl21,HEPES 5,用NaOH调pH至7.4)及0.3%三卡因液体。
KB-900定轨摇床(海门市其林贝尔仪器制造有限公司),RNA显微注射系统和电极拉制仪(美国Sutter Instrument),倒置光学显微镜(日本Olympus),Mili Q超纯水系统(昆明倍捷科技有限公司),恒温培养箱(美国Thermo),数模转换器(美国Axon),放大器(美国Axon)。
1.2 mRNA的制备
将L-型钙通道(Cav1.2),N-型钙通道(Cav2.2),T-型钙通道(Cav3.1),P/Q-型钙通道(Cav2.1),钾通道KCNQ1,KCNH2,KCNQ1/KCNE1和BK的重组质粒用限制性内切酶将其线性化;用苯酚∶氯仿∶异戊醇(V∶V∶V=25∶24∶1)提纯DNA;使用T7聚合酶在体外合成RNA:T7聚合酶(40 U·μL-1)2 μL+m7G帽子(10 mmol·L-1)15 μL+rNTP(80 mmol·L-1)1 μL+DTT(100 mmol·L-1)5 μL+ MgCl2(50 mmol·L-1)5 μL+RNA酶抑制剂2 μL+ 10×T7聚合酶缓冲液5 μL+DEPC水15 μL。体外合成4 h,纯化后用DEPC水溶解,置于-80℃保存。
1.3 爪蟾卵母细胞的制备
成年雌性非洲爪蟾,购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。将爪蟾放于0.3%三卡因液体,-20°下冷冻15~25 min,使其完全麻醉,用手术刀在腹部剪开皮肤层及肌肉层,取卵,置于OR2中,剪成3 mm×3 mm的小块,加入胶原蛋白酶Ⅱ0.5 g·L-1,置于KB-900定轨摇床,用180 rmp·min-1振荡1~1.5 h,转速调至100 rmp·min-1,每隔15 min清洗换液,重复3次,最后用ND96液清洗,静置30 min,挑选出表面光滑、动物极与植物极分明且中间有亮带、无残留纤维组织、圆润饱满的Ⅴ或Ⅵ期爪蟾卵母细胞,置于DN96液。向每个爪蟾卵母细胞注射mRNA 100~150 ng,表达3~5 d后电流记录。
1.4 双电极电压钳检测钙离子通道
拉制电极的电阻为0.3~1 MΩ,以钡离子溶液作为记录液,用钡离子溶液溶解RPNS。电压钳制在-80 mV,记录Cav1.2,Cav2.2和Cav2.1时的检测电压为-30~+60 mV,记录Cav3.1时的检测电压为-50~+60 mV,每个扫描记录0.05 s,间隔5 s。实验组加入RPNS 0.01,0.06,0.1,0.6,1和4 g·L-1,检测其对Cav1.2的作用;加入RPNS 1 g·L-1,检测其对Cav2.2,Cav3.1和Cav2.1的作用。细胞对照组加入相同体积的钡离子溶液。
1.5 双电极电压钳检测钾离子通道
拉制电极的电阻为0.3~1 MΩ,记录KCNH2时用Kulori液作为记录液,用Kulori液溶解RPNS;记录KCNQ1,KCNQ1/KCNE1及BK通道时用DN96液作为记录液,用DN96液溶解RPNS。记录KCNH2时,电压钳制在-80 mV,用+40 mV的电压预刺激1 s,检测电压为-120~+40 mV,每个扫描记录3 s,间隔30 s。记录KCNQ1时,电压钳制在-80 mV,检测电压为-60~+60 mV,每个扫描记录3 s,间隔30 s。记录KCNQ1/KCNE1时,钳制电压为-80 mV,检测电压为-30~+60 mV,每个扫描记录7 s,间隔30 s。记录BK通道时,钳制电压为-50 mV,检测电压为-10~+200 mV,每个扫描记录0.06 s,间隔5 s。实验组加入RPNS 1 g·L-1,检测其对KCNH2,KCNQ1,KCNQ1/KCNE1及BK通道的作用,根据记录的不同离子通道细胞对照组加入相应的相同体积Kulori液或DN96液。
1.6 统计学分析
实验结果数据用x±s表示,用GraphPad Prism 5软件分析数据,组间比较采用双尾t检验。浓度效应曲线用 Sigmoidal dose-response(variable slope)方 程Y=Bottom+(Top-Bottom)/{1+ 10∧〔(LogEC50-X)×HillSlope〕}拟合。
2 结果
2.1 RPNS对Cav1.2的影响
双电极电压钳实验结果(表1)显示,与细胞对照组相比,RPNS 0.01,0.06,0.1,0.6,1和4 g·L-1对Cav1.2在+10 mV时有不同的抑制作用(P< 0.05,P<0.01)。RPNS 1 g·L-1对Cav1.2的抑制率为(57.1±8.6)%(P<0.01)。与细胞对照组相比(图1A),RPNS 1 g·L-1对Cav1.2在0~+30 mV均表现出明显的抑制作用(P<0.05,P<0.01);图2A直观显示,在+10 mV时,RPNS 1 g·L-1对Cav1.2有明显抑制作用;图3A表明,不同浓度RPNS对Cav1.2的抑制作用呈浓度效应关系,EC50=0.048 g·L-1,Hill⁃slope=1.055。表明RPNS对Cav1.2有明显的抑制作用并呈现出一定的电压及浓度依赖性,但RPNS无法完全抑制Cav1.2。
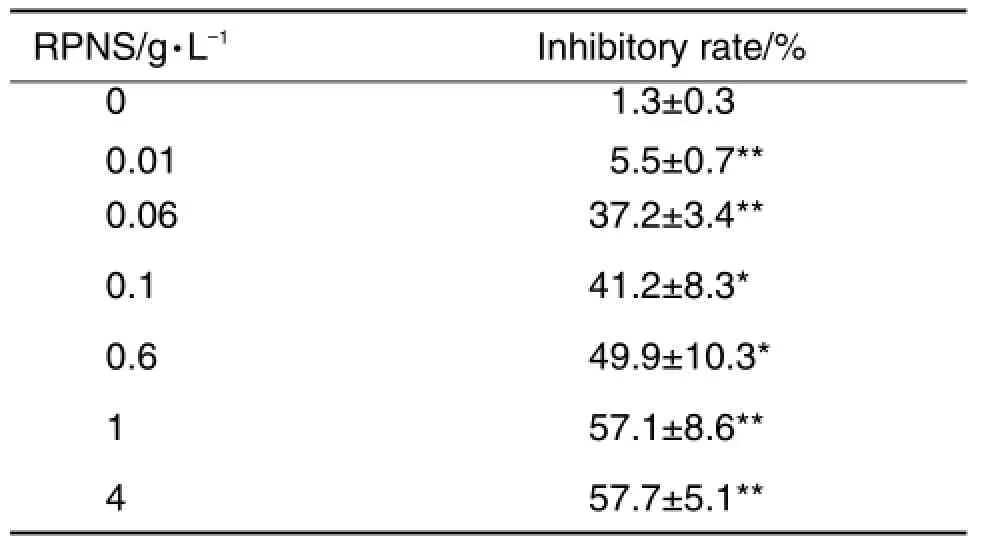
Tab.1 Inhibitory effect of root saponins ofPanax notoginseng(RPNS)on peak current(10 mV)of Cav1.2
2.2 RPNS对其他离子通道的影响
与细胞对照组相比(表2),RPNS 1 g·L-1对Cav2.2和Cav3.1分别在+10 mV和-10 mV时有显著抑制作用,抑制率分别为(17.2±0.7)%和(50.2± 7.7)%(P<0.01),对BK通道在+200 mV时有显著激活作用,其激活率为(37.9±2.7)%(P<0.01),但对Cav2.1,KCNH2,KCNQ1及KCNQ1/KCNE1在+10 mV,-50 mV,+60 mV及+60 mV时无明显作用。图2B~H表明,RPNS 1 g·L-1对Cav2.1,Cav3.1及BK通道分别在+10 mV,-10 mV及+200 mV时有明显抑制或激活作用,但对Cav2.1,KCNH2,KCNQ1及KCNQ1/KCNE1分别在+10 mV,-50 mV,+60 mV及+60 mV时无明显作用。与细胞对照组相比,RPNS 1 g·L-1(图1C)对Cav2.2在+10~+30 mV有明显抑制作用(P<0.01),RPNS 1 g·L-1(图1D)对Cav3.1在-20~+20 mV有明显抑制作用(P<0.01),RPNS 1 g·L-1(图1E)对BK通道在+140~+200 mV有明显激活作用(P<0.01,P<0.05),RPNS 1 g·L-1(图1B,F~H)对Cav2.1,KCNH2,KCNQ1及KCNQ1/KCNE1在任何电压下均无明显影响。与Cav1.2通道相比(图3B),RPNS 1 g·L-1对Cav3.1无抑制作用,但对Cav2.1、Cav2.2、BK通道、KCNH2、KCNQ1及KCNQ1/KCNE1有明显抑制作用(P<0.01,P<0.05)。综上,RPNS 1 g·L-1对Cav2.2和Cav3.1有明显抑制作用,但对BK通道有明显激活作用,并呈现出一定的电压依赖性,其中,RPNS 1 g·L-1对Cav2.2的抑制作用很弱。此外,RPNS1 g·L-1对Cav2.1,KCNH2,KCNQ1及KCNQ1/KCNE1无作用。
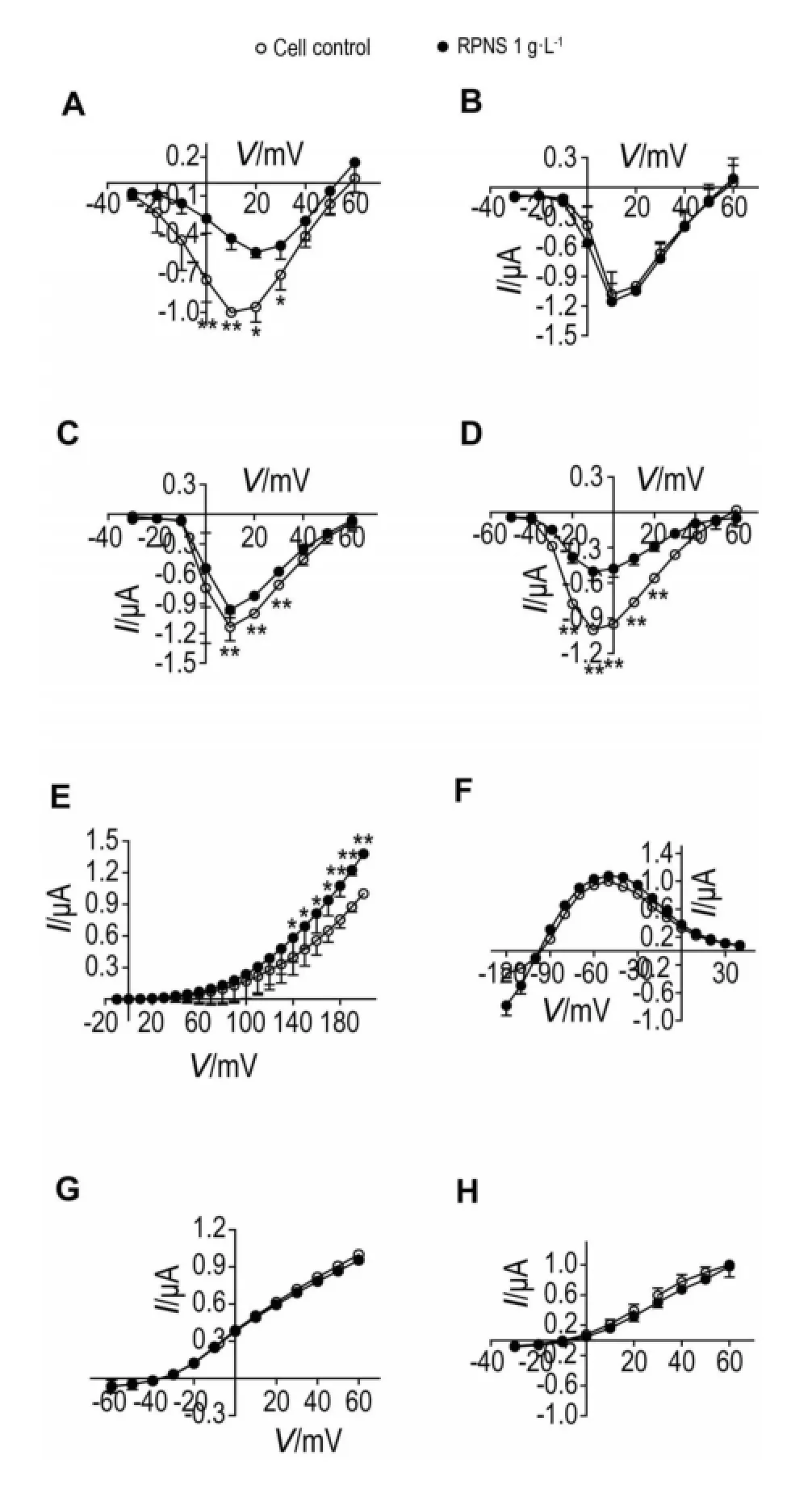
Fig.1 Effect of RPNS on current-voltage(I-V)rela⁃tionship of different calcium and potassium channels. A-H:theI-Vrelationship for the current of Cav1.2,Cav2.1,Cav2.2,Cav3.1,BK channel,KCNH2,KCNQ1 and KCNQ1/ KCNE1.x±s,n=24.*P<0.05,**P<0.01,compared with corre⁃sponding cell control group.
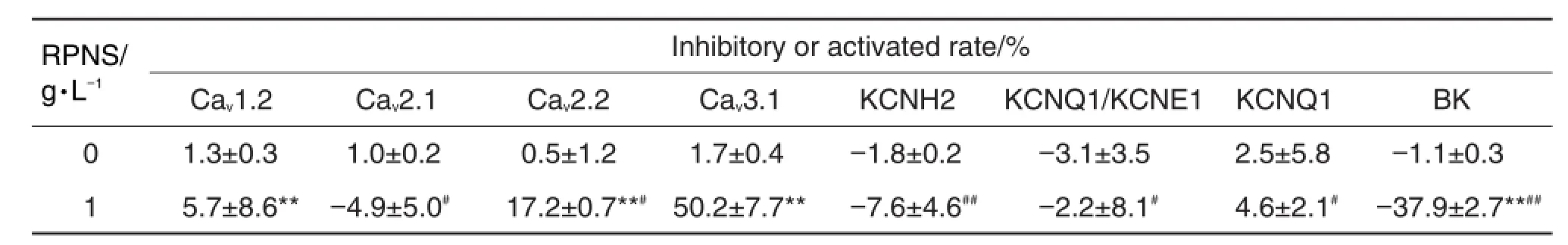
Tab.2 Inhibitory or activated rate of RPNS on peak current of different channels

Fig.2 Effect of RPNS on peak current of different calcium and potassium channels.A-H:the peak current for Cav1.2,Cav2.1,Cav2.2,Cav3.1,BK channel,KCNH2,KCNQ1 and KCNQ1/KCNE1,respectively.
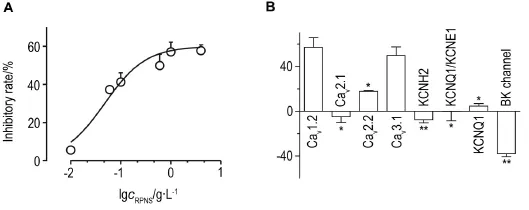
Fig.3 Effect of RPNS on Cav1.2(A)and different calcium and potassium channels(B).A:concentration-responsive curve of RPNS on peak current of Cav1.2.EC50=0.048 g·L-1,Hillslope=1.055.Fitting equation:Y=Bottom+(Top-Bottom)/{1+ 10^〔(LogEC50-X)×HillSlope〕}.See Tab.1 for the treatment.B:inhibitory or activated rate of RPNS 1 g·L-1on peak current of different channels.See Tab.2 for the treatment.x±s,n=24.*P<0.05,**P<0.01,compared with Cav1.2 channel.
3 讨论
本研究发现,RPNS 1 g·L-1对L-型钙通道及T-型钙通道有明显抑制作用,对BK通道有激活作用,提示RPNS中存在一系列通过抑制L-型钙通道和T-型钙通道、激活BK通道的协同作用以发挥非内皮依赖性血管舒张的分子,这与三七总苷可用于治疗高血压疾病相吻和。
据报道,在血管平滑肌细胞膜上主要分布着参与血管收缩与舒张的电压门控L-型钙通道和BK通道[13-16]。L-型钙通道抑制剂盐酸维拉帕米和硝苯地平能明显引起非内皮依赖性血管舒张的作用[17-20];L-型钙通道激活剂Bay K8644可减缓由L-型钙通道阻断剂引起的血管舒张[21-22]。相比于L-型钙通道广泛的存在于血管平滑肌及心肌细胞膜上并对血管的收缩起重要作用而言,电压门控的T-型钙通道所起的作用则相对较弱,其主要分布于微血管平滑肌细胞膜上,其被抑制也可以舒张微血管来调节微血管的血压,但其对于主动脉血压的调节作用很弱[23]。因此,未将T-型钙通道作为治疗高血压的主要靶点。BK通道的激活剂KB130015可引起非内皮依赖性血管舒张[24]。当BK通道被激活时,钾离子外流,引起膜电位的超级化,使得电压门控的钙离子通道失活而关闭,在血管平滑肌细胞上,主要是通过抑制L-型钙通道而导致钙离子内流减少,使血管不能进一步收缩[13,15]。因此,BK通道的激活作用可以间接抑制L-型钙通道,从而协同L-型钙通道的抑制作用引起非内皮依赖性血管舒张,而T-型钙通道的抑制作用则进一步加强对微血管的舒张作用,从而起到降血压作用。
KCNH2,KCNQ1和KCNQ1/KCNE1主要分布在心脏和肾中,若其功能紊乱可导致室性心律失常或长QT综合征[25]。其中,如果有药物引起了QT间期增长,那么必然对KCNH2有作用[26]。P/Q-型钙通道主要分布在神经末梢,若其功能紊乱会导致偏头痛或者失神性癫痫[27-28]。N-型钙通道主要分布在神经末梢,特别是感觉和运动神经末梢,在神经疼痛方面起着非常重要的作用,其抑制剂被认为是止痛剂[29]。本研究结果表明,RPNS对KCNH2,KCNQ1和KCNQ1/KCNE1以及P/Q-型钙离子通道均无明显作用,对N-型钙通道的作用很弱,提示RPNS不影响心脏和神经系统的正常功能。总之,本研究从离子通道角度,提示从RPNS中寻找非内皮依赖性舒张血管且对心脏和神经系统无影响的用于治疗高血压疾病的分子是可行的。
[1]Wang W,Wang JG,Zhang YQ.Develop strategies and programs for the prevention and treatment of hypertension based on Chinese characteristics of Chinese hypertension[J].Chin J Hypert(中华高血压杂志),2010,18(10):904-907.
[2]Feng LB,Pan XF,Sun ZL.Pharmacological research progress of notoginseng[J].China Pharm(中国药师),2008,11(10):1185-1187.
[3]Wang Z,Jiang JY,Ke Y,Jiang YB,Wei L,Wang YH.Vasodilatory effects of flower ofPanax notoginsengsaponins on rat aorta[J].Chin Phar⁃macol Bull(中国药理学通报),2014,30(7):956-960.
[4]Lai CM,Li SP,Yu H,Wan JB,Kan KW,Wang YT. A rapid HPLC-ESI-MS/MS for qualitative and quan⁃titative analysis of saponins in″XUESETONG″injection[J].J Pharm Biomed Anal,2006,40(3):669-678.
[5]Shen K,Leung SW,Ji L,Huang Y,Hou M,Xu A,et al.Notoginsenoside Ft1 activates both glucocor⁃ticoid and estrogen receptors to induce endotheliumdependent,nitric oxide-mediated relaxations in rat mesenteric arteries[J].Biochem Pharmacol,2014,88(1):66-74.
[6]Kim ND,Kang SY,Park JH,Schini-Kerth VB. Ginsenoside Rg3 mediates endothelium-dependent re⁃laxation in response to ginsenosides in rat aorta:role of K+channels[J].Eur J Pharmacol,1999,367(1):41-49.
[7]Pan CS,Huo YQ,An XJ,Singh G,Chen M,Yang ZX,et al.Panax notoginsengand its compo⁃nents decreased hypertension via stimulation of endothelial-dependent vessel dilatation[J].Vascul Pharmacol,2012,56(3-4):150-158.
[8]Yu J,Eto M,Akishita M,Kaneko A,Ouchi Y,Okabe T.Signaling pathway of nitric oxide production induced by ginsenoside Rb1 in human aortic endo⁃thelial cells:a possible involvement of androgenreceptor[J].Biochem Biophys Res Commun,2007,353(3):764-769.
[9]Su P,Du SJ,Li H,Li Z,Xin WA.Notoginsen⁃oside R1 inhibits oxidized low-density lipoprotein induced inflammatory cytokines production in human endothelial EA.hy926 cells[J].Eur J Pharmacol,2016,770(2016):9-15.
[10]Cai BX,Li XY,Chen JH,Tang YB,Wang GL,Zhou JG,et al.Ginsenoside-Rd,a new voltageindependent Ca2+entry blocker,reverses basilar hypertrophic remodeling in stroke-prone renovascular hypertensive rats[J].Eur J Pharmacol,2009,606(1-3):142-149.
[11]Li HT,Shi L.Effects of total saponins ofPanax notoginsengon Ca2+influx into myocardial cells[J].Acta Pharmacol Sin(中国药理学报),1990,11(3):213-217.
[12]Chinese Pharmacopoeia Commission.Pharmaco⁃poeia of the People′s Republic of China,2010,Vol.Ⅰ(中华人民共和国药典2010年版Ⅰ部)[S]. Beijing:China Medical Science Press,2010,11-11.
[13]Platoshyn O,Yu Y,Ko EA,Remillard CV,Yuan JX. Heterogeneity of hypoxia-mediated decrease inIK(V)and increase in[Ca2+]cytin pulmonary artery smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2007,293(2):L402-L416.
[14]Ren Y,Zhu HC,Xiao Y,Guo JJ,Li LL.Research progress in vascular ion channels[J].Tianjin J Tradit Chin Med(天津中医药),2013,30(9):573-576.
[15]Van Welie I,Du Lac S.Bidirectional control of BK channel open probability by CAMKⅡ and PKC in medial vestibular nucleus neurons[J].J Neurophysiol,2011,105(4):1651-1659.
[16]Suzuki Y,Inoue T,Ra C.L-Type Ca2+channels:a new player in the regulation of Ca2+signaling,cell activation and cell survival in immune cells[J].Mol Immunol,2010,47(4):640-648.
[17]González A,Cabrera Mde L,Mellado M,Cabello S,Márquez S,Morales B,et al.Copper-induced intracellular calcium release requires extracellular calcium entry and activation of L-type voltagedependent calcium channels inUlva compressa[J].Plant Signal Behav,2012,7(7):728-732.
[18]Zhou S,Liu L,Yang X,Wu S,Chen G.Paraoxon attenuates vascular smooth muscle contraction through inhibiting Ca2+influx in the rabbit thoracic aorta[J].J Biomed Biotechnol,2010,2010:829-190.
[19]Semenov I,Wang B,Herlihy JT,Brenner R.BK Channel β1subunits regulate airway contraction secondary to M2 muscarinic acetylcholine receptor mediated depolarization[J].J Physiol,2011,589(Pt 7):1803-1817.
[20]Karaki H,Nakagawa H,Urakawa N.Comparative effects of verapamil and sodium nitroprusside on contraction and45Ca uptake in the smooth muscle of rabbit aorta,rat aorta and guinea-pigtaenia coli[J].Br J Pharmacol,1984,81(2):393-400.
[21]Patel MK,ClunnGF,LymnJS,AustinO,Hughes AD.Effect of serum withdrawal on the contribution of L-type calcium channels(Cav1.2)to intracellular Ca2+responses and chemotaxis in cultured human vascular smooth muscle cells[J].Br J Pharmacol,2005,145(6):811-817.
[22]Matsuo K,Uchida MK.Opposite effects of Bay K 8644 and nicardipine on the inhibitory effect of Ca2+on rat myometrium[J].Eur J Pharmacol,1987,140(3):295-301.
[23]Kuo IY,Howitt L,Sandow SL,McFarlane A,Hansen PB,Hill CE.Role of T-type channels in vasomotor function:team player or chameleon?[J].Pflugers Arch,2014,466(4):767-779.
[24]Gessner G,Heller R,Hoshi T,Heinemann SH. The amiodarone derivative 2-methyl-3-(3,5-diiodo-4-carboxymethoxybenzyl)benzofuran(KB130015)opens large-conductance Ca2+-activated K+channels and relaxes vascular smooth muscle[J].Eur J Pharmacol,2007,555(2-3):185-193.
[25]Gutman GA,Chandy KG,Grissmer S,Lazdunski M,Mckinnon D,Pardo LA,et al.International Union of Pharmacology.LⅢ.Nomenclature and molecular relationships of voltage-gated potassium channels[J].Pharmacol Rev,2005,57(4):473-508.
[26]Lacerda AE,Kuryshev YA,Chen Y,Renganathan M,Eng H,Danthi SJ,et al.Alfuzosin delays cardiac repolarization by a novel mechanism[J].J Pharmacol Exp Ther,2008,324(2):427-433.
[27]Tottene A, Conti R, Fabbro A,Vecchia D,Shapovalova M,Santello M,et al.Enhanced excit⁃atory transmission at cortical synapses as the basis for facilitated spreading depression in Cav2.1 knockin migraine mice[J].Neuron,2009,61(5):762-773.
[28]Fletcher CF,Tottene A,Lennon VA,Wilson SM,Dubel SJ,Paylor R,et al.Dystonia and cerebellar atrophy in Cacna1a null mice lacking P/Q calciumchannel activity[J].FASEB J,2001,15(7):1288-1290.
[29] Perret D,Luo ZD.Targeting voltage-gated calcium channels for neuropathic pain management[J].Neurotherapeutics,2009,6(4):679-692.
[30]Catterall WA.Voltage-gated calcium channels[J]Cold Spring Harb Perspect Biol,2011,3(8):a003947.
Effect of root saponins of Panax notoginseng on different voltagedependent calcium and potassium ion channels
JIANG He-hai1,2,NIAN Yin2,ZHANG A-mei1
(1.Faculty of Life Science and Technology,Kunming University of Science and Technology,Kunming 650504,China;2.Ion Channel Research and Drug Development Center,Kunming Institute of Zoology,Chinese Academy of Sciences,Kunming 650223,China)
OBJECTIVE To investigate the effect of root saponins ofPanax notoginseng(RPNS)on different voltage-dependent calcium and potassium ion channels.METHODS By using the two-elec⁃trode voltage clamp(TEVC),the effect of RPNS 0.01,0.06,0.1,0.6,1 and 4 g·L-1was investigated on Cav1.2,and the effect of RPNS 1 g·L-1was evaluated on Cav2.1,Cav2.2,Cav3.1,KCNH2,KCNQ1,KCNQ1/KCNE1 and BK channel.All the ion channels examined were expressed inXenopus laevisoocytes.RESULTS TEVC suggested that the effect of RPNS on Cav1.2 exhibited the concentration-response relationship and its EC50was 0.048 g·L-1.Compared with cell control,TEVC also showed that RPNS 1 g·L-1had obviously inhibitory effect on Cav1.2,Cav2.2 and Cav3.1,and the inhibitory rate of RPNS 1 g·L-1on the peak current of Cav1.2,Cav2.2 and Cav3.1 was(57.1±8.6)%,(17.2±0.7)%and(50.2±7.7)%(P<0.01),respectively.RPNS 1 g·L-1had obviously activated effect on BK channel,and the activated rate of RPNS 1 g·L-1on the peak current of BK channel was(37.9± 2.7)%(P<0.01).RPNS 1 g·L-1showed no significant effect on Cav2.1,KCNH2,KCNQ1 and KCNQ1/ KCNE1.CONCLUSION RPNS may effectively inhibit Cav1.2 and Cav3.1,activate BK channel,but have little effect on Cav2.1,Cav2.2,KCNH2,KCNQ1 and KCNQ1/KCNE1.
total saponins;Panax notoginseng;Cav1.2;Cav3.1;potassium channel;Xenopus laevisoocytes
NIAN Yin,Tel:13987692057,E-mail:nianyin@mail.kiz.ac.cn;ZHANG A-mei,Tel:13577083421,E-mail:zam1980@yeah.net
R285
A
1000-3002-(2016)09-0921-07
10.3867/j.issn.1000-3002.2016.09.003
2015-12-08接受日期:2016-08-22)
(本文编辑:乔 虹)
姜河海,男,硕士研究生,主要从事离子通道药物研发,E-mail:jianghehai2013@aliyun.com;年 寅,男,助理研究员,主要从事离子通道药物研发及植物化学研究;张阿梅女,副教授,主要从事分子病毒学研究。
年 寅,E-mail:nianyin@mail.kiz.ac.cn,Tel 13987692057;张阿梅,E-mail:zam1980@yeah.net Tel:13577083421

