DWI及 1H-MRS在脑胶质瘤伽玛刀治疗后疗效预测中的应用价值▲
刘铁军 郑英杰
(广西柳州市人民医院放射科,柳州市 545006)
DWI及1H-MRS在脑胶质瘤伽玛刀治疗后疗效预测中的应用价值▲
刘铁军 郑英杰
(广西柳州市人民医院放射科,柳州市 545006)
目的 探讨弥散加权成像(DWI)及磁共振波谱成像(1H-MRS)在脑胶质瘤伽玛刀治疗后疗效预测中的应用价值。方法 40例脑胶质瘤患者,多次行DWI和1H-MRS检查;首先测量伽马刀手术前一周内的DWI和1H-MRS数据,分别获得手术前肿瘤实质区的Cho/Cr、Cho/NAA、NAA/Cr和ADC值和瘤周水肿区的ADC值,并根据二次手术或随访(随访时间大于6个月)结果,将患者分为复发组和非复发组,分析两者之间各个参数是否存在显著性差异,并应用ROC曲线判断各个参数的诊断价值,以确定各个参数疗效预测的有效性。结果 伽玛刀治疗前复发组和非复发组肿瘤实质区的值分别为Cho/Cr(2.15±0.41,2.0±0.64,P=0.445)、Cho/NAA(2.23±0.70,1.89±0.76,P=0.183)、NAA/Cr(1.0±0.37,1.09±0.39,P=0.512),两组肿瘤实质区的ADC值分别为(881±145)×10-6mm2/s,(1260±212)×10-6mm2/s,P<0.001),水肿区的ADC值分别为(1225±244)×10-6mm2/s,(1529±469)×10-6mm2/s;ROC曲线分析表明,肿瘤实质区和瘤周水肿区的曲线下面积分别为0.973和0.696。结论 胶质瘤术前肿瘤实质区和瘤周水肿区的ADC值对于治疗后的疗效预测具有重要的价值,而1H-MRS的所有参数均无意义,ADC值对于提高伽马刀的治疗效率具有重要参考价值,有助于辅助临床制定更加合理的治疗方案。
弥散加权成像;磁共振波谱成像;伽玛刀;脑胶质瘤
神经胶质瘤是发病率最高的颅内肿瘤,约占大脑肿瘤的40.0%,其呈现出浸润生长的特点,生长范围往往不受大脑功能区的限制,呈侵袭性生长并破坏正常脑组织,无法与正常脑组织区别开来,是最难治愈的一种中枢神经系统肿瘤[1]。如能在术前通过影像学参数提前预测肿瘤的治疗效果,采取更加有效的差异性治疗方法,将显著提高患者的术后生存期[4,5]。本研究将脑胶质瘤诊断当中最为常见的弥散加权成像(DWI)及磁共振波谱(1H-MRS)技术结合起来,分析各个参数与术后疗效之间的相关性,评价伽玛刀在治疗胶质瘤术后当中的疗效,以进一步辅助临床制定更加合理的治疗方案。
1 资料与方法
1.1 临床资料 收集我院或外院手术病理确诊为脑胶质瘤并在我院行头部伽玛刀治疗的患者40例,伽玛刀治疗前及治疗后半年及一年以上,均行磁共振1H-MRS、DWI检查。入组病例平均年龄(43±7.8)岁,根据二次手术病理或随访(随访时间大于6个月)确认,非复发组患者25例,肿瘤复发患者15例。排除标准:①伽玛刀治疗后时间较短,未达半年及以上;②病变部位特殊,病灶接近颅顶及颅底骨质,易造成磁场不均匀,影响检查结果准确性;③患者有起搏器置入及其他磁共振检查禁忌证。
1.2 诊断标准 ①非复发组的诊断标准:手术病理未见肿瘤细胞;影像学定期随诊无病灶或病灶无变化或病灶缩小,水肿减轻;临床表现逐渐好转。②肿瘤复发的诊断标准:手术病理找到肿瘤细胞或影像学定期随诊病灶进行性增大;临床表现逐渐恶化。
1.3 检查方法 使用PhilipsAchieva 3.0 TTX/GE singa HDE 1.5 T磁共振成像系统、8通道相控阵线圈进行扫描。检查序列包括常规T1WI、T2WI、DWI和1H-MRS。具体成像参数:T1WI,层厚7 mm,层间距2 mm,FOV 24 cm×24 cm,矩阵192×256,NEX=2,T1-FLAIR序列,TR/TE=2 100 ms/9.0ms,TI=750 ms,成像时间90 s;T2WI,层厚7 mm,层间距2 mm,FOV 24 cm×24 cm,矩阵192×256,NEX=2,TSE/FSE序列,TR/TE=3 000 ms/95 ms,成像时间110 s;DWI:采用SE平面成像技术,3个垂直平面弥散梯度,b值取0、1 000 s/mm,TR/TE=8 000 ms/120 ms,层厚/间隔6 mm/1 mm,成像时间约60 s。在常规增强完成后行1H-MRS扫描,采用3D/2D Press序列,反转角90°,FOV 12 cm×12 cm,体素10×10 mm,TR 1 000 ms,NSA=1,用时6 min 10 s,体素放置区尽量避开囊变、坏死等部位。
1.4 数据处理 应用MR Extended Workspace(EWS)工作站后处理软件进行1H-MRS和DWI分析。
1.4.11H-MRS分析方法 将MRS原始图像导入工作站,软件完成信号平均、基线校正、相位循环、代谢物识别及峰值计算,分别获得实质强化区域的CHo/Cr、CHo/NAA和NAA/Cr值。
1.4.2 DWI分析方法 将DWI图像导入工作站,自动计算出ADC图,ADC值的实质强化区测量应尽量与1H-MRS体素放置区保持一致。本研究中经3次测量,取标准差最小的一组数据的平均值,水肿区的ADC值测量主要参考T1增强图和DWI图,选取区域与实质强化区位于同一层面。实质强化区的确定需结合T1增强图像,并由两位有10年以上临床经验的医生共同确定,选取实质强化区最大层面,并尽量避开囊变、坏死、出血等区域。
1.5 统计学方法 采用SPSS 19.0软件分析,计量资料比较用t检验,以P<0.05为差异有统计学意义。
2 结 果
对于肿瘤复发病例,ADC值明显降低,而非复发组ADC与对侧正常去相比呈等信号甚至更高,瘤周水肿区域也表现出相同的特征,二者具有统计学意义;见图1、图2。复发组Cho/Cr和Cho/NAA值虽然也略高于非复发组,但不具有统计学意义;而NAA/Cr值在两组间比较,差异无统计学意义。见表1。
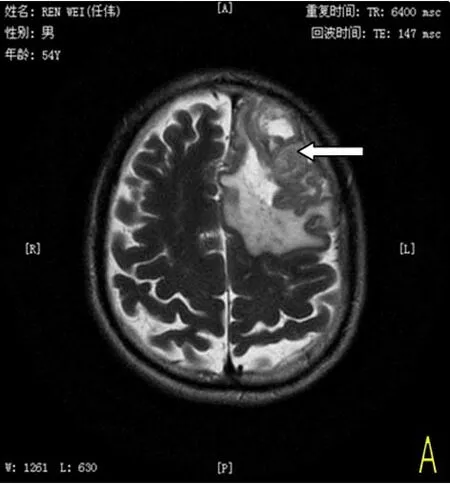



图1 患者为54岁男性,脑质瘤放射治疗结束3个月后随访发现复发,所有图像均在伽马刀治疗前1周内的拍摄。图A:MRT2WI图像,左侧额顶叶信号混杂,局部见类圆形稍高信号(箭头);图B:T1常规增强,左侧额叶病灶呈中度强化;图C:为ADC图,ADC值较低,提示弥散受限严重;图D:为MRS波谱图,与对侧正常区域相比,提示病灶区病灶区NAA、Cr明显减低,NAA/Cho比值减低。


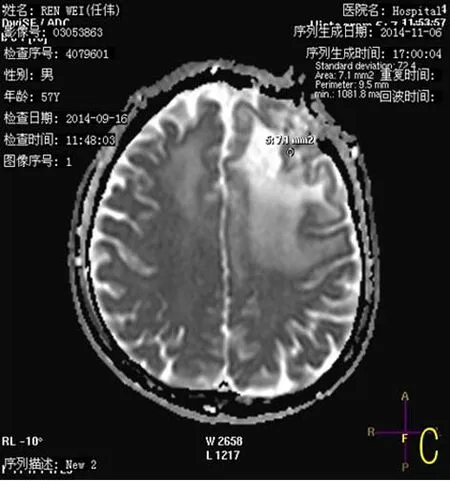

图2 患者为57岁男性,脑质瘤放射治疗结束随访1年以上,病情稳定,所有图像均在其伽马刀治疗前1周内的拍摄。图A:为伽玛刀治疗1年后复查,MRT2WI图像,左侧额顶叶类圆形稍高信号未见明显显示;图B:T1常规增强,左侧额叶未见异常强化病灶;图C:为ADC图,未见明显受限;图D:为MRS图像,左侧额叶感兴趣区MRS提示Cho、NAA、Cr均减低,未提示恶性肿瘤谱线。

表1 DWI及1H-MRS参数的检验结果
进一步对肿瘤实质区和瘤周水肿区的ADC值进行ROC分析,二者的曲线下面积分别为0.973和0.696,具有较高的临床诊断价值,ROC曲线见图3。

图3 肿瘤实质区和水肿区ADC值的ROC曲线
3 讨 论
脑胶质瘤作为颅内最常见的原发性肿瘤,其生长方式大多沿白质纤维束呈浸润性生长,由于瘤周水肿区的存在使得肿瘤的边界更加难以确定,因而肿瘤的实际边界可远远超出常规影像学的可见程度。因此,术前明确胶质瘤分级、确定肿瘤边界对治疗方案的制订、治疗效果的评估及预后有重要意义[6,7]。
扩散加权成像(DWI)是目前唯一能够直接在活体组织上测量水分子扩散运动与成像的方法,可通过DWI间接了解细胞的密度、功能状态及微观结构的改变。因此,可通过ADC值的测量来定量研究水分子扩散运动的大小[8]。在肿瘤组织中,细胞排列越紧密,密度越大,细胞间隙相对越狭窄,细胞内水分子扩散就越受到限制,故低级别胶质瘤的DWI表现为等或低信号,ADC值相对增高,而高级别胶质瘤的DWI表现为高信号,ADC值较低[9]。在复发组中,其术前肿瘤实质区和瘤周水肿区的ADC值都更低,一方面肿瘤实质区的低ADC值预示肿瘤的恶性程度越高,另一方面瘤周水肿区的ADC值较低,也预示这一块组织的肿瘤恶性程度越高、侵袭性越强,应在手术当中采取更加激进的治疗手段,切断肿瘤的复发通路。Randy等[10]的研究也发现,瘤周水肿区和肿瘤实质区的HIF-1和VEGF都与患者的全局生存期和无进展生存期相关,与本研究结论一致。伽马刀治疗后的肿瘤复发与非复发组的ADC值有明显统计学差异,肿瘤实质区和瘤周水肿区有显著相关性,因此在进行手术方案制定时,可联合二者分析制定手术计划。
1H-MRS是目前唯一无创的反映活体组织病理生理及生化变化的技术,可检测出常规MRI不能显示的组织代谢情况。磁共振波谱技术反映脑组织代谢的化合物主要有N-乙酰天门冬氨酸(NAA)、胆碱(Cho)、肌酸(Cr)等。由于肿瘤细胞增殖旺盛,细胞代谢加快,细胞膜及细胞器的崩解可释放游离的胆碱,1H-MRS表现为Cho峰升高;肿瘤细胞呈浸润性生长,神经细胞遭到破坏,故其NAA峰降低[11]。余光宏等[6]、柏根基等[7]的研究都表明,在脑胶质瘤复发患者中的术前图像中,其1H-MRS典型表现为NAA显著降低,Cr稍下降,Cho不同程度升高,Cho/Cr、Cho/NAA均升高,而NAA/Cr的值比较难以预测。本研究结果显示,各个参数均与疗效均无相关性,这可能和以下三个因素有关:一是数据量较小,复发组的Cho/Cr和Cho/NAA虽然是高于非复发组,但是由于标准差太大,造成结果无意义;二是肿瘤在生长过程中会不断增值分化,形成乏氧、坏死等等区域,而1H-MRS图像分辨率较低,影响感兴趣区域的选择,造成结果误差较大;三是Cr的值同胶质瘤级别相关,本研究中并未考虑该影响因素。
本研究存在以下局限性:①数据量太小,因此数据结果的标准差太大;②没有探讨肿瘤分级与肿瘤术后疗效之间的关系,并不能确定究竟这些参数与肿瘤病理之间是否相关及与患者的生存期之间是否相关,这有待进一步研究。本研究初步证实了肿瘤实质区和瘤周水肿区的ADC数值对于伽马刀治疗后疗效的预测能力,这将为临床手术方案的制定提供新的参数。
[1] Bear MF,Connoors BW,Paradiso MA.Neuroscience:Exploring the brain[M].BeiJing: Higher Education Press,2002:255-493.
[2] Mader SS. Understanding Human Anatomy and Physiology[M].BeiJing:Higher Education Press,2002:135-160.
[3] 于 频.系统解剖学[M].北京:人民卫生出版社,1996:324-374.
[4] 戴勤弼,沈光建,耿明英,等.星形胶质细胞瘤伽玛刀治疗的疗效与影响因素[J].中国微侵袭神经外科杂志,2004,6(12):322-324.
[5] 付学海,石 梅,肖 锋,等.分次伽玛刀治疗脑胶质瘤的近期疗效分析[J].现代肿瘤医学,2010,18(11):2130-2132.
[6] 余光宏,许百男,陈晓雷.氢质子磁共振波谱在胶质瘤诊断与分级中的应用进展[J].华南国防医学杂志,2010,24:233-236.
[7] 柏根基,王书中,张 辉,等.脑胶质瘤ADC值及1 H磁共振波谱分析与病理分级的相关性研究[J].实用放射学杂志,2010,26(10):1393-1397.
[8] 张秀明,戴 峰,乔 伟,等. 磁共振功能成像在鉴别脑胶质瘤术后复发与放射性损伤中的应用[J]. 中国医学影像学杂志,2013,21(3):161-165.
[9] Pozza F,Clolombo F,Chierego G,et al.Low-grade astrocytomas:treatment with unconventionally fractionated external beam sterotactic radiation therapy[J].Radiology,1989,171(2):565-569
[10]Randy J, Karen S, Mattias S. Preoperative dynamic contrast-enhanced MRI correlates with molecular markers of hypoxia and vascularity in specific areas of intratumoral microenvironment and is predictive of patient outcome[J]. Neuro-oncology,2014,3(2):289-340.
[11]Ando K, Ishikura R, Nagami Y, et al. Usefulness of Cho/Cr ratio in proton MR spectroscopy for differentiating residual/recurrent glioma from non-neoplastic lesions[J]. Nihon Igaku Hoshasen Gakkai Zasshi,2004,64(3):121-126.
广西区卫生厅科研计划课题(编号:Z2013648)
刘铁军(1969~),男,在职研究生,副主任医师,研究方向:神经系统、胸部疾病影像诊断。
R 739.41
B
1673-6575(2016)04-0579-04
10.11864/j.issn.1673.2016.04.32
2016-04-25
2016-06-22)

